2.2化学平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2化学平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 462.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 12:50:10 | ||
图片预览


文档简介
2.2化学平衡同步练习题
一、选择题
1.利用合成气(CO和)在催化剂作用下合成甲醇:(Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是
A.升高温度,平衡常数减小
B.
C.在不同温度、压强下进行该反应,α(CO)不可能相等
D.若,则合成气中
2.关于化工生产的叙述中,符合生产实际的是
A.石油化工中,采用干馏的方法把石油分成不同沸点范围的产品
B.硫酸工业中,利用热交换器预热反应物,降低能耗提高生产效率
C.纯碱工业中,侯氏制碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率
D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率
3.利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,若要提高NO的转化率,可采取的措施是
A.升高温度 B.分离出部分CO2和N2
C.增大容器体积 D.恒容时通入氦气
4.将溶液与溶液混合,发生反应: ,达到平衡状态时,下列说法正确的是
A.升高温度,平衡常数减小 B.加入苯,振荡,平衡不移动
C.加入固体,平衡正向移动 D.该反应的平衡常数
5.下列叙述正确的是
A.化学平衡发生移动,平衡常数不一定发生变化
B.使用高效催化剂可以提高原料的转化率
C.反应物分子间发生碰撞一定能发生化学反应
D.化学反应的平衡常数越大,其反应速率就越快
6.下列事实不能用勒夏特列原理解释的是
A.打开可乐瓶盖,瓶中立即泛起大量泡沫
B.H2(g)、I2(g)、HI(g)平衡混合气加压后颜色变深
C.实验室用排饱和食盐水的方法收集氯气
D.在pH等于3的醋酸溶液中加入少量CH3COONa固体,溶液pH增大
7.在恒温恒容条件下,可逆反应达到化学平衡状态的标志是
A.
B.、、不再发生变化
C.
D.气体的密度不再发生变化
8.下列变化不能用勒夏特列原理解释的是
A.紫色石蕊试剂遇酸变红
B.加入催化剂有利于合成氨的反应
C.向溶液中加入固体KSCN后颜色变深
D.合成氨时将氨液化分离,可提高原料的利用率
二、非选择题
9.Ⅰ.如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL6mol·L-1的盐酸,烧杯乙中盛放100mL冷水。现向烧杯甲的溶液中放入25gNaOH固体,同时向烧杯乙中放入25gNH4NO3固体,搅拌使之溶解。
已知:2NO2N2O4 ΔH<0。
(1)A瓶中气体颜色____,理由是____。
(2)B瓶中气体颜色____,理由是____。
Ⅱ.在水溶液中,橙红色的Cr2O与黄色的CrO有下列平衡关系:Cr2O+H2O2CrO+2H+。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(3)向上述溶液中加入NaOH溶液,溶液呈____色,因为____。
(4)向已加入NaOH溶液的(1)中再加入过量稀硫酸,则溶液呈___色,因为____。
(5)向原溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____,溶液颜色将____。
10.某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
(1)该反应的化学方程式为___________;
(2)反应开始至4 min时,B的平均反应速率为___________ , A的反应速率为___________ ,A的转化率为___________
(3)4 min时,反应是否达到平衡状态?___________ (填“是”或“否”),8 min时,υ(正)___________υ(逆)(填“>”、“<”或“=”)。
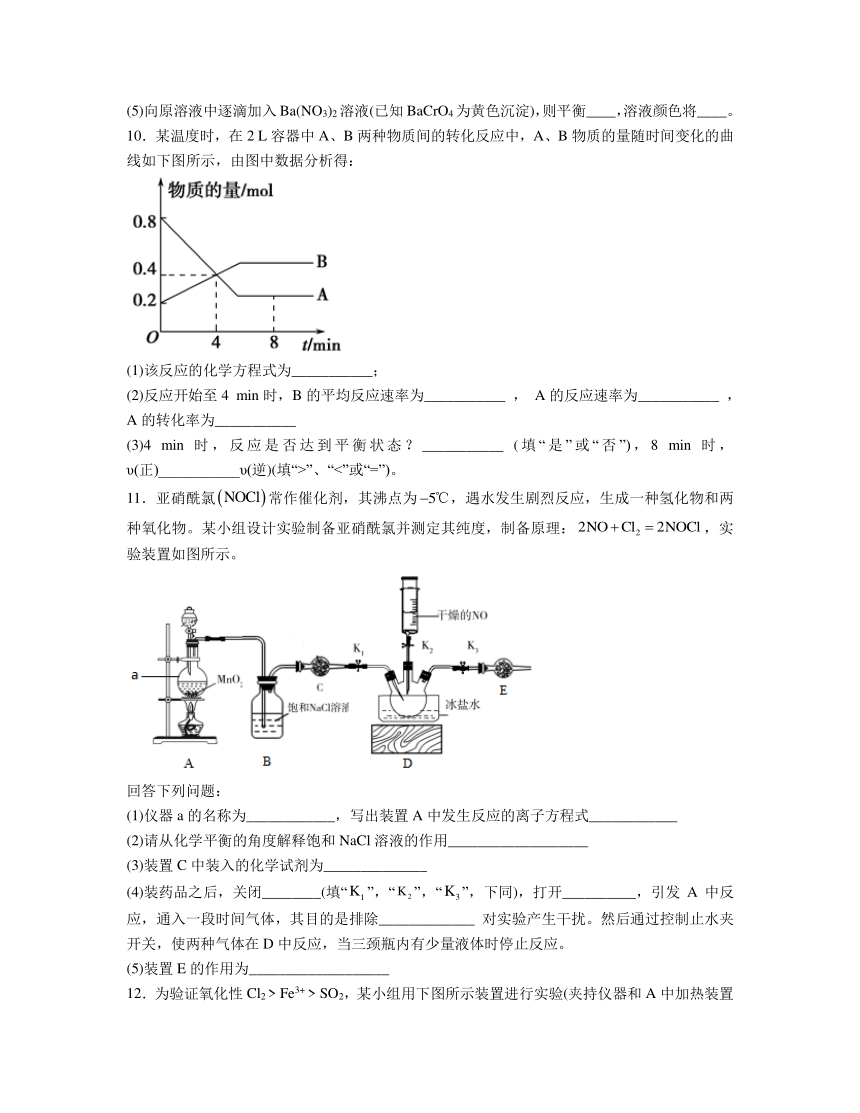
11.亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理:,实验装置如图所示。
回答下列问题:
(1)仪器a的名称为____________,写出装置A中发生反应的离子方程式____________
(2)请从化学平衡的角度解释饱和NaCl溶液的作用___________________
(3)装置C中装入的化学试剂为______________
(4)装药品之后,关闭________(填“”,“”,“”,下同),打开__________,引发A中反应,通入一段时间气体,其目的是排除_____________ 对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应。
(5)装置E的作用为___________________
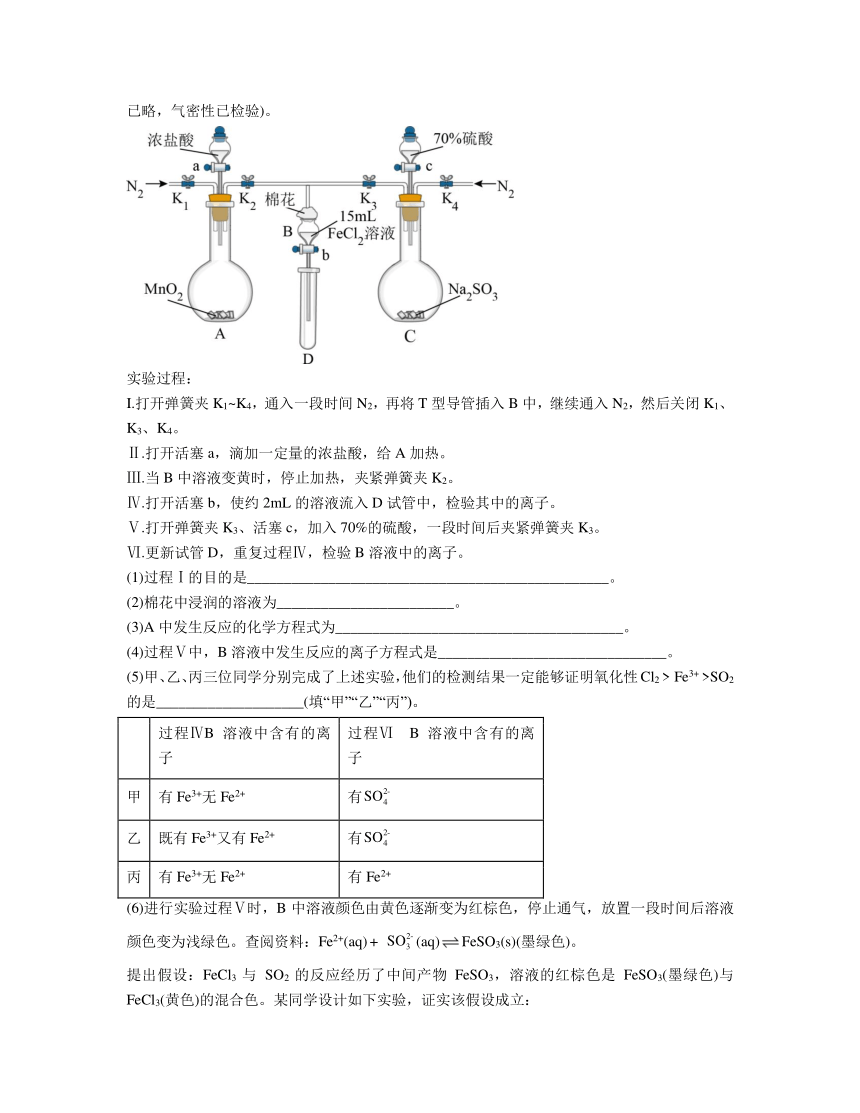
12.为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为________________________。
(3)A中发生反应的化学方程式为_______________________________________。
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是_______________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是____________________(填“甲”“乙”“丙”)。
过程ⅣB溶液中含有的离子 过程Ⅵ B溶液中含有的离子
甲 有Fe3+无Fe2+ 有
乙 既有Fe3+又有Fe2+ 有
丙 有Fe3+无Fe2+ 有Fe2+
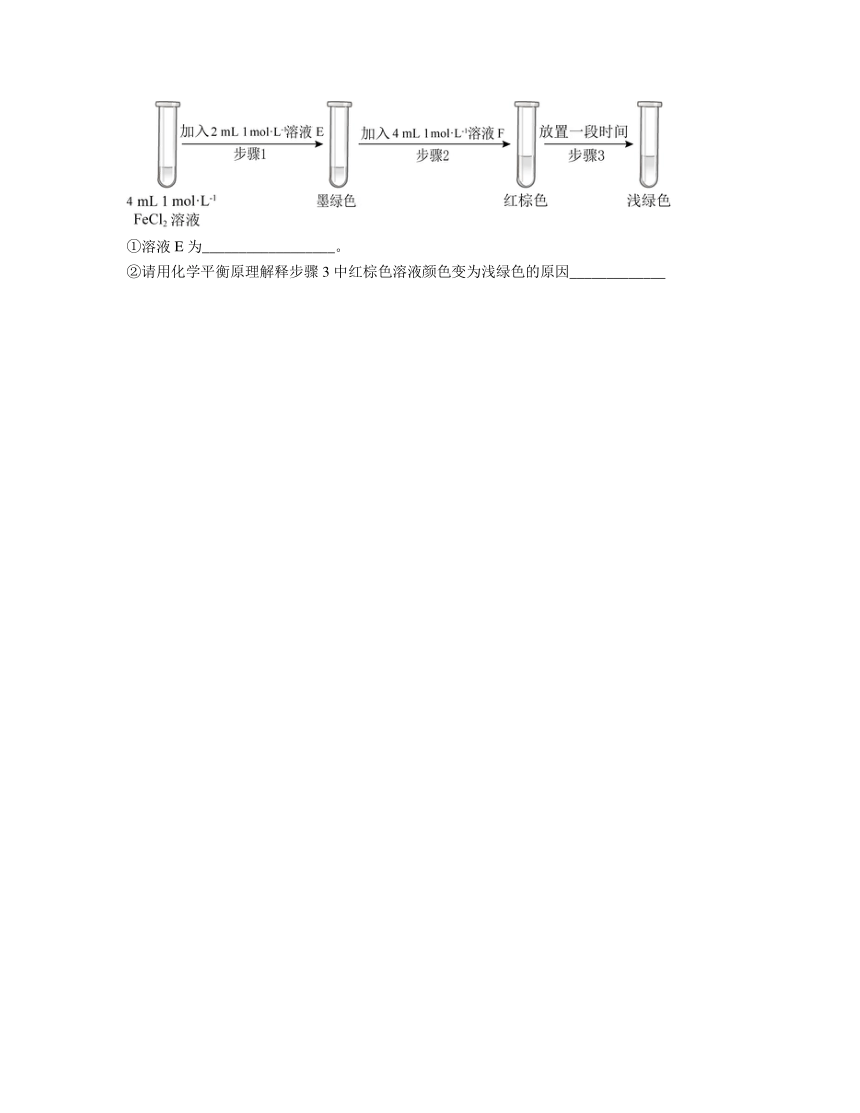
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。查阅资料:Fe2+(aq) + (aq)FeSO3(s)(墨绿色)。
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
①溶液E为__________________。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因_____________
【参考答案】
一、选择题
1.C
【分析】反应为放热反应,升高温度平衡逆向移动,平衡常数减小;反应为气体分子数减小的反应,相同条件下,增大压强,平衡正向移动,CO的平衡转化率增大,故;
解析:A.由分析可知,升高温度平衡逆向移动,平衡常数减小,A正确;
B.由分析可知,增大压强,平衡正向移动,CO的平衡转化率增大,故,B正确;
C.温度、压强均会改变平衡移动,由图可知,不同温度、压强下进行该反应,α(CO)可能相等,C错误;
D.若,则反应中投料比等于反应的系数比,故合成气中,D正确;
故选C。
2.B
解析:A.石油化工利用分馏的方法提取沸点不同的产品,描述错误,不符题意;
B.硫酸工业中,利用热交换器实现反应混合气和产物混合气之间的热能交换,节约能源,降低能耗,描述正确,符合题意;
C.侯氏制碱法中CO2循环利用,NH3直接得到副产物NH4Cl,不参与循环生产,描述错误,不符题意;
D.化学平衡常数只与温度有关,与其它条件无关,描述错误,不符题意;
综上,本题选B。
3.B
解析:A.此反应为放热反应,温度升高,平衡逆向移动,一氧化氮转化率降低,A错误;
B.分离出二氧化碳和氮气,生成物浓度减少,平衡正向移动,一氧化氮转化率升高,B正确;
C.增大容器容积,压强降低,平衡逆向移动,一氧化氮转化率降低,C错误;
D.恒容时通入氦气,参与反应的各物质浓度不变,平衡不移动,一氧化氮转化率不变,D错误;
答案选B。
4.A
解析:A.反应为放热反应,温度升高,平衡逆向进行,平衡常数减小,A正确;
B.单质碘易溶于苯,加入苯,振荡,萃取 I2 ,平衡向右移动,B错误;
C.加入 FeSO4 固体,增大 Fe2+ 浓度,平衡向左移动,C错误;
D.平衡常数表达式中缺少 I2(aq) ,D错误;
故答案为:A。
5.A
解析:A.气体体积减小的反应,增大压强,平衡向正反应方向移动,但温度不变平衡常数不变,则化学平衡发生移动,平衡常数不一定发生变化,故A正确;
B.使用高效催化剂可以降低反应的活化能,化学反应速率加快,但化学平衡不移动,原料的转化率不变,故B错误;
C.活化分子间的有效碰撞一定能发生化学反应,但反应物分子间发生碰撞不一定能发生化学反应,故C错误;
D.降低温度,化学反应速率减慢,但放热反应形成的平衡向正反应方向移动,平衡常数越增大,则化学反应的平衡常数越大,其反应速率不一定就越快,故D错误;
故选A。
6.B
【分析】勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
解析:A.存在平衡H2CO3 H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故A不符合题意;
B.该反应加压后导致容器体积减小,碘浓度增大,但是平衡不移动,所以不能用平衡移动原理解释,故B符合题意;
C.氯气溶于水的反应是一个可逆反应Cl2+H2O ClO +2H++Cl ,饱和食盐水中含有大量的氯离子,导致氯气的溶解平衡向逆向移动,氯气的溶解度减小,可用勒夏特列原理解释,故C不符合题意;
D.pH等于3的醋酸溶液中存在可逆反应CH3COOH CH3COO-+H+;CH3COONa固体后CH3COO-浓度增大,平衡逆向移动,H+浓度减小,溶液pH增大;故D不符合题意;
故答案选B。
【点睛】本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理适用范围是解本题关键,只有改变条件时能引起平衡移动的才能用平衡移动原理解释,否则不能。
7.B
解析:A.用不同物质表示平衡状态时的速率关系,必须满足两个要求:一是要同时包括正、逆速率,二是速率之比等于计量数之比。该反应平衡时用、速率表示时,应有,A错误;
B.可逆反应平衡状态特征之一是各物质浓度保持不变,B正确;
C.各物质浓度之比等于计量数之比,不代表各物质浓度保持不变,不能证明平衡状态,C错误;
D.反应体系各物质都是气体,在恒容条件下发生反应,根据质量守恒定律与得混合气体密度在反应过程恒定不变,不能说明何时达到平衡状态,D错误;
故选B。
8.B
解析:A.紫色石蕊试剂遇酸后离子会和氢离子结合生成红色物质,当氢离子浓度减小时红色物质又会生成离子,显示出蓝色,A错误;
B.加入催化剂是为了提高反应速率,不能用勒夏特列原理解释,B正确;
C.向溶液中加入固体KSCN后,增大了反应物的浓度平衡正向移动,颜色变深,C错误;
D.合成氨时将氨液化分离,减少了生成物的浓度平衡向正反应方向移动,可提高原料的利用率,D错误;
故选B。
二、非选择题
9.(1) 变深 甲中NaOH溶解放热,中和反应也放热,甲中溶液及A中气体温度升高,平衡2NO2N2O4向左移动,NO2的浓度增大,颜色加深
(2) 变浅 NH4NO3溶解吸热,乙中溶液及B中气体温度降低,使平衡2NO2N2O4向右移动,NO2的浓度减小,颜色变浅
(3) 黄 加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO)增大,c(Cr2O)减小
(4) 橙红 加入过量稀硫酸,使平衡左移,c(Cr2O)增大,c(CrO)减小
(5) 向右移动 逐渐变为无色
解析:(1)甲中NaOH溶解放热,与盐酸发生中和反应也放热,所以甲中溶液及A中气体温度升高,则平衡反应2NO2N2O4向左移动,NO2的浓度增大,颜色变深;故答案为:变深;甲中NaOH溶解放热,中和反应也放热,甲中溶液及A中气体温度升高,平衡2NO2N2O4向左移动,NO2的浓度增大,颜色加深。
(2)NH4NO3溶解吸热,所以乙中溶液及B中气体温度降低,使平衡反应2NO2N2O4向右移动,NO2的浓度减小,颜色变浅;故答案为:变浅;NH4NO3溶解吸热,乙中溶液及B中气体温度降低,使平衡2NO2N2O4向右移动,NO2的浓度减小,颜色变浅。
(3)加入NaOH溶液,使c(H+)减小,则反应Cr2O+H2O2CrO+2H+平衡右移,c(CrO)增大,c(Cr2O)减小,溶液呈黄色;故答案为:黄;加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO)增大,c(Cr2O)减小。
(4)加入过量稀硫酸,使c(H+)增大,则反应Cr2O+H2O2CrO+2H+平衡左移,c(Cr2O)增大,c(CrO)减小,溶液呈橙红色;故答案为:橙红;加入过量稀硫酸,使平衡左移,c(Cr2O)增大,c(CrO)减小。
(5)向原溶液中逐滴加入Ba(NO3)2溶液,与CrO结合生成BaCrO4沉淀,平衡向右移动,溶液颜色将逐渐变为无色;故答案为:向右移动;逐渐变为无色。
10.(1)2A(g) B (g)
(2) 0.025 mol L 1 min 1 0.05 mol L 1 min 1 50%
(3) 否 =
解析:(1)根据图中信息A为反应物,B为生成物,在反应到4min时,A改变量为0.4mol,B改变量为0.2mol,根据改变量之比等于计量系数之比,因此该反应的化学方程式为:2A(g) B (g);故答案为:2A(g) B (g);
(2)反应开始至4 min时,B的平均反应速率为, A的反应速率为B反应速率的2倍即0.05 mol L 1 min 1,A的转化率为;故答案为:0.025 mol L 1 min 1;0.05 mol L 1 min 1;50%;
(3)从图中看出4 min后,A还在减少,B在增加,说明4min时反应未达到平衡状态,8 min时,A、B的量都未改变,说明已经达到平衡即υ(正) =υ(逆);故答案为:否;=。
11. 圆底烧瓶 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动 P2O5或硅胶 和 排除装置中的空气 吸收多余的Cl2,进行尾气处理
【分析】本题以实验室制备氯气并模拟NO和Cl2反应来制备NOCl,装置A为氯气的发生装置,发生的反应为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B为除去Cl2中的HCl,装置C为干燥氯气,装置D为制备NOCl的发生装置,发生的反应为,装置E为尾气吸收装置,据此分析解题。
解析:(1)由实验装置图可知,仪器a的名称为圆底烧瓶,装置A为实验室制备氯气的发生装置,故发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,故答案为:圆底烧瓶;MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
(2)由于Cl2溶于水后发生离子反应为:Cl2+H2OH++Cl-+HClO,故使用饱和NaCl溶液增大了氯离子浓度,使化学平衡逆向移动,故可以使用饱和食盐水来除去Cl2中的HCl,故答案为:Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动;
(3)由分析可知,装置C为干燥Cl2装置,故装置C中装入的化学试剂为P2O5或硅胶,故答案为:P2O5或硅胶;
(4)由题干信息可知,亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,同时装置内的氧气会和一氧化氮反应,故实验过程中,发生之前需将装置中的空气排空,故装药品之后,关闭,打开和,引发A中反应,通入一段时间气体,其目的是排除装置中的空气对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应,故答案为:;和;排除装置中的空气;
(5)由分析可知,装置E的作用为吸收多余的Cl2,进行尾气处理,故答案未:吸收多余的Cl2,进行尾气处理。
12. 排出装置中的空气,防止氧气干扰; NaOH溶液 MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑ 2Fe3++SO2+2H2O=2Fe2+++4H+ 乙 丙 Na2SO3溶液 Fe3+消耗,c()减小,使得Fe2+(aq)+ (aq)FeSO3 (s)平衡逆向移动,所以溶液中红棕色变为浅绿色
【分析】打开弹簧夹通入氮气,排尽装置中的空气,先打开活塞a,二氧化锰与浓盐酸加热反应生成氯气,氯气进入氯化亚铁溶液生成氯化铁,关闭K2后打开活塞b,亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫进入氯化铁溶液发生氧化还原反应,据此回答问题。
解析:(1)由于装置中含有空气,空气中的O2会干扰实验,过程Ⅰ中通入一段时间N2,目的是排除装置中的空气,防止干扰。
(2)为了防止多余的Cl2、SO2污染环境,所以棉花中浸润的溶液是NaOH溶液,吸收未反应的Cl2、SO2。
(3)A中二氧化锰与浓盐酸的反应生成MnCl2、氯气、水,该反应的化学方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是2Fe3++SO2+2H2O=2Fe2+++4H+;
(5)甲、过程Ⅳ的B溶液中含有的离子有Fe3+无Fe2+,氯气可能过量,过程Ⅵ的B溶液中含有的,可能是氯气氧化SO2生成的,不能证明Fe3+的氧化性大于SO2;不能证明结论;
乙、过程Ⅳ的B溶液中含有的离子既有Fe3+又有Fe2+,说明氯气不足,氯气氧化性大于铁离子,过程Ⅵ的B溶液中含有的,说明二氧化硫与铁离子发生了反应:2Fe3++SO2+2H2O=2Fe2+++4H+,则Fe3+氧化性大于二氧化硫;能证明结论;
丙、过程Ⅳ的B溶液中有Fe3+、无Fe2+,则氯气的氧化性大于铁离子,过程Ⅵ的B溶液中含有Fe2+,说明SO2将Fe3+还原成Fe2+,则氧化性铁离子大于二氧化硫;能证明结论;
故乙、丙一定能够证明氧化性Cl2>Fe3+>SO2;
(6)①FeCl2溶液加入溶液E后,溶液变为墨绿色,说明生成了FeSO3,说明E为Na2SO3(或可溶性亚硫酸盐);
②溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色,Fe3+消耗,c()减小,使平衡Fe2+(aq)+(aq)FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色
一、选择题
1.利用合成气(CO和)在催化剂作用下合成甲醇:(Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是
A.升高温度,平衡常数减小
B.
C.在不同温度、压强下进行该反应,α(CO)不可能相等
D.若,则合成气中
2.关于化工生产的叙述中,符合生产实际的是
A.石油化工中,采用干馏的方法把石油分成不同沸点范围的产品
B.硫酸工业中,利用热交换器预热反应物,降低能耗提高生产效率
C.纯碱工业中,侯氏制碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率
D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率
3.利用反应2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,若要提高NO的转化率,可采取的措施是
A.升高温度 B.分离出部分CO2和N2
C.增大容器体积 D.恒容时通入氦气
4.将溶液与溶液混合,发生反应: ,达到平衡状态时,下列说法正确的是
A.升高温度,平衡常数减小 B.加入苯,振荡,平衡不移动
C.加入固体,平衡正向移动 D.该反应的平衡常数
5.下列叙述正确的是
A.化学平衡发生移动,平衡常数不一定发生变化
B.使用高效催化剂可以提高原料的转化率
C.反应物分子间发生碰撞一定能发生化学反应
D.化学反应的平衡常数越大,其反应速率就越快
6.下列事实不能用勒夏特列原理解释的是
A.打开可乐瓶盖,瓶中立即泛起大量泡沫
B.H2(g)、I2(g)、HI(g)平衡混合气加压后颜色变深
C.实验室用排饱和食盐水的方法收集氯气
D.在pH等于3的醋酸溶液中加入少量CH3COONa固体,溶液pH增大
7.在恒温恒容条件下,可逆反应达到化学平衡状态的标志是
A.
B.、、不再发生变化
C.
D.气体的密度不再发生变化
8.下列变化不能用勒夏特列原理解释的是
A.紫色石蕊试剂遇酸变红
B.加入催化剂有利于合成氨的反应
C.向溶液中加入固体KSCN后颜色变深
D.合成氨时将氨液化分离,可提高原料的利用率
二、非选择题
9.Ⅰ.如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间止水夹K夹紧,烧杯甲中盛放100mL6mol·L-1的盐酸,烧杯乙中盛放100mL冷水。现向烧杯甲的溶液中放入25gNaOH固体,同时向烧杯乙中放入25gNH4NO3固体,搅拌使之溶解。
已知:2NO2N2O4 ΔH<0。
(1)A瓶中气体颜色____,理由是____。
(2)B瓶中气体颜色____,理由是____。
Ⅱ.在水溶液中,橙红色的Cr2O与黄色的CrO有下列平衡关系:Cr2O+H2O2CrO+2H+。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(3)向上述溶液中加入NaOH溶液,溶液呈____色,因为____。
(4)向已加入NaOH溶液的(1)中再加入过量稀硫酸,则溶液呈___色,因为____。
(5)向原溶液中逐滴加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____,溶液颜色将____。
10.某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
(1)该反应的化学方程式为___________;
(2)反应开始至4 min时,B的平均反应速率为___________ , A的反应速率为___________ ,A的转化率为___________
(3)4 min时,反应是否达到平衡状态?___________ (填“是”或“否”),8 min时,υ(正)___________υ(逆)(填“>”、“<”或“=”)。
11.亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,生成一种氢化物和两种氧化物。某小组设计实验制备亚硝酰氯并测定其纯度,制备原理:,实验装置如图所示。
回答下列问题:
(1)仪器a的名称为____________,写出装置A中发生反应的离子方程式____________
(2)请从化学平衡的角度解释饱和NaCl溶液的作用___________________
(3)装置C中装入的化学试剂为______________
(4)装药品之后,关闭________(填“”,“”,“”,下同),打开__________,引发A中反应,通入一段时间气体,其目的是排除_____________ 对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应。
(5)装置E的作用为___________________
12.为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为________________________。
(3)A中发生反应的化学方程式为_______________________________________。
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是_______________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是____________________(填“甲”“乙”“丙”)。
过程ⅣB溶液中含有的离子 过程Ⅵ B溶液中含有的离子
甲 有Fe3+无Fe2+ 有
乙 既有Fe3+又有Fe2+ 有
丙 有Fe3+无Fe2+ 有Fe2+
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。查阅资料:Fe2+(aq) + (aq)FeSO3(s)(墨绿色)。
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
①溶液E为__________________。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因_____________
【参考答案】
一、选择题
1.C
【分析】反应为放热反应,升高温度平衡逆向移动,平衡常数减小;反应为气体分子数减小的反应,相同条件下,增大压强,平衡正向移动,CO的平衡转化率增大,故;
解析:A.由分析可知,升高温度平衡逆向移动,平衡常数减小,A正确;
B.由分析可知,增大压强,平衡正向移动,CO的平衡转化率增大,故,B正确;
C.温度、压强均会改变平衡移动,由图可知,不同温度、压强下进行该反应,α(CO)可能相等,C错误;
D.若,则反应中投料比等于反应的系数比,故合成气中,D正确;
故选C。
2.B
解析:A.石油化工利用分馏的方法提取沸点不同的产品,描述错误,不符题意;
B.硫酸工业中,利用热交换器实现反应混合气和产物混合气之间的热能交换,节约能源,降低能耗,描述正确,符合题意;
C.侯氏制碱法中CO2循环利用,NH3直接得到副产物NH4Cl,不参与循环生产,描述错误,不符题意;
D.化学平衡常数只与温度有关,与其它条件无关,描述错误,不符题意;
综上,本题选B。
3.B
解析:A.此反应为放热反应,温度升高,平衡逆向移动,一氧化氮转化率降低,A错误;
B.分离出二氧化碳和氮气,生成物浓度减少,平衡正向移动,一氧化氮转化率升高,B正确;
C.增大容器容积,压强降低,平衡逆向移动,一氧化氮转化率降低,C错误;
D.恒容时通入氦气,参与反应的各物质浓度不变,平衡不移动,一氧化氮转化率不变,D错误;
答案选B。
4.A
解析:A.反应为放热反应,温度升高,平衡逆向进行,平衡常数减小,A正确;
B.单质碘易溶于苯,加入苯,振荡,萃取 I2 ,平衡向右移动,B错误;
C.加入 FeSO4 固体,增大 Fe2+ 浓度,平衡向左移动,C错误;
D.平衡常数表达式中缺少 I2(aq) ,D错误;
故答案为:A。
5.A
解析:A.气体体积减小的反应,增大压强,平衡向正反应方向移动,但温度不变平衡常数不变,则化学平衡发生移动,平衡常数不一定发生变化,故A正确;
B.使用高效催化剂可以降低反应的活化能,化学反应速率加快,但化学平衡不移动,原料的转化率不变,故B错误;
C.活化分子间的有效碰撞一定能发生化学反应,但反应物分子间发生碰撞不一定能发生化学反应,故C错误;
D.降低温度,化学反应速率减慢,但放热反应形成的平衡向正反应方向移动,平衡常数越增大,则化学反应的平衡常数越大,其反应速率不一定就越快,故D错误;
故选A。
6.B
【分析】勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。
解析:A.存在平衡H2CO3 H2O+CO2,打开瓶盖时,压强减小,平衡向右移动,二氧化碳气体溶解度减小,逸出二氧化碳,可以用平衡移动原理来解释,故A不符合题意;
B.该反应加压后导致容器体积减小,碘浓度增大,但是平衡不移动,所以不能用平衡移动原理解释,故B符合题意;
C.氯气溶于水的反应是一个可逆反应Cl2+H2O ClO +2H++Cl ,饱和食盐水中含有大量的氯离子,导致氯气的溶解平衡向逆向移动,氯气的溶解度减小,可用勒夏特列原理解释,故C不符合题意;
D.pH等于3的醋酸溶液中存在可逆反应CH3COOH CH3COO-+H+;CH3COONa固体后CH3COO-浓度增大,平衡逆向移动,H+浓度减小,溶液pH增大;故D不符合题意;
故答案选B。
【点睛】本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理适用范围是解本题关键,只有改变条件时能引起平衡移动的才能用平衡移动原理解释,否则不能。
7.B
解析:A.用不同物质表示平衡状态时的速率关系,必须满足两个要求:一是要同时包括正、逆速率,二是速率之比等于计量数之比。该反应平衡时用、速率表示时,应有,A错误;
B.可逆反应平衡状态特征之一是各物质浓度保持不变,B正确;
C.各物质浓度之比等于计量数之比,不代表各物质浓度保持不变,不能证明平衡状态,C错误;
D.反应体系各物质都是气体,在恒容条件下发生反应,根据质量守恒定律与得混合气体密度在反应过程恒定不变,不能说明何时达到平衡状态,D错误;
故选B。
8.B
解析:A.紫色石蕊试剂遇酸后离子会和氢离子结合生成红色物质,当氢离子浓度减小时红色物质又会生成离子,显示出蓝色,A错误;
B.加入催化剂是为了提高反应速率,不能用勒夏特列原理解释,B正确;
C.向溶液中加入固体KSCN后,增大了反应物的浓度平衡正向移动,颜色变深,C错误;
D.合成氨时将氨液化分离,减少了生成物的浓度平衡向正反应方向移动,可提高原料的利用率,D错误;
故选B。
二、非选择题
9.(1) 变深 甲中NaOH溶解放热,中和反应也放热,甲中溶液及A中气体温度升高,平衡2NO2N2O4向左移动,NO2的浓度增大,颜色加深
(2) 变浅 NH4NO3溶解吸热,乙中溶液及B中气体温度降低,使平衡2NO2N2O4向右移动,NO2的浓度减小,颜色变浅
(3) 黄 加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO)增大,c(Cr2O)减小
(4) 橙红 加入过量稀硫酸,使平衡左移,c(Cr2O)增大,c(CrO)减小
(5) 向右移动 逐渐变为无色
解析:(1)甲中NaOH溶解放热,与盐酸发生中和反应也放热,所以甲中溶液及A中气体温度升高,则平衡反应2NO2N2O4向左移动,NO2的浓度增大,颜色变深;故答案为:变深;甲中NaOH溶解放热,中和反应也放热,甲中溶液及A中气体温度升高,平衡2NO2N2O4向左移动,NO2的浓度增大,颜色加深。
(2)NH4NO3溶解吸热,所以乙中溶液及B中气体温度降低,使平衡反应2NO2N2O4向右移动,NO2的浓度减小,颜色变浅;故答案为:变浅;NH4NO3溶解吸热,乙中溶液及B中气体温度降低,使平衡2NO2N2O4向右移动,NO2的浓度减小,颜色变浅。
(3)加入NaOH溶液,使c(H+)减小,则反应Cr2O+H2O2CrO+2H+平衡右移,c(CrO)增大,c(Cr2O)减小,溶液呈黄色;故答案为:黄;加入NaOH溶液,使c(H+)减小,平衡右移,c(CrO)增大,c(Cr2O)减小。
(4)加入过量稀硫酸,使c(H+)增大,则反应Cr2O+H2O2CrO+2H+平衡左移,c(Cr2O)增大,c(CrO)减小,溶液呈橙红色;故答案为:橙红;加入过量稀硫酸,使平衡左移,c(Cr2O)增大,c(CrO)减小。
(5)向原溶液中逐滴加入Ba(NO3)2溶液,与CrO结合生成BaCrO4沉淀,平衡向右移动,溶液颜色将逐渐变为无色;故答案为:向右移动;逐渐变为无色。
10.(1)2A(g) B (g)
(2) 0.025 mol L 1 min 1 0.05 mol L 1 min 1 50%
(3) 否 =
解析:(1)根据图中信息A为反应物,B为生成物,在反应到4min时,A改变量为0.4mol,B改变量为0.2mol,根据改变量之比等于计量系数之比,因此该反应的化学方程式为:2A(g) B (g);故答案为:2A(g) B (g);
(2)反应开始至4 min时,B的平均反应速率为, A的反应速率为B反应速率的2倍即0.05 mol L 1 min 1,A的转化率为;故答案为:0.025 mol L 1 min 1;0.05 mol L 1 min 1;50%;
(3)从图中看出4 min后,A还在减少,B在增加,说明4min时反应未达到平衡状态,8 min时,A、B的量都未改变,说明已经达到平衡即υ(正) =υ(逆);故答案为:否;=。
11. 圆底烧瓶 MnO2+4H++2Cl-Mn2++Cl2↑+2H2O Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动 P2O5或硅胶 和 排除装置中的空气 吸收多余的Cl2,进行尾气处理
【分析】本题以实验室制备氯气并模拟NO和Cl2反应来制备NOCl,装置A为氯气的发生装置,发生的反应为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,装置B为除去Cl2中的HCl,装置C为干燥氯气,装置D为制备NOCl的发生装置,发生的反应为,装置E为尾气吸收装置,据此分析解题。
解析:(1)由实验装置图可知,仪器a的名称为圆底烧瓶,装置A为实验室制备氯气的发生装置,故发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,故答案为:圆底烧瓶;MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
(2)由于Cl2溶于水后发生离子反应为:Cl2+H2OH++Cl-+HClO,故使用饱和NaCl溶液增大了氯离子浓度,使化学平衡逆向移动,故可以使用饱和食盐水来除去Cl2中的HCl,故答案为:Cl2溶于水后存在Cl2+H2OH++Cl-+HClO,饱和食盐水增大了Cl-浓度,使平衡逆向移动;
(3)由分析可知,装置C为干燥Cl2装置,故装置C中装入的化学试剂为P2O5或硅胶,故答案为:P2O5或硅胶;
(4)由题干信息可知,亚硝酰氯常作催化剂,其沸点为,遇水发生剧烈反应,同时装置内的氧气会和一氧化氮反应,故实验过程中,发生之前需将装置中的空气排空,故装药品之后,关闭,打开和,引发A中反应,通入一段时间气体,其目的是排除装置中的空气对实验产生干扰。然后通过控制止水夹开关,使两种气体在D中反应,当三颈瓶内有少量液体时停止反应,故答案为:;和;排除装置中的空气;
(5)由分析可知,装置E的作用为吸收多余的Cl2,进行尾气处理,故答案未:吸收多余的Cl2,进行尾气处理。
12. 排出装置中的空气,防止氧气干扰; NaOH溶液 MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑ 2Fe3++SO2+2H2O=2Fe2+++4H+ 乙 丙 Na2SO3溶液 Fe3+消耗,c()减小,使得Fe2+(aq)+ (aq)FeSO3 (s)平衡逆向移动,所以溶液中红棕色变为浅绿色
【分析】打开弹簧夹通入氮气,排尽装置中的空气,先打开活塞a,二氧化锰与浓盐酸加热反应生成氯气,氯气进入氯化亚铁溶液生成氯化铁,关闭K2后打开活塞b,亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫进入氯化铁溶液发生氧化还原反应,据此回答问题。
解析:(1)由于装置中含有空气,空气中的O2会干扰实验,过程Ⅰ中通入一段时间N2,目的是排除装置中的空气,防止干扰。
(2)为了防止多余的Cl2、SO2污染环境,所以棉花中浸润的溶液是NaOH溶液,吸收未反应的Cl2、SO2。
(3)A中二氧化锰与浓盐酸的反应生成MnCl2、氯气、水,该反应的化学方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是2Fe3++SO2+2H2O=2Fe2+++4H+;
(5)甲、过程Ⅳ的B溶液中含有的离子有Fe3+无Fe2+,氯气可能过量,过程Ⅵ的B溶液中含有的,可能是氯气氧化SO2生成的,不能证明Fe3+的氧化性大于SO2;不能证明结论;
乙、过程Ⅳ的B溶液中含有的离子既有Fe3+又有Fe2+,说明氯气不足,氯气氧化性大于铁离子,过程Ⅵ的B溶液中含有的,说明二氧化硫与铁离子发生了反应:2Fe3++SO2+2H2O=2Fe2+++4H+,则Fe3+氧化性大于二氧化硫;能证明结论;
丙、过程Ⅳ的B溶液中有Fe3+、无Fe2+,则氯气的氧化性大于铁离子,过程Ⅵ的B溶液中含有Fe2+,说明SO2将Fe3+还原成Fe2+,则氧化性铁离子大于二氧化硫;能证明结论;
故乙、丙一定能够证明氧化性Cl2>Fe3+>SO2;
(6)①FeCl2溶液加入溶液E后,溶液变为墨绿色,说明生成了FeSO3,说明E为Na2SO3(或可溶性亚硫酸盐);
②溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色,Fe3+消耗,c()减小,使平衡Fe2+(aq)+(aq)FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色
