2.2化学平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2化学平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 403.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 12:50:49 | ||
图片预览




文档简介
2.2化学平衡同步练习题
一、选择题
1.C、Si同处于ⅣA族,它们的单质或化合物有重要用途。实验室可用回收废液中的苯酚,工业上用和焦炭高温下反应制得粗硅,再经如下2步反应制得精硅: ,,反应过程中可能会生成。有关反应的说法正确的是
A.该反应在低温条件下不能自发
B.其他条件不变,增大压强平衡产率减小
C.实际工业生产选择高温,原因是高温时Si的平衡转化率比低温时大
D.如图所示,当,平衡产率减小说明发生了副反应
2.在一定条件下,恒容密闭容器中反应2A(g)2B(g)+C(g) ΔH>0,达到平衡后,能使B的浓度增大的措施是
A.升温 B.充入惰性气体 C.加压 D.减少A的浓度
3.两个均充有H2S的刚性密闭容器,起始压强均为pkPa,以温度、Al2O3催化剂为条件变量,进行实验:2H2S(g)2H2(g)+S2(g),反应相同时间,结果如图所示。下列说法错误的是
A.温度升高,H2S分解的正,逆反应速率均增大
B.900℃,ts后达平衡,H2的平均生成速率为pkPa s 1
C.Al2O3催化剂使得正反应的活化能小于逆反应的活化能
D.1100℃,曲线II、III重合,说明Al2O3催化剂失去活性
4.可逆反应达到平衡的重要特征是( )
A.反应停止了
B.正、逆反应的速率均为零
C.正、逆反应都还在继续进行
D.正、逆反应的速率相等
5.在密闭容器中用一定量的混合气体发生反应:,平衡时测得B的浓度为0.5,保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得B的浓度为1.1,下列有关判断正确的是
A. B.A的转化率减小
C.平衡向正反应方向移动 D.C的体积分数增大
6.已知反应A2(g) + 2B2(g)2AB2(g) 的△H<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡逆向移动
7.已知反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小 B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)减小
8.在恒温恒容的密闭容器中发生反应,下列叙述中,能说明反应已达平衡状态的是
A.混合气体的压强不发生变化
B.该反应的平衡常数K不发生变化
C.混合气体的密度不发生变化
D.消耗CO的速率与生成的速率相等
二、非选择题
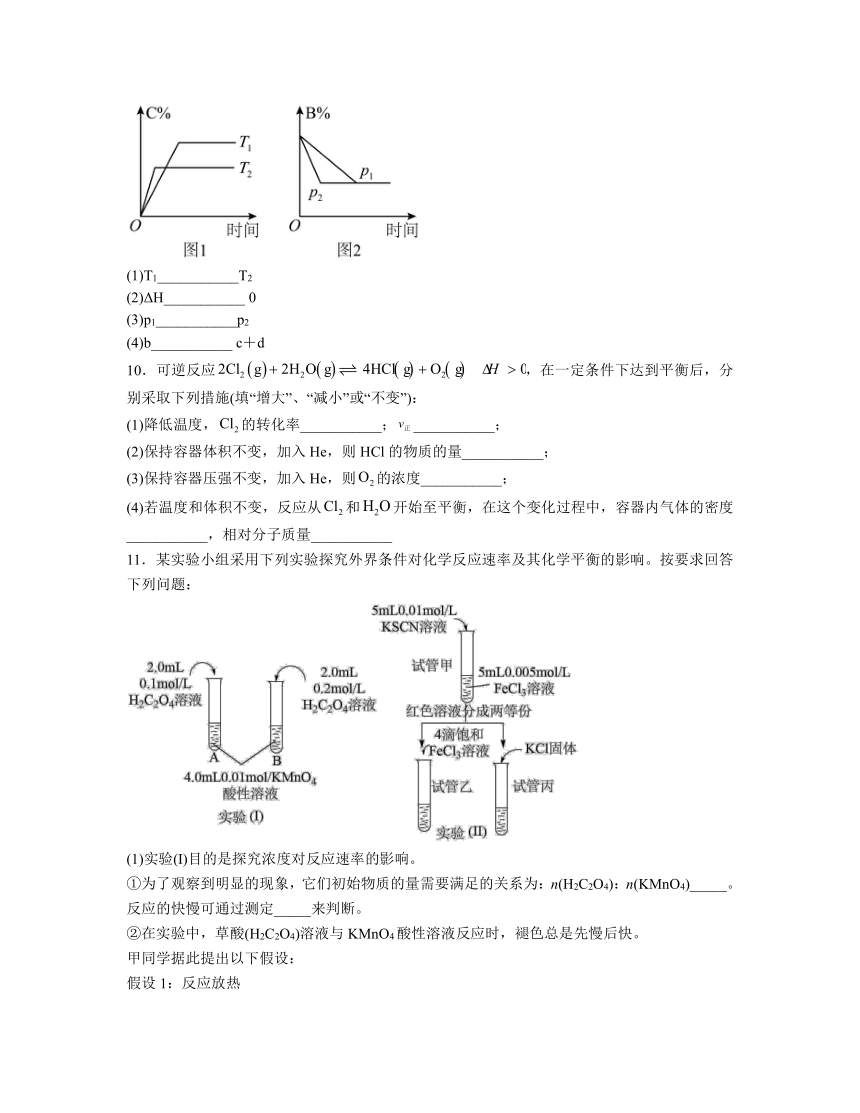
9.可逆反应aA(s)+bB(g) cC(g)+dD(g) ΔH=Q kJ mol 1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析可知:(填>、<或=)
(1)T1___________T2
(2)ΔH___________ 0
(3)p1___________p2
(4)b___________ c+d
10.可逆反应,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,的转化率___________;___________;
(2)保持容器体积不变,加入He,则HCl的物质的量___________;
(3)保持容器压强不变,加入He,则的浓度___________;
(4)若温度和体积不变,反应从和开始至平衡,在这个变化过程中,容器内气体的密度___________,相对分子质量___________
11.某实验小组采用下列实验探究外界条件对化学反应速率及其化学平衡的影响。按要求回答下列问题:
(1)实验(I)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)_____。反应的快慢可通过测定_____来判断。
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
实验编号 室温下,试管中所加试剂及用量/mL
0.20 mol/LH2C2O4溶液 0.10 mol/L酸性KMnO4溶液 0.10 mol/LMnSO4溶液 H2O
a 4.00 1.00 1.00 0
b 4.00 1.00 0 V
则实验b中V=_____mL,在实验b中加入蒸馏水的目的是_____。预期的实验现象是_____,同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)_____。
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为___________。
②试管乙中的现象是______,说明增大溶液中的Fe3+浓度,平衡______,重新达到平衡时Fe3+转化率______。
③向试管丙中加入KC1固体,平衡________。
12.某小组同学探究盐对Fe3++3SCN-Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响将已用稀盐酸酸化0.005mol·L-1FeCl3溶液(无色)和0.01mol·L-1KSCN溶液等体积混合,静置至体系达平衡,得红色溶液X。各取2mL溶液X放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②Cl、与Fe3+均能发生络合反应:Fe3++4C1-[FeCl4]-(黄色)、Fe3++2[Fe(SO4)2]-(无色)。
(1)稀盐酸酸化FeCl3溶液的目的是___________。(用离子方程式表示)。采用浓度较低的FeCl3溶液制备Fe3+和SCN-的平衡体系,是为了避免___________(填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对Fe3+和SCN-平衡体系有影响,且随着KCl浓度增大,Fe3++3SCN-Fe(SCN)3平衡向___________(填“正反应”或“逆反应”)方向移动。
实验II:探究盐对Fe3+和SCN-平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使Fe3+和SCN-平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应Fe3++4C1-[FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
(3)基于以上分析,该组同学取2mL红色溶液X,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
序号 加入少量盐 溶液颜色
① KCl 变浅
② NaCl 变浅程度较大
基于以上实验现象可得出结论:K+的盐效应弱于Na+的盐效应。简述获得结论的依据:______。
(4)取2mL溶液X继续进行实验,结果如下表。
序号 加入溶液 溶液颜色
③ 1mL蒸馏水 略变浅
④ 1mL3mol·L-1盐酸 明显变浅,溶液偏黄
⑤ 1mL1.5mol·L-1硫酸 现象a:溶液变为浅黄色
上述实验③和实验④可证明副反应影响了Fe3+和SCN-平衡体系,结合实验现象及化学用语分析副反应对Fe3+和SCN-平衡体系有影响的原因:___________。
实验III:探究现象a中溶液变为浅黄色的的原因
序号 实验操作 溶液颜色
⑥ 取1mL0.0025mol:L-1Fe2(SO4)3溶液(无色),加入1mL0.01mol·L-1KSCN溶液,再加入1mL1.5mol·L-1硫酸 溶液先变红,加入硫酸后变为浅黄色
⑦ 取1mL0.005mol·L-1FeCl3溶液(无色) 溶液为无色
(5)由实验④、实验⑤和实验⑥可知,溶液变为浅黄色与___________(填微粒的化学式)无关。
(6)为了进一步确认现象a中使溶液呈浅黄色的微粒只有Fe(SCN)3,补充完整实验⑦的操作___________。
【参考答案】
一、选择题
1.D
解析:A.该反应当中,反应前气体的计量系数和为3,反应后气体的计量系数和为2,故反应的△S<0,根据△H-T△S<0反应能够自发,反应为放热反应,则该反应在低温条件下能自发,A错误;
B.加压向气体计量系数减小的方向移动,对于该反应来说是正向移动,SiHCl3平衡产率增大,B错误;
C.由题干信息可知,该反应为放热反应,升高温度平衡逆向移动,即高温时Si的平衡转化率比低温时小,C错误;
D.由图可知,当>3,SiHCl3平衡产率减小,说明此时SiHCl3参与了其他的反应,导致平衡体系内SiHCl3浓度降低,产率降低,D正确;
故选D。
2.A
解析:A.该反应正反应是吸热反应,升高温度,平衡正向移动,B的浓度增大,选项A正确;
B.反应在恒容密闭容器中进行,充入惰性气体,气体的总压增大,但参与反应的气体浓度增不变,平衡不移动,B的浓度不变,选项B错误;
C.增大压强,平衡向气体体积缩小的逆反应方向移动,B的浓度减小,选项C错误;
D.减少A的浓度,平衡逆向移动,B的浓度减小,选项D错误;
答案选A。
3.C
解析:A.温度升高,反应速率均增大即H2S分解的正,逆反应速率均增大,故A正确;
B.900℃,ts后达平衡,硫化氢的转化率为50%,则氢气的压强为0.5pkPa,则H2的平均生成速率为,故B正确;
C.根据图中曲线分析,升高温度,硫化氢的转化率增大,因此该反应是吸热反应,则正反应的活化能大于逆反应的活化能,而加入Al2O3催化剂使正反应和逆反应活化能都降低,但正反应的活化能仍大于逆反应的活化能,故C错误;
D.催化剂需要适宜温度,在1100℃,曲线II、III重合,说明Al2O3催化剂可能几乎失去活性,故D正确。
综上所述,答案为C。
4.D
解析:A.化学平衡是动态平衡,达到平衡时反应并没有停止,A不符合题意;
B.达到平衡时,正、逆反应速率相等但不为0,B不符合题意;
C.正、逆反应都还在进行并不是达到平衡的特征,如达到平衡之前正逆反应也都在进行,C不符合题意;
D.达到化学平衡状态时,正、逆反应的速率相等且不等于0为达到平衡的特征,D符合题意。
答案选D。
5.B
【分析】压缩体积到原来的一半即增大压强,若体系中平衡不移动,则B的浓度为原来的2倍,即0.5mol L 1×2=1.0mol L 1,而B的浓度为1.1mol L 1,说明平衡移动向生成B的方向移动,即逆反应方向移动,加压平衡向着气体分子数减少的方向移动,即m+n解析:A.根据分析可知,反应逆向移动,加压平衡向着气体分子数减少的方向移动,即m+nB.根据分析可知平衡移动向生成B的方向移动,即逆反应方向移动,A的转化率减小,故B正确;
C.根据分析可知加压平衡向着气体分子数减少的方向移动,即反应逆向移动,故C错误;
D.根据分析可知,反应逆向移动,C的体积分数减小,故D错误;
故答案为:B。
6.B
解析:A.升高温度,正逆向反应速率均会增大,A错误;
B.升高温度,提高活化分子百分数,有利于反应速率增加,从而缩短达到平衡的时间,B正确;
C.上述反应是气体分子数减少的放热反应,所以升高温度,不利于反应向正向移动,C错误;
D.上述反应是气体分子数减少的放热反应,降低温度平衡正向移动,D错误;
故选B。
7.A
【分析】上述反应为气体分子数不变的放热反应,结合影响化学平衡的因素分析解答。
解析:A.反应放热,所以升高温度,化学平衡常数K减小,A正确;
B.减小压强,平衡不移动,n(CO2)不变,B错误;
C.催化剂不改变化学平衡,所以平衡态的α(CO)不变,C错误;
D.在一定温度和压强下于密闭容器中充入一定量的非反应气体氮气,对于反应体系的各物质浓度不影响,所以n(H2)不变,D错误;
故选A。
8.C
解析:A.反应前后气体分子个数不发生变化,恒温恒容条件下压强一直不变,A错误;
B.反应的平衡常数K只与温度有关,温度不变平衡常数不变,B错误;
C.根据,恒温恒容条件下,密度不变即气体质量不变,反应达到平衡状态,C正确;
D.消耗CO的速率与生成的速率相等只表示正反应速率,不能判断是否达到平衡,D错误;
故选C。
二、非选择题
9.(1)<(2)<(3)<(4)=
解析:(1)根据图中曲线和“先拐先平衡数值大”得到T1<T2,故答案为:<。
(2)根据图从T1到T2,温度升高,C%降低,说明平衡逆向移动,即逆向是吸热反应,正向为放热反应即ΔH<0;故答案为:<。
(3)根据图中曲线和“先拐先平衡数值大”得到p1<p2,故答案为:<。
(4)根据图从p1到p2,增大压强,B%没有改变,平衡没有移动,说明反应是等体积反应即b=c+d;故答案为:=。
10.(1) 减小 减小
(2)不变
(3)增大
(4) 不变 减小
解析:(1)该反应的正方向为吸热反应,所以降低温度,平衡逆移,Cl2的转化率 减小;v正减小;故答案为减小、减小;
(2)保持容器体积不变,加入He,容器体积不变,各物质的浓度不变,所以对反应无影响,所以HCl的物质的量不变,故答案为不变;
(3)保持容器压强不变,加入He,体积变大,反应物所占分压减小,平衡正移,则O2的浓度增大,故答案为增大;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器的体积不变,气体的总质量也不变,,所以容器内气体的密度,,但是气体总物质的量增大,所以相对分子质量减小.故答案为不变;减小。
11.(1) 2.5 生成气泡的快慢 1.00 采用控制变量法进行实验,保证其它条件都相同,只有实验a使用了Mn2+,实验b没有使用Mn2+这一个外界条件不同 实验a中褪色比实验b快,产生气泡比b早; 2+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(2) Fe3++3SCN-Fe(SCN)3 红色加深 正向移动 减小 不移动
解析:(1)①H2C2O4被酸性KMnO4氧化为CO2逸出,根据电子守恒、原子守恒,可得该反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H20+10CO2↑。为了观察到实验现象从而判断反应的快慢,H2C2O4与KMnO4初始的物质的量需要满足关系为:n(H2C2O4) :n(KMnO4)≥2.5;
反应快慢可通过逸出CO2气体,根据反应产生气泡的快慢来判断;
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,溶液褪色总是先慢后快。为验证Mn2+是否对反应有催化作用,应该保持其它外界条件都相同,根据表格数据可知V=1.00 mL;
在实验b中加入蒸馏水的目的是使其它反应条件都相同,只改变一个变量,即采用控制变量法进行实验;
预期实验现象是:实验a中使用了催化剂,褪色比实验b快,产生气泡也比b快;
同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,这是由于Cl-具有还原性,会被酸性KMnO4溶液氧化,也会导致溶液褪色,用离子方程式表示为:2+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)①在实验II中,在甲试管中FeCl3与KSCN发生反应产生Fe(SCN)3和KCl,反应的离子方程式为:Fe3++3SCN-Fe(SCN)3;
②在试管乙中,向上述平衡体系中加入几滴饱和FeCl3溶液,溶液中c(Fe3+)增大,化学平衡正向移动,最终达到平衡时溶液中c[Fe(SCN)3]增大,溶液红色加深;但平衡移动的趋势是微弱的,平衡移动使c(Fe3+)减小的影响远小于加入饱和FeCl3溶液使c(Fe3+)增大的影响,因此反应重新达到平衡时Fe3+转化率减小;
③向试管丙中加入KC1固体,固体溶解电离产生K+、Cl-,但不能改变反应体系中任何一种微粒的浓度,因此化学平衡不移动。
12.(1) Fe3++3H2OFe(OH)3+3H+ [FeCl4]-
(2)逆反应
(3)阴离子均为氯离子,加入NaCl,溶液颜色变浅程度较大
(4)加入盐酸,氯离子浓度增大,Fe3++4C1-[FeCl4]-平衡正向移动,Fe3+浓度减小,Fe3++3SCN-Fe(SCN)3平衡逆向移动,溶液颜色变浅
(5)
(6)加入1mL蒸馏水,再加入1mL1.5mol·L-1硫酸
解析:(1)稀盐酸酸化FeCl3溶液的目的是抑制Fe3+水解Fe3++3H2OFe(OH)3+3H+; [FeCl4]-有颜色, 采用浓度较低的FeCl3液制备Fe3+和SCN-平衡体系,是为了避免[FeCl4]-的颜色对实验干扰,
故答案为: Fe3++3H2OFe(OH)3+3H+;[FeCl4]-;
(2)随着KCl浓度增大,Fe3+ +4Cl- =[FeCl4]-平衡正向移动,Fe3+浓度减小,Fe3++ 3SCN-= Fe(SCN)3平衡逆向移动,故答案为:逆反应;
(3)实验①和实验②对比,阴离子均为氯离子,阴离子相同,阳离子不同,实验①、②中阴离子种类、浓度均相同,依据②中溶液颜色变浅程度相较于①更大,故答案为: 阴离子均为氯离子,加入NaCl,溶液颜色变浅程度较大;
(4)实验④中加入1mL3mol·L-1盐酸,增大Cl-浓度,Fe3+ +4Cl- =[FeCl4]-平衡正向移动,明显变浅,溶液偏黄色,Fe3+浓度降低,Fe3++ 3SCN-= Fe(SCN)3逆向移动,溶液颜色明显变浅,
故答案为: 加入盐酸,氯离子浓度增大,Fe3++4C1-[FeCl4]-平衡正向移动,Fe3+浓度减小,Fe3++3SCN-Fe(SCN)3平衡逆向移动,溶液颜色变浅;
(5)取1mL0.0025mol:L-1Fe2(SO4)3溶液(无色),加入1mL0.01mol·L-1KSCN溶液,再加入1mL1.5mol·L-1硫酸,溶液先变红,加硫酸后变为浅黄色,刚开始变红是因为发生反应Fe3+ + 3SCN- = Fe(SCN)3,此时溶液含有, 但溶液颜色没有影响,加入硫酸后颜色发生变化,说明对该平衡体系没有影响,故答案为: ;
(6)根据实验⑤溶液呈浅黄色的原因可能是Fe(SCN)3或Fe2(SO4)3,实验⑦取1mL0.005mol/LFeCl3溶液(无色),加入1mL蒸馏水,再加入1mL1.5mol·L-1硫酸,得到无色溶液,证明不是Fe2 (SO4)3使溶液呈浅黄色,
故答案为: 加入1mL蒸馏水,再加入1mL1.5mol·L-1硫酸
一、选择题
1.C、Si同处于ⅣA族,它们的单质或化合物有重要用途。实验室可用回收废液中的苯酚,工业上用和焦炭高温下反应制得粗硅,再经如下2步反应制得精硅: ,,反应过程中可能会生成。有关反应的说法正确的是
A.该反应在低温条件下不能自发
B.其他条件不变,增大压强平衡产率减小
C.实际工业生产选择高温,原因是高温时Si的平衡转化率比低温时大
D.如图所示,当,平衡产率减小说明发生了副反应
2.在一定条件下,恒容密闭容器中反应2A(g)2B(g)+C(g) ΔH>0,达到平衡后,能使B的浓度增大的措施是
A.升温 B.充入惰性气体 C.加压 D.减少A的浓度
3.两个均充有H2S的刚性密闭容器,起始压强均为pkPa,以温度、Al2O3催化剂为条件变量,进行实验:2H2S(g)2H2(g)+S2(g),反应相同时间,结果如图所示。下列说法错误的是
A.温度升高,H2S分解的正,逆反应速率均增大
B.900℃,ts后达平衡,H2的平均生成速率为pkPa s 1
C.Al2O3催化剂使得正反应的活化能小于逆反应的活化能
D.1100℃,曲线II、III重合,说明Al2O3催化剂失去活性
4.可逆反应达到平衡的重要特征是( )
A.反应停止了
B.正、逆反应的速率均为零
C.正、逆反应都还在继续进行
D.正、逆反应的速率相等
5.在密闭容器中用一定量的混合气体发生反应:,平衡时测得B的浓度为0.5,保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得B的浓度为1.1,下列有关判断正确的是
A. B.A的转化率减小
C.平衡向正反应方向移动 D.C的体积分数增大
6.已知反应A2(g) + 2B2(g)2AB2(g) 的△H<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡逆向移动
7.已知反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小 B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)减小
8.在恒温恒容的密闭容器中发生反应,下列叙述中,能说明反应已达平衡状态的是
A.混合气体的压强不发生变化
B.该反应的平衡常数K不发生变化
C.混合气体的密度不发生变化
D.消耗CO的速率与生成的速率相等
二、非选择题
9.可逆反应aA(s)+bB(g) cC(g)+dD(g) ΔH=Q kJ mol 1,反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析可知:(填>、<或=)
(1)T1___________T2
(2)ΔH___________ 0
(3)p1___________p2
(4)b___________ c+d
10.可逆反应,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,的转化率___________;___________;
(2)保持容器体积不变,加入He,则HCl的物质的量___________;
(3)保持容器压强不变,加入He,则的浓度___________;
(4)若温度和体积不变,反应从和开始至平衡,在这个变化过程中,容器内气体的密度___________,相对分子质量___________
11.某实验小组采用下列实验探究外界条件对化学反应速率及其化学平衡的影响。按要求回答下列问题:
(1)实验(I)目的是探究浓度对反应速率的影响。
①为了观察到明显的现象,它们初始物质的量需要满足的关系为:n(H2C2O4):n(KMnO4)_____。反应的快慢可通过测定_____来判断。
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
甲同学据此提出以下假设:
假设1:反应放热
假设2:生成Mn2+对反应有催化作用
乙同学用如下实验证明假设2成立:
实验编号 室温下,试管中所加试剂及用量/mL
0.20 mol/LH2C2O4溶液 0.10 mol/L酸性KMnO4溶液 0.10 mol/LMnSO4溶液 H2O
a 4.00 1.00 1.00 0
b 4.00 1.00 0 V
则实验b中V=_____mL,在实验b中加入蒸馏水的目的是_____。预期的实验现象是_____,同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,其原因是(用离子方程式表示)_____。
(2)实验(II)探究浓度对化学平衡的影响。
①试管甲中发生反应的离子方程式为___________。
②试管乙中的现象是______,说明增大溶液中的Fe3+浓度,平衡______,重新达到平衡时Fe3+转化率______。
③向试管丙中加入KC1固体,平衡________。
12.某小组同学探究盐对Fe3++3SCN-Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响将已用稀盐酸酸化0.005mol·L-1FeCl3溶液(无色)和0.01mol·L-1KSCN溶液等体积混合,静置至体系达平衡,得红色溶液X。各取2mL溶液X放入3支比色皿中,分别滴加0.1mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②Cl、与Fe3+均能发生络合反应:Fe3++4C1-[FeCl4]-(黄色)、Fe3++2[Fe(SO4)2]-(无色)。
(1)稀盐酸酸化FeCl3溶液的目的是___________。(用离子方程式表示)。采用浓度较低的FeCl3溶液制备Fe3+和SCN-的平衡体系,是为了避免___________(填离子符号)的颜色对实验干扰。
(2)从实验结果来看,KCl溶液确实对Fe3+和SCN-平衡体系有影响,且随着KCl浓度增大,Fe3++3SCN-Fe(SCN)3平衡向___________(填“正反应”或“逆反应”)方向移动。
实验II:探究盐对Fe3+和SCN-平衡体系产生影响的原因
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。KCl溶液的加入使Fe3+和SCN-平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应Fe3++4C1-[FeCl4]-,离子浓度发生变化,导致Fe3+和SCN-平衡状态发生变化。
(3)基于以上分析,该组同学取2mL红色溶液X,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
序号 加入少量盐 溶液颜色
① KCl 变浅
② NaCl 变浅程度较大
基于以上实验现象可得出结论:K+的盐效应弱于Na+的盐效应。简述获得结论的依据:______。
(4)取2mL溶液X继续进行实验,结果如下表。
序号 加入溶液 溶液颜色
③ 1mL蒸馏水 略变浅
④ 1mL3mol·L-1盐酸 明显变浅,溶液偏黄
⑤ 1mL1.5mol·L-1硫酸 现象a:溶液变为浅黄色
上述实验③和实验④可证明副反应影响了Fe3+和SCN-平衡体系,结合实验现象及化学用语分析副反应对Fe3+和SCN-平衡体系有影响的原因:___________。
实验III:探究现象a中溶液变为浅黄色的的原因
序号 实验操作 溶液颜色
⑥ 取1mL0.0025mol:L-1Fe2(SO4)3溶液(无色),加入1mL0.01mol·L-1KSCN溶液,再加入1mL1.5mol·L-1硫酸 溶液先变红,加入硫酸后变为浅黄色
⑦ 取1mL0.005mol·L-1FeCl3溶液(无色) 溶液为无色
(5)由实验④、实验⑤和实验⑥可知,溶液变为浅黄色与___________(填微粒的化学式)无关。
(6)为了进一步确认现象a中使溶液呈浅黄色的微粒只有Fe(SCN)3,补充完整实验⑦的操作___________。
【参考答案】
一、选择题
1.D
解析:A.该反应当中,反应前气体的计量系数和为3,反应后气体的计量系数和为2,故反应的△S<0,根据△H-T△S<0反应能够自发,反应为放热反应,则该反应在低温条件下能自发,A错误;
B.加压向气体计量系数减小的方向移动,对于该反应来说是正向移动,SiHCl3平衡产率增大,B错误;
C.由题干信息可知,该反应为放热反应,升高温度平衡逆向移动,即高温时Si的平衡转化率比低温时小,C错误;
D.由图可知,当>3,SiHCl3平衡产率减小,说明此时SiHCl3参与了其他的反应,导致平衡体系内SiHCl3浓度降低,产率降低,D正确;
故选D。
2.A
解析:A.该反应正反应是吸热反应,升高温度,平衡正向移动,B的浓度增大,选项A正确;
B.反应在恒容密闭容器中进行,充入惰性气体,气体的总压增大,但参与反应的气体浓度增不变,平衡不移动,B的浓度不变,选项B错误;
C.增大压强,平衡向气体体积缩小的逆反应方向移动,B的浓度减小,选项C错误;
D.减少A的浓度,平衡逆向移动,B的浓度减小,选项D错误;
答案选A。
3.C
解析:A.温度升高,反应速率均增大即H2S分解的正,逆反应速率均增大,故A正确;
B.900℃,ts后达平衡,硫化氢的转化率为50%,则氢气的压强为0.5pkPa,则H2的平均生成速率为,故B正确;
C.根据图中曲线分析,升高温度,硫化氢的转化率增大,因此该反应是吸热反应,则正反应的活化能大于逆反应的活化能,而加入Al2O3催化剂使正反应和逆反应活化能都降低,但正反应的活化能仍大于逆反应的活化能,故C错误;
D.催化剂需要适宜温度,在1100℃,曲线II、III重合,说明Al2O3催化剂可能几乎失去活性,故D正确。
综上所述,答案为C。
4.D
解析:A.化学平衡是动态平衡,达到平衡时反应并没有停止,A不符合题意;
B.达到平衡时,正、逆反应速率相等但不为0,B不符合题意;
C.正、逆反应都还在进行并不是达到平衡的特征,如达到平衡之前正逆反应也都在进行,C不符合题意;
D.达到化学平衡状态时,正、逆反应的速率相等且不等于0为达到平衡的特征,D符合题意。
答案选D。
5.B
【分析】压缩体积到原来的一半即增大压强,若体系中平衡不移动,则B的浓度为原来的2倍,即0.5mol L 1×2=1.0mol L 1,而B的浓度为1.1mol L 1,说明平衡移动向生成B的方向移动,即逆反应方向移动,加压平衡向着气体分子数减少的方向移动,即m+n
C.根据分析可知加压平衡向着气体分子数减少的方向移动,即反应逆向移动,故C错误;
D.根据分析可知,反应逆向移动,C的体积分数减小,故D错误;
故答案为:B。
6.B
解析:A.升高温度,正逆向反应速率均会增大,A错误;
B.升高温度,提高活化分子百分数,有利于反应速率增加,从而缩短达到平衡的时间,B正确;
C.上述反应是气体分子数减少的放热反应,所以升高温度,不利于反应向正向移动,C错误;
D.上述反应是气体分子数减少的放热反应,降低温度平衡正向移动,D错误;
故选B。
7.A
【分析】上述反应为气体分子数不变的放热反应,结合影响化学平衡的因素分析解答。
解析:A.反应放热,所以升高温度,化学平衡常数K减小,A正确;
B.减小压强,平衡不移动,n(CO2)不变,B错误;
C.催化剂不改变化学平衡,所以平衡态的α(CO)不变,C错误;
D.在一定温度和压强下于密闭容器中充入一定量的非反应气体氮气,对于反应体系的各物质浓度不影响,所以n(H2)不变,D错误;
故选A。
8.C
解析:A.反应前后气体分子个数不发生变化,恒温恒容条件下压强一直不变,A错误;
B.反应的平衡常数K只与温度有关,温度不变平衡常数不变,B错误;
C.根据,恒温恒容条件下,密度不变即气体质量不变,反应达到平衡状态,C正确;
D.消耗CO的速率与生成的速率相等只表示正反应速率,不能判断是否达到平衡,D错误;
故选C。
二、非选择题
9.(1)<(2)<(3)<(4)=
解析:(1)根据图中曲线和“先拐先平衡数值大”得到T1<T2,故答案为:<。
(2)根据图从T1到T2,温度升高,C%降低,说明平衡逆向移动,即逆向是吸热反应,正向为放热反应即ΔH<0;故答案为:<。
(3)根据图中曲线和“先拐先平衡数值大”得到p1<p2,故答案为:<。
(4)根据图从p1到p2,增大压强,B%没有改变,平衡没有移动,说明反应是等体积反应即b=c+d;故答案为:=。
10.(1) 减小 减小
(2)不变
(3)增大
(4) 不变 减小
解析:(1)该反应的正方向为吸热反应,所以降低温度,平衡逆移,Cl2的转化率 减小;v正减小;故答案为减小、减小;
(2)保持容器体积不变,加入He,容器体积不变,各物质的浓度不变,所以对反应无影响,所以HCl的物质的量不变,故答案为不变;
(3)保持容器压强不变,加入He,体积变大,反应物所占分压减小,平衡正移,则O2的浓度增大,故答案为增大;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器的体积不变,气体的总质量也不变,,所以容器内气体的密度,,但是气体总物质的量增大,所以相对分子质量减小.故答案为不变;减小。
11.(1) 2.5 生成气泡的快慢 1.00 采用控制变量法进行实验,保证其它条件都相同,只有实验a使用了Mn2+,实验b没有使用Mn2+这一个外界条件不同 实验a中褪色比实验b快,产生气泡比b早; 2+16H++10Cl-=2Mn2++5Cl2↑+8H2O
(2) Fe3++3SCN-Fe(SCN)3 红色加深 正向移动 减小 不移动
解析:(1)①H2C2O4被酸性KMnO4氧化为CO2逸出,根据电子守恒、原子守恒,可得该反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H20+10CO2↑。为了观察到实验现象从而判断反应的快慢,H2C2O4与KMnO4初始的物质的量需要满足关系为:n(H2C2O4) :n(KMnO4)≥2.5;
反应快慢可通过逸出CO2气体,根据反应产生气泡的快慢来判断;
②在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,溶液褪色总是先慢后快。为验证Mn2+是否对反应有催化作用,应该保持其它外界条件都相同,根据表格数据可知V=1.00 mL;
在实验b中加入蒸馏水的目的是使其它反应条件都相同,只改变一个变量,即采用控制变量法进行实验;
预期实验现象是:实验a中使用了催化剂,褪色比实验b快,产生气泡也比b快;
同学们认为不宜用MnCl2溶液代替MnSO4溶液对该反应进行催化探究,这是由于Cl-具有还原性,会被酸性KMnO4溶液氧化,也会导致溶液褪色,用离子方程式表示为:2+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)①在实验II中,在甲试管中FeCl3与KSCN发生反应产生Fe(SCN)3和KCl,反应的离子方程式为:Fe3++3SCN-Fe(SCN)3;
②在试管乙中,向上述平衡体系中加入几滴饱和FeCl3溶液,溶液中c(Fe3+)增大,化学平衡正向移动,最终达到平衡时溶液中c[Fe(SCN)3]增大,溶液红色加深;但平衡移动的趋势是微弱的,平衡移动使c(Fe3+)减小的影响远小于加入饱和FeCl3溶液使c(Fe3+)增大的影响,因此反应重新达到平衡时Fe3+转化率减小;
③向试管丙中加入KC1固体,固体溶解电离产生K+、Cl-,但不能改变反应体系中任何一种微粒的浓度,因此化学平衡不移动。
12.(1) Fe3++3H2OFe(OH)3+3H+ [FeCl4]-
(2)逆反应
(3)阴离子均为氯离子,加入NaCl,溶液颜色变浅程度较大
(4)加入盐酸,氯离子浓度增大,Fe3++4C1-[FeCl4]-平衡正向移动,Fe3+浓度减小,Fe3++3SCN-Fe(SCN)3平衡逆向移动,溶液颜色变浅
(5)
(6)加入1mL蒸馏水,再加入1mL1.5mol·L-1硫酸
解析:(1)稀盐酸酸化FeCl3溶液的目的是抑制Fe3+水解Fe3++3H2OFe(OH)3+3H+; [FeCl4]-有颜色, 采用浓度较低的FeCl3液制备Fe3+和SCN-平衡体系,是为了避免[FeCl4]-的颜色对实验干扰,
故答案为: Fe3++3H2OFe(OH)3+3H+;[FeCl4]-;
(2)随着KCl浓度增大,Fe3+ +4Cl- =[FeCl4]-平衡正向移动,Fe3+浓度减小,Fe3++ 3SCN-= Fe(SCN)3平衡逆向移动,故答案为:逆反应;
(3)实验①和实验②对比,阴离子均为氯离子,阴离子相同,阳离子不同,实验①、②中阴离子种类、浓度均相同,依据②中溶液颜色变浅程度相较于①更大,故答案为: 阴离子均为氯离子,加入NaCl,溶液颜色变浅程度较大;
(4)实验④中加入1mL3mol·L-1盐酸,增大Cl-浓度,Fe3+ +4Cl- =[FeCl4]-平衡正向移动,明显变浅,溶液偏黄色,Fe3+浓度降低,Fe3++ 3SCN-= Fe(SCN)3逆向移动,溶液颜色明显变浅,
故答案为: 加入盐酸,氯离子浓度增大,Fe3++4C1-[FeCl4]-平衡正向移动,Fe3+浓度减小,Fe3++3SCN-Fe(SCN)3平衡逆向移动,溶液颜色变浅;
(5)取1mL0.0025mol:L-1Fe2(SO4)3溶液(无色),加入1mL0.01mol·L-1KSCN溶液,再加入1mL1.5mol·L-1硫酸,溶液先变红,加硫酸后变为浅黄色,刚开始变红是因为发生反应Fe3+ + 3SCN- = Fe(SCN)3,此时溶液含有, 但溶液颜色没有影响,加入硫酸后颜色发生变化,说明对该平衡体系没有影响,故答案为: ;
(6)根据实验⑤溶液呈浅黄色的原因可能是Fe(SCN)3或Fe2(SO4)3,实验⑦取1mL0.005mol/LFeCl3溶液(无色),加入1mL蒸馏水,再加入1mL1.5mol·L-1硫酸,得到无色溶液,证明不是Fe2 (SO4)3使溶液呈浅黄色,
故答案为: 加入1mL蒸馏水,再加入1mL1.5mol·L-1硫酸
