第五章《合成高分子》单元测试卷(含解析)2023-2024学年下学期人教版(2019)高二化学选择性必修3
文档属性
| 名称 | 第五章《合成高分子》单元测试卷(含解析)2023-2024学年下学期人教版(2019)高二化学选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 12:56:31 | ||
图片预览



文档简介
第五章《合成高分子》单元测试卷
一、单选题
1.某高分子化合物的结构简式为:合成它的单体可能有
①邻苯二甲酸() ②丙烯醇 ③丙烯 ④乙烯 ⑤邻苯二甲酸甲酯 ⑥甲醛
A.④⑤⑥ B.③④ C.④⑤ D.①②
2.被称为碳的第四种同素异形体的链式炔碳 的一个分子中含300~500个碳原子;导电塑料聚乙炔的结构简式为-[CH=CH]-n。有关这两种物质的下列说法中正确的是
A.都是有机高分子化合物
B.都可以看作为乙炔的加聚产物
C.都能燃烧且一定条件下都可以与H2发生加成反应
D.都有很高的熔点和硬度且难溶于水
3.高分子M广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如下图。下列说法错误的是
A.试剂a是甲醇
B.化合物B不存在顺反异构体
C.合成M的聚合反应是缩聚反应
D.利用质谱仪测定M的平均相对分子质量可得其聚合度
4.越来越多的高分子材料得到人们的重视,下列有关高分子化合物的说法错误的是
A.酚醛树脂是用苯酚和甲醇在酸或碱的催化作用下缩合成的高分子化合物
B.聚乳酸是由单体通过缩聚反应生成的
C.涤纶属于合成纤维
D.塑料可分为热塑性塑料和热固性塑料
5.山梨酸是一种高效安全的防腐保鲜剂。其合成路线如图所示,下列说法正确的是
A.反应1属于加聚反应
B.根据溴水是否褪色可以鉴别巴豆醛和山梨酸
C.聚酯不能使酸性高锰酸钾褪色
D.聚酯中存在1个手性碳原子(注:连有四个不同的原子或基团的碳称为手性碳)
6.下列说法正确的是
A.酚醛树脂可由邻羟甲基苯酚发生缩聚反应得到
B.合成的单体是乙烯和2-丁烯
C.己二酸与乙醇可缩聚形成高分子化合物
D.由合成的聚合物为
7.瓜环[n](n=5,6,7,8…)是一种具有大杯空腔、两端开口的化合物(结构如图),在分子开关、催化剂、药物载体等方面有广泛应用。瓜环[n]可由和HCHO在一定条件下合成。
下列说法不正确的是
A.合成瓜环的两种单体中分别含有酰胺基和醛基
B.分子间可能存在不同类型的氢键
C.生成瓜环[n]的反应中,有键断裂
D.合成1mol瓜环[7]时,有7mol水生成
8.2022 北京冬奥会处处体现“科技、发展、环保、和平”的理念,下列说法错误的是
A.冬奥场馆通过光伏发电和风力发电获得的电能属于可再生清洁能源
B.火爆全网的吉祥物“冰墩墩”的毛绒材质主要是聚酯纤维属于合成纤维
C.运动员的头盔、滑板,主火炬等多处使用的碳纤维属于有机高分子材料
D.首钢滑雪大跳台的主体结构使用的特种钢属于金属材料
9.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛用于食品、蔬菜的外包装,但它对人体有潜在危害。下列有关叙述中不正确的是
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC的单体不能由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可将其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则为PVC;不变红,则为PE
D.等质量的聚乙烯和乙烯分别完全燃烧,聚乙烯消耗的氧气多
10.下列物质中,属于天然高分子化合物的是
A.塑料 B.油脂 C.纤维素 D.合成橡胶
11.某高分子化合物R的结构简式如图,下列有关R的说法正确的是
A.R的单体之一的分子式为C9H10O2
B.R可通过加聚和缩聚反应合成,完全水解后生成物均为小分子有机物
C.R是一种溶于水的物质
D.碱性条件下,1molR完全水解消耗NaOH的物质的量为n(m+1)mol
12.下列合成路线不合理的是
A.用环己烷合成1,3环已二烯:
B.用二甲基二氯硅烷合成硅橡胶:(CH3)2SiCl2(CH3)2Si(OH)2硅橡胶
C.用乙烯合成乙酸:
D.用乙醇合成乙二醇:
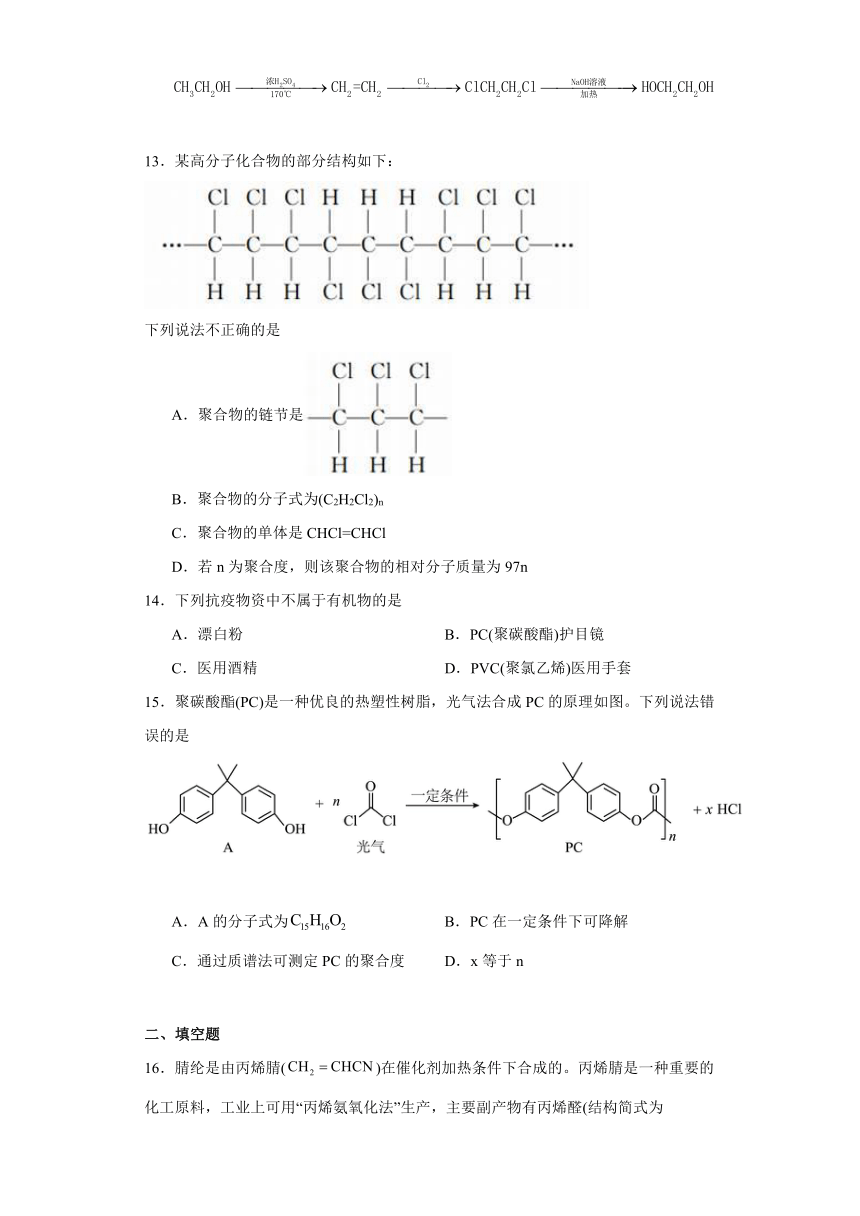
13.某高分子化合物的部分结构如下:
下列说法不正确的是
A.聚合物的链节是
B.聚合物的分子式为(C2H2Cl2)n
C.聚合物的单体是CHCl=CHCl
D.若n为聚合度,则该聚合物的相对分子质量为97n
14.下列抗疫物资中不属于有机物的是
A.漂白粉 B.PC(聚碳酸酯)护目镜
C.医用酒精 D.PVC(聚氯乙烯)医用手套
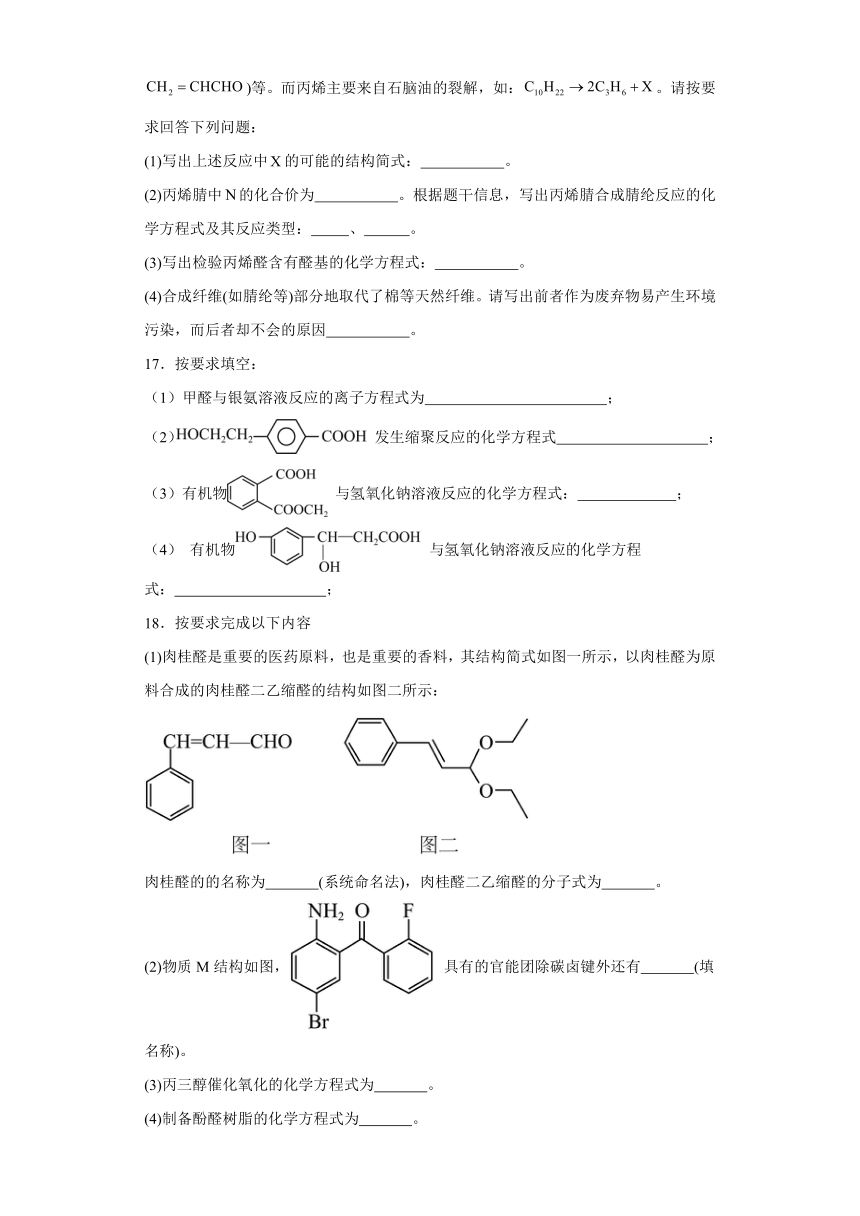
15.聚碳酸酯(PC)是一种优良的热塑性树脂,光气法合成PC的原理如图。下列说法错误的是
A.A的分子式为 B.PC在一定条件下可降解
C.通过质谱法可测定PC的聚合度 D.x等于n
二、填空题
16.腈纶是由丙烯腈()在催化剂加热条件下合成的。丙烯腈是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(结构简式为)等。而丙烯主要来自石脑油的裂解,如:。请按要求回答下列问题:
(1)写出上述反应中的可能的结构简式: 。
(2)丙烯腈中的化合价为 。根据题干信息,写出丙烯腈合成腈纶反应的化学方程式及其反应类型: 、 。
(3)写出检验丙烯醛含有醛基的化学方程式: 。
(4)合成纤维(如腈纶等)部分地取代了棉等天然纤维。请写出前者作为废弃物易产生环境污染,而后者却不会的原因 。
17.按要求填空:
(1)甲醛与银氨溶液反应的离子方程式为 ;
(2) 发生缩聚反应的化学方程式 ;
(3)有机物 与氢氧化钠溶液反应的化学方程式: ;
(4) 有机物 与氢氧化钠溶液反应的化学方程式: ;
18.按要求完成以下内容
(1)肉桂醛是重要的医药原料,也是重要的香料,其结构简式如图一所示,以肉桂醛为原料合成的肉桂醛二乙缩醛的结构如图二所示:
肉桂醛的的名称为 (系统命名法),肉桂醛二乙缩醛的分子式为 。
(2)物质M结构如图, 具有的官能团除碳卤键外还有 (填名称)。
(3)丙三醇催化氧化的化学方程式为 。
(4)制备酚醛树脂的化学方程式为 。
(5)合成结构简式为 的高分子材料的单体为 。
三、实验题
19.氨基甲磺酸(H2NCH2SO3H)具有抗癌和抗病毒活性,在生产生活领域应用广泛。某兴趣小组在实验室模拟工业上用氨气、甲醛和亚硫酸氢钠反应制备氨基甲磺酸的反应,装置及步骤如下。
查阅资料:①甲醛为无色、有特殊刺激性气味的气体,具有还原性。
②氨基甲磺酸为白色结晶或粉末.微溶于水、甲醇和乙醚,溶于碱液。
③制备过程涉及的反应HCHO+NaHSO3→HOCH2SO3Na;
HOCH2SO3Na+NH3→H2NCH2SO3Na+H2O;
2H2NCH2SO3Na+H2SO4→2H2NCH2SO3H+Na2SO4。
步骤Ⅰ:准确量取含66.0g甲醛的水溶液,加入三颈烧瓶中;
步骤Ⅱ:控制温度10℃左右,缓慢加入饱和亚硫酸氢钠溶液至过量,缓慢升温到50℃左右继续反应;
步骤Ⅲ:待反应完成后,通入过量氨气,充分反应;
步骤Ⅳ:反应完成后,缓慢加入足量的硫酸溶液,降温结晶,过滤并用冰水洗涤,得干燥固体177.6g。
回答下列问题:
(1)仪器甲的名称为 ;步骤Ⅱ中控制温度50℃左右的加热方式最好是 。
(2)实验室用氯化铵和氢氧化钙反应制取氨气的化学方程式为 。装置A能够制取少量氨气,请结合化学用语简述原理: 。
(3)步骤Ⅳ中,用冰水洗涤的目的是 。
(4)装置B中,导管a的作用是 。
(5)本实验中的产品产率为 (保留三位有效数字)。
20.聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。反应方程式及主要装置示意图如下:
回答问题:
(1)仪器A的名称是 ,P4O10作用是 。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为 .。
(3)浴槽中可选用的适宜冷却剂是 (填序号)。
序号 冷却剂 最低温度/℃
甲 NaCl-冰(质量比1:3) -21
乙 CaCl2·6H2O-冰(质量比1.43:1) -55
丙 液氨 -33
(4)补齐操作步骤
选项为:a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量正己烷
① (填编号);
②待反应体系温度下降至既定温度:
③ (填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×106,平均聚合度为 。
21.己二酸是工业上具有重要用途的二元羧酸,白色晶体,易溶于酒精,熔点153℃,主要用于制造尼龙,泡沫塑料及润滑剂和增塑剂等,用途十分广泛。生产原理如下:
绿色合成法流程如下:
①在150mL三颈烧瓶加入2.00g催化剂(由乌酸钠和草酸合成),50mL30%的H2O2溶液和磁子;室温下搅拌15~20分钟后,加入12.3g环己烯;连接好装置(如图所示,固定夹持仪器已略去),继续快速剧烈搅拌并加热,在80~90℃反应3h后,得到热的合成液。
②趁热倒出三颈烧瓶中的产品,在冷水中降温冷却,析出的晶体在布氏漏斗上进行抽滤,将晶体进行重结晶,用3mL-洗涤晶体,再抽滤。取出产品,洗涤、干燥后称重,得纯净的己二酸12.8g。(己二酸溶解度随温度变化较大)
回答下列问题:
(1)绿色合成法中仪器b的名称为 ,其作用是 。
(2)传统法与绿色制备的原理相比,传统法被淘汰的主要原因是 。
(3)绿色合成时,反应需维持温度在80~90℃,最好采取 加热。
(4)洗涤晶体时应选择的最合适的洗涤剂为 (填字母序号)
A. 热水 B. 冷水 C. 乙醇 D. 滤液
(5)抽滤装置中仪器C的作用除了增大系统容积做缓冲瓶之外,另一个作用是 。
(6)该实验的产物的产率为 (结果保留4位有效数字)。
试卷第4页,共9页
参考答案:
1.D
【详解】由结构简式可知,合成高分子化合物的反应为邻苯二甲酸与丙烯醇一定条件下发生置换反应生成邻苯二甲酸二丙烯酯,邻苯二甲酸二丙烯酯一定条件下发生加聚反应生成聚邻苯二甲酸二丙烯酯,所以合成高分子化合物的单体为邻苯二甲酸和丙烯醇,故选D。
2.C
【详解】链式炔碳是单质不是化合物,选项A、B不正确;应用分子中都含有碳碳三键或碳碳双键,因此都能和氢气发生加成反应,且都可以燃烧,选项C正确;选项D不正确,链式炔碳的熔点和硬度不是很大,答案选C。
3.C
【分析】由高分子M的结构采用弯箭头法可知其单体为CH2=CHOCH3和 ,则B为CH2=CHOCH3,C为 ,乙炔和试剂a为甲醇发生加成反应得到CH2=CHOCH3。
【详解】A.物质B为CH2=CHOCH3,由乙炔和甲醇发生加成反应得到,因此试剂a是甲醇,故A正确;
B.化合物B为CH2=CHOCH3,左边碳连有两个氢原子,因此不存在顺反异构体,故B正确;
C.合成M的聚合反应是加聚反应,是由CH2=CHOCH3和 加聚得到,故C错误;
D.利用质谱仪测定M的平均相对分子质量,再除以链节的相对分子质量,从而得到其聚合度,故D正确;
综上所述,答案为C。
4.A
【详解】A.酚醛树脂是用苯酚和甲醛在酸或碱的催化作用下缩合成的高分子化合物,A错误;
B.聚乳酸是由乳酸单体通过分子间缩聚反应生成的,B正确;
C.涤纶、腈纶等均属于合成纤维,C正确;
D.塑料可分为热塑性塑料和热固性塑料,D正确。
故答案为:A。
5.A
【详解】A.反应1没有小分子物质生成,属于加聚反应,故A正确;
B.巴豆醛、山梨酸都含有碳碳双键,都可以和溴水发生加成反应而褪色,用溴水不能鉴别二者,故B错误;
C. 聚酯中含碳碳双键、能使酸性高锰酸钾褪色,故C错误;
D. 聚酯中每1个链节存在1个手性碳原子,含n个手性碳原子,故D错误;
答案选A。
6.A
【详解】A.邻羟甲基苯酚发生缩聚反应脱去水可得到酚醛树脂,故A正确;
B.根据“见双键,四个碳,无双键,两个碳”规律画线断开,然后将半键闭合,可得到的单体为1,3-丁二烯和丙烯,故B错误;
C.己二酸与乙醇可发生酯化反应生成己二酸二乙酯,但不能缩聚形成高分子化合物,故C错误;
D.发生加聚反应生成的聚合物为,故D错误;
故答案为A。
7.D
【详解】A. 中含有酰胺基、HCHO中含有醛基,故A正确;
B. 分子中含N、O两种非金属性较强的元素,分子之间可以形成OH、NH两种氢键,故B正确;
C.生成瓜环[n]的反应中,甲醛中的C=O键断裂,即键断裂,故C正确;
D.由瓜环[n]结构简式可知生成1mol链节结构生成2mol水,则合成1mol瓜环[7]时,有14mol水生成,故D错误;
故选:D。
8.C
【详解】A.可再生能源是指原材料可以再生的能源如水力发电、风力发电、光伏发电、生物能沼气、海潮能等,故A正确;
B.毛绒材质中的聚酯纤维是有机合成高分子材料,属于合成纤维,故B正确;
C.碳纤维的主要成分是碳,属于新型无机非金属材料,不属于有机高分子材料,故C错误;
D.特种钢是性能优良的铁合金,属于金属材料,故D正确;
故选C。
9.D
【详解】A.PE、PVC都属于链状高分子化合物,能溶于酒精,加热熔化、冷却后变成固体,可以反复进行,A正确;
B.PVC单体为氯乙烯,应该由乙炔和HCl加成得到,PE是乙烯的加聚产物,因此PVC的单体不能由PE的单体与氯化氢加成制得,B正确;
C.PVC受热时可产生HCl气体,PE则不能,可用蓝色石蕊试纸检验,试纸变红的则为PVC,试纸不变红则为PE,C正确;
D.乙烯是聚乙烯的单体,它们的最简式相同,它们含C和H的质量分数分别相等,所以等质量的两者分别完全燃烧消耗的O2相等,D错误;
答案选D。
10.C
【详解】A. 塑料是人工合成高分子材料,A不符合题意;
B. 油脂是由高级脂肪酸的甘油油酯,不属于高分子化合物,B不符合题意;
C. 纤维素是由数千个葡萄糖单元构成的天然高分子化合物,C符合题意;
D. 合成橡胶是合成高分子材料,D不符合题意;
答案选C。
11.D
【详解】A.由结构可知,单体为CH2=C(CH3)COOH、OHCH2CH2OH、HOOCCHOHCH2C6H5,R的单体之一的分子式为C9H10O3,A项错误;
B.单体中存在C=C、-OH、-COOH,则通过加聚反应和缩聚反应可以生成R,含-COOC-,完全水解生成乙二醇、HOOCCHOHCH2C6H5和一种高分子化合物,B项错误;
C.R为高分子化合物,难溶于水,C项错误;
D.1molR中含n(1+m)mol-COOC-,则碱性条件下,1molR完全水解消耗NaOH的物质的量为n(m+1)mol,D项正确;
答案选D。
12.A
【详解】A.在氢氧化钠溶液中发生水解反应生成,得不到,要得到,需要在氢氧化钠醇溶液中加热,合成路线不合理,故A选;
B.(CH3)2SiCl2水解生成(CH3)2Si(OH)2,(CH3)2Si(OH)2在一定条件下发生缩聚反应生成,经过交联得到硅橡胶,合成路线合理,故B不选;
C.乙烯与水发生加成反应生成乙醇,乙醇可以发生催化氧化生成乙醛,乙醛可以进一步氧化生成乙酸,合成路线合理,故C不选;
D.乙醇在浓硫酸,170℃条件下发生消去反应生成乙烯,乙烯与氯气发生加成反应生成,在氢氧化钠溶液中水解生成,合成路线合理,故D不选;
故选A。
13.A
【详解】因碳碳单键可以旋转,则可判断题述聚合物重复的结构单元(即链节)为,则其结构简式为,即,分子式为(C2H2Cl2)n,相对分子质量为97n,聚合物的单体是CHCl=CHCl。
故答案选A。
14.A
【详解】A.漂白粉的主要成分是氯化钙和次氯酸钙,属于无机物,A正确;
B.塑料护目镜中含有有机合成材料,含有有机物,B错误;
C.医用酒精的主要成分为CH3CH2OH,属于有机物,C错误;
D.医用橡胶手套含有有机合成材料,含有有机物,D错误;
故选A。
15.D
【详解】A.根据A的结构简式,A的分子式为C15H16O2,故A说法正确;
B.PC中含有酯基,在酸、碱条件下可以降解,故B说法正确;
C.最大的质荷比等于相对分子质量,从而计算出PC的聚合度,故C说法正确;
D.根据原子守恒,x=2n,故D说法错误;
答案为D。
16. CH3CH2CH2CH3、CH3CH(CH3)2 -3 nCH2=CHCN 加聚反应 CH2=CHCHO+2Ag(NH3)2OHCH2=CHCOONH4+2Ag↓+3NH3 晴纶等合成高分子化合物难以降解,造成环境污染,而棉、麻等天然纤维,易降解,不会造成污染
【详解】(1)根据原子守恒可知,X的化学式为C4H10,则X的可能的结构简式为CH3CH2CH2CH3、CH3CH(CH3)2;
(2)丙烯晴中含有—CN,—CN中N的化合价为-3价,丙烯晴在催化剂加热的条件下发生加聚反应生成晴纶,反应的化学方程式为:nCH2=CHCN,反应类型为加聚反应;
(3)醛基可发生银镜反应,因此检验丙烯醛含有醛基可用银氨溶液进行检验,反应的化学方程式为CH2=CHCHO+2Ag(NH3)2OHCH2=CHCOONH4+2Ag↓+3NH3;
(4)由于晴纶等合成高分子化合物难以降解,而棉、麻等天然纤维,易降解,故前者作为废弃物容易产生环境污染,而后者不会造成污染。
17. HCHO+4[Ag(NH3)2]++4OH-+2+4Ag↓+6NH3+2H2O +(n-1)H2O +2NaOH+CH3OH+H2O +2 NaOH+2H2O
【详解】(1)1mol HCHO中含有2mol醛基,最多与4mol[Ag(NH3)2]OH发生银镜反应,反应的离子方程式为HCHO+4[Ag(NH3)2]++4OH-+2+4Ag↓+6NH3+2H2O;
(2)含有醇羟基、羧基,在一定条件下可以发生缩聚反应,形成聚酯和水,反应的化学方程式为:+(n-1)H2O;
(3)该有机物含有羧基与NaOH会发生反应,含有的酯基和羧基都可以与NaOH发生反应,反应的方程式是:+2NaOH+CH3OH+H2O;
(4) 有机物含有的酚羟基、羧基可以与NaOH发生反应,而醇羟基不能反应,所以与氢氧化钠溶液反应的方程式是+2 NaOH+2H2O。
18.(1) 3-苯基丙烯醛 C13H18O2
(2)氨基、酮羰基
(3)
(4)
(5) 、 、
【详解】(1)肉桂醛的结构简式为 ,它含有碳碳双键、醛基,命名时,从醛基碳原子开始编号,名称为3-苯基丙烯醛;肉桂醛二乙缩醛的分子中,含有13个碳原子、2个氧原子,不饱和度为5,则含氢原子数为13×2+2-5×2=18,所以分子式为C13H18O2。
(2)物质M结构简式为 ,苯基不属于官能团,则具有的官能团除碳卤键外还有氨基、酮羰基。
(3)丙三醇在Cu、Ag的催化作用下发生催化氧化时,-CH2OH被氧化为-CHO,-CHOH被氧化为-CO-,化学方程式为 。
(4)制备酚醛树脂时,以苯酚和甲醛为原料,在催化剂、沸水浴作用下发生反应,从而生成酚醛树脂和水,化学方程式为。
(5)高分子材料 的链节是 ,采用“弯箭头法”将 的链从红线处打断,从而得出其单体为 、 、 。
19.(1) 恒压滴液漏斗 水浴加热
(2) ,,氧化钙与水反应放出大量的热,并生成,促进平衡左移,氨气挥发
(3)减少氨基甲磺酸的溶解损耗
(4)平衡气压
(5)72.7%
【详解】(1)由题图可知,仪器甲为恒压滴液漏斗;步骤Ⅱ要求温度50℃,温度不高且要求稳定,故可采取水浴加热的方式。
(2)实验室用氯化铵和氢氧化钙制备氨气的反应方程式为;装置A用浓氨水与氧化钙制备氨气,一水合氨在水溶液中存在电离平衡,且一水合氨受热易分解,氧化钙与水反应不仅能放出大量的热,而且生成促进平衡左移,氨气挥发。
(3)由题给信息可知,氨基甲磺酸微溶于水,因此用冰水洗涤可以减少氨基甲磺酸的溶解损耗。
(4)导管a连通大气,能够起到平衡气压的作用,防止三颈烧瓶中压强过大,产生危险。
(5)因为氨气和亚硫酸氢钠均过量,故用甲醛的来计算理论产量,甲醛的物质的量为,根据题给方程式可知,氨基甲磺酸的理论产量为2.2mol,质量为,因此产品产率为
20. U形管或U型干燥管 吸收空气中的水分,防止水分进入三口瓶中 乙 b a
50000
【分析】使用特定引发剂、正己烷为溶剂、无水条件下,将沸点266K异丁烯适当加热后转变成气体,通入三口瓶中,在冷却槽中加入合适的冷却剂,在下发生加聚反应得到聚异丁烯;
【详解】(1)仪器A的名称是U形管或U型干燥管;由信息知,聚异丁烯是在无水条件下异丁烯发生加聚反应获得,P4O10能吸收水分,作用是吸收空气中的水分,防止水分进入三口瓶中;
(2)正己烷不和钠反应,而钠可与水反应,故将钠块加入正己烷中除去微量的水,反应方程式为;
(3)由信息知,加聚反应需在和引发剂作用下发生,由信息知,甲最低温度为-21℃,不合适;乙最低温度为-55℃,比较合适;丙最低温度为-33℃,离的上限-30℃很接近,也不合适,故浴槽中可选用的适宜冷却剂是乙;
(4)按实验流程可知,步骤为:向三口瓶中加入一定量 正己烷,将沸点266K异丁烯适当加热后转变成气体,通入三口瓶中,所以答案为b、a;
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)异丁烯的分子式为C4H8,其相对分子质量为56,已知成品聚异丁烯平均相对分子质量为2.8×106,则平均聚合度为。
21. 恒压滴液漏斗或恒压分液漏斗 平衡压强,使漏斗内液体顺利流下 反应中会生成有毒的氮氧化物污染环境(若答出“浓硝酸具有强腐蚀性,对设备腐蚀严重”也可以) 水浴 B 作安全瓶,防止自来水压不稳时,在负压情况下运行时水会倒吸进入吸滤瓶。(写出“作安全瓶”或“防倒吸”这些关键采分点就可以给分。) 58.45%(58.46%也可以)
【详解】(1)根据仪器b结构特征可知为恒压滴液漏斗,由于其瓶身和下端有玻璃管相通,所以恒压滴液漏斗的作用为平衡压强,使漏斗内液体顺利流下,故答案为:恒压滴液漏斗、平衡压强,使漏斗内液体顺利流下;
(2) 对比传统法和绿色法可知,传统法采用浓硝酸做氧化剂,反应中会生成有毒的氮氧化物污染环境,除此之外硝酸具有强腐蚀性,对设备腐蚀严重,而绿色法采用过氧化氢做氧化剂,产物无污染,绿色环保,故答案为:反应中会生成有毒的氮氧化物污染环境,或者浓硝酸具有强腐蚀性,对设备腐蚀严重;
(3)绿色合成时,反应需维持温度在80~90℃,此温度正好是水浴加热的控制范围,且水浴加热受热均匀、温度易控制,故答案为:水浴加热;
(4)由题中信息可知:①己二酸溶解度随温度变化较大,②易溶于酒精,洗涤晶体一定要防止产品损失,利用信息①可知己二酸在热水中溶解度大,溶解损失大,故不能选择热水,根据信息②可知,己二酸易溶于酒精,溶解损失大,不能选择酒精,滤液洗涤影响纯度,达不到洗涤效果,所以应该用冷水洗涤,故选择:B;
(5)抽滤装置中仪器C的作用可增大系统容积做缓冲瓶,除此之外还可作安全瓶,防止自来水压不稳时,在负压情况下运行时水会倒吸进入吸滤瓶,故答案为:作安全瓶,防止自来水压不稳时,在负压情况下运行时水会倒吸进入吸滤瓶。
(6)根据产率计算公式:可知,己二酸实际产量=12.8g,理论产量=,己二酸的产率,故答案为:58.45%
一、单选题
1.某高分子化合物的结构简式为:合成它的单体可能有
①邻苯二甲酸() ②丙烯醇 ③丙烯 ④乙烯 ⑤邻苯二甲酸甲酯 ⑥甲醛
A.④⑤⑥ B.③④ C.④⑤ D.①②
2.被称为碳的第四种同素异形体的链式炔碳 的一个分子中含300~500个碳原子;导电塑料聚乙炔的结构简式为-[CH=CH]-n。有关这两种物质的下列说法中正确的是
A.都是有机高分子化合物
B.都可以看作为乙炔的加聚产物
C.都能燃烧且一定条件下都可以与H2发生加成反应
D.都有很高的熔点和硬度且难溶于水
3.高分子M广泛用于牙膏、牙科粘合剂等口腔护理产品,合成路线如下图。下列说法错误的是
A.试剂a是甲醇
B.化合物B不存在顺反异构体
C.合成M的聚合反应是缩聚反应
D.利用质谱仪测定M的平均相对分子质量可得其聚合度
4.越来越多的高分子材料得到人们的重视,下列有关高分子化合物的说法错误的是
A.酚醛树脂是用苯酚和甲醇在酸或碱的催化作用下缩合成的高分子化合物
B.聚乳酸是由单体通过缩聚反应生成的
C.涤纶属于合成纤维
D.塑料可分为热塑性塑料和热固性塑料
5.山梨酸是一种高效安全的防腐保鲜剂。其合成路线如图所示,下列说法正确的是
A.反应1属于加聚反应
B.根据溴水是否褪色可以鉴别巴豆醛和山梨酸
C.聚酯不能使酸性高锰酸钾褪色
D.聚酯中存在1个手性碳原子(注:连有四个不同的原子或基团的碳称为手性碳)
6.下列说法正确的是
A.酚醛树脂可由邻羟甲基苯酚发生缩聚反应得到
B.合成的单体是乙烯和2-丁烯
C.己二酸与乙醇可缩聚形成高分子化合物
D.由合成的聚合物为
7.瓜环[n](n=5,6,7,8…)是一种具有大杯空腔、两端开口的化合物(结构如图),在分子开关、催化剂、药物载体等方面有广泛应用。瓜环[n]可由和HCHO在一定条件下合成。
下列说法不正确的是
A.合成瓜环的两种单体中分别含有酰胺基和醛基
B.分子间可能存在不同类型的氢键
C.生成瓜环[n]的反应中,有键断裂
D.合成1mol瓜环[7]时,有7mol水生成
8.2022 北京冬奥会处处体现“科技、发展、环保、和平”的理念,下列说法错误的是
A.冬奥场馆通过光伏发电和风力发电获得的电能属于可再生清洁能源
B.火爆全网的吉祥物“冰墩墩”的毛绒材质主要是聚酯纤维属于合成纤维
C.运动员的头盔、滑板,主火炬等多处使用的碳纤维属于有机高分子材料
D.首钢滑雪大跳台的主体结构使用的特种钢属于金属材料
9.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等种类。PVC被广泛用于食品、蔬菜的外包装,但它对人体有潜在危害。下列有关叙述中不正确的是
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC的单体不能由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可将其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则为PVC;不变红,则为PE
D.等质量的聚乙烯和乙烯分别完全燃烧,聚乙烯消耗的氧气多
10.下列物质中,属于天然高分子化合物的是
A.塑料 B.油脂 C.纤维素 D.合成橡胶
11.某高分子化合物R的结构简式如图,下列有关R的说法正确的是
A.R的单体之一的分子式为C9H10O2
B.R可通过加聚和缩聚反应合成,完全水解后生成物均为小分子有机物
C.R是一种溶于水的物质
D.碱性条件下,1molR完全水解消耗NaOH的物质的量为n(m+1)mol
12.下列合成路线不合理的是
A.用环己烷合成1,3环已二烯:
B.用二甲基二氯硅烷合成硅橡胶:(CH3)2SiCl2(CH3)2Si(OH)2硅橡胶
C.用乙烯合成乙酸:
D.用乙醇合成乙二醇:
13.某高分子化合物的部分结构如下:
下列说法不正确的是
A.聚合物的链节是
B.聚合物的分子式为(C2H2Cl2)n
C.聚合物的单体是CHCl=CHCl
D.若n为聚合度,则该聚合物的相对分子质量为97n
14.下列抗疫物资中不属于有机物的是
A.漂白粉 B.PC(聚碳酸酯)护目镜
C.医用酒精 D.PVC(聚氯乙烯)医用手套
15.聚碳酸酯(PC)是一种优良的热塑性树脂,光气法合成PC的原理如图。下列说法错误的是
A.A的分子式为 B.PC在一定条件下可降解
C.通过质谱法可测定PC的聚合度 D.x等于n
二、填空题
16.腈纶是由丙烯腈()在催化剂加热条件下合成的。丙烯腈是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(结构简式为)等。而丙烯主要来自石脑油的裂解,如:。请按要求回答下列问题:
(1)写出上述反应中的可能的结构简式: 。
(2)丙烯腈中的化合价为 。根据题干信息,写出丙烯腈合成腈纶反应的化学方程式及其反应类型: 、 。
(3)写出检验丙烯醛含有醛基的化学方程式: 。
(4)合成纤维(如腈纶等)部分地取代了棉等天然纤维。请写出前者作为废弃物易产生环境污染,而后者却不会的原因 。
17.按要求填空:
(1)甲醛与银氨溶液反应的离子方程式为 ;
(2) 发生缩聚反应的化学方程式 ;
(3)有机物 与氢氧化钠溶液反应的化学方程式: ;
(4) 有机物 与氢氧化钠溶液反应的化学方程式: ;
18.按要求完成以下内容
(1)肉桂醛是重要的医药原料,也是重要的香料,其结构简式如图一所示,以肉桂醛为原料合成的肉桂醛二乙缩醛的结构如图二所示:
肉桂醛的的名称为 (系统命名法),肉桂醛二乙缩醛的分子式为 。
(2)物质M结构如图, 具有的官能团除碳卤键外还有 (填名称)。
(3)丙三醇催化氧化的化学方程式为 。
(4)制备酚醛树脂的化学方程式为 。
(5)合成结构简式为 的高分子材料的单体为 。
三、实验题
19.氨基甲磺酸(H2NCH2SO3H)具有抗癌和抗病毒活性,在生产生活领域应用广泛。某兴趣小组在实验室模拟工业上用氨气、甲醛和亚硫酸氢钠反应制备氨基甲磺酸的反应,装置及步骤如下。
查阅资料:①甲醛为无色、有特殊刺激性气味的气体,具有还原性。
②氨基甲磺酸为白色结晶或粉末.微溶于水、甲醇和乙醚,溶于碱液。
③制备过程涉及的反应HCHO+NaHSO3→HOCH2SO3Na;
HOCH2SO3Na+NH3→H2NCH2SO3Na+H2O;
2H2NCH2SO3Na+H2SO4→2H2NCH2SO3H+Na2SO4。
步骤Ⅰ:准确量取含66.0g甲醛的水溶液,加入三颈烧瓶中;
步骤Ⅱ:控制温度10℃左右,缓慢加入饱和亚硫酸氢钠溶液至过量,缓慢升温到50℃左右继续反应;
步骤Ⅲ:待反应完成后,通入过量氨气,充分反应;
步骤Ⅳ:反应完成后,缓慢加入足量的硫酸溶液,降温结晶,过滤并用冰水洗涤,得干燥固体177.6g。
回答下列问题:
(1)仪器甲的名称为 ;步骤Ⅱ中控制温度50℃左右的加热方式最好是 。
(2)实验室用氯化铵和氢氧化钙反应制取氨气的化学方程式为 。装置A能够制取少量氨气,请结合化学用语简述原理: 。
(3)步骤Ⅳ中,用冰水洗涤的目的是 。
(4)装置B中,导管a的作用是 。
(5)本实验中的产品产率为 (保留三位有效数字)。
20.聚异丁烯是一种性能优异的功能高分子材料。某科研小组研究了使用特定引发剂、正己烷为溶剂、无水条件下异丁烯的聚合工艺。已知:异丁烯沸点266K。反应方程式及主要装置示意图如下:
回答问题:
(1)仪器A的名称是 ,P4O10作用是 。
(2)将钠块加入正己烷中,除去微量的水,反应方程式为 .。
(3)浴槽中可选用的适宜冷却剂是 (填序号)。
序号 冷却剂 最低温度/℃
甲 NaCl-冰(质量比1:3) -21
乙 CaCl2·6H2O-冰(质量比1.43:1) -55
丙 液氨 -33
(4)补齐操作步骤
选项为:a.向三口瓶中通入一定量异丁烯
b.向三口瓶中加入一定量正己烷
① (填编号);
②待反应体系温度下降至既定温度:
③ (填编号);
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)测得成品平均相对分子质量为2.8×106,平均聚合度为 。
21.己二酸是工业上具有重要用途的二元羧酸,白色晶体,易溶于酒精,熔点153℃,主要用于制造尼龙,泡沫塑料及润滑剂和增塑剂等,用途十分广泛。生产原理如下:
绿色合成法流程如下:
①在150mL三颈烧瓶加入2.00g催化剂(由乌酸钠和草酸合成),50mL30%的H2O2溶液和磁子;室温下搅拌15~20分钟后,加入12.3g环己烯;连接好装置(如图所示,固定夹持仪器已略去),继续快速剧烈搅拌并加热,在80~90℃反应3h后,得到热的合成液。
②趁热倒出三颈烧瓶中的产品,在冷水中降温冷却,析出的晶体在布氏漏斗上进行抽滤,将晶体进行重结晶,用3mL-洗涤晶体,再抽滤。取出产品,洗涤、干燥后称重,得纯净的己二酸12.8g。(己二酸溶解度随温度变化较大)
回答下列问题:
(1)绿色合成法中仪器b的名称为 ,其作用是 。
(2)传统法与绿色制备的原理相比,传统法被淘汰的主要原因是 。
(3)绿色合成时,反应需维持温度在80~90℃,最好采取 加热。
(4)洗涤晶体时应选择的最合适的洗涤剂为 (填字母序号)
A. 热水 B. 冷水 C. 乙醇 D. 滤液
(5)抽滤装置中仪器C的作用除了增大系统容积做缓冲瓶之外,另一个作用是 。
(6)该实验的产物的产率为 (结果保留4位有效数字)。
试卷第4页,共9页
参考答案:
1.D
【详解】由结构简式可知,合成高分子化合物的反应为邻苯二甲酸与丙烯醇一定条件下发生置换反应生成邻苯二甲酸二丙烯酯,邻苯二甲酸二丙烯酯一定条件下发生加聚反应生成聚邻苯二甲酸二丙烯酯,所以合成高分子化合物的单体为邻苯二甲酸和丙烯醇,故选D。
2.C
【详解】链式炔碳是单质不是化合物,选项A、B不正确;应用分子中都含有碳碳三键或碳碳双键,因此都能和氢气发生加成反应,且都可以燃烧,选项C正确;选项D不正确,链式炔碳的熔点和硬度不是很大,答案选C。
3.C
【分析】由高分子M的结构采用弯箭头法可知其单体为CH2=CHOCH3和 ,则B为CH2=CHOCH3,C为 ,乙炔和试剂a为甲醇发生加成反应得到CH2=CHOCH3。
【详解】A.物质B为CH2=CHOCH3,由乙炔和甲醇发生加成反应得到,因此试剂a是甲醇,故A正确;
B.化合物B为CH2=CHOCH3,左边碳连有两个氢原子,因此不存在顺反异构体,故B正确;
C.合成M的聚合反应是加聚反应,是由CH2=CHOCH3和 加聚得到,故C错误;
D.利用质谱仪测定M的平均相对分子质量,再除以链节的相对分子质量,从而得到其聚合度,故D正确;
综上所述,答案为C。
4.A
【详解】A.酚醛树脂是用苯酚和甲醛在酸或碱的催化作用下缩合成的高分子化合物,A错误;
B.聚乳酸是由乳酸单体通过分子间缩聚反应生成的,B正确;
C.涤纶、腈纶等均属于合成纤维,C正确;
D.塑料可分为热塑性塑料和热固性塑料,D正确。
故答案为:A。
5.A
【详解】A.反应1没有小分子物质生成,属于加聚反应,故A正确;
B.巴豆醛、山梨酸都含有碳碳双键,都可以和溴水发生加成反应而褪色,用溴水不能鉴别二者,故B错误;
C. 聚酯中含碳碳双键、能使酸性高锰酸钾褪色,故C错误;
D. 聚酯中每1个链节存在1个手性碳原子,含n个手性碳原子,故D错误;
答案选A。
6.A
【详解】A.邻羟甲基苯酚发生缩聚反应脱去水可得到酚醛树脂,故A正确;
B.根据“见双键,四个碳,无双键,两个碳”规律画线断开,然后将半键闭合,可得到的单体为1,3-丁二烯和丙烯,故B错误;
C.己二酸与乙醇可发生酯化反应生成己二酸二乙酯,但不能缩聚形成高分子化合物,故C错误;
D.发生加聚反应生成的聚合物为,故D错误;
故答案为A。
7.D
【详解】A. 中含有酰胺基、HCHO中含有醛基,故A正确;
B. 分子中含N、O两种非金属性较强的元素,分子之间可以形成OH、NH两种氢键,故B正确;
C.生成瓜环[n]的反应中,甲醛中的C=O键断裂,即键断裂,故C正确;
D.由瓜环[n]结构简式可知生成1mol链节结构生成2mol水,则合成1mol瓜环[7]时,有14mol水生成,故D错误;
故选:D。
8.C
【详解】A.可再生能源是指原材料可以再生的能源如水力发电、风力发电、光伏发电、生物能沼气、海潮能等,故A正确;
B.毛绒材质中的聚酯纤维是有机合成高分子材料,属于合成纤维,故B正确;
C.碳纤维的主要成分是碳,属于新型无机非金属材料,不属于有机高分子材料,故C错误;
D.特种钢是性能优良的铁合金,属于金属材料,故D正确;
故选C。
9.D
【详解】A.PE、PVC都属于链状高分子化合物,能溶于酒精,加热熔化、冷却后变成固体,可以反复进行,A正确;
B.PVC单体为氯乙烯,应该由乙炔和HCl加成得到,PE是乙烯的加聚产物,因此PVC的单体不能由PE的单体与氯化氢加成制得,B正确;
C.PVC受热时可产生HCl气体,PE则不能,可用蓝色石蕊试纸检验,试纸变红的则为PVC,试纸不变红则为PE,C正确;
D.乙烯是聚乙烯的单体,它们的最简式相同,它们含C和H的质量分数分别相等,所以等质量的两者分别完全燃烧消耗的O2相等,D错误;
答案选D。
10.C
【详解】A. 塑料是人工合成高分子材料,A不符合题意;
B. 油脂是由高级脂肪酸的甘油油酯,不属于高分子化合物,B不符合题意;
C. 纤维素是由数千个葡萄糖单元构成的天然高分子化合物,C符合题意;
D. 合成橡胶是合成高分子材料,D不符合题意;
答案选C。
11.D
【详解】A.由结构可知,单体为CH2=C(CH3)COOH、OHCH2CH2OH、HOOCCHOHCH2C6H5,R的单体之一的分子式为C9H10O3,A项错误;
B.单体中存在C=C、-OH、-COOH,则通过加聚反应和缩聚反应可以生成R,含-COOC-,完全水解生成乙二醇、HOOCCHOHCH2C6H5和一种高分子化合物,B项错误;
C.R为高分子化合物,难溶于水,C项错误;
D.1molR中含n(1+m)mol-COOC-,则碱性条件下,1molR完全水解消耗NaOH的物质的量为n(m+1)mol,D项正确;
答案选D。
12.A
【详解】A.在氢氧化钠溶液中发生水解反应生成,得不到,要得到,需要在氢氧化钠醇溶液中加热,合成路线不合理,故A选;
B.(CH3)2SiCl2水解生成(CH3)2Si(OH)2,(CH3)2Si(OH)2在一定条件下发生缩聚反应生成,经过交联得到硅橡胶,合成路线合理,故B不选;
C.乙烯与水发生加成反应生成乙醇,乙醇可以发生催化氧化生成乙醛,乙醛可以进一步氧化生成乙酸,合成路线合理,故C不选;
D.乙醇在浓硫酸,170℃条件下发生消去反应生成乙烯,乙烯与氯气发生加成反应生成,在氢氧化钠溶液中水解生成,合成路线合理,故D不选;
故选A。
13.A
【详解】因碳碳单键可以旋转,则可判断题述聚合物重复的结构单元(即链节)为,则其结构简式为,即,分子式为(C2H2Cl2)n,相对分子质量为97n,聚合物的单体是CHCl=CHCl。
故答案选A。
14.A
【详解】A.漂白粉的主要成分是氯化钙和次氯酸钙,属于无机物,A正确;
B.塑料护目镜中含有有机合成材料,含有有机物,B错误;
C.医用酒精的主要成分为CH3CH2OH,属于有机物,C错误;
D.医用橡胶手套含有有机合成材料,含有有机物,D错误;
故选A。
15.D
【详解】A.根据A的结构简式,A的分子式为C15H16O2,故A说法正确;
B.PC中含有酯基,在酸、碱条件下可以降解,故B说法正确;
C.最大的质荷比等于相对分子质量,从而计算出PC的聚合度,故C说法正确;
D.根据原子守恒,x=2n,故D说法错误;
答案为D。
16. CH3CH2CH2CH3、CH3CH(CH3)2 -3 nCH2=CHCN 加聚反应 CH2=CHCHO+2Ag(NH3)2OHCH2=CHCOONH4+2Ag↓+3NH3 晴纶等合成高分子化合物难以降解,造成环境污染,而棉、麻等天然纤维,易降解,不会造成污染
【详解】(1)根据原子守恒可知,X的化学式为C4H10,则X的可能的结构简式为CH3CH2CH2CH3、CH3CH(CH3)2;
(2)丙烯晴中含有—CN,—CN中N的化合价为-3价,丙烯晴在催化剂加热的条件下发生加聚反应生成晴纶,反应的化学方程式为:nCH2=CHCN,反应类型为加聚反应;
(3)醛基可发生银镜反应,因此检验丙烯醛含有醛基可用银氨溶液进行检验,反应的化学方程式为CH2=CHCHO+2Ag(NH3)2OHCH2=CHCOONH4+2Ag↓+3NH3;
(4)由于晴纶等合成高分子化合物难以降解,而棉、麻等天然纤维,易降解,故前者作为废弃物容易产生环境污染,而后者不会造成污染。
17. HCHO+4[Ag(NH3)2]++4OH-+2+4Ag↓+6NH3+2H2O +(n-1)H2O +2NaOH+CH3OH+H2O +2 NaOH+2H2O
【详解】(1)1mol HCHO中含有2mol醛基,最多与4mol[Ag(NH3)2]OH发生银镜反应,反应的离子方程式为HCHO+4[Ag(NH3)2]++4OH-+2+4Ag↓+6NH3+2H2O;
(2)含有醇羟基、羧基,在一定条件下可以发生缩聚反应,形成聚酯和水,反应的化学方程式为:+(n-1)H2O;
(3)该有机物含有羧基与NaOH会发生反应,含有的酯基和羧基都可以与NaOH发生反应,反应的方程式是:+2NaOH+CH3OH+H2O;
(4) 有机物含有的酚羟基、羧基可以与NaOH发生反应,而醇羟基不能反应,所以与氢氧化钠溶液反应的方程式是+2 NaOH+2H2O。
18.(1) 3-苯基丙烯醛 C13H18O2
(2)氨基、酮羰基
(3)
(4)
(5) 、 、
【详解】(1)肉桂醛的结构简式为 ,它含有碳碳双键、醛基,命名时,从醛基碳原子开始编号,名称为3-苯基丙烯醛;肉桂醛二乙缩醛的分子中,含有13个碳原子、2个氧原子,不饱和度为5,则含氢原子数为13×2+2-5×2=18,所以分子式为C13H18O2。
(2)物质M结构简式为 ,苯基不属于官能团,则具有的官能团除碳卤键外还有氨基、酮羰基。
(3)丙三醇在Cu、Ag的催化作用下发生催化氧化时,-CH2OH被氧化为-CHO,-CHOH被氧化为-CO-,化学方程式为 。
(4)制备酚醛树脂时,以苯酚和甲醛为原料,在催化剂、沸水浴作用下发生反应,从而生成酚醛树脂和水,化学方程式为。
(5)高分子材料 的链节是 ,采用“弯箭头法”将 的链从红线处打断,从而得出其单体为 、 、 。
19.(1) 恒压滴液漏斗 水浴加热
(2) ,,氧化钙与水反应放出大量的热,并生成,促进平衡左移,氨气挥发
(3)减少氨基甲磺酸的溶解损耗
(4)平衡气压
(5)72.7%
【详解】(1)由题图可知,仪器甲为恒压滴液漏斗;步骤Ⅱ要求温度50℃,温度不高且要求稳定,故可采取水浴加热的方式。
(2)实验室用氯化铵和氢氧化钙制备氨气的反应方程式为;装置A用浓氨水与氧化钙制备氨气,一水合氨在水溶液中存在电离平衡,且一水合氨受热易分解,氧化钙与水反应不仅能放出大量的热,而且生成促进平衡左移,氨气挥发。
(3)由题给信息可知,氨基甲磺酸微溶于水,因此用冰水洗涤可以减少氨基甲磺酸的溶解损耗。
(4)导管a连通大气,能够起到平衡气压的作用,防止三颈烧瓶中压强过大,产生危险。
(5)因为氨气和亚硫酸氢钠均过量,故用甲醛的来计算理论产量,甲醛的物质的量为,根据题给方程式可知,氨基甲磺酸的理论产量为2.2mol,质量为,因此产品产率为
20. U形管或U型干燥管 吸收空气中的水分,防止水分进入三口瓶中 乙 b a
50000
【分析】使用特定引发剂、正己烷为溶剂、无水条件下,将沸点266K异丁烯适当加热后转变成气体,通入三口瓶中,在冷却槽中加入合适的冷却剂,在下发生加聚反应得到聚异丁烯;
【详解】(1)仪器A的名称是U形管或U型干燥管;由信息知,聚异丁烯是在无水条件下异丁烯发生加聚反应获得,P4O10能吸收水分,作用是吸收空气中的水分,防止水分进入三口瓶中;
(2)正己烷不和钠反应,而钠可与水反应,故将钠块加入正己烷中除去微量的水,反应方程式为;
(3)由信息知,加聚反应需在和引发剂作用下发生,由信息知,甲最低温度为-21℃,不合适;乙最低温度为-55℃,比较合适;丙最低温度为-33℃,离的上限-30℃很接近,也不合适,故浴槽中可选用的适宜冷却剂是乙;
(4)按实验流程可知,步骤为:向三口瓶中加入一定量 正己烷,将沸点266K异丁烯适当加热后转变成气体,通入三口瓶中,所以答案为b、a;
④搅拌下滴加引发剂,一定时间后加入反应终止剂停止反应。经后续处理得成品。
(5)异丁烯的分子式为C4H8,其相对分子质量为56,已知成品聚异丁烯平均相对分子质量为2.8×106,则平均聚合度为。
21. 恒压滴液漏斗或恒压分液漏斗 平衡压强,使漏斗内液体顺利流下 反应中会生成有毒的氮氧化物污染环境(若答出“浓硝酸具有强腐蚀性,对设备腐蚀严重”也可以) 水浴 B 作安全瓶,防止自来水压不稳时,在负压情况下运行时水会倒吸进入吸滤瓶。(写出“作安全瓶”或“防倒吸”这些关键采分点就可以给分。) 58.45%(58.46%也可以)
【详解】(1)根据仪器b结构特征可知为恒压滴液漏斗,由于其瓶身和下端有玻璃管相通,所以恒压滴液漏斗的作用为平衡压强,使漏斗内液体顺利流下,故答案为:恒压滴液漏斗、平衡压强,使漏斗内液体顺利流下;
(2) 对比传统法和绿色法可知,传统法采用浓硝酸做氧化剂,反应中会生成有毒的氮氧化物污染环境,除此之外硝酸具有强腐蚀性,对设备腐蚀严重,而绿色法采用过氧化氢做氧化剂,产物无污染,绿色环保,故答案为:反应中会生成有毒的氮氧化物污染环境,或者浓硝酸具有强腐蚀性,对设备腐蚀严重;
(3)绿色合成时,反应需维持温度在80~90℃,此温度正好是水浴加热的控制范围,且水浴加热受热均匀、温度易控制,故答案为:水浴加热;
(4)由题中信息可知:①己二酸溶解度随温度变化较大,②易溶于酒精,洗涤晶体一定要防止产品损失,利用信息①可知己二酸在热水中溶解度大,溶解损失大,故不能选择热水,根据信息②可知,己二酸易溶于酒精,溶解损失大,不能选择酒精,滤液洗涤影响纯度,达不到洗涤效果,所以应该用冷水洗涤,故选择:B;
(5)抽滤装置中仪器C的作用可增大系统容积做缓冲瓶,除此之外还可作安全瓶,防止自来水压不稳时,在负压情况下运行时水会倒吸进入吸滤瓶,故答案为:作安全瓶,防止自来水压不稳时,在负压情况下运行时水会倒吸进入吸滤瓶。
(6)根据产率计算公式:可知,己二酸实际产量=12.8g,理论产量=,己二酸的产率,故答案为:58.45%
