3.2水的电离和溶液的PH同步练习题(含答案)2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH同步练习题(含答案)2023-2024学年高二上学期人教版(2019)化学选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 147.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 17:18:27 | ||
图片预览


文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
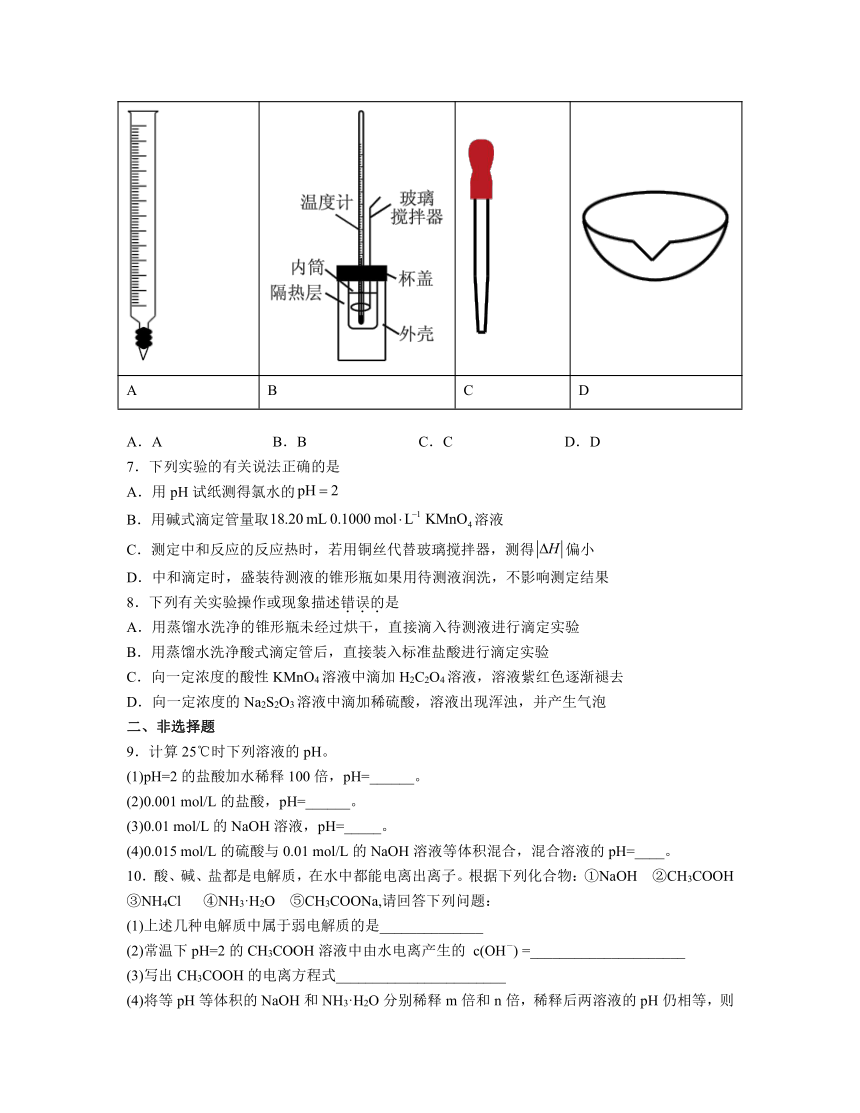
1.在中和滴定实验过程中一定用不到的仪器是
A. B. C. D.
2.下列仪器使用前不需检验是否漏水的有
A.锥形瓶 B.分液漏斗 C.滴定管 D.容量瓶
3.下列溶液一定呈中性的是
A.水电离出的OH- 浓度为10-7mol/L的溶液 B.pH=7的溶液
C.能使石蕊试液呈紫色的溶液 D.c(H+)=的溶液
4.仅用下表提供的玻璃仪器(非玻璃仪器任选)不能实现相应实验目的的是( )
选项 实验目的 玻璃仪器
A 配制一定质量分数的NaCl溶液 胶头滴管、量筒、烧杯、玻璃棒
B 测定NaOH溶液浓度 滴定管、锥形瓶、烧杯
C 鉴别葡萄糖和蔗糖 试管、烧杯、酒精灯
D 实验室用浓氨水和生石灰制备氨气 漏斗、烧杯、玻璃棒
A.A B.B C.C D.D
5.常温下,若1体积溶液与2体积的溶液混合所得溶液的(溶液体积变化不计),则与物质的量浓度之比应为
A. B. C. D.
6.进行下列实验操作时,选用仪器不正确的是
量取一定体积的溶液 中和热的测定 胶体的制备 浓缩NaCl溶液
A B C D
A.A B.B C.C D.D
7.下列实验的有关说法正确的是
A.用pH试纸测得氯水的
B.用碱式滴定管量取溶液
C.测定中和反应的反应热时,若用铜丝代替玻璃搅拌器,测得偏小
D.中和滴定时,盛装待测液的锥形瓶如果用待测液润洗,不影响测定结果
8.下列有关实验操作或现象描述错误的是
A.用蒸馏水洗净的锥形瓶未经过烘干,直接滴入待测液进行滴定实验
B.用蒸馏水洗净酸式滴定管后,直接装入标准盐酸进行滴定实验
C.向一定浓度的酸性KMnO4溶液中滴加H2C2O4溶液,溶液紫红色逐渐褪去
D.向一定浓度的Na2S2O3溶液中滴加稀硫酸,溶液出现浑浊,并产生气泡
二、非选择题
9.计算25℃时下列溶液的pH。
(1)pH=2的盐酸加水稀释100倍,pH=______。
(2)0.001 mol/L的盐酸,pH=______。
(3)0.01 mol/L的NaOH溶液,pH=_____。
(4)0.015 mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,混合溶液的pH=____。
10.酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:①NaOH ②CH3COOH ③NH4Cl ④NH3·H2O ⑤CH3COONa,请回答下列问题:
(1)上述几种电解质中属于弱电解质的是______________
(2)常温下pH=2的CH3COOH溶液中由水电离产生的 c(OH-) =_____________________
(3)写出CH3COOH的电离方程式_______________________
(4)将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m ___________n (填“大于、等于或小于”)
(5)pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/L HCl,应加_______mL。(体积变化忽略不计)
【参考答案】
一、选择题
1.C
解析:A.A为烧杯,中和滴定实验中用于盛装调节液面时的液体,A不选;
B.B为容量瓶,用于配制标准液,B不选;
C.C为恒压分液漏斗,在中和滴定实验中不用,C选;
D.D为移液管,可以量取一定体积的溶液,在中和滴定实验中可以使用,D不选;
故选C。
2.A
解析:在高中阶段常见仪器需要检漏的有:分液漏斗、容量瓶、酸式滴定管和碱式滴定管,综上所述,A符合题意。
故选A。
3.D
解析:A.溶液温度未知,水电离出的OH- 浓度为10-7mol/L的溶液不一定是中性溶液,如100℃时,水电离出的OH- 浓度为10-7mol/L的溶液说明水的电离受到抑制,可能为酸或碱的溶液,故A错误;
B.溶液温度未知,pH=7的溶液不一定呈中性,如100℃时,pH=6的溶液呈中性,故B错误;
C.常温能使石蕊试液呈紫色的溶液pH为5—8,溶液可能呈酸性、中性或碱性,故C错误;
D.c(H+)=的溶液中氢离子和氢氧根离子浓度相等,溶液呈中性,故D正确;
故选D。
4.D
解析:A.配制一定质量分数的NaCl溶液,需要用胶头滴管和量筒量取一定体积的水,需要烧杯溶解,玻璃杯搅拌,故A能实现;
B.测定NaOH溶液浓度,需要用酸滴定,所以需要滴定管,装NaOH溶液的锥形瓶,滴定管润洗的时候需要烧杯盛装润洗后的溶液,故B能实现;
C.鉴别葡萄糖和蔗糖是利用银镜反应,故需要试管装反应试剂,需要烧杯水浴加热,故C能实现;
D.实验室用浓氨水和生石灰制备氨气,需把浓氨水装在分液漏斗中,需把生石灰放在烧瓶中,故所给玻璃仪器缺少烧瓶,不能完成氨气制取,故D不能实现;
本题答案 D 。
5.B
解析:的溶液物质的量浓度为1×10 3mol L 1,,设溶液的物质的量浓度为,体积为,则氢氧化钠溶液的体积为,混合所得溶液的,即,解得,则与物质的量浓度之比应为,故B符合题意。
综上所述,答案为B。
6.A
解析:A. KMnO4溶液有强氧化性会腐蚀橡胶,应该用酸式滴定管, A不正确;
B.中和热的测定装置需要绝热、需要搅拌使盐酸和氢氧化钠迅速反应、需要用温度计量取最高温度,B正确;
C.胶体的制备时,需用胶头滴管逐滴把饱和氯化铁溶液滴加到沸水中,C正确;
D.浓缩NaCl溶液应该用蒸发皿,D正确;
故选A。
7.C
解析:A.氯水中含有的HClO具有漂白性,能漂白pH试纸,不能用该法测定氯水的pH,A错误;
B.KMnO4具有强氧化性,能腐蚀碱式滴定管尖嘴部分的橡胶管,故不能用碱式滴定管盛装酸性KMnO4溶液,B错误;
C.铜丝有良好的导热性,如用铜丝代替玻璃搅拌器,会加快反应放出的热量散失,使测得的偏小,C正确;
D.中和滴定时,盛装待测液的锥形瓶不能用待测液润洗,如润洗,会使待测液用量增大,测定结果偏高,D错误;
故选C。
8.B
解析:A.锥形瓶洗净后不需要经过烘干,直接滴入待测液进行滴定实验,故A正确;
B.用蒸馏水洗净酸式滴定管后,先润洗2~3次,再装入标准盐酸进行滴定实验,故B错误;
C.KMnO4溶液是紫红色,向一定浓度的酸性KMnO4溶液中滴加H2C2O4溶液,当酸性KMnO4溶液消耗完,则紫红色逐渐褪去,故C正确;
D.Na2S2O3与稀硫酸反应生成硫酸钠、硫单质和二氧化硫,因此向一定浓度的Na2S2O3溶液中滴加稀硫酸,溶液出现浑浊,并产生气泡,故D正确。
综上所述,答案为B。
二、非选择题
9.3 12 2
解析:(1) pH=2的盐酸溶液中c(H+)=10-2mol/L,加水稀释100倍,溶液中c(H+)=10-4mol/L,pH=4;
故答案为:4。
(2) 0.001mol/L的盐酸,c(H+)=10-3mol/L,pH=3;
故答案为:3。
(3) 0.01mol/L的NaOH溶液,c(OH-)=10-2mol/L,根据Kw=c(OH-)×(H+)=10-14得溶液中c(H+)=10-12mol/L,pH=12;
故答案为:12。
(4) 0.015mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,酸过量,溶液显酸性,设溶液的体积均为1L,所得混和溶液中c(H+)=(0.015mol/L×1L×2-0.01mol/L×1L)÷2L=10-2mol/L,pH=2;
故答案为:2。
10. ②④ 10-12mol/L CH3COOHCH3COO—+H+ 小于 81.8
解析:(1)弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等,所以②CH3COOH、④NH3 H2O是弱电解质;
答案为:②④;
(2)常温下pH=2的CH3COOH溶液中c(H+)=1.0×10-2mol/L,醋酸溶液中的氢氧根离子来自于水的电离,由水电离产生的 c(OH-) =mol/L;
答案为:10-12mo1/L
(3) CH3COOH为弱电解质,部分电离,电离方程式;
答案为:
(4)氨水是弱电解质,氢氧化钠是强电解质,氨水存在电离平衡,氢氧化钠不存在电离平衡,将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则氢氧化钠的稀释倍数小于氨水,
答案为:小于;
(5) 盐酸的浓度是0.01mol/L,设加入盐酸的体积是V,c(OH )===0.001mol/L,解得:V=81.8mL,
故答案为81.8
一、选择题
1.在中和滴定实验过程中一定用不到的仪器是
A. B. C. D.
2.下列仪器使用前不需检验是否漏水的有
A.锥形瓶 B.分液漏斗 C.滴定管 D.容量瓶
3.下列溶液一定呈中性的是
A.水电离出的OH- 浓度为10-7mol/L的溶液 B.pH=7的溶液
C.能使石蕊试液呈紫色的溶液 D.c(H+)=的溶液
4.仅用下表提供的玻璃仪器(非玻璃仪器任选)不能实现相应实验目的的是( )
选项 实验目的 玻璃仪器
A 配制一定质量分数的NaCl溶液 胶头滴管、量筒、烧杯、玻璃棒
B 测定NaOH溶液浓度 滴定管、锥形瓶、烧杯
C 鉴别葡萄糖和蔗糖 试管、烧杯、酒精灯
D 实验室用浓氨水和生石灰制备氨气 漏斗、烧杯、玻璃棒
A.A B.B C.C D.D
5.常温下,若1体积溶液与2体积的溶液混合所得溶液的(溶液体积变化不计),则与物质的量浓度之比应为
A. B. C. D.
6.进行下列实验操作时,选用仪器不正确的是
量取一定体积的溶液 中和热的测定 胶体的制备 浓缩NaCl溶液
A B C D
A.A B.B C.C D.D
7.下列实验的有关说法正确的是
A.用pH试纸测得氯水的
B.用碱式滴定管量取溶液
C.测定中和反应的反应热时,若用铜丝代替玻璃搅拌器,测得偏小
D.中和滴定时,盛装待测液的锥形瓶如果用待测液润洗,不影响测定结果
8.下列有关实验操作或现象描述错误的是
A.用蒸馏水洗净的锥形瓶未经过烘干,直接滴入待测液进行滴定实验
B.用蒸馏水洗净酸式滴定管后,直接装入标准盐酸进行滴定实验
C.向一定浓度的酸性KMnO4溶液中滴加H2C2O4溶液,溶液紫红色逐渐褪去
D.向一定浓度的Na2S2O3溶液中滴加稀硫酸,溶液出现浑浊,并产生气泡
二、非选择题
9.计算25℃时下列溶液的pH。
(1)pH=2的盐酸加水稀释100倍,pH=______。
(2)0.001 mol/L的盐酸,pH=______。
(3)0.01 mol/L的NaOH溶液,pH=_____。
(4)0.015 mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,混合溶液的pH=____。
10.酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:①NaOH ②CH3COOH ③NH4Cl ④NH3·H2O ⑤CH3COONa,请回答下列问题:
(1)上述几种电解质中属于弱电解质的是______________
(2)常温下pH=2的CH3COOH溶液中由水电离产生的 c(OH-) =_____________________
(3)写出CH3COOH的电离方程式_______________________
(4)将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m ___________n (填“大于、等于或小于”)
(5)pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/L HCl,应加_______mL。(体积变化忽略不计)
【参考答案】
一、选择题
1.C
解析:A.A为烧杯,中和滴定实验中用于盛装调节液面时的液体,A不选;
B.B为容量瓶,用于配制标准液,B不选;
C.C为恒压分液漏斗,在中和滴定实验中不用,C选;
D.D为移液管,可以量取一定体积的溶液,在中和滴定实验中可以使用,D不选;
故选C。
2.A
解析:在高中阶段常见仪器需要检漏的有:分液漏斗、容量瓶、酸式滴定管和碱式滴定管,综上所述,A符合题意。
故选A。
3.D
解析:A.溶液温度未知,水电离出的OH- 浓度为10-7mol/L的溶液不一定是中性溶液,如100℃时,水电离出的OH- 浓度为10-7mol/L的溶液说明水的电离受到抑制,可能为酸或碱的溶液,故A错误;
B.溶液温度未知,pH=7的溶液不一定呈中性,如100℃时,pH=6的溶液呈中性,故B错误;
C.常温能使石蕊试液呈紫色的溶液pH为5—8,溶液可能呈酸性、中性或碱性,故C错误;
D.c(H+)=的溶液中氢离子和氢氧根离子浓度相等,溶液呈中性,故D正确;
故选D。
4.D
解析:A.配制一定质量分数的NaCl溶液,需要用胶头滴管和量筒量取一定体积的水,需要烧杯溶解,玻璃杯搅拌,故A能实现;
B.测定NaOH溶液浓度,需要用酸滴定,所以需要滴定管,装NaOH溶液的锥形瓶,滴定管润洗的时候需要烧杯盛装润洗后的溶液,故B能实现;
C.鉴别葡萄糖和蔗糖是利用银镜反应,故需要试管装反应试剂,需要烧杯水浴加热,故C能实现;
D.实验室用浓氨水和生石灰制备氨气,需把浓氨水装在分液漏斗中,需把生石灰放在烧瓶中,故所给玻璃仪器缺少烧瓶,不能完成氨气制取,故D不能实现;
本题答案 D 。
5.B
解析:的溶液物质的量浓度为1×10 3mol L 1,,设溶液的物质的量浓度为,体积为,则氢氧化钠溶液的体积为,混合所得溶液的,即,解得,则与物质的量浓度之比应为,故B符合题意。
综上所述,答案为B。
6.A
解析:A. KMnO4溶液有强氧化性会腐蚀橡胶,应该用酸式滴定管, A不正确;
B.中和热的测定装置需要绝热、需要搅拌使盐酸和氢氧化钠迅速反应、需要用温度计量取最高温度,B正确;
C.胶体的制备时,需用胶头滴管逐滴把饱和氯化铁溶液滴加到沸水中,C正确;
D.浓缩NaCl溶液应该用蒸发皿,D正确;
故选A。
7.C
解析:A.氯水中含有的HClO具有漂白性,能漂白pH试纸,不能用该法测定氯水的pH,A错误;
B.KMnO4具有强氧化性,能腐蚀碱式滴定管尖嘴部分的橡胶管,故不能用碱式滴定管盛装酸性KMnO4溶液,B错误;
C.铜丝有良好的导热性,如用铜丝代替玻璃搅拌器,会加快反应放出的热量散失,使测得的偏小,C正确;
D.中和滴定时,盛装待测液的锥形瓶不能用待测液润洗,如润洗,会使待测液用量增大,测定结果偏高,D错误;
故选C。
8.B
解析:A.锥形瓶洗净后不需要经过烘干,直接滴入待测液进行滴定实验,故A正确;
B.用蒸馏水洗净酸式滴定管后,先润洗2~3次,再装入标准盐酸进行滴定实验,故B错误;
C.KMnO4溶液是紫红色,向一定浓度的酸性KMnO4溶液中滴加H2C2O4溶液,当酸性KMnO4溶液消耗完,则紫红色逐渐褪去,故C正确;
D.Na2S2O3与稀硫酸反应生成硫酸钠、硫单质和二氧化硫,因此向一定浓度的Na2S2O3溶液中滴加稀硫酸,溶液出现浑浊,并产生气泡,故D正确。
综上所述,答案为B。
二、非选择题
9.3 12 2
解析:(1) pH=2的盐酸溶液中c(H+)=10-2mol/L,加水稀释100倍,溶液中c(H+)=10-4mol/L,pH=4;
故答案为:4。
(2) 0.001mol/L的盐酸,c(H+)=10-3mol/L,pH=3;
故答案为:3。
(3) 0.01mol/L的NaOH溶液,c(OH-)=10-2mol/L,根据Kw=c(OH-)×(H+)=10-14得溶液中c(H+)=10-12mol/L,pH=12;
故答案为:12。
(4) 0.015mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,酸过量,溶液显酸性,设溶液的体积均为1L,所得混和溶液中c(H+)=(0.015mol/L×1L×2-0.01mol/L×1L)÷2L=10-2mol/L,pH=2;
故答案为:2。
10. ②④ 10-12mol/L CH3COOHCH3COO—+H+ 小于 81.8
解析:(1)弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等,所以②CH3COOH、④NH3 H2O是弱电解质;
答案为:②④;
(2)常温下pH=2的CH3COOH溶液中c(H+)=1.0×10-2mol/L,醋酸溶液中的氢氧根离子来自于水的电离,由水电离产生的 c(OH-) =mol/L;
答案为:10-12mo1/L
(3) CH3COOH为弱电解质,部分电离,电离方程式;
答案为:
(4)氨水是弱电解质,氢氧化钠是强电解质,氨水存在电离平衡,氢氧化钠不存在电离平衡,将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则氢氧化钠的稀释倍数小于氨水,
答案为:小于;
(5) 盐酸的浓度是0.01mol/L,设加入盐酸的体积是V,c(OH )===0.001mol/L,解得:V=81.8mL,
故答案为81.8
