2.4化学反应的调控 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 336.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 18:47:36 | ||
图片预览

文档简介
2.4化学反应的调控同步练习题
一、选择题
1.羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在一定条件下,将CO与H2S以体积比1:2置于某刚性密闭容器中发生下列反应:CO(g)+H2S(g) COS(g)+H2(g)。下列说法正确的是
A.升高温度,H2S的浓度增大,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大,逆反应速率不变
C.COS与H2的体积比保持不变时,说明反应达到平衡状态
D.向反应器中再通入CO,能使H2S的转化率增大
2.为阿伏加德罗常数的值。在恒容密闭容器中加入和,一定条件下反应:达到平衡状态,下列说法正确的是
A.达到平衡时放出的热量为
B.达到平衡状态时转移电子数目为
C.容器内原子总数为
D.在反应中若有个断键时达到平衡状态,则的平衡转化率约为
3.下列事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.合成氨时,加催化剂,使和在一定条件下转化为
C.由和组成的平衡体系加压后颜色先变深、后变浅
D.增大压强,有利于与反应生成
4.合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,且进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
20MPa 60MPa
500℃ 19.1 42.2
而实际从合成塔出来的混合气体中含有氨约为15%,这表明
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应并未达到平衡
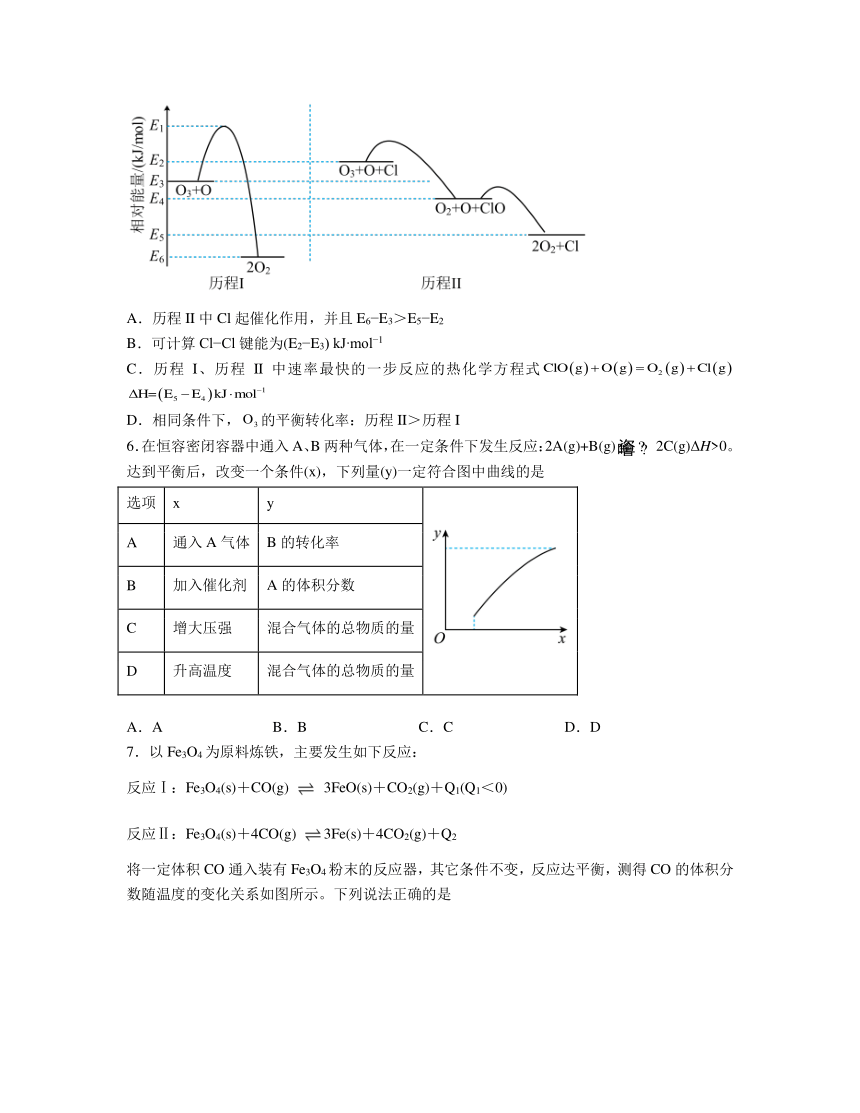
5.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下(已知O2(g)和Cl2(g)的相对能量为0),下列说法正确的是
A.历程II中Cl起催化作用,并且E6 E3>E5 E2
B.可计算Cl Cl键能为(E2 E3) kJ mol 1
C.历程I、历程II中速率最快的一步反应的热化学方程式
D.相同条件下,的平衡转化率:历程II>历程I
6.在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)2C(g)ΔH>0。达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
选项 x y
A 通入A气体 B的转化率
B 加入催化剂 A的体积分数
C 增大压强 混合气体的总物质的量
D 升高温度 混合气体的总物质的量
A.A B.B C.C D.D
7.以Fe3O4为原料炼铁,主要发生如下反应:
反应Ⅰ:Fe3O4(s)+CO(g) 3FeO(s)+CO2(g)+Q1(Q1<0)
反应Ⅱ:Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)+Q2
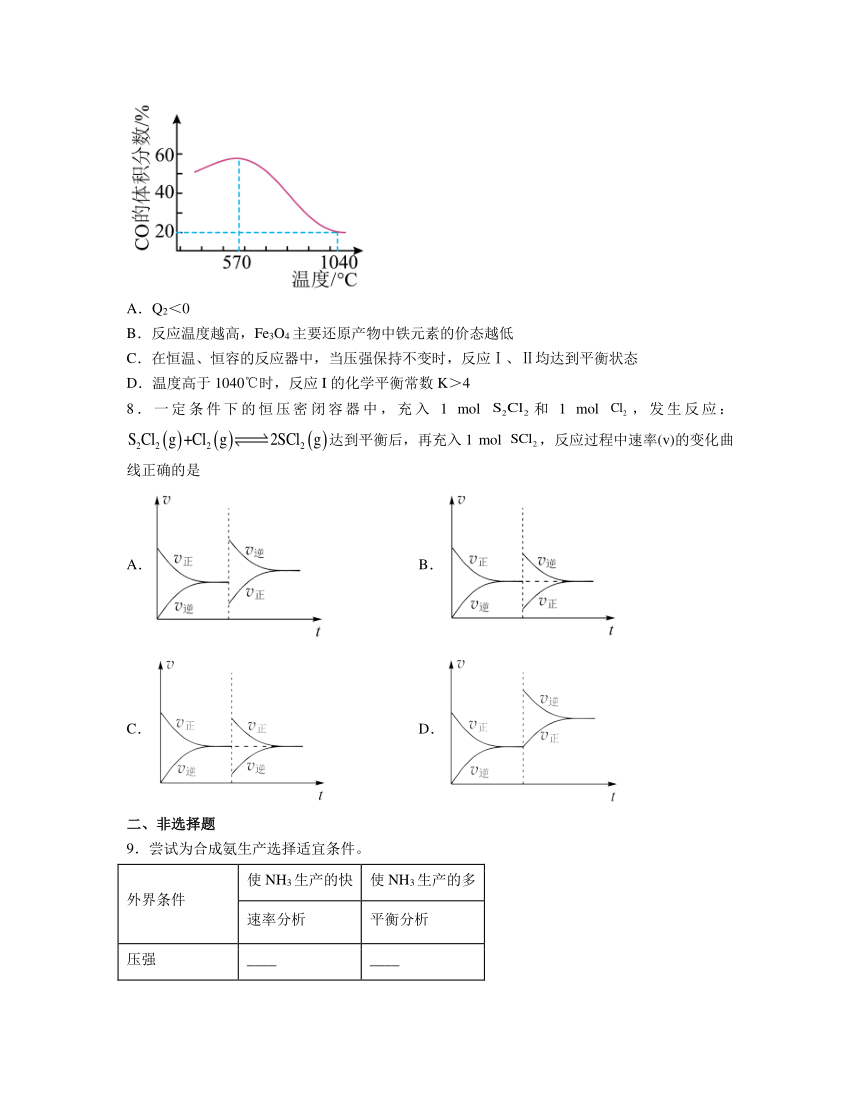
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO的体积分数随温度的变化关系如图所示。下列说法正确的是
A.Q2<0
B.反应温度越高,Fe3O4主要还原产物中铁元素的价态越低
C.在恒温、恒容的反应器中,当压强保持不变时,反应Ⅰ、Ⅱ均达到平衡状态
D.温度高于1040℃时,反应I的化学平衡常数K>4
8.一定条件下的恒压密闭容器中,充入1 mol 和1 mol ,发生反应:达到平衡后,再充入1 mol ,反应过程中速率(v)的变化曲线正确的是
A. B.
C. D.
二、非选择题
9.尝试为合成氨生产选择适宜条件。
外界条件 使NH3生产的快 使NH3生产的多
速率分析 平衡分析
压强 ____ ____
温度 ____ ____
催化剂 ____ ____
反应物的浓度 ____ ____
生成物氨的浓度 ____ ____
10.汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,即2NO+2CO2CO2+N2。
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0)。
时间(s) 0 1 2 3 4 5
c(NO)(×10-4,mol/L) 10.0 4.50 2.50 1.50 1.00 1.00
c(CO)(×10-3,mol/L) 3.60 3.05 2.85 2.75 2.70 2.70
回答下列问题:
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是___反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率:v(N2)=___。
(3)t1℃时该反应的平衡常数表达式:K=___。
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是___(选填答案编号)。
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积
【参考答案】
一、选择题
1.D
解析:A.升高温度,H2S的浓度增大,说明平衡逆向移动。升高温度,平衡向吸热反应方向移动,所以表明该反应的正反应是放热反应,故A错误;
B.通入CO后,反应物浓度增大,正反应速率逐渐增大,平衡正向移动,生成物浓度随之增大,逆反应速率也随之增大,故B错误;
C.COS与H2都是生成物,该反应起始时加入的是反应物,则生成物COS和H2的体积比始终为1:1,所以COS和H2体积比保持不变时,不能说明反应达到平衡状态,故C错误;
D.向反应器中再通入CO,平衡正向移动,转化的H2S增多,则H2S的转化率增大,故D正确;
故选D。
2.C
解析:A.该反应是可逆反应,反应达到平衡状态时,起始的和不能完全反应,放出来的热量小于,故A项错误;
B.该反应是可逆反应,反应达到平衡时,N2的消耗量小于1mol,因此达到平衡状态时,转移电子数小于,故B项错误;
C.起始容器内原子数为2×4=8,根据反应过程中原子守恒可知,反应前后原子总数不变,故C项正确;
D.若反应中共有2个断键,说明反应共消耗,同时也消耗了,则平衡转化率为,故D项错误;
综上所述,说法正确的C项。
3.B
解析:A.,光照下次氯酸分解,使平衡正向移动,浓度降低,颜色变浅,符合勒夏特列原理,A不符合题意;
B.催化剂可以改变反应速率,但不改变化学平衡状态,不能用勒夏特列原理解释,B符合题意;
C.反应,加压后浓度增大,气体颜色变深,同时加压使平衡右移,气体颜色又变浅,故符合勒夏特列原理,C不符合题意;
D.与反应生成是气体物质的量减少的反应,增大压强,平衡向正反应方向移动,能用勒夏特列原理解释,D不符合题意;
选B。
4.D
解析:A.表中数据为通过科学实验所得,不可能有明显误差,A错误;
B.合成氨连续操作,不可能对生产条件控制不当,B错误;
C.平衡浓度与速率的大小没有直接关系,C错误;
D.合成氨工业考虑单位时间的产量问题,并未让合成氨反应达到平衡,因为让反应达到平衡需要一定的时间,时间太长得不偿失,D正确;
故答案选D。
5.C
解析:A.历程II中Cl起催化作用,催化剂降低反应活化能,但焓变不变即E6 E3=E5 E2,故A错误;
B.Cl2(g)的相对能量为0,由图可知Cl(g)的相对能量为(E2 E3) kJ mol 1,断裂化学键吸收热量,Cl2(g)→2Cl(g)吸收能量为2(E2 E3) kJ mol 1,则Cl Cl键能为2(E2 E3) kJ mol 1,故B错误;
C.历程I、历程II中速率最快的一步是活化能最小的一步即,其反应的热化学方程式 ,故C正确;
D.相同条件下,催化剂不改变平衡移动,因此的平衡转化率:历程II=历程I,故D错误。
综上所述,答案为C。
6.A
解析:A.恒容下再加气体A,A的浓度增大,平衡正移,B的转化率增大,A正确;
B.催化剂只改变反应速率,不影响平衡移动,与图象不符,B错误;
C.该反应是一个反应后气体分子数减小的反应,增大压强,平衡正移,混合气体的总物质的量减小,与图象不符,C错误;
D.该正反应为吸热反应,升高温度,平衡正移,混合气体的总物质的量减小,与图象不符,D错误;
故选:A。
7.D
解析:A.反应Ⅰ是吸热反应,升高温度,平衡正向移动,CO体积分数减小,而图中温度在570℃以下,CO的体积分数增大,说明反应Ⅱ逆向移动,则反应Ⅱ是放热反应即Q2>0,故A错误;
B.根据图中信息可知,温度在570℃以上,CO的体积分数随温度升高不断减小,说明以反应Ⅰ为主,反应温度越高,Fe3O4主要还原产物中铁元素的价态越高,故B错误;
C.反应Ⅰ、Ⅱ都是等体积反应,因此在恒温、恒容的反应器中,当压强保持不变时,反应Ⅰ、Ⅱ不能说明达到平衡状态,故C错误;
D.由图中信息可知,在1040℃时,发生的反应为反应Ⅰ,一氧化碳体积分数为20%,则反应的平衡常数,反应Ⅰ是吸热反应,升高温度,平衡正向移动,平衡常数增大,当温度高于1040℃时,因此反应I的化学平衡常数K>4,故D正确。
综上所述,答案为D。
8.B
解析:恒压密闭容器中反应达到平衡后,再充入1 mol SCl2,体积增大到2倍,反应物浓度减小为1/2,正反应速率减小,SCl2浓度不变,逆反应速率增大;新平衡和旧平衡互为等效平衡,各物质的物质的量浓度相等,故新、旧反应速率相等,B正确;
故选B。
二、非选择题
9. 高压 高压 高温 低温 使用 无影响 增大浓度 增大浓度 减小浓度 减小浓度
解析:略
10. 放热 1.42×10-4mol/(L·s) c、d
【分析】(1)根据图示所给的反应物总能量与生成物总能量大小关系进行分析;
(2)同一反应同一时段内各物质反应速率之比等于计量数之比,v(N2)=v(NO);
(3)根据平衡常数的概念进行书写;
(4)根据影响平衡移动的规律进行分析。
解析:(1)反应物总能量大于生成物总能量,则该反应为放热反应;
(2)同一反应同一时段内各物质反应速率之比等于计量数之比,所以前3s内的平均反应速率v(N2)=v(NO)=×=1.42×10-4 mol L-1 s-1;
(3)根据平衡常数的概念可知反应 2NO+2CO2CO2 +N2的K=;
(4)a.选用更有效的催化剂,不能使平衡发生移动,故错误;
b.因反应放热,升高反应体系的温度,则平衡逆向移动,转化率减小,故错误;
c.降低反应体系的温度,平衡正向移动,转化率增大,故正确;
d.缩小容器的体积,平衡正向移动,转化率增大,故正确;
故答案为:cd
一、选择题
1.羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在一定条件下,将CO与H2S以体积比1:2置于某刚性密闭容器中发生下列反应:CO(g)+H2S(g) COS(g)+H2(g)。下列说法正确的是
A.升高温度,H2S的浓度增大,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大,逆反应速率不变
C.COS与H2的体积比保持不变时,说明反应达到平衡状态
D.向反应器中再通入CO,能使H2S的转化率增大
2.为阿伏加德罗常数的值。在恒容密闭容器中加入和,一定条件下反应:达到平衡状态,下列说法正确的是
A.达到平衡时放出的热量为
B.达到平衡状态时转移电子数目为
C.容器内原子总数为
D.在反应中若有个断键时达到平衡状态,则的平衡转化率约为
3.下列事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.合成氨时,加催化剂,使和在一定条件下转化为
C.由和组成的平衡体系加压后颜色先变深、后变浅
D.增大压强,有利于与反应生成
4.合成氨反应通常控制在20~50MPa的压强和500℃左右的温度,且进入合成塔的氮气和氢气的体积比为1∶3,经科学测定,在相应条件下氮气和氢气反应所得氨的平衡浓度(体积分数)如表所示:
20MPa 60MPa
500℃ 19.1 42.2
而实际从合成塔出来的混合气体中含有氨约为15%,这表明
A.表中所测数据有明显误差
B.生产条件控制不当
C.氨的分解速率大于预测值
D.合成塔中的反应并未达到平衡
5.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下(已知O2(g)和Cl2(g)的相对能量为0),下列说法正确的是
A.历程II中Cl起催化作用,并且E6 E3>E5 E2
B.可计算Cl Cl键能为(E2 E3) kJ mol 1
C.历程I、历程II中速率最快的一步反应的热化学方程式
D.相同条件下,的平衡转化率:历程II>历程I
6.在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)2C(g)ΔH>0。达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
选项 x y
A 通入A气体 B的转化率
B 加入催化剂 A的体积分数
C 增大压强 混合气体的总物质的量
D 升高温度 混合气体的总物质的量
A.A B.B C.C D.D
7.以Fe3O4为原料炼铁,主要发生如下反应:
反应Ⅰ:Fe3O4(s)+CO(g) 3FeO(s)+CO2(g)+Q1(Q1<0)
反应Ⅱ:Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)+Q2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO的体积分数随温度的变化关系如图所示。下列说法正确的是
A.Q2<0
B.反应温度越高,Fe3O4主要还原产物中铁元素的价态越低
C.在恒温、恒容的反应器中,当压强保持不变时,反应Ⅰ、Ⅱ均达到平衡状态
D.温度高于1040℃时,反应I的化学平衡常数K>4
8.一定条件下的恒压密闭容器中,充入1 mol 和1 mol ,发生反应:达到平衡后,再充入1 mol ,反应过程中速率(v)的变化曲线正确的是
A. B.
C. D.
二、非选择题
9.尝试为合成氨生产选择适宜条件。
外界条件 使NH3生产的快 使NH3生产的多
速率分析 平衡分析
压强 ____ ____
温度 ____ ____
催化剂 ____ ____
反应物的浓度 ____ ____
生成物氨的浓度 ____ ____
10.汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,即2NO+2CO2CO2+N2。
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,用气体传感器测得了不同时间的NO和CO的浓度如表(CO2和N2的起始浓度为0)。
时间(s) 0 1 2 3 4 5
c(NO)(×10-4,mol/L) 10.0 4.50 2.50 1.50 1.00 1.00
c(CO)(×10-3,mol/L) 3.60 3.05 2.85 2.75 2.70 2.70
回答下列问题:
(1)已知在上述反应中,反应物总能量大于生成物总能量,则正反应是___反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率:v(N2)=___。
(3)t1℃时该反应的平衡常数表达式:K=___。
(4)假设在密闭容器中该反应达到平衡后,改变下列条件,能提高NO转化率的是___(选填答案编号)。
a.选用更有效的催化剂 b.升高反应体系的温度
c.降低反应体系的温度 d.缩小容器的体积
【参考答案】
一、选择题
1.D
解析:A.升高温度,H2S的浓度增大,说明平衡逆向移动。升高温度,平衡向吸热反应方向移动,所以表明该反应的正反应是放热反应,故A错误;
B.通入CO后,反应物浓度增大,正反应速率逐渐增大,平衡正向移动,生成物浓度随之增大,逆反应速率也随之增大,故B错误;
C.COS与H2都是生成物,该反应起始时加入的是反应物,则生成物COS和H2的体积比始终为1:1,所以COS和H2体积比保持不变时,不能说明反应达到平衡状态,故C错误;
D.向反应器中再通入CO,平衡正向移动,转化的H2S增多,则H2S的转化率增大,故D正确;
故选D。
2.C
解析:A.该反应是可逆反应,反应达到平衡状态时,起始的和不能完全反应,放出来的热量小于,故A项错误;
B.该反应是可逆反应,反应达到平衡时,N2的消耗量小于1mol,因此达到平衡状态时,转移电子数小于,故B项错误;
C.起始容器内原子数为2×4=8,根据反应过程中原子守恒可知,反应前后原子总数不变,故C项正确;
D.若反应中共有2个断键,说明反应共消耗,同时也消耗了,则平衡转化率为,故D项错误;
综上所述,说法正确的C项。
3.B
解析:A.,光照下次氯酸分解,使平衡正向移动,浓度降低,颜色变浅,符合勒夏特列原理,A不符合题意;
B.催化剂可以改变反应速率,但不改变化学平衡状态,不能用勒夏特列原理解释,B符合题意;
C.反应,加压后浓度增大,气体颜色变深,同时加压使平衡右移,气体颜色又变浅,故符合勒夏特列原理,C不符合题意;
D.与反应生成是气体物质的量减少的反应,增大压强,平衡向正反应方向移动,能用勒夏特列原理解释,D不符合题意;
选B。
4.D
解析:A.表中数据为通过科学实验所得,不可能有明显误差,A错误;
B.合成氨连续操作,不可能对生产条件控制不当,B错误;
C.平衡浓度与速率的大小没有直接关系,C错误;
D.合成氨工业考虑单位时间的产量问题,并未让合成氨反应达到平衡,因为让反应达到平衡需要一定的时间,时间太长得不偿失,D正确;
故答案选D。
5.C
解析:A.历程II中Cl起催化作用,催化剂降低反应活化能,但焓变不变即E6 E3=E5 E2,故A错误;
B.Cl2(g)的相对能量为0,由图可知Cl(g)的相对能量为(E2 E3) kJ mol 1,断裂化学键吸收热量,Cl2(g)→2Cl(g)吸收能量为2(E2 E3) kJ mol 1,则Cl Cl键能为2(E2 E3) kJ mol 1,故B错误;
C.历程I、历程II中速率最快的一步是活化能最小的一步即,其反应的热化学方程式 ,故C正确;
D.相同条件下,催化剂不改变平衡移动,因此的平衡转化率:历程II=历程I,故D错误。
综上所述,答案为C。
6.A
解析:A.恒容下再加气体A,A的浓度增大,平衡正移,B的转化率增大,A正确;
B.催化剂只改变反应速率,不影响平衡移动,与图象不符,B错误;
C.该反应是一个反应后气体分子数减小的反应,增大压强,平衡正移,混合气体的总物质的量减小,与图象不符,C错误;
D.该正反应为吸热反应,升高温度,平衡正移,混合气体的总物质的量减小,与图象不符,D错误;
故选:A。
7.D
解析:A.反应Ⅰ是吸热反应,升高温度,平衡正向移动,CO体积分数减小,而图中温度在570℃以下,CO的体积分数增大,说明反应Ⅱ逆向移动,则反应Ⅱ是放热反应即Q2>0,故A错误;
B.根据图中信息可知,温度在570℃以上,CO的体积分数随温度升高不断减小,说明以反应Ⅰ为主,反应温度越高,Fe3O4主要还原产物中铁元素的价态越高,故B错误;
C.反应Ⅰ、Ⅱ都是等体积反应,因此在恒温、恒容的反应器中,当压强保持不变时,反应Ⅰ、Ⅱ不能说明达到平衡状态,故C错误;
D.由图中信息可知,在1040℃时,发生的反应为反应Ⅰ,一氧化碳体积分数为20%,则反应的平衡常数,反应Ⅰ是吸热反应,升高温度,平衡正向移动,平衡常数增大,当温度高于1040℃时,因此反应I的化学平衡常数K>4,故D正确。
综上所述,答案为D。
8.B
解析:恒压密闭容器中反应达到平衡后,再充入1 mol SCl2,体积增大到2倍,反应物浓度减小为1/2,正反应速率减小,SCl2浓度不变,逆反应速率增大;新平衡和旧平衡互为等效平衡,各物质的物质的量浓度相等,故新、旧反应速率相等,B正确;
故选B。
二、非选择题
9. 高压 高压 高温 低温 使用 无影响 增大浓度 增大浓度 减小浓度 减小浓度
解析:略
10. 放热 1.42×10-4mol/(L·s) c、d
【分析】(1)根据图示所给的反应物总能量与生成物总能量大小关系进行分析;
(2)同一反应同一时段内各物质反应速率之比等于计量数之比,v(N2)=v(NO);
(3)根据平衡常数的概念进行书写;
(4)根据影响平衡移动的规律进行分析。
解析:(1)反应物总能量大于生成物总能量,则该反应为放热反应;
(2)同一反应同一时段内各物质反应速率之比等于计量数之比,所以前3s内的平均反应速率v(N2)=v(NO)=×=1.42×10-4 mol L-1 s-1;
(3)根据平衡常数的概念可知反应 2NO+2CO2CO2 +N2的K=;
(4)a.选用更有效的催化剂,不能使平衡发生移动,故错误;
b.因反应放热,升高反应体系的温度,则平衡逆向移动,转化率减小,故错误;
c.降低反应体系的温度,平衡正向移动,转化率增大,故正确;
d.缩小容器的体积,平衡正向移动,转化率增大,故正确;
故答案为:cd
