3.1氯气及氯的化合物(含解析) 同步练习 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1氯气及氯的化合物(含解析) 同步练习 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 283.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 19:19:36 | ||
图片预览




文档简介
出卷网
3.1氯气及氯的化合物 同步练习 2023-2024学年高一上学期化学苏教版(2019)必修第一册
一、单选题
1.为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.的硫酸溶液中含的数目为
B.含有的质子数和中子数均为
C.通入适量水中,转移的电子数为
D.标准状况下,含有的共价键数为
2.下列关于氯气的叙述,错误的是( )
A.氯气是一种有毒的气体
B.氯气、氯水、液氯是同一种物质
C.氯气能与水发生反应
D.氯气是一种黄绿色,有刺激性气味的气体
3.下列说法中,正确的是( )
A.氯原子和氯离子的化学性质相同
B.氯离子比氯原子多一个电子
C.氯气有毒,氯离子也有毒
D.氯气和氯离子都显黄绿色
4.某化工厂发生了氯气泄漏,以下自救得当的是( )
A.喷射氢氧化钠溶液将泄露的氯气吸收
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用湿毛巾或蘸有肥皂水的毛巾捂住口鼻撤退
5.化学是以实验为基础的学科。下列说法正确的是( )
A.可用pH试纸测定新制氯水的pH
B.将80gNaOH固体溶解在1L水中,可配制2mol L-1NaOH溶液
C.利用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体
D.将过量的铁在氯气中燃烧可生成FeCl2
6.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.0.2 mol苯甲醇完全燃烧,生成的CO2数目为1.4NA
B.1 L0.5 mol·L-1 NaHCO3溶液中含有数目为0.5NA
C.56g Fe与1 mol Cl2充分反应时转移的电子数为3NA
D.1 mol 中含有电子数为10NA
7.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
8.KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应的下列说法错误的是( )
A.被氧化的元素和被还原的元素的质量之比为6:1
B.Cl2既是氧化产物,又是还原产物
C.盐酸既体现酸性,又体现还原性
D.转移5mol电子时,产生3molCl2
9.将 0.2mol MnO2和 50mL 12mol L﹣1浓盐酸混合后缓缓加热,反应完全后,再向溶液中加入足量 AgNO3溶液,生成 AgCl 沉淀的物质的量为(不考虑盐酸的挥发)( )
A.大于 0.3 mol,小于 0.6 mol
B.等于 0.3 mol
C.小于 0.3 mol
D.大于 0.6 mol
10.实验室用下列方法制取氯气:①用含4mol HCl的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,若不考虑HCl的挥发,则反应后所得Cl2的物质的量( )
A.方法①比方法②多 B.方法②比方法①多
C.两种方法一样多 D.无法比较
11.2018年11月在法国凡尔赛召开的国际计量大会( CGPM)第26次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这常数被称为阿伏加德罗常数,单位为mol-1”。基于这一新定义,阿伏加德罗常数的不确定度被消除了。新定义将于2019年5月20日正式生效。NA为阿伏加德罗常数的值。下列说法错误的是( )
A.新定义中阿伏加德罗常数的不确定度被消除
B.0.4 moI NH3与0.6molO2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
C.2.7g铝中加入足量1mol·L-1的NaOH溶液,转移的电子数为0.3NA
D.常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为NA
12.氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1mol N2有6mol电子转移
13.NA为阿伏加德罗常数的值。下列说法正确的是( )
A.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA
B.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
D.1 mol Cl2参加反应转移电子数一定为2NA
14.将氯气分别通入含下列离子的溶液中,离子浓度变化最小的是( )
A. B. C. D.
15.如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的干燥红色布条看不到明显现象,当打开B阀后,C处红色布条逐渐褪色,D瓶中装的溶液不可能是 ( )
A.浓硫酸 B.NaOH溶液
C.KI溶液 D.饱和NaCl溶液
16.如图所示,A处通入氯气,打开B阀时,C处红色布条不褪色;关闭B阀时,C处红色布条褪色;由此作出的判断正确的是( )
A.D中可能是浓硫酸 B.通入的氯气含有水蒸气
C.D中可能是水 D.D中可能是NaOH溶液
二、综合题
17.仔细阅读材料,应用物质分类和氧化还原反应等相关概念,回答下列问题:
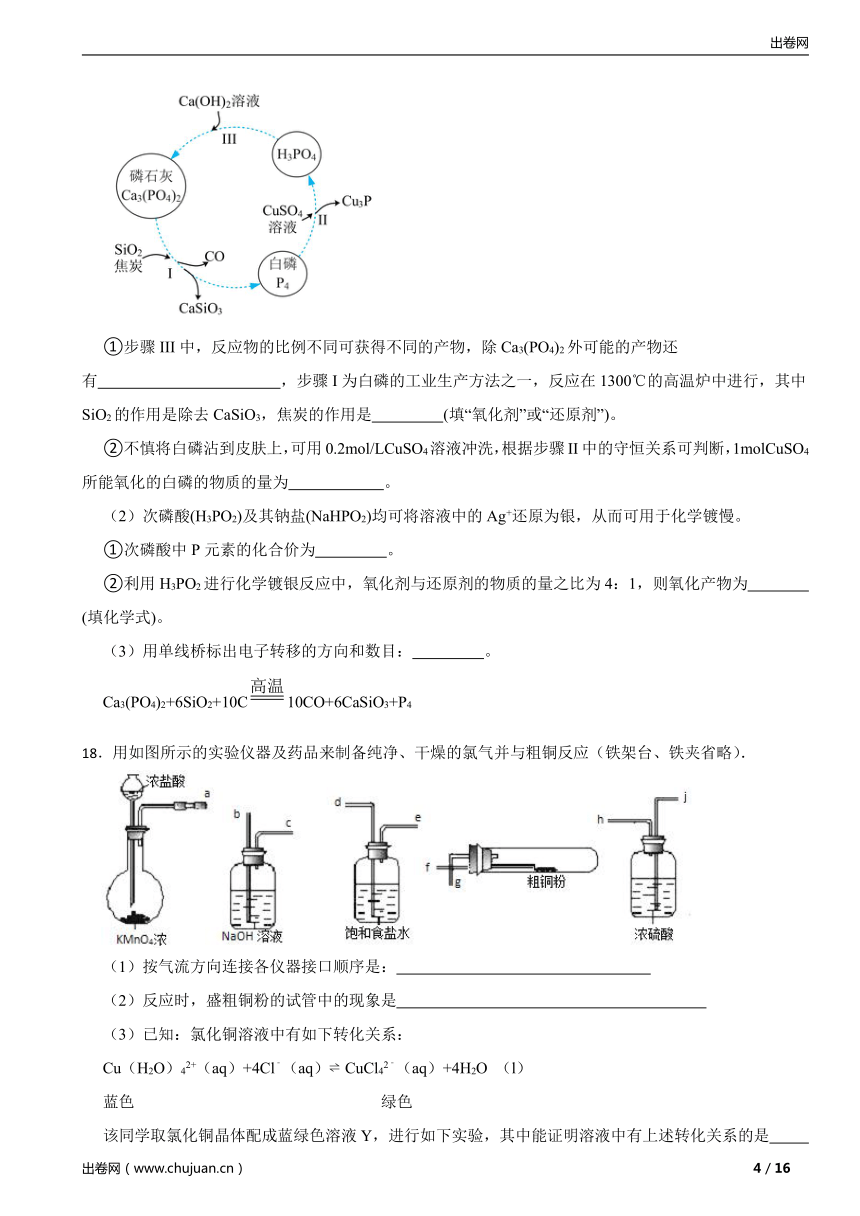
(1)磷及部分重要化合物的相互转化如图所示。
①步骤III中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 ,步骤I为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是除去CaSiO3,焦炭的作用是 (填“氧化剂”或“还原剂”)。
②不慎将白磷沾到皮肤上,可用0.2mol/LCuSO4溶液冲洗,根据步骤II中的守恒关系可判断,1molCuSO4所能氧化的白磷的物质的量为 。
(2)次磷酸(H3PO2)及其钠盐(NaHPO2)均可将溶液中的Ag+还原为银,从而可用于化学镀慢。
①次磷酸中P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式)。
(3)用单线桥标出电子转移的方向和数目: 。
Ca3(PO4)2+6SiO2+10C10CO+6CaSiO3+P4
18.用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略).
(1)按气流方向连接各仪器接口顺序是:
(2)反应时,盛粗铜粉的试管中的现象是
(3)已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl﹣(aq) CuCl42﹣(aq)+4H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 填序号).
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失
19.某工厂废水中含有大量的和较多的,为了减少污染并变废为宝,通过以下反应从废水中回收和:①②
(1)反应①中,化合价升高的元素是 (填元素符号),氧化剂是 (填化学式)。
(2)反应②中若每消耗1,则生成的体积约是 L(标准状况),转移电子的物质的量为 。
20.工业上氯气用途非常广泛,回答下列问题:
(1)实验室制取氯气的化学方程式为 。
(2)下表是某实验研究氯水性质实验的部分活动记录。
实验内容 实验现象 解释原因(文字或反应)
观察氯水颜色 ① 氯水中含有氯气分子
向氯水中滴入 有无色气体生成 ② (写离子方程式)
用玻璃棒蘸取氯水,点在品红试纸上 红色褪去 ③
(3)“价态—类别”二维图是研究元素的重要方法,下图为氯及其化合物的“价态—类别”二维图。
①二维图缺失的类别A是 ;B是家庭学校常用的消毒药品,则B是 (填化学式);C的焰色试验呈紫色,则C是 (填化学式)。
②某同学利用a.b.c.酸性三种溶液探究盐酸性质,试验前进行如下预测:从物质类别上看,盐酸有酸的通性,可能与 发生反应(填序号);从化合价角度看,盐酸的具有 性,(填“氧化”或“还原”);可能与 发生反应(填序号)。
(4)下图是用强光照射密闭广口瓶中新制氯水时,用数字化传感器采集的图像,下列纵坐标代表的物理量与图像相符的是 。
a.溶液颜色的变化 b.瓶中氧气的体积分数
c.溶液的导电能力 d.溶液的漂白能力
21.饮用水质量是关系人类健康的重要问题.
(1)在我国,一些贫困山区的农民至今还饮用井水,但暴雨过后井水混浊,无法饮用.为了能让暴雨过后井水尽快变的澄清,你会建议他们最好向井水中投入下列中的 (填序号)
A.NaCl B.Na2CO3
C.KAl(SO4)2 12H2O D.CuSO4
(2)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为: .
(3)写出工业上制取漂白粉的化学方程式: .
(4)臭氧,也称作超氧,可以替代氯气给自来水消毒,即提高了消毒效率且安全无副作用,臭氧的分子式为 ;该物质、氯气以及SO2均可以做漂白剂,三者的漂白原理分别是: ; ; .
(5)ClO2是一种光谱型的消毒剂,将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为 .
答案解析部分
1.【答案】B
【解析】【解答】A.溶液的体积未知,无法计算含的数目,故A不符合题意;
B.的摩尔质量为20g/mol,的物质的量为0.1mol,每个分子含有质子数、中子数均为10,故含有的质子数和中子数均为,故B符合题意;
C.通与水反应是可逆反应,通入适量水中,转移的电子数小于,故C不符合题意;
D.在标准状况下为液态,不能用22.4L/mol计算其物质的量,故D不符合题意。
故答案为:B。
【分析】A. 要得到氢离子的物质的量需要溶液体积;
C.氯气通水属于可逆反应无法完全反应;
D.四氯化碳标况下为液体。
2.【答案】B
【解析】【解答】A.氯气有毒,A不符合题意;
B.氯水是混合物,氯气、液氯为纯净物;B符合题意;
C.氯气能与水发生反应生成盐酸和次氯酸,C不符合题意;
D.氯气是一种黄绿色,有刺激性气味的气体,D不符合题意;
故答案为:B。
【分析】依据氯气的性质以及物质的成分判断。
3.【答案】B
【解析】【解答】A.氯原子和氯离子的最外层电子数不同,因此二者的化学性质不相同,A不符合题意;
B.Cl原子最外层有7个电子,不稳定,容易从外界获得1个电子变为Cl-,所以氯离子比氯原子多一个电子,B符合题意;
C.氯气有毒,而氯离子是食盐的主要成分,用于调味,没有毒性,C不符合题意;
D.氯气是黄绿色有毒的气体,而氯离子无色,与阳离子共存于物质中,D不符合题意;
故合理选项是B。
【分析】A.同种元素的最外层电子的多少决定微粒的化学性质;
B.根据氯离子和氯原子的核外电子数进行判断;
C.氯离子无毒,这需要记忆;
D.氯离子是无色离子。
4.【答案】D
【解析】【解答】A.氢氧化钠具有强腐蚀性,不符合题意
B.氯气密度比空气大,应向地势较高的地方撤离,不符合题意
C.应逆风撤离,不符合题意
D.用湿毛巾或者蘸有肥皂水的毛巾捂住口鼻可吸收氯气,减少人吸入氯气,符合题意
故答案为:D
【分析】氯气的物理性质,密度比空气大,化学性质有毒,能被水或者碱液吸收
5.【答案】C
【解析】【解答】A.氯水具有漂白性,故不可用pH试纸测定新制氯水的pH,A不符合题意;
B.水的体积不等同于溶液的体积,需要配制成1L的溶液才能得到2molL-1NaOH溶液,B不符合题意;
C.Fe(OH)3胶体可产生丁达尔效应,FeCl3溶液不会产生丁达尔效应,故利用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体,C符合题意;
D.铁在氯气中燃烧可生成FeCl3,与反应物的用量无关,D不符合题意;
故答案为:C。
【分析】A、氯水具有酸性和漂白性;
B、浓度公式中的体积为溶液体积;
C、丁达尔效应可以鉴别胶体;
D、氯气和铁反应生成氯化铁。
6.【答案】A
【解析】【解答】A.1个苯甲醇中含有7个碳原子,苯甲醇完全燃烧生成CO2和H2O,所以0.2 mol苯甲醇完全燃烧,生成的n(CO2)=0.2mol×7=1.4mol,则其数目为1.4NA,A符合题意;
B.由分析可知,n(NaHCO3)=1 L×0.5 mol·L-1=0.5mol,由于 能发生水解反应,所以溶液中n( )<0.5mol,则其数目小于0.5NA,B不符合题意;
C.涉及反应为2Fe+3Cl22FeCl3,56gFe即1mol过量,实际反应的n(Fe)=mol,则转移的电子物质的量为×3mol=2mol,即2NA,C不符合题意;
D.1个 中含有8个电子,则1 mol 中含有电子数为8NA,D不符合题意;
故答案为:A。
【分析】A.根据反应前后原子个数不变和N=nNA进行分析。
B.注意弱酸根或弱碱根离子能发生水解反应,结合n=cV进行分析。
C.Fe与Cl2反应生成FeCl3,结合参加反应的量进行分析。
D.注意1个 中含有8个电子。
7.【答案】C
【解析】【解答】A、核素D和H的质量数不同,质子数相同。则18gD2O和18gH2O的物质的量不同,所以含有的质子数不同,A不符合题意;
B、亚硫酸为弱酸,水溶液中不完全电离,所以溶液中氢离子数目小于2NA,B不符合题意;
C、过氧化钠与水反应生成氧气,氧气的来源于-1价的O元素,所以生成0.1mol氧气时转移电子0.2NA,C符合题意;
D、由于在反应过程中盐酸浓度降低,稀盐酸与二氧化锰不反应,所以不能计算转移的电子数,D不符合题意,
故答案为:C
【分析】该题考察同位素的概念、质子数中子数和质量数之间的关系、强弱电解质的概念、氧化还原反应电子转移的有关计算等。1、同位素指的是质子数相同而中子数不同的核素,且质量数=质子数+中子数;2、弱电解质指的是部分电离的电解质,即不完全发生电离;3、氧化还原反应中电子转移数目的计算只看得电子数或只看失电子数。
8.【答案】A
【解析】【解答】A. 被氧化的元素和被还原的元素的质量之比为5:1,A符合题意;
B. Cl2中的Cl既来自KClO3又来自HCl,所以它既是氧化产物,又是还原产物,B不符合题意;
C. 由上面分析可知,盐酸既体现酸性,又体现还原性,C不符合题意;
D.从反应中可以看出,转移5mol电子时,产生3molCl2,D不符合题意;
故答案为:A
【分析】在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3是氧化剂,Cl的价态由+5价降为0价;5HCl为还原剂,价态由-1价升为0价,1HCl表现出酸性;据此结合选项进行分析。
9.【答案】A
【解析】【解答】50mL 12mol L﹣1浓盐酸中氯化氢的物质的量为0.05× 12mol L﹣1=0.6mol,根据反应方程式 ,若盐酸完全反应则生成氯气的物质的量是0.15mol,由于二氧化锰与稀盐酸不反应,所以生成氯气的物质的量小于0.15mol,溶液中剩余氯离子的物质的量大于(0.6mol-0.15mol×2),所以生成 AgCl 沉淀的物质的量大于大于 0.3 mol,小于 0.6 mol,故A符合题意。
【分析】注意过量问题,当固体过量时,溶液的浓度发生变化导致反应也发生变化。
10.【答案】B
【解析】【解答】①用含4molHCl的浓盐酸与足量的MnO2反应时,由于MnO2与稀盐酸不反应,故4molHCl无法完全反应,因此产生Cl2的物质的量小于0.25mol;
②87gMnO2的物质的量,由于浓盐酸足量,故1molMnO2完全反应,此时产生的Cl2的物质的量为1mol;
综上,方法②产生的Cl2的量比方法①多,B符合题意;
故答案为:B
【分析】MnO2与浓HCl反应的化学方程式为:MnO2+4HClMnCl2+2H2O+Cl2;当浓盐酸变为稀盐酸时,反应停止。计算产生Cl2的量时,应用完全反应的量进行计算。
11.【答案】B
【解析】【解答】A.根据新定义,NA就是具体的6.02214076×1023个基本单元,不确定度被消除,故A不符合题意;
B.依据反应4NH3+5O2 4NO+6H2O,0.4moINH3与0.6molO2在催化剂的作用下充分反应,氧气剩余,则生成的一氧化氮部分与氧气反应生成二氧化氮,所以最终生成的NO的分子数小于0.4NA,故B符合题意;
C.2.7g铝的物质的量为0.1mol,而铝反应后变为+3价,故0.1mol铝反应转移0.3NA个电子,故C不符合题意;
D.过氧化钠与水蒸气反应的方程式是2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠既是氧化剂,也是还原剂,2molNa2O2参与反应转移2mol电子,增重4g;则增重2g时,参加反应的过氧化钠是1mol,所以转移电子的物质的量是1mol,转移的电子数为NA,故D不符合题意;
故答案为:B。
【分析】A.根据最新定义,阿伏加德罗常数已经确定,说明阿伏加德罗常数不确定度被消除
B.根据化学方程式4NH3+5O2 4NO+6H2O,发现n(NH3):n(O2)=4:5恰好完全反应,所以会生成0.4molNO,但是题目中的氧气有剩余,导致生成的一氧化氮在催化剂的作用下与氧气反应生成二氧化氮。NO小于0.4mol
C.根据计算铝的物质的量为0.1mol,AlAl3+3e.转移0.3mol电子
D.写出方程式:2Na2O2+2H2O=4NaOH+O2↑2e,根据差量法,增加相对分子质量为4,根据比值可以求出转移的电子数为1mol
12.【答案】C
【解析】【解答】解:A、如果管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应生成HCl,HCl与NH3反应生成NH4Cl,现象为有白烟生成,故A正确;
B、在3Cl2+2NH3=N2+6HCl反应中,Cl元素的化合价由0价降低为﹣1价,氯气表现出氧化性,故B正确;
C、反应中元素化合价发生变化,为氧化还原反应,故C错误;
D、在3Cl2+2NH3=N2+6HCl反应中,N元素的化合价由﹣3价升高到0价,则生成1molN2有6mol电子转移,故D正确.
故选C.
【分析】如果管道漏气,则发生反应3Cl2+2NH3=N2+6HCl,生成HCl气体继续与氨气反应生成氯化铵,现象为有白烟生成,反应中氯气表现出氧化性,根据化合价的变化可知生成1molN2有6mol电子转移.
13.【答案】B
【解析】【解答】A.5.6 g铁粉的物质的量为0.1mol,与少量硝酸反应时生成亚铁离子,失去的电子数0.2NA,故A不符合题意;
B.钠与氧气反应,无论生成氧化钠还是过氧化钠,均生成+1价钠离子,则1 mol Na与足量O2反应,转移的电子数为NA,故B符合题意;
C.碘离子的还原性强于亚铁离子,当有1 mol Fe2+被氧化时,碘离子已经完全反应,则转移的电子的数目一定大于NA,故C不符合题意;
D.若1 mol Cl2与氢氧化钠溶液发生歧化反应生成氯化钠、次氯酸钠和水,转移电子数为NA,故D不符合题意;
故答案为:B。
【分析】碘离子的还原性强于亚铁离子,当有1 mol Fe2+被氧化时,碘离子已经完全反应是解答关键。
14.【答案】A
【解析】【解答】A.Cl2与不反应,A项符合题意;
B.Cl2与水反应生成H+,会消耗,不符合题意,B项不符合题意;
C.Cl2与水反应生成H+,会消耗,不符合题意,C项不符合题意;
D.Cl2具有强氧化性,有强还原性,二者会发生氧化还原反应,不符合题意,D项不符合题意;
故答案为:A。
【分析】依据氯气的性质分析,A中Cl2与不反应。
15.【答案】D
【解析】【解答】A.浓硫酸具有吸水性,氯气通过浓硫酸得到干燥的氯气,故A与题意不符;
B.氯气通过NaOH溶液,与氢氧化钠反应,关闭B阀时,C处的红色布条看不到明显现象,故B与题意不符;
C.氯气通过KI溶液,与KI溶液反应,关闭B阀时,C处的红色布条看不到明显现象,故C与题意不符;
D.氯气与食盐水不反应,进入C的为潮湿的氯气,关闭B阀时,C处红色布条逐渐褪色,故D符合题意;
故答案为:D。
【分析】依据氯气的性质和实验的现象分析。
16.【答案】C
【解析】【解答】A、D中盛放浓硫酸时,具有吸水作用,关闭活塞B,C处的有色布条不会褪色,A不符合题意;
B、A处通入的是潮湿的氯气时,具有漂白性,若打开活塞B,C处的有色布条会褪色,B不符合题意;
C、D中盛放水时,氯气通过会带出水,潮湿的氯气具有漂白性,关闭活塞B,C处的有色布条褪色,C符合题意;
D、D盛放的是氢氧化钠溶液时,会和氯气发生反应,生成氯化钠、次氯酸钠和水,这样再关闭活塞B,C处的有色布条不会褪色,D不符合题意;
故答案为:C
【分析】从A处通入氯气,若打开活塞B,C处的有色布条不褪色,因为干燥的氯气不具备漂白性,若关闭活塞B,C处的有色布条褪色,这说明氯气经过溶液D后带出了水,潮湿的氯气具有漂白性;发生反应为Cl2+H2O=HCl+HClO;生成的次氯酸具有漂白作用。据此结合选项进行分析。
17.【答案】(1)CaHPO4、Ca(H2PO4)2;还原剂;0.05mol
(2)+1;H3PO4
(3)
【解析】【解答】(1)①H3PO4为三元弱酸,步骤III中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有CaHPO4、Ca(H2PO4)2;步骤I中焦炭被氧化为CO,其作用是还原剂。
②CuSO4被还原为Cu3P,Cu的化合价从+2降低为+1价,1molCuSO4得到1mol电子,白磷中P的化合价从0价升高为磷酸中的+5价,1mol白磷失去20mol电子,故1molCuSO4所能氧化的白磷的物质的量为 。
(2)次磷酸(H3PO2)及其钠盐(NaHPO2)均可将溶液中的Ag+还原为银,从而可用于化学镀慢。
①根据化合价代数和为0,可知次磷酸中P元素的化合价为+1。
②利用H3PO2进行化学镀银反应中,假设P的化合价升高为+x价,氧化剂与还原剂的物质的量之比为4:1,根据得失电子守恒可得,,解得x=5,则氧化产物为H3PO4。
(3)反应Ca3(PO4)2+6SiO2+10C10CO+6CaSiO3+P4中,C元素的化合价从0价升高为+2价,P元素的化合价从+5价降低为0价,10molC与1mol硫酸钙反应转移20mol电子,用单线桥标出电子转移的方向和数目:。
【分析】(1)①H3PO4为三元弱酸,能生成三种盐;氧化剂元素化合价降低, 还原剂元素化合价升高;
②依据化合价变化判断转移电子数;
(2)①根据化合价代数和为0;
②根据得失电子守恒;
(3)依据化合价变化表示单线桥。
18.【答案】(1)a→d→e→j→h→f→g→b→c;
(2)铜粉逐渐减少并生成大量棕黄色的烟;
(3)ABC
【解析】【解答】(1)①从a出来的气体含有氯化氢和水蒸气,依次通过d e j h 除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过f g b c,所以按照气流方向各仪器接口的连接顺序为a→d→e→j→h→f→g→b→c,故答案为:a→d→e→j→h→f→g→b→c;
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟,故答案为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故A正确;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故B正确;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故C正确;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故D错误.
故答案为:ABC.
【分析】(1)①要制备收集纯净的氯气应该除去氯气中的杂质(水、HCl),除氯化氢用饱和食盐水,除去水用浓硫酸,然后与铜反应,最后尾气处理用氢氧化钠,据此解答;
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系;
19.【答案】(1)Fe;CuSO4
(2)22.4;2
【解析】【解答】(1)反应①中,化合价升高的是Fe元素,被氧化,化合价降低的元素是Cu元素,所在的反应物CuSO4是氧化剂,答案为Fe;CuSO4;
(2)反应②中若每消耗1,根据反应可知,则生成的体积约是1mol22.4L/mol=22.4L(标准状况),转移电子的物质的量为1mol2=2;答案为22.4;2。
【分析】(1)氧化剂元素化合价降低, 还原剂元素化合价升高;
(2)根据反应的化学方程式计算。
20.【答案】(1)MnO2+4HCl(浓) MnCl2+Cl2+2H2O
(2)氯水颜色为浅黄绿色;;次氯酸具有漂白性,使有色物质褪色
(3)单质;ClO2;KClO3;ab;还原;ac
(4)bc
【解析】【解答】(1)实验室制取氯气是利用二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2+2H2O;
(2)氯水中存在化学平衡Cl2+H2O HCl+HClO,氯气是黄绿色气体,氯水颜色为浅黄绿色;向氯水中滴入NaHCO3溶液,有无色气体生成,该气体为二氧化碳气体,碳酸氢钠和盐酸反应生成氯化钠、二氧化碳和水,反应的离子方程式为:;用玻璃棒蘸取氯水,点在品红试纸上,红色褪去,是因为次氯酸具有漂白性,使有色物质褪色;
(3)①A对应的Cl2是单质,B对应的是+4价氯的氧化物,化学式为ClO2,C的焰色试验呈紫色,则C中含有K元素,其中Cl为+5价,则C是含氧酸盐,化学式为KClO3;
②NaClO是弱酸强碱盐、具有强氧化性,NaOH是碱,酸性KMnO4具有强氧化性,从物质类别上看,盐酸有酸的通性,可能与NaClO、NaOH反应,从化合价角度看,盐酸中的Cl-处于最低价,具有还原性,可与强氧化性物质反应,能与NaClO、酸性KMnO4反应;
(4)a.光照新制氯水,HClO会分解生成HCl,Cl2+H2O HCl+HClO的平衡正向移动,Cl2的浓度减小,溶液颜色会变浅,与图像不相符,故a不正确;
b.HClO分解生成O2,则瓶中氧气的体积分数增大,与图像相符,故b正确;
c.HClO是弱电解质,分解生成强电解质HCl,溶液中离子浓度增大,则溶液的电导率(导电能力)增大,与图像相符,故c正确;
d.用强光照射新制氯水,HClO分解生成HCl,次氯酸浓度减小,溶液的漂白能力减弱,图像不符合,故d不正确。
【分析】(1)二氧化锰和浓盐酸在加热条件下反应生成氯化锰、水和氯气;
(2)依据氯水中存在化学平衡和组分的性质分析;
(3)①依据价态和类别判断;
②利用酸的通性和氧化还原反应原理分析;
(4)利用氯水的性质及平衡移动原理,结合图像分析。
21.【答案】(1)C
(2)Cl2+H2O=H++Cl﹣+HClO
(3)2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O
(4)O3;强氧化性;强氧化性;发生化合反应
(5)2:1
【解析】【解答】解:(1)但暴雨过后井水混浊,加入少量的KAl(SO4)2 12H2O 净水,故选:C;(2)氯气溶于水后生成了次氯酸和盐酸,氯气、水、次氯酸在离子反应中保留化学式,则离子反应为Cl2+H2O═H++Cl﹣+HClO,故答案为:Cl2+H2O═H++Cl﹣+HClO;(3)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,故答案为:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;(4)臭氧的分子式为O3,O3、氯气以及SO2均可以做漂白剂,三者的漂白原理分别是:强氧化性、强氧化性、与有色物质发生化合反应生成无色的大分子,故答案为:O3;强氧化性;强氧化性;发生化合反应;(5)根据题意知,酸性条件下,NaClO3和Na2SO3发生氧化还原生成ClO2和Na2SO4,同时生成水,该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,其转移电子数为2,根据转移电子相等配平方程式为H2SO4+2NaClO3+Na2SO3=2Na2SO4+2ClO2+H2O,所以该反应中NaClO3和Na2SO3的物质的量之比为2:1,故答案为:2:1.
【分析】(1)KAl(SO4)2 12H2O 水解生成氢氧化铝胶体具有吸附性;(2)氯气与水反应生成HCl、HClO,HClO具有消毒作用;(3)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水;(4)臭氧的分子式为O3,O3、氯气以及SO2均可以做漂白剂,三者的漂白原理分别是:强氧化性、强氧化性、与有色物质发生化合反应生成无色的大分子;(5)根据题意知,酸性条件下,NaClO3和Na2SO3发生氧化还原生成ClO2和Na2SO4,同时生成水,该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,根据转移电子相等配平方程式,从而确定NaClO3和Na2SO3的物质的量之比.
出卷网(www.chujuan.cn) 1 / 1
3.1氯气及氯的化合物 同步练习 2023-2024学年高一上学期化学苏教版(2019)必修第一册
一、单选题
1.为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.的硫酸溶液中含的数目为
B.含有的质子数和中子数均为
C.通入适量水中,转移的电子数为
D.标准状况下,含有的共价键数为
2.下列关于氯气的叙述,错误的是( )
A.氯气是一种有毒的气体
B.氯气、氯水、液氯是同一种物质
C.氯气能与水发生反应
D.氯气是一种黄绿色,有刺激性气味的气体
3.下列说法中,正确的是( )
A.氯原子和氯离子的化学性质相同
B.氯离子比氯原子多一个电子
C.氯气有毒,氯离子也有毒
D.氯气和氯离子都显黄绿色
4.某化工厂发生了氯气泄漏,以下自救得当的是( )
A.喷射氢氧化钠溶液将泄露的氯气吸收
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用湿毛巾或蘸有肥皂水的毛巾捂住口鼻撤退
5.化学是以实验为基础的学科。下列说法正确的是( )
A.可用pH试纸测定新制氯水的pH
B.将80gNaOH固体溶解在1L水中,可配制2mol L-1NaOH溶液
C.利用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体
D.将过量的铁在氯气中燃烧可生成FeCl2
6.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.0.2 mol苯甲醇完全燃烧,生成的CO2数目为1.4NA
B.1 L0.5 mol·L-1 NaHCO3溶液中含有数目为0.5NA
C.56g Fe与1 mol Cl2充分反应时转移的电子数为3NA
D.1 mol 中含有电子数为10NA
7.NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
8.KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应的下列说法错误的是( )
A.被氧化的元素和被还原的元素的质量之比为6:1
B.Cl2既是氧化产物,又是还原产物
C.盐酸既体现酸性,又体现还原性
D.转移5mol电子时,产生3molCl2
9.将 0.2mol MnO2和 50mL 12mol L﹣1浓盐酸混合后缓缓加热,反应完全后,再向溶液中加入足量 AgNO3溶液,生成 AgCl 沉淀的物质的量为(不考虑盐酸的挥发)( )
A.大于 0.3 mol,小于 0.6 mol
B.等于 0.3 mol
C.小于 0.3 mol
D.大于 0.6 mol
10.实验室用下列方法制取氯气:①用含4mol HCl的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,若不考虑HCl的挥发,则反应后所得Cl2的物质的量( )
A.方法①比方法②多 B.方法②比方法①多
C.两种方法一样多 D.无法比较
11.2018年11月在法国凡尔赛召开的国际计量大会( CGPM)第26次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这常数被称为阿伏加德罗常数,单位为mol-1”。基于这一新定义,阿伏加德罗常数的不确定度被消除了。新定义将于2019年5月20日正式生效。NA为阿伏加德罗常数的值。下列说法错误的是( )
A.新定义中阿伏加德罗常数的不确定度被消除
B.0.4 moI NH3与0.6molO2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
C.2.7g铝中加入足量1mol·L-1的NaOH溶液,转移的电子数为0.3NA
D.常温常压下,水蒸气通过Na2O2使其增重2g时,反应中转移的电子数为NA
12.氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1mol N2有6mol电子转移
13.NA为阿伏加德罗常数的值。下列说法正确的是( )
A.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA
B.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA
C.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
D.1 mol Cl2参加反应转移电子数一定为2NA
14.将氯气分别通入含下列离子的溶液中,离子浓度变化最小的是( )
A. B. C. D.
15.如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的干燥红色布条看不到明显现象,当打开B阀后,C处红色布条逐渐褪色,D瓶中装的溶液不可能是 ( )
A.浓硫酸 B.NaOH溶液
C.KI溶液 D.饱和NaCl溶液
16.如图所示,A处通入氯气,打开B阀时,C处红色布条不褪色;关闭B阀时,C处红色布条褪色;由此作出的判断正确的是( )
A.D中可能是浓硫酸 B.通入的氯气含有水蒸气
C.D中可能是水 D.D中可能是NaOH溶液
二、综合题
17.仔细阅读材料,应用物质分类和氧化还原反应等相关概念,回答下列问题:
(1)磷及部分重要化合物的相互转化如图所示。
①步骤III中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 ,步骤I为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是除去CaSiO3,焦炭的作用是 (填“氧化剂”或“还原剂”)。
②不慎将白磷沾到皮肤上,可用0.2mol/LCuSO4溶液冲洗,根据步骤II中的守恒关系可判断,1molCuSO4所能氧化的白磷的物质的量为 。
(2)次磷酸(H3PO2)及其钠盐(NaHPO2)均可将溶液中的Ag+还原为银,从而可用于化学镀慢。
①次磷酸中P元素的化合价为 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为 (填化学式)。
(3)用单线桥标出电子转移的方向和数目: 。
Ca3(PO4)2+6SiO2+10C10CO+6CaSiO3+P4
18.用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略).
(1)按气流方向连接各仪器接口顺序是:
(2)反应时,盛粗铜粉的试管中的现象是
(3)已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl﹣(aq) CuCl42﹣(aq)+4H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 填序号).
A.将Y稀释,发现溶液呈蓝色
B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色
D.取Y进行电解,溶液颜色最终消失
19.某工厂废水中含有大量的和较多的,为了减少污染并变废为宝,通过以下反应从废水中回收和:①②
(1)反应①中,化合价升高的元素是 (填元素符号),氧化剂是 (填化学式)。
(2)反应②中若每消耗1,则生成的体积约是 L(标准状况),转移电子的物质的量为 。
20.工业上氯气用途非常广泛,回答下列问题:
(1)实验室制取氯气的化学方程式为 。
(2)下表是某实验研究氯水性质实验的部分活动记录。
实验内容 实验现象 解释原因(文字或反应)
观察氯水颜色 ① 氯水中含有氯气分子
向氯水中滴入 有无色气体生成 ② (写离子方程式)
用玻璃棒蘸取氯水,点在品红试纸上 红色褪去 ③
(3)“价态—类别”二维图是研究元素的重要方法,下图为氯及其化合物的“价态—类别”二维图。
①二维图缺失的类别A是 ;B是家庭学校常用的消毒药品,则B是 (填化学式);C的焰色试验呈紫色,则C是 (填化学式)。
②某同学利用a.b.c.酸性三种溶液探究盐酸性质,试验前进行如下预测:从物质类别上看,盐酸有酸的通性,可能与 发生反应(填序号);从化合价角度看,盐酸的具有 性,(填“氧化”或“还原”);可能与 发生反应(填序号)。
(4)下图是用强光照射密闭广口瓶中新制氯水时,用数字化传感器采集的图像,下列纵坐标代表的物理量与图像相符的是 。
a.溶液颜色的变化 b.瓶中氧气的体积分数
c.溶液的导电能力 d.溶液的漂白能力
21.饮用水质量是关系人类健康的重要问题.
(1)在我国,一些贫困山区的农民至今还饮用井水,但暴雨过后井水混浊,无法饮用.为了能让暴雨过后井水尽快变的澄清,你会建议他们最好向井水中投入下列中的 (填序号)
A.NaCl B.Na2CO3
C.KAl(SO4)2 12H2O D.CuSO4
(2)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为: .
(3)写出工业上制取漂白粉的化学方程式: .
(4)臭氧,也称作超氧,可以替代氯气给自来水消毒,即提高了消毒效率且安全无副作用,臭氧的分子式为 ;该物质、氯气以及SO2均可以做漂白剂,三者的漂白原理分别是: ; ; .
(5)ClO2是一种光谱型的消毒剂,将逐渐取代Cl2成为生产自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为 .
答案解析部分
1.【答案】B
【解析】【解答】A.溶液的体积未知,无法计算含的数目,故A不符合题意;
B.的摩尔质量为20g/mol,的物质的量为0.1mol,每个分子含有质子数、中子数均为10,故含有的质子数和中子数均为,故B符合题意;
C.通与水反应是可逆反应,通入适量水中,转移的电子数小于,故C不符合题意;
D.在标准状况下为液态,不能用22.4L/mol计算其物质的量,故D不符合题意。
故答案为:B。
【分析】A. 要得到氢离子的物质的量需要溶液体积;
C.氯气通水属于可逆反应无法完全反应;
D.四氯化碳标况下为液体。
2.【答案】B
【解析】【解答】A.氯气有毒,A不符合题意;
B.氯水是混合物,氯气、液氯为纯净物;B符合题意;
C.氯气能与水发生反应生成盐酸和次氯酸,C不符合题意;
D.氯气是一种黄绿色,有刺激性气味的气体,D不符合题意;
故答案为:B。
【分析】依据氯气的性质以及物质的成分判断。
3.【答案】B
【解析】【解答】A.氯原子和氯离子的最外层电子数不同,因此二者的化学性质不相同,A不符合题意;
B.Cl原子最外层有7个电子,不稳定,容易从外界获得1个电子变为Cl-,所以氯离子比氯原子多一个电子,B符合题意;
C.氯气有毒,而氯离子是食盐的主要成分,用于调味,没有毒性,C不符合题意;
D.氯气是黄绿色有毒的气体,而氯离子无色,与阳离子共存于物质中,D不符合题意;
故合理选项是B。
【分析】A.同种元素的最外层电子的多少决定微粒的化学性质;
B.根据氯离子和氯原子的核外电子数进行判断;
C.氯离子无毒,这需要记忆;
D.氯离子是无色离子。
4.【答案】D
【解析】【解答】A.氢氧化钠具有强腐蚀性,不符合题意
B.氯气密度比空气大,应向地势较高的地方撤离,不符合题意
C.应逆风撤离,不符合题意
D.用湿毛巾或者蘸有肥皂水的毛巾捂住口鼻可吸收氯气,减少人吸入氯气,符合题意
故答案为:D
【分析】氯气的物理性质,密度比空气大,化学性质有毒,能被水或者碱液吸收
5.【答案】C
【解析】【解答】A.氯水具有漂白性,故不可用pH试纸测定新制氯水的pH,A不符合题意;
B.水的体积不等同于溶液的体积,需要配制成1L的溶液才能得到2molL-1NaOH溶液,B不符合题意;
C.Fe(OH)3胶体可产生丁达尔效应,FeCl3溶液不会产生丁达尔效应,故利用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体,C符合题意;
D.铁在氯气中燃烧可生成FeCl3,与反应物的用量无关,D不符合题意;
故答案为:C。
【分析】A、氯水具有酸性和漂白性;
B、浓度公式中的体积为溶液体积;
C、丁达尔效应可以鉴别胶体;
D、氯气和铁反应生成氯化铁。
6.【答案】A
【解析】【解答】A.1个苯甲醇中含有7个碳原子,苯甲醇完全燃烧生成CO2和H2O,所以0.2 mol苯甲醇完全燃烧,生成的n(CO2)=0.2mol×7=1.4mol,则其数目为1.4NA,A符合题意;
B.由分析可知,n(NaHCO3)=1 L×0.5 mol·L-1=0.5mol,由于 能发生水解反应,所以溶液中n( )<0.5mol,则其数目小于0.5NA,B不符合题意;
C.涉及反应为2Fe+3Cl22FeCl3,56gFe即1mol过量,实际反应的n(Fe)=mol,则转移的电子物质的量为×3mol=2mol,即2NA,C不符合题意;
D.1个 中含有8个电子,则1 mol 中含有电子数为8NA,D不符合题意;
故答案为:A。
【分析】A.根据反应前后原子个数不变和N=nNA进行分析。
B.注意弱酸根或弱碱根离子能发生水解反应,结合n=cV进行分析。
C.Fe与Cl2反应生成FeCl3,结合参加反应的量进行分析。
D.注意1个 中含有8个电子。
7.【答案】C
【解析】【解答】A、核素D和H的质量数不同,质子数相同。则18gD2O和18gH2O的物质的量不同,所以含有的质子数不同,A不符合题意;
B、亚硫酸为弱酸,水溶液中不完全电离,所以溶液中氢离子数目小于2NA,B不符合题意;
C、过氧化钠与水反应生成氧气,氧气的来源于-1价的O元素,所以生成0.1mol氧气时转移电子0.2NA,C符合题意;
D、由于在反应过程中盐酸浓度降低,稀盐酸与二氧化锰不反应,所以不能计算转移的电子数,D不符合题意,
故答案为:C
【分析】该题考察同位素的概念、质子数中子数和质量数之间的关系、强弱电解质的概念、氧化还原反应电子转移的有关计算等。1、同位素指的是质子数相同而中子数不同的核素,且质量数=质子数+中子数;2、弱电解质指的是部分电离的电解质,即不完全发生电离;3、氧化还原反应中电子转移数目的计算只看得电子数或只看失电子数。
8.【答案】A
【解析】【解答】A. 被氧化的元素和被还原的元素的质量之比为5:1,A符合题意;
B. Cl2中的Cl既来自KClO3又来自HCl,所以它既是氧化产物,又是还原产物,B不符合题意;
C. 由上面分析可知,盐酸既体现酸性,又体现还原性,C不符合题意;
D.从反应中可以看出,转移5mol电子时,产生3molCl2,D不符合题意;
故答案为:A
【分析】在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,KClO3是氧化剂,Cl的价态由+5价降为0价;5HCl为还原剂,价态由-1价升为0价,1HCl表现出酸性;据此结合选项进行分析。
9.【答案】A
【解析】【解答】50mL 12mol L﹣1浓盐酸中氯化氢的物质的量为0.05× 12mol L﹣1=0.6mol,根据反应方程式 ,若盐酸完全反应则生成氯气的物质的量是0.15mol,由于二氧化锰与稀盐酸不反应,所以生成氯气的物质的量小于0.15mol,溶液中剩余氯离子的物质的量大于(0.6mol-0.15mol×2),所以生成 AgCl 沉淀的物质的量大于大于 0.3 mol,小于 0.6 mol,故A符合题意。
【分析】注意过量问题,当固体过量时,溶液的浓度发生变化导致反应也发生变化。
10.【答案】B
【解析】【解答】①用含4molHCl的浓盐酸与足量的MnO2反应时,由于MnO2与稀盐酸不反应,故4molHCl无法完全反应,因此产生Cl2的物质的量小于0.25mol;
②87gMnO2的物质的量,由于浓盐酸足量,故1molMnO2完全反应,此时产生的Cl2的物质的量为1mol;
综上,方法②产生的Cl2的量比方法①多,B符合题意;
故答案为:B
【分析】MnO2与浓HCl反应的化学方程式为:MnO2+4HClMnCl2+2H2O+Cl2;当浓盐酸变为稀盐酸时,反应停止。计算产生Cl2的量时,应用完全反应的量进行计算。
11.【答案】B
【解析】【解答】A.根据新定义,NA就是具体的6.02214076×1023个基本单元,不确定度被消除,故A不符合题意;
B.依据反应4NH3+5O2 4NO+6H2O,0.4moINH3与0.6molO2在催化剂的作用下充分反应,氧气剩余,则生成的一氧化氮部分与氧气反应生成二氧化氮,所以最终生成的NO的分子数小于0.4NA,故B符合题意;
C.2.7g铝的物质的量为0.1mol,而铝反应后变为+3价,故0.1mol铝反应转移0.3NA个电子,故C不符合题意;
D.过氧化钠与水蒸气反应的方程式是2Na2O2+2H2O=4NaOH+O2↑,反应中过氧化钠既是氧化剂,也是还原剂,2molNa2O2参与反应转移2mol电子,增重4g;则增重2g时,参加反应的过氧化钠是1mol,所以转移电子的物质的量是1mol,转移的电子数为NA,故D不符合题意;
故答案为:B。
【分析】A.根据最新定义,阿伏加德罗常数已经确定,说明阿伏加德罗常数不确定度被消除
B.根据化学方程式4NH3+5O2 4NO+6H2O,发现n(NH3):n(O2)=4:5恰好完全反应,所以会生成0.4molNO,但是题目中的氧气有剩余,导致生成的一氧化氮在催化剂的作用下与氧气反应生成二氧化氮。NO小于0.4mol
C.根据计算铝的物质的量为0.1mol,AlAl3+3e.转移0.3mol电子
D.写出方程式:2Na2O2+2H2O=4NaOH+O2↑2e,根据差量法,增加相对分子质量为4,根据比值可以求出转移的电子数为1mol
12.【答案】C
【解析】【解答】解:A、如果管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应生成HCl,HCl与NH3反应生成NH4Cl,现象为有白烟生成,故A正确;
B、在3Cl2+2NH3=N2+6HCl反应中,Cl元素的化合价由0价降低为﹣1价,氯气表现出氧化性,故B正确;
C、反应中元素化合价发生变化,为氧化还原反应,故C错误;
D、在3Cl2+2NH3=N2+6HCl反应中,N元素的化合价由﹣3价升高到0价,则生成1molN2有6mol电子转移,故D正确.
故选C.
【分析】如果管道漏气,则发生反应3Cl2+2NH3=N2+6HCl,生成HCl气体继续与氨气反应生成氯化铵,现象为有白烟生成,反应中氯气表现出氧化性,根据化合价的变化可知生成1molN2有6mol电子转移.
13.【答案】B
【解析】【解答】A.5.6 g铁粉的物质的量为0.1mol,与少量硝酸反应时生成亚铁离子,失去的电子数0.2NA,故A不符合题意;
B.钠与氧气反应,无论生成氧化钠还是过氧化钠,均生成+1价钠离子,则1 mol Na与足量O2反应,转移的电子数为NA,故B符合题意;
C.碘离子的还原性强于亚铁离子,当有1 mol Fe2+被氧化时,碘离子已经完全反应,则转移的电子的数目一定大于NA,故C不符合题意;
D.若1 mol Cl2与氢氧化钠溶液发生歧化反应生成氯化钠、次氯酸钠和水,转移电子数为NA,故D不符合题意;
故答案为:B。
【分析】碘离子的还原性强于亚铁离子,当有1 mol Fe2+被氧化时,碘离子已经完全反应是解答关键。
14.【答案】A
【解析】【解答】A.Cl2与不反应,A项符合题意;
B.Cl2与水反应生成H+,会消耗,不符合题意,B项不符合题意;
C.Cl2与水反应生成H+,会消耗,不符合题意,C项不符合题意;
D.Cl2具有强氧化性,有强还原性,二者会发生氧化还原反应,不符合题意,D项不符合题意;
故答案为:A。
【分析】依据氯气的性质分析,A中Cl2与不反应。
15.【答案】D
【解析】【解答】A.浓硫酸具有吸水性,氯气通过浓硫酸得到干燥的氯气,故A与题意不符;
B.氯气通过NaOH溶液,与氢氧化钠反应,关闭B阀时,C处的红色布条看不到明显现象,故B与题意不符;
C.氯气通过KI溶液,与KI溶液反应,关闭B阀时,C处的红色布条看不到明显现象,故C与题意不符;
D.氯气与食盐水不反应,进入C的为潮湿的氯气,关闭B阀时,C处红色布条逐渐褪色,故D符合题意;
故答案为:D。
【分析】依据氯气的性质和实验的现象分析。
16.【答案】C
【解析】【解答】A、D中盛放浓硫酸时,具有吸水作用,关闭活塞B,C处的有色布条不会褪色,A不符合题意;
B、A处通入的是潮湿的氯气时,具有漂白性,若打开活塞B,C处的有色布条会褪色,B不符合题意;
C、D中盛放水时,氯气通过会带出水,潮湿的氯气具有漂白性,关闭活塞B,C处的有色布条褪色,C符合题意;
D、D盛放的是氢氧化钠溶液时,会和氯气发生反应,生成氯化钠、次氯酸钠和水,这样再关闭活塞B,C处的有色布条不会褪色,D不符合题意;
故答案为:C
【分析】从A处通入氯气,若打开活塞B,C处的有色布条不褪色,因为干燥的氯气不具备漂白性,若关闭活塞B,C处的有色布条褪色,这说明氯气经过溶液D后带出了水,潮湿的氯气具有漂白性;发生反应为Cl2+H2O=HCl+HClO;生成的次氯酸具有漂白作用。据此结合选项进行分析。
17.【答案】(1)CaHPO4、Ca(H2PO4)2;还原剂;0.05mol
(2)+1;H3PO4
(3)
【解析】【解答】(1)①H3PO4为三元弱酸,步骤III中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有CaHPO4、Ca(H2PO4)2;步骤I中焦炭被氧化为CO,其作用是还原剂。
②CuSO4被还原为Cu3P,Cu的化合价从+2降低为+1价,1molCuSO4得到1mol电子,白磷中P的化合价从0价升高为磷酸中的+5价,1mol白磷失去20mol电子,故1molCuSO4所能氧化的白磷的物质的量为 。
(2)次磷酸(H3PO2)及其钠盐(NaHPO2)均可将溶液中的Ag+还原为银,从而可用于化学镀慢。
①根据化合价代数和为0,可知次磷酸中P元素的化合价为+1。
②利用H3PO2进行化学镀银反应中,假设P的化合价升高为+x价,氧化剂与还原剂的物质的量之比为4:1,根据得失电子守恒可得,,解得x=5,则氧化产物为H3PO4。
(3)反应Ca3(PO4)2+6SiO2+10C10CO+6CaSiO3+P4中,C元素的化合价从0价升高为+2价,P元素的化合价从+5价降低为0价,10molC与1mol硫酸钙反应转移20mol电子,用单线桥标出电子转移的方向和数目:。
【分析】(1)①H3PO4为三元弱酸,能生成三种盐;氧化剂元素化合价降低, 还原剂元素化合价升高;
②依据化合价变化判断转移电子数;
(2)①根据化合价代数和为0;
②根据得失电子守恒;
(3)依据化合价变化表示单线桥。
18.【答案】(1)a→d→e→j→h→f→g→b→c;
(2)铜粉逐渐减少并生成大量棕黄色的烟;
(3)ABC
【解析】【解答】(1)①从a出来的气体含有氯化氢和水蒸气,依次通过d e j h 除去氯化氢和水蒸气,然后与铜反应,最后尾气处理用氢氧化钠,则依次再通过f g b c,所以按照气流方向各仪器接口的连接顺序为a→d→e→j→h→f→g→b→c,故答案为:a→d→e→j→h→f→g→b→c;
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟,故答案为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故A正确;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故B正确;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故C正确;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故D错误.
故答案为:ABC.
【分析】(1)①要制备收集纯净的氯气应该除去氯气中的杂质(水、HCl),除氯化氢用饱和食盐水,除去水用浓硫酸,然后与铜反应,最后尾气处理用氢氧化钠,据此解答;
②粗铜粉与氯气反应的现象为:铜粉逐渐减少并生成大量棕黄色的烟;
③A.将Y稀释,平衡向左反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系;
B.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
C.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系;
D.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系;
19.【答案】(1)Fe;CuSO4
(2)22.4;2
【解析】【解答】(1)反应①中,化合价升高的是Fe元素,被氧化,化合价降低的元素是Cu元素,所在的反应物CuSO4是氧化剂,答案为Fe;CuSO4;
(2)反应②中若每消耗1,根据反应可知,则生成的体积约是1mol22.4L/mol=22.4L(标准状况),转移电子的物质的量为1mol2=2;答案为22.4;2。
【分析】(1)氧化剂元素化合价降低, 还原剂元素化合价升高;
(2)根据反应的化学方程式计算。
20.【答案】(1)MnO2+4HCl(浓) MnCl2+Cl2+2H2O
(2)氯水颜色为浅黄绿色;;次氯酸具有漂白性,使有色物质褪色
(3)单质;ClO2;KClO3;ab;还原;ac
(4)bc
【解析】【解答】(1)实验室制取氯气是利用二氧化锰和浓盐酸加热反应生成,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2+2H2O;
(2)氯水中存在化学平衡Cl2+H2O HCl+HClO,氯气是黄绿色气体,氯水颜色为浅黄绿色;向氯水中滴入NaHCO3溶液,有无色气体生成,该气体为二氧化碳气体,碳酸氢钠和盐酸反应生成氯化钠、二氧化碳和水,反应的离子方程式为:;用玻璃棒蘸取氯水,点在品红试纸上,红色褪去,是因为次氯酸具有漂白性,使有色物质褪色;
(3)①A对应的Cl2是单质,B对应的是+4价氯的氧化物,化学式为ClO2,C的焰色试验呈紫色,则C中含有K元素,其中Cl为+5价,则C是含氧酸盐,化学式为KClO3;
②NaClO是弱酸强碱盐、具有强氧化性,NaOH是碱,酸性KMnO4具有强氧化性,从物质类别上看,盐酸有酸的通性,可能与NaClO、NaOH反应,从化合价角度看,盐酸中的Cl-处于最低价,具有还原性,可与强氧化性物质反应,能与NaClO、酸性KMnO4反应;
(4)a.光照新制氯水,HClO会分解生成HCl,Cl2+H2O HCl+HClO的平衡正向移动,Cl2的浓度减小,溶液颜色会变浅,与图像不相符,故a不正确;
b.HClO分解生成O2,则瓶中氧气的体积分数增大,与图像相符,故b正确;
c.HClO是弱电解质,分解生成强电解质HCl,溶液中离子浓度增大,则溶液的电导率(导电能力)增大,与图像相符,故c正确;
d.用强光照射新制氯水,HClO分解生成HCl,次氯酸浓度减小,溶液的漂白能力减弱,图像不符合,故d不正确。
【分析】(1)二氧化锰和浓盐酸在加热条件下反应生成氯化锰、水和氯气;
(2)依据氯水中存在化学平衡和组分的性质分析;
(3)①依据价态和类别判断;
②利用酸的通性和氧化还原反应原理分析;
(4)利用氯水的性质及平衡移动原理,结合图像分析。
21.【答案】(1)C
(2)Cl2+H2O=H++Cl﹣+HClO
(3)2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O
(4)O3;强氧化性;强氧化性;发生化合反应
(5)2:1
【解析】【解答】解:(1)但暴雨过后井水混浊,加入少量的KAl(SO4)2 12H2O 净水,故选:C;(2)氯气溶于水后生成了次氯酸和盐酸,氯气、水、次氯酸在离子反应中保留化学式,则离子反应为Cl2+H2O═H++Cl﹣+HClO,故答案为:Cl2+H2O═H++Cl﹣+HClO;(3)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水,该反应为2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,故答案为:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;(4)臭氧的分子式为O3,O3、氯气以及SO2均可以做漂白剂,三者的漂白原理分别是:强氧化性、强氧化性、与有色物质发生化合反应生成无色的大分子,故答案为:O3;强氧化性;强氧化性;发生化合反应;(5)根据题意知,酸性条件下,NaClO3和Na2SO3发生氧化还原生成ClO2和Na2SO4,同时生成水,该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,其转移电子数为2,根据转移电子相等配平方程式为H2SO4+2NaClO3+Na2SO3=2Na2SO4+2ClO2+H2O,所以该反应中NaClO3和Na2SO3的物质的量之比为2:1,故答案为:2:1.
【分析】(1)KAl(SO4)2 12H2O 水解生成氢氧化铝胶体具有吸附性;(2)氯气与水反应生成HCl、HClO,HClO具有消毒作用;(3)氯气通入石灰乳中反应生成氯化钙、次氯酸钙、水;(4)臭氧的分子式为O3,O3、氯气以及SO2均可以做漂白剂,三者的漂白原理分别是:强氧化性、强氧化性、与有色物质发生化合反应生成无色的大分子;(5)根据题意知,酸性条件下,NaClO3和Na2SO3发生氧化还原生成ClO2和Na2SO4,同时生成水,该反应中Cl元素化合价由+5价变为+4价、S元素化合价由+4价变为+6价,根据转移电子相等配平方程式,从而确定NaClO3和Na2SO3的物质的量之比.
出卷网(www.chujuan.cn) 1 / 1
