4.1 含硫化合物的性质 同步练习(含解析) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 4.1 含硫化合物的性质 同步练习(含解析) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 239.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 19:25:51 | ||
图片预览

文档简介
出卷网
4.1 含硫化合物的性质 同步练习 2023-2024学年高一上学期化学苏教版(2019)必修第一册
一、单选题
1.下列说法正确的是( )
A.做焰色反应的实验时,每次实验都要用盐酸把铂丝洗净
B.浓具有强吸水性,能吸收蔗糖中的水分并使其炭化
C.、均能使品红溶液褪色,说明二者均有氧化性
D.NO是一种无色、无味的气体,达到定浓度时有毒,对人有害无利
2.下列各组气体通常条件下不能相互发生化学反应的是( )
A.SO2和H2S B.Cl2和CO2 C.H2和F2 D.NH3和HCl
3.将蘸有浓硫酸的温度计置于空气中,片刻后,温度计读数升高,说明浓硫酸具有( )
A.吸水性 B.脱水性 C.强酸性 D.氧化性
4.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液变稀(挥发性)
B.在加热条件下铜与浓硫酸反应(脱水性)
C.浓硫酸在白纸上书写的字迹变黑(氧化性)
D.浓硫酸可用来干燥某些气体(吸水性)
5.将一定量的锌与100mL18mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液中氢离子的浓度为0.4mol/L,则下列叙述错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共转移3mol电子
C.反应中共消耗Zn97.5g
D.气体A中SO2和H2的体积比为1:4
6.下列物质露置在空气中质量减小的是( )
A.氢氧化钠 B.浓硫酸 C.浓盐酸 D.氯化钠
7.中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐, 能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮这种“碱剂”可能是( )
A.草木灰 B.火碱
C.食盐 D.胆矾
8.下列有关SO2的说法正确的是( )
A.SO2和SO3均是酸性氧化物
B.SO2的漂白原理和氯气的漂白原理相同
C.在SO2+2H2S=3S↓+2H2O反应中,氧化产物和还原产物的物质的量之比为1∶2
D.把某气体通入澄清的石灰水中,石灰水变浑浊,该气体一定是SO2
9.SO2与我们的生活息息相关,低浓度SO2废气的处理是工业难题,目前常用的一种处理方法如下
已知:反应器中发生反应3H2+SO2=H2S+2H2O。
下列有关说法不正确的是( )
A.SO2是有毒气体,能形成酸雨破坏环境,不能用作食品的防腐剂
B.二乙醇胺的作用是吸收H2S,且可以循环使用
C.再生塔中加热分解重新获得H2S,主要目的是富集H2S
D.理论上燃烧室中的O2可以用SO2代替
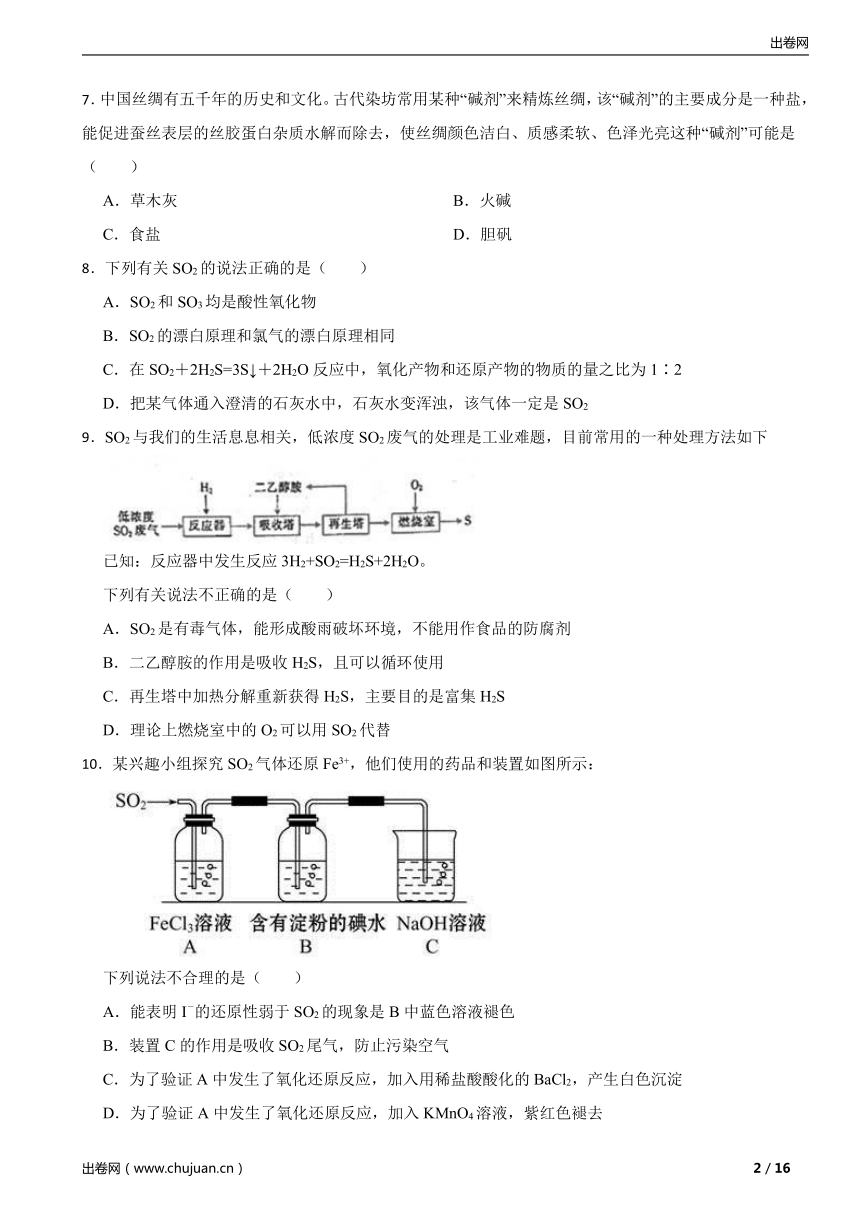
10.某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如图所示:
下列说法不合理的是( )
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
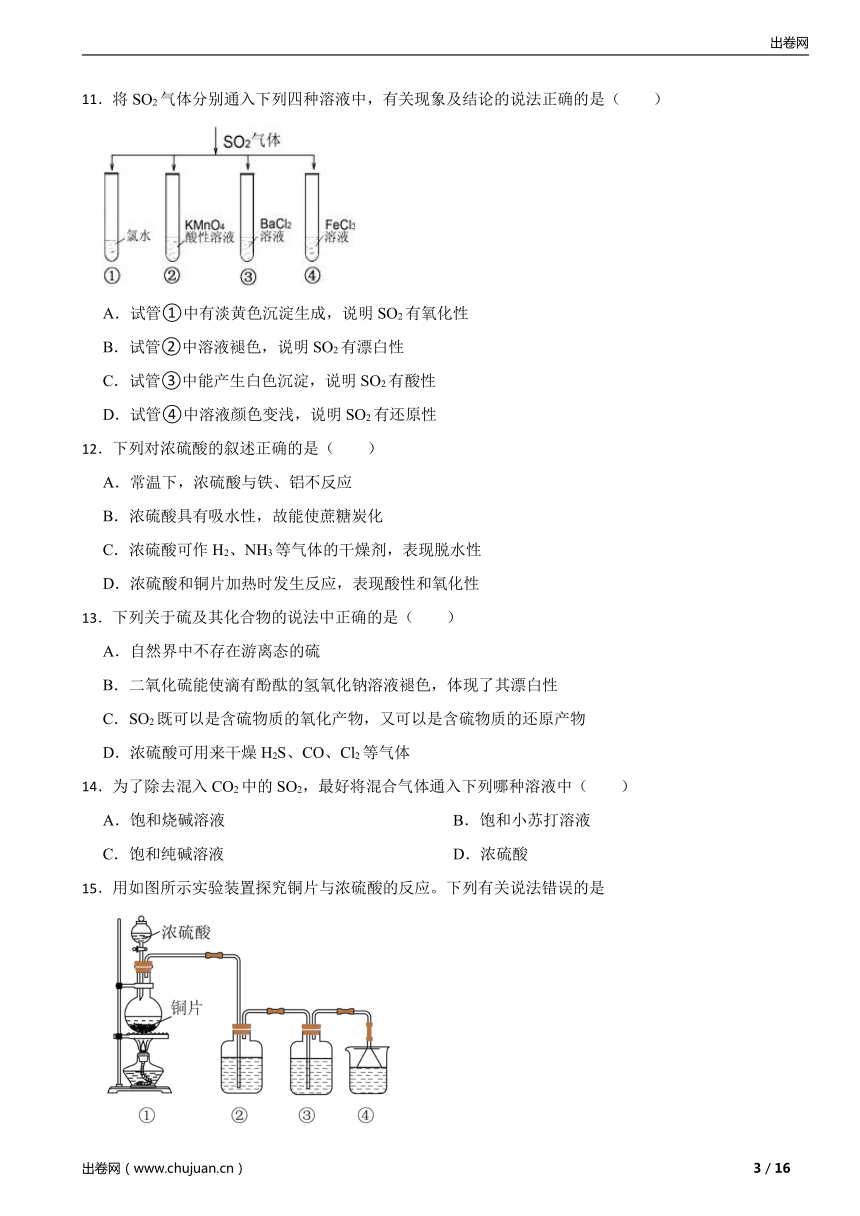
11.将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性
B.试管②中溶液褪色,说明SO2有漂白性
C.试管③中能产生白色沉淀,说明SO2有酸性
D.试管④中溶液颜色变浅,说明SO2有还原性
12.下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁、铝不反应
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸可作H2、NH3等气体的干燥剂,表现脱水性
D.浓硫酸和铜片加热时发生反应,表现酸性和氧化性
13.下列关于硫及其化合物的说法中正确的是( )
A.自然界中不存在游离态的硫
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
C.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
D.浓硫酸可用来干燥H2S、CO、Cl2等气体
14.为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中( )
A.饱和烧碱溶液 B.饱和小苏打溶液
C.饱和纯碱溶液 D.浓硫酸
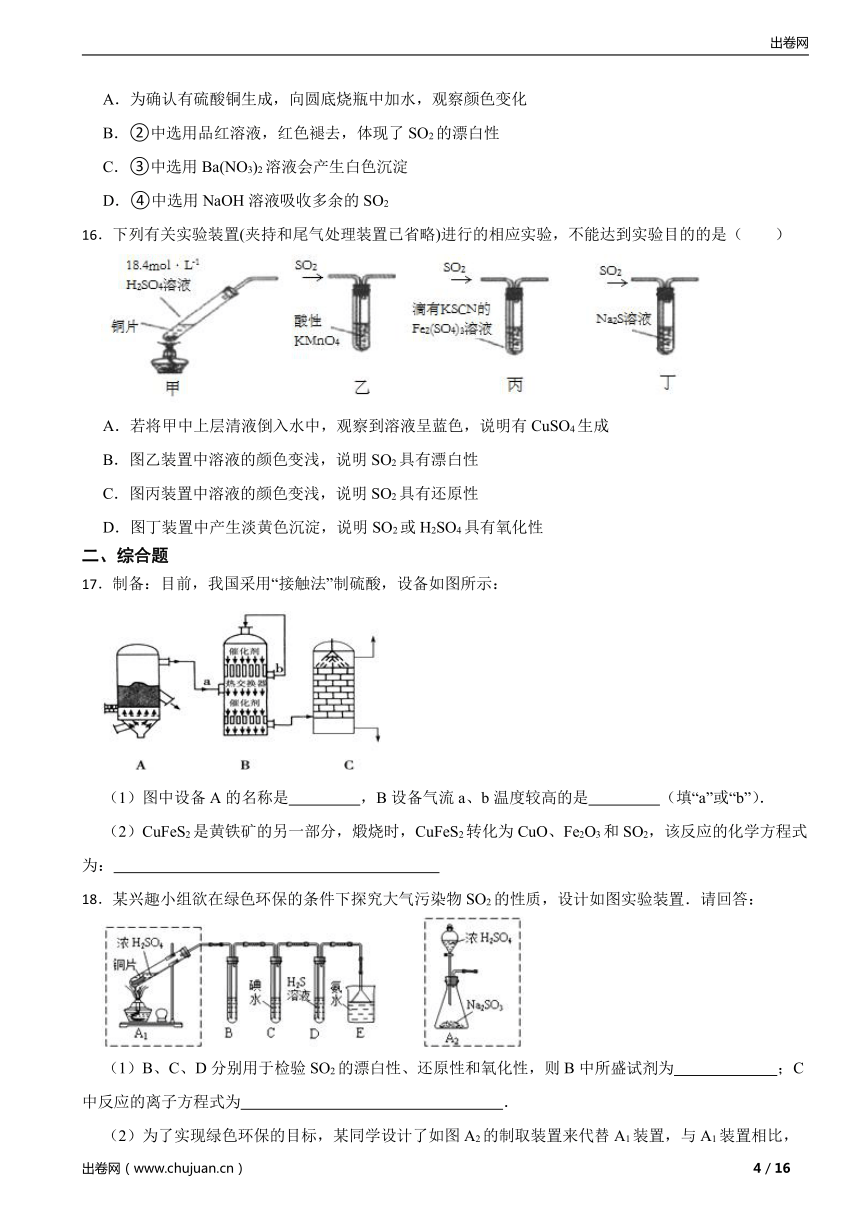
15.用如图所示实验装置探究铜片与浓硫酸的反应。下列有关说法错误的是
A.为确认有硫酸铜生成,向圆底烧瓶中加水,观察颜色变化
B.②中选用品红溶液,红色褪去,体现了SO2的漂白性
C.③中选用Ba(NO3)2溶液会产生白色沉淀
D.④中选用NaOH溶液吸收多余的SO2
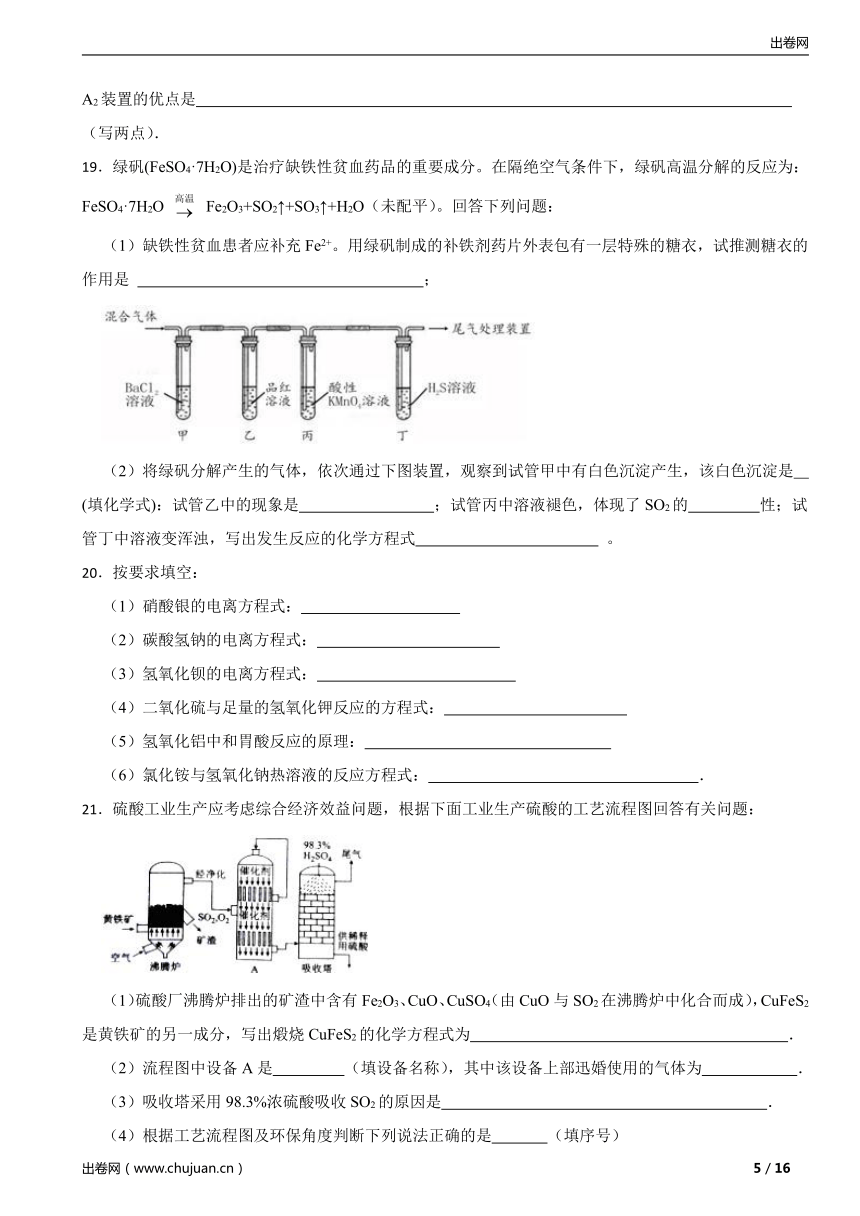
16.下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是( )
A.若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成
B.图乙装置中溶液的颜色变浅,说明SO2具有漂白性
C.图丙装置中溶液的颜色变浅,说明SO2具有还原性
D.图丁装置中产生淡黄色沉淀,说明SO2或H2SO4具有氧化性
二、综合题
17.制备:目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是 ,B设备气流a、b温度较高的是 (填“a”或“b”).
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为:
18.某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,某同学设计了如图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是 (写两点).
19.绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。在隔绝空气条件下,绿矾高温分解的反应为:FeSO4·7H2O Fe2O3+SO2↑+SO3↑+H2O(未配平)。回答下列问题:
(1)缺铁性贫血患者应补充Fe2+。用绿矾制成的补铁剂药片外表包有一层特殊的糖衣,试推测糖衣的作用是 ;
(2)将绿矾分解产生的气体,依次通过下图装置,观察到试管甲中有白色沉淀产生,该白色沉淀是 (填化学式):试管乙中的现象是 ;试管丙中溶液褪色,体现了SO2的 性;试管丁中溶液变浑浊,写出发生反应的化学方程式 。
20.按要求填空:
(1)硝酸银的电离方程式:
(2)碳酸氢钠的电离方程式:
(3)氢氧化钡的电离方程式:
(4)二氧化硫与足量的氢氧化钾反应的方程式:
(5)氢氧化铝中和胃酸反应的原理:
(6)氯化铵与氢氧化钠热溶液的反应方程式: .
21.硫酸工业生产应考虑综合经济效益问题,根据下面工业生产硫酸的工艺流程图回答有关问题:
(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为 .
(2)流程图中设备A是 (填设备名称),其中该设备上部迅婚使用的气体为 .
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是 .
(4)根据工艺流程图及环保角度判断下列说法正确的是 (填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃ 600 620 640 660
炉渣中CuSO4的质量分数/% 9.3 9.2 9.0 8.4
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因 .
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为 .
答案解析部分
1.【答案】A
【解析】【解答】A.焰色反应实验时,要用盐酸把铂丝洗净并在酒精灯上灼烧至无特殊焰色,A项符合题意;
B.浓具有强脱水性,能使蔗糖中的水分脱出使其炭化,B项不符合题意;
C.能使品红溶液褪色,是因为二氧化硫与有色物质结合,具有漂白性,不能说明其氧化性,C项不符合题意;
D.NO是一种无色、无味的气体,达到一定浓度时,可以治疗一些疾病,D项不符合题意;
故答案为:A。
【分析】B.浓硫酸使蔗糖炭化体现其脱水性;
B.氯气不具有漂白性;
C.NO达到一定浓度时,可以治疗一些疾病。
2.【答案】B
【解析】【解答】A. SO2和 H2S反应生成硫和水,选项A不选;
B. Cl2 和 CO2不发生化学反应,选项B选;
C. H2和F2发生反应生成HF,选项C不选;
D. NH3和 HCl发生反应生成氯化铵,选项D不选。
故答案为:B。
【分析】A. SO2和 H2S是+4的硫与-2价的硫的归中反应
C. H2和F2在冷暗处爆炸化合
D. NH3是碱性气体和 HCl是酸性气体相遇冒白烟
3.【答案】A
【解析】【解答】A.浓硫酸具有吸水性,浓硫酸吸水放热。温度计读数升高,说明浓硫酸吸收空气中的水蒸气放热,证明浓硫酸具有吸水性,故选A;
B.浓硫酸脱水性指的是把有机物当中的氢和氧按2:1的比例脱出来,将蘸有浓硫酸的温度计置于空气中,不可能体现脱水性,故不选B;
C.浓硫酸遇碱性物质表现强酸性,将蘸有浓硫酸的温度计置于空气中,没有遇到碱性物质,不可能体现强酸性,故不选C;
D.浓硫酸遇还原性物质表现强氧化性,将蘸有浓硫酸的温度计置于空气中,没有遇到还原性物质,不可能体现强氧化性,故不选D;
故答案为:A。
【分析】温度计读数升高,说明浓硫酸吸收水蒸气放出热量。
4.【答案】D
【解析】【解答】A.浓硫酸具有吸水性,则在空气中敞口久置的浓硫酸,会吸收空气中的水分而使溶液变稀,表现的是浓硫酸的吸水性,故A不符合题意;
B.浓硫酸具有强氧化性,在加热条件下铜与浓硫酸反应发生氧化还原反应,表现的是浓硫酸的氧化性,故B不符合题意;
C.浓硫酸具有脱水性,能使有机物中的H、O元素以水的形式脱出,浓硫酸在白纸上书写的字迹变黑,表现的是浓硫酸的脱水性,故C不符合题意;
D.浓硫酸具有吸水性,可以用来干燥某些与浓硫酸不反应的酸性或中性气体,如氢气、二氧化碳等,表现的是浓硫酸的吸水性,故D符合题意;
故答案为:D。
【分析】A.在空气中敞口久置的浓硫酸,溶液变稀,体现浓硫酸吸水性;
B.铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,体现浓硫酸的强的氧化性、酸性;
C.浓硫酸在白纸上书写的字迹变黑,体现浓硫酸的脱水性。
5.【答案】D
【解析】【解答】A.若气体A只有SO2,则反应需要消耗硫酸的物质的量3mol,实际参加反应的硫酸为1.6mol,所以气体A为SO2和H2的混合物,故A不符合题意;
B.反应生成1mol SO2转移2mol电子,生成1mol H2转移2mol电子,该反应生成1.5mol气体,所以反应中共转移3mol电子,故B不符合题意;
C.1mol锌失2mol电子,生成1.5mol气体共转移3mol电子,所以参加反应的锌为1.5mol,共消耗Zn97.5g,故C不符合题意;
D.设气体A中SO2为xmol, 反应消耗硫酸2xmol, H2为(1.5-x)mol, 反应消耗硫酸(1.5-x)mol,2xmol+(1.5-x)mol=1.6mol,x=0.1mol,所以气体A中SO2和H2的体积比为1:14,故D符合题意;
故答案为:D。
【分析】A.锌与浓硫酸反应生成SO2,与稀硫酸反应生成氢气;
B.生成1mol SO2转移2mol电子,生成1mol H2转移2mol电子,共生成1.5mol气体;
C.生成1.5mol气体,参加反应的锌为1.5mol;
D.根据和计算生成的气体。
6.【答案】C
【解析】【解答】解:A.固体氢氧化钠易潮解,在固体表面形成溶液,且吸收空气中的二氧化碳气体,使自身质量变大,故A错误;
B.浓硫酸有吸水性,在空气中易吸收水分而使溶液的质量增加,故B错误;
C.浓盐酸有挥发性,在空气中易挥发出氯化氢气体而使本身质量减小,故C正确;
D.氯化钠固体在空气中几乎不改变,质量也无增减,故D错误.
故选C.
【分析】利用相关的四种物质在空气中的变化情况解决此题,浓盐酸具有挥发性而质量减少;浓硫酸具有吸水性而质量增加;固体氢氧化钠易潮解,在固体表面形成溶液,且吸收空气中的二氧化碳气体;氯化钠固体在空气中没有变化而质量不变.
7.【答案】A
【解析】【解答】A.草木灰的成分是碳酸钾,属于盐,溶液呈碱性,故A符合题意;
B.火碱是氢氧化钠,属于碱,故B不符合题意;
C.食盐是氯化钠属于盐,溶液呈中性,故C不符合题意;
D.胆矾是 ,属于盐,溶液呈酸性,故D不符合题意。
故答案为:A
【分析】本题考查物质的化学成分。
8.【答案】A
【解析】【解答】A.SO2和SO3都能与碱反应生成盐和水,故二者都是酸性氧化物,A符合题意;
B.SO2的漂白是与有色物质发生化合反应生成不稳定的无色物质,而氯气的漂白是氯气与水反应生成HClO,HClO具有氧化性,利用其氧化性进行漂白,二者原理不同,B不符合题意;
C.在该反应中,SO2被还原为S,H2S被氧化成S,故氧化产物和还原产物的物质的量之比为2:1,C不符合题意;
D.能使澄清石灰水变浑浊的气体有CO2和SO2,D不符合题意;
故答案为:A
【分析】A.酸性氧化物是指能碱反应生成盐和水的氧化物;
B.根据SO2和氯气的漂白原理分析;
C.由反应的化学方程式确定氧化产物和还原产物,从而确定其物质的量之比;
D.能使澄清石灰水变浑浊的气体有SO2和CO2;
9.【答案】A
【解析】【解答】A.SO2是一种有毒气体,具有还原性,也可作为食品的防腐剂,如SO2是红酒的添加剂,选项错误,A符合题意;
B.二乙醇胺可吸收反应生成的H2S,由流程可知,二乙醇胺可循环使用,选项正确,B不符合题意;
C.再生塔中加热分解重新获得二乙醇胺和H2S,此时得到的H2S纯度较高,因此再生塔主要的目的是富集H2S,选项正确,C不符合题意;
D.由于H2S和SO2能反应生成S和H2O,因此燃烧室中的O2可以用O2代替,选项正确,D不符合题意;
故答案为:A
【分析】此题是对SO2处理的考查,结合流程和SO2的性质进行分析即可。
10.【答案】D
【解析】【解答】A. B装置中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故A不符合题意;
B. 二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,故B不符合题意;
C. Fe3+氧化二氧化硫生成硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入用稀盐酸酸化的BaCl2溶液生成沉淀说明反应中生成了SO42-,故C不符合题意;
D. SO2、Fe2+都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故D符合题意。
故答案为:D。
【分析】A.B装置中蓝色消失,说明碘单质氧化了二氧化硫,还原产物是碘离子,还原剂的还原性大于还原产物的还原性;
B.二氧化硫使酸性气体,能与碱溶液反应而被吸收;
C.盐酸酸化可排除亚硫酸根离子,加入氯化钡溶液生成白色沉淀,生成硫酸钡;
D.二氧化硫和亚铁离子都有还原性。
11.【答案】D
【解析】【解答】解:A.SO2与与氯水发生氧化还原反应不产生淡黄色沉淀,故A错误;
B.试管②中溶液褪色,因为SO2与KMnO4酸性溶液发生氧化还原反应,表现了SO2的还原性,故B错误;
C.SO2与BaCl2溶液不反应,试管③中不能产生白色沉,故C错误;
D.SO2与氯化铁溶液反应,二氧化硫被氧化生成生成硫酸,铁离子被还原生成亚铁离子,溶液颜色变浅,说明SO2有还原性,故D正确;
故选D.
【分析】A.SO2与与氯水发生氧化还原反应不产生淡黄色沉淀;
B.SO2与KMnO4酸性溶液发生氧化还原反应,表现了SO2的还原性;
C.SO2与BaCl2溶液不反应;
D.SO2与氯化铁溶液反应,二氧化硫被氧化生成生成硫酸,铁离子被还原生成亚铁离子.
12.【答案】D
【解析】【解答】A.常温下浓硫酸与铁、铝发生钝化,在铁、铝表面形成一薄层致密氧化膜阻止反应进行,故A不符合题意;
B.浓硫酸使蔗糖炭化体现其脱水性,故B不符合题意;
C.浓硫酸不能干燥NH3,浓硫酸可作H2的干燥剂体现其吸水性,故C不符合题意;
D.浓硫酸和铜片加热时发生反应生成硫酸铜表现酸性,生成二氧化硫,硫元素化合价由+6价变化为+4价,表现氧化性,故D符合题意;
故答案为:D。
【分析】吸水性与脱水性的区别:吸水性是物质中有现成的水分子,浓硫酸作干燥剂是利用其吸水性;脱水性是物质中没有现成的水分子,按水的组成比,浓硫酸夺取某些有机物中的氢、氧元素形成水分子,浓硫酸使蔗糖炭化体现其脱水性。
13.【答案】C
【解析】【解答】解:A.自然界中存在游离态的硫,如火山口存在游离态的硫,故A错误;
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了酸性氧化物的性质,与漂白性无关,故B错误;
C.二氧化硫的生成可以是浓硫酸被还原生成,也可以是硫单质燃烧被氧化生成,故C正确;
D.浓硫酸具有吸水性,可干燥CO、Cl2等气体,H2S具有还原性可以被浓硫酸氧化,故D错误;
故选C.
【分析】A.火山口存在游离态的硫;
B.发生复分解反应生成亚硫酸钠;
C.二氧化硫中硫元素化合价处于中间价态可以升高也可以降低;
D.浓硫酸具有吸水性,且与SO2、CO、Cl2等不反应.
14.【答案】B
【解析】【解答】解:二者都可与饱和烧碱溶液、饱和纯碱溶液反应,与浓硫酸都不反应;
饱和NaHCO3溶液与SO2反应生成二氧化碳而除去,碳酸氢钠与二氧化碳不反应,
故选B.
【分析】二氧化硫具有还原性,可被氧化,除去混入CO2中的SO2,所选用的试剂能够将二氧化硫除去且不能够与二氧化碳反应、不能引进新的杂质,以此解答该题.
15.【答案】A
【解析】【解答】解:A.铜与浓硫酸反应后溶液中混有剩余的浓硫酸,稀释时,应该将圆底烧瓶中的溶液加入水中,玻璃棒不断搅拌不能直接向反应后的溶液中加水,因浓硫酸溶于水放出大量的热,会造成溶液四溅,A错误;
B.SO2使品红溶液褪色,体现了SO2的漂白性,B正确;
C.SO2具有还原性,溶于水呈酸性,所以SO2通入Ba(NO3)2溶液中会发生氧化还原反应生成硫酸根,与Ba2+结合会产生白色沉淀,C正确;
D.SO2会污染空气,所以需要用NaOH溶液吸收尾气,防止污染空气,D正确;
故答案为:A。
【分析】易错分析:A.浓硫酸稀释过程要注意浓硫酸溶于水放出大量的热,会造成溶液四溅,要将浓硫酸加到水中;不可将浓硫酸加到水中,铜和浓硫酸反应不可能进行彻底,还有很多浓硫酸没有反应。
16.【答案】B
【解析】【解答】A.若观察到溶液呈蓝色,则说明溶液中含有Cu2+,因此可说明反应有CuSO4生成,选项正确,A不符合题意;
B.图乙中试剂为酸性KMnO4溶液,具有强化性,而SO2具有还原性,二者可发生氧化还原反应,使得溶液颜色变浅,该实验未能说明SO2具有漂白性,选项错误,B符合题意;
C.图丙中试剂为滴有KSCN溶液的Fe2(SO4)3溶液,溶液中Fe3+具有氧化性,能与SO2反应,使得溶液中Fe3+含量减小,溶液颜色变浅,该实验能说明SO2具有还原性,选项正确,C不符合题意;
D.图丁中往Na2S溶液中通入SO2,发生反应的离子方程式为:SO2+2S2-+4H+=3S↓+2H2O,因此可说明SO2或H2SO4具有氧化性,选项正确,D不符合题意;
故答案为:B
【分析】加热条件下,Cu与浓硫酸反应生成SO2,SO2中硫元素为+4价,处于中间价态,具有还原性和氧化性。Fe3+为最高价, 具有氧化性,能将SO2氧化成SO42-;Na2S中硫元素为-2价,具有还原性,能与SO2反应生成S沉淀;据此结合选项进行分析。
17.【答案】(1)沸腾炉;b
(2)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2
【解析】【解答】解:(1)A设备是硫铁矿与氧气在高温下煅烧反应在沸腾炉中进行;二氧化硫氧化生成三氧化硫为放热反应,所以b处温度高于a,
故答案为:沸腾炉; b;(2)根据题意可知,高温煅烧时CuFeS2时,反应物为CuFeS2和O2,生成物为CuO、Fe2O3 和SO2,再根据化合价升降法配平氧化还原反应方程式,
故答案为:4CuFeS2+13O2 4CuO+2Fe2O3+8SO2.
【分析】(1)依据接触法制硫酸的工业流程和设备反应分析判断;二氧化硫氧化生成三氧化硫为放热反应分析判断;(2)根据已知信息,确定出反应物和生成物,然后配平化学方程式.
18.【答案】(1)品红溶液;SO2+I2+2H2O═SO42﹣+2I﹣+4H+
(2)不用加热或节约能源或药品;或相对安全;或易于控制反应进行;或反应更充分
【解析】【解答】解:(1)依据装置图可知,铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,C检验二氧化硫的还原性,D检验二氧化硫的氧化性,检验二氧化硫漂白性可以通过品红试液,品红褪色是二氧化硫气体的特性;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;反应的两种方程式为:SO2+I2+2H2O═SO42﹣+2I﹣+4H+;
故答案为:品红溶液; SO2+I2+2H2O═SO42﹣+2I﹣+4H+;(2)装置图分析可知,A2的制取装置来代替A1装置,可以不需要加热或节约能源或药品,用分液漏斗加入硫酸可以控制反应速率,易于控制反应进行;或反应更充分,故答案为:不用加热或节约能源或药品;或相对安全;或易于控制反应进行;或反应更充分.
【分析】(1)铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,检验二氧化硫漂白性可以通过品红试液;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;(2)依据装置图对比分析不同,总结优点.
19.【答案】(1)隔绝空气,防止绿矾中 被氧化
(2);品红溶液褪色;还原性;
【解析】【解答】(1)绿矾的主要成分为FeSO4·7H2O,Fe2+易被空气中的O2氧化,因此补铁药剂药片外表包有一层糖衣,可起到隔绝空气,防止Fe2+被氧化的作用;
(2)由反应的化学方程式可知,FeSO4分解产生SO2、SO3,SO3能与BaCl2反应生成难溶于酸的白色沉淀BaSO4;SO2通入品红溶液中,能使品红溶液褪色;丙中KMnO4酸性溶液具有氧化性,溶液褪色,说明SO2具有还原性;SO2中硫元素为中间价态,既有氧化性又有还原性,H2S中硫元素为最低价,只具有还原性,二者可发生氧化还原反应生成S,反应的化学方程式为:SO2+2H2S=3S↓+2H2O;
【分析】(1)结合Fe2+易被空气中氧气氧化的性质分析;
(2)结合FeSO4分解产生的气体成分的性质进行分析;
20.【答案】(1)AgNO3=Ag++NO3﹣
(2)NaHCO3═Na++HCO3﹣
(3)Ba(OH)2=Ba2++2OH﹣
(4)SO2+2KOH=K2SO3+H2O
(5)Al(OH)3+3HCl═AlCl3+3H2O
(6)NH4Cl+NaOH NH3↑+H2O+NaCl
【解析】【解答】解:(1)硝酸银是强电解质完全电离出银离子和硝酸根离子,其电离的离子方程式为:AgNO3=Ag++NO3﹣;故答案为:AgNO3=Ag++NO3﹣;(2)碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3﹣;故答案为:NaHCO3═Na++HCO3﹣;(3)氢氧化钡完全电离出钡离子和氢氧根离子,氢氧化钡的电离方程式:Ba(OH)2=Ba2++2OH﹣,故答案为:Ba(OH)2=Ba2++2OH﹣;(4)二氧化硫与足量的氢氧化钾反应生成亚硫酸钾和水,其反应的化学方程式为SO2+2KOH=K2SO3+H2O;故答案为:SO2+2KOH=K2SO3+H2O;(5)氢氧化铝和胃酸中的HCl反应生成氯化铝和水,反应的化学方程式为Al(OH)3+3HCl═AlCl3+3H2O;
故答案为:Al(OH)3+3HCl═AlCl3+3H2O;(6)氯化铵与氢氧化钠热溶液生成氯化钠、氨气和水,反应的化学方程式为:NH4Cl+NaOH NH3↑+H2O+NaCl;
故答案为:NH4Cl+NaOH NH3↑+H2O+NaCl.
【分析】(1)硝酸银是强电解质完全电离出银离子和硝酸根离子;(2)碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆;(3)氢氧化钡完全电离出钡离子和氢氧根离子;(4)二氧化硫与足量的氢氧化钾反应生成亚硫酸钾和水;(5)氢氧化铝和胃酸中的HCl反应生成氯化铝和水;(6)氯化铵与氢氧化钠热溶液生成氯化钠、氨气和水.
21.【答案】(1)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2
(2)接触室;SO2和O2
(3)可以防止形成酸雾,使三氧化硫吸收完全
(4)A;B;D;E
(5)SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
(6)12.00%
【解析】【解答】解:(1)反应物和生成物已知,结合质量守恒来书写化学方程式为:4CuFeS2+13O2 4CuO+2Fe2O3+8SO2,故答案为:4CuFeS2+13O2 4CuO+2Fe2O3+8SO2;(2)SO2和O2的反应在接触室中进行;由图可知:该设备上部循环使用的气体是SO2和O2,下部是产物SO3;
故答案为:接触室;SO2和O2;(3)SO3与H2O化合时放出大量的热,用水或稀硫酸吸收易形成酸雾,反而不利于成分吸收SO3,所以在吸收塔吸收SO3不用水或稀硫酸,用浓硫酸吸收,
故答案为:可以防止形成酸雾,使三氧化硫吸收完全;(4)A.在沸腾炉中,原料黄铁矿是固体、空气是气体,为了加快反应速率,所以要将黄铁矿粉碎,增大接触面,提高反应速率,故A正确;
B.沸腾炉排出的矿渣有F2O3,F2O3可供炼铁,故B正确;
C.催化剂只能改变反应速率,不能影响转化率,故C错误;
D.因为SO2+2NaOH═Na2SO3+H2O,所以尾气中SO2可用NaOH浓溶液来吸收,故D正确;
E.硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂,所以硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
故E正确;
故答案为:ABDE;(5)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3 CuSO4中SO3的质量减少导致的,根据2SO2(g)+O2(g) 2SO3(g)△H=﹣98.3kJ mol﹣1 反应制备SO3,该反应为可逆反应,正方向为放热,随着温度升高,平衡逆向移动,导致SO3的量减少,由CuO与SO3在沸腾炉中化合而成CuSO4的量也减少,
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少);(6)根据14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+可得关系式:
3SO2~ Cr2O72﹣
3 1
x 0.02mol/L×0.025L
解得:x= =0.0015mol,
则接触室中所得气体中SO2的体积分数为:0.0015mol÷ ×100%=12.00%,
故答案为:12.00%.
【分析】(1)根据反应物和生成物结合质量守恒来书写化学方程式;(2)SO2和O2的反应在接触室中进行;由图可知:该设备上部循环使用的气体是SO2和O2,下部是产物SO3;(3)SO3与H2O化合时放出大量的热,能形成酸雾,不利于三氧化硫的吸收;(4)第一步:SO2的制取.主要原料是黄铁矿和空气,在高温下煅烧,使硫元素转变成SO2气体,设备为沸腾炉.黄铁矿需要粉碎,以增大和空气的接触面;第二步:SO3的制取,从沸腾炉中出来的气体需经过净化、除尘,进入接触室在催化剂作用下SO2和O2反应生成SO3,设备为接触室,同时涉及热量的交换、催化剂的作用、平衡的移动等问题;第三步:硫酸的生成,从接触室中出来的气体进入吸收塔,为避免酸雾形成需用浓H2SO4吸收;硫酸工业尾气中含二氧化硫,根据二氧化硫的性质可用碱液吸收;硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂;(5)由表中数据分析出温度和CuSO4的质量分数之间的关系,而CuSO4的质量取决于SO3 的质量,再由反应2SO2(g)+O2(g) 2SO3(g),△H=﹣98.3kJ mol﹣1分析SO3 的质量和温度之间的关系;(6)二氧化硫与硫酸铁反应生成硫酸亚铁和硫酸,据此写出反应的离子方程式;利用14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+可知,3SO2~Cr2O72﹣,结合题中数据进行计算.
出卷网(www.chujuan.cn) 1 / 1
4.1 含硫化合物的性质 同步练习 2023-2024学年高一上学期化学苏教版(2019)必修第一册
一、单选题
1.下列说法正确的是( )
A.做焰色反应的实验时,每次实验都要用盐酸把铂丝洗净
B.浓具有强吸水性,能吸收蔗糖中的水分并使其炭化
C.、均能使品红溶液褪色,说明二者均有氧化性
D.NO是一种无色、无味的气体,达到定浓度时有毒,对人有害无利
2.下列各组气体通常条件下不能相互发生化学反应的是( )
A.SO2和H2S B.Cl2和CO2 C.H2和F2 D.NH3和HCl
3.将蘸有浓硫酸的温度计置于空气中,片刻后,温度计读数升高,说明浓硫酸具有( )
A.吸水性 B.脱水性 C.强酸性 D.氧化性
4.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液变稀(挥发性)
B.在加热条件下铜与浓硫酸反应(脱水性)
C.浓硫酸在白纸上书写的字迹变黑(氧化性)
D.浓硫酸可用来干燥某些气体(吸水性)
5.将一定量的锌与100mL18mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液中氢离子的浓度为0.4mol/L,则下列叙述错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共转移3mol电子
C.反应中共消耗Zn97.5g
D.气体A中SO2和H2的体积比为1:4
6.下列物质露置在空气中质量减小的是( )
A.氢氧化钠 B.浓硫酸 C.浓盐酸 D.氯化钠
7.中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐, 能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮这种“碱剂”可能是( )
A.草木灰 B.火碱
C.食盐 D.胆矾
8.下列有关SO2的说法正确的是( )
A.SO2和SO3均是酸性氧化物
B.SO2的漂白原理和氯气的漂白原理相同
C.在SO2+2H2S=3S↓+2H2O反应中,氧化产物和还原产物的物质的量之比为1∶2
D.把某气体通入澄清的石灰水中,石灰水变浑浊,该气体一定是SO2
9.SO2与我们的生活息息相关,低浓度SO2废气的处理是工业难题,目前常用的一种处理方法如下
已知:反应器中发生反应3H2+SO2=H2S+2H2O。
下列有关说法不正确的是( )
A.SO2是有毒气体,能形成酸雨破坏环境,不能用作食品的防腐剂
B.二乙醇胺的作用是吸收H2S,且可以循环使用
C.再生塔中加热分解重新获得H2S,主要目的是富集H2S
D.理论上燃烧室中的O2可以用SO2代替
10.某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如图所示:
下列说法不合理的是( )
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
11.将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性
B.试管②中溶液褪色,说明SO2有漂白性
C.试管③中能产生白色沉淀,说明SO2有酸性
D.试管④中溶液颜色变浅,说明SO2有还原性
12.下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁、铝不反应
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸可作H2、NH3等气体的干燥剂,表现脱水性
D.浓硫酸和铜片加热时发生反应,表现酸性和氧化性
13.下列关于硫及其化合物的说法中正确的是( )
A.自然界中不存在游离态的硫
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
C.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
D.浓硫酸可用来干燥H2S、CO、Cl2等气体
14.为了除去混入CO2中的SO2,最好将混合气体通入下列哪种溶液中( )
A.饱和烧碱溶液 B.饱和小苏打溶液
C.饱和纯碱溶液 D.浓硫酸
15.用如图所示实验装置探究铜片与浓硫酸的反应。下列有关说法错误的是
A.为确认有硫酸铜生成,向圆底烧瓶中加水,观察颜色变化
B.②中选用品红溶液,红色褪去,体现了SO2的漂白性
C.③中选用Ba(NO3)2溶液会产生白色沉淀
D.④中选用NaOH溶液吸收多余的SO2
16.下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是( )
A.若将甲中上层清液倒入水中,观察到溶液呈蓝色,说明有CuSO4生成
B.图乙装置中溶液的颜色变浅,说明SO2具有漂白性
C.图丙装置中溶液的颜色变浅,说明SO2具有还原性
D.图丁装置中产生淡黄色沉淀,说明SO2或H2SO4具有氧化性
二、综合题
17.制备:目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是 ,B设备气流a、b温度较高的是 (填“a”或“b”).
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为:
18.某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,某同学设计了如图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是 (写两点).
19.绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。在隔绝空气条件下,绿矾高温分解的反应为:FeSO4·7H2O Fe2O3+SO2↑+SO3↑+H2O(未配平)。回答下列问题:
(1)缺铁性贫血患者应补充Fe2+。用绿矾制成的补铁剂药片外表包有一层特殊的糖衣,试推测糖衣的作用是 ;
(2)将绿矾分解产生的气体,依次通过下图装置,观察到试管甲中有白色沉淀产生,该白色沉淀是 (填化学式):试管乙中的现象是 ;试管丙中溶液褪色,体现了SO2的 性;试管丁中溶液变浑浊,写出发生反应的化学方程式 。
20.按要求填空:
(1)硝酸银的电离方程式:
(2)碳酸氢钠的电离方程式:
(3)氢氧化钡的电离方程式:
(4)二氧化硫与足量的氢氧化钾反应的方程式:
(5)氢氧化铝中和胃酸反应的原理:
(6)氯化铵与氢氧化钠热溶液的反应方程式: .
21.硫酸工业生产应考虑综合经济效益问题,根据下面工业生产硫酸的工艺流程图回答有关问题:
(1)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO2在沸腾炉中化合而成),CuFeS2是黄铁矿的另一成分,写出煅烧CuFeS2的化学方程式为 .
(2)流程图中设备A是 (填设备名称),其中该设备上部迅婚使用的气体为 .
(3)吸收塔采用98.3%浓硫酸吸收SO2的原因是 .
(4)根据工艺流程图及环保角度判断下列说法正确的是 (填序号)
A.为使黄铁矿充分燃烧,需将其粉碎
B.沸腾炉中排出的炉渣可供炼铁
C.使用催化剂可提高SO2的反应速率和转化率
D.尾气中SO2可用NaOH浓溶液来吸收
E.硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
(5)沸腾炉排出的炉渣中的硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃ 600 620 640 660
炉渣中CuSO4的质量分数/% 9.3 9.2 9.0 8.4
请用平衡移动原理解释上表中CuSO4的质量分数随温度升高而降低的原因 .
(6)某硫酸厂为测定设备A中所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe(SO4)3溶液完全反应后(不考虑氧气的影响),用浓度为0.02mol/L的K2Cr2O7标准溶液滴定至中点,消耗K2Cr2O7溶液25.00mL,则接触室所得气体中SO2的体积分数为 .
答案解析部分
1.【答案】A
【解析】【解答】A.焰色反应实验时,要用盐酸把铂丝洗净并在酒精灯上灼烧至无特殊焰色,A项符合题意;
B.浓具有强脱水性,能使蔗糖中的水分脱出使其炭化,B项不符合题意;
C.能使品红溶液褪色,是因为二氧化硫与有色物质结合,具有漂白性,不能说明其氧化性,C项不符合题意;
D.NO是一种无色、无味的气体,达到一定浓度时,可以治疗一些疾病,D项不符合题意;
故答案为:A。
【分析】B.浓硫酸使蔗糖炭化体现其脱水性;
B.氯气不具有漂白性;
C.NO达到一定浓度时,可以治疗一些疾病。
2.【答案】B
【解析】【解答】A. SO2和 H2S反应生成硫和水,选项A不选;
B. Cl2 和 CO2不发生化学反应,选项B选;
C. H2和F2发生反应生成HF,选项C不选;
D. NH3和 HCl发生反应生成氯化铵,选项D不选。
故答案为:B。
【分析】A. SO2和 H2S是+4的硫与-2价的硫的归中反应
C. H2和F2在冷暗处爆炸化合
D. NH3是碱性气体和 HCl是酸性气体相遇冒白烟
3.【答案】A
【解析】【解答】A.浓硫酸具有吸水性,浓硫酸吸水放热。温度计读数升高,说明浓硫酸吸收空气中的水蒸气放热,证明浓硫酸具有吸水性,故选A;
B.浓硫酸脱水性指的是把有机物当中的氢和氧按2:1的比例脱出来,将蘸有浓硫酸的温度计置于空气中,不可能体现脱水性,故不选B;
C.浓硫酸遇碱性物质表现强酸性,将蘸有浓硫酸的温度计置于空气中,没有遇到碱性物质,不可能体现强酸性,故不选C;
D.浓硫酸遇还原性物质表现强氧化性,将蘸有浓硫酸的温度计置于空气中,没有遇到还原性物质,不可能体现强氧化性,故不选D;
故答案为:A。
【分析】温度计读数升高,说明浓硫酸吸收水蒸气放出热量。
4.【答案】D
【解析】【解答】A.浓硫酸具有吸水性,则在空气中敞口久置的浓硫酸,会吸收空气中的水分而使溶液变稀,表现的是浓硫酸的吸水性,故A不符合题意;
B.浓硫酸具有强氧化性,在加热条件下铜与浓硫酸反应发生氧化还原反应,表现的是浓硫酸的氧化性,故B不符合题意;
C.浓硫酸具有脱水性,能使有机物中的H、O元素以水的形式脱出,浓硫酸在白纸上书写的字迹变黑,表现的是浓硫酸的脱水性,故C不符合题意;
D.浓硫酸具有吸水性,可以用来干燥某些与浓硫酸不反应的酸性或中性气体,如氢气、二氧化碳等,表现的是浓硫酸的吸水性,故D符合题意;
故答案为:D。
【分析】A.在空气中敞口久置的浓硫酸,溶液变稀,体现浓硫酸吸水性;
B.铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,体现浓硫酸的强的氧化性、酸性;
C.浓硫酸在白纸上书写的字迹变黑,体现浓硫酸的脱水性。
5.【答案】D
【解析】【解答】A.若气体A只有SO2,则反应需要消耗硫酸的物质的量3mol,实际参加反应的硫酸为1.6mol,所以气体A为SO2和H2的混合物,故A不符合题意;
B.反应生成1mol SO2转移2mol电子,生成1mol H2转移2mol电子,该反应生成1.5mol气体,所以反应中共转移3mol电子,故B不符合题意;
C.1mol锌失2mol电子,生成1.5mol气体共转移3mol电子,所以参加反应的锌为1.5mol,共消耗Zn97.5g,故C不符合题意;
D.设气体A中SO2为xmol, 反应消耗硫酸2xmol, H2为(1.5-x)mol, 反应消耗硫酸(1.5-x)mol,2xmol+(1.5-x)mol=1.6mol,x=0.1mol,所以气体A中SO2和H2的体积比为1:14,故D符合题意;
故答案为:D。
【分析】A.锌与浓硫酸反应生成SO2,与稀硫酸反应生成氢气;
B.生成1mol SO2转移2mol电子,生成1mol H2转移2mol电子,共生成1.5mol气体;
C.生成1.5mol气体,参加反应的锌为1.5mol;
D.根据和计算生成的气体。
6.【答案】C
【解析】【解答】解:A.固体氢氧化钠易潮解,在固体表面形成溶液,且吸收空气中的二氧化碳气体,使自身质量变大,故A错误;
B.浓硫酸有吸水性,在空气中易吸收水分而使溶液的质量增加,故B错误;
C.浓盐酸有挥发性,在空气中易挥发出氯化氢气体而使本身质量减小,故C正确;
D.氯化钠固体在空气中几乎不改变,质量也无增减,故D错误.
故选C.
【分析】利用相关的四种物质在空气中的变化情况解决此题,浓盐酸具有挥发性而质量减少;浓硫酸具有吸水性而质量增加;固体氢氧化钠易潮解,在固体表面形成溶液,且吸收空气中的二氧化碳气体;氯化钠固体在空气中没有变化而质量不变.
7.【答案】A
【解析】【解答】A.草木灰的成分是碳酸钾,属于盐,溶液呈碱性,故A符合题意;
B.火碱是氢氧化钠,属于碱,故B不符合题意;
C.食盐是氯化钠属于盐,溶液呈中性,故C不符合题意;
D.胆矾是 ,属于盐,溶液呈酸性,故D不符合题意。
故答案为:A
【分析】本题考查物质的化学成分。
8.【答案】A
【解析】【解答】A.SO2和SO3都能与碱反应生成盐和水,故二者都是酸性氧化物,A符合题意;
B.SO2的漂白是与有色物质发生化合反应生成不稳定的无色物质,而氯气的漂白是氯气与水反应生成HClO,HClO具有氧化性,利用其氧化性进行漂白,二者原理不同,B不符合题意;
C.在该反应中,SO2被还原为S,H2S被氧化成S,故氧化产物和还原产物的物质的量之比为2:1,C不符合题意;
D.能使澄清石灰水变浑浊的气体有CO2和SO2,D不符合题意;
故答案为:A
【分析】A.酸性氧化物是指能碱反应生成盐和水的氧化物;
B.根据SO2和氯气的漂白原理分析;
C.由反应的化学方程式确定氧化产物和还原产物,从而确定其物质的量之比;
D.能使澄清石灰水变浑浊的气体有SO2和CO2;
9.【答案】A
【解析】【解答】A.SO2是一种有毒气体,具有还原性,也可作为食品的防腐剂,如SO2是红酒的添加剂,选项错误,A符合题意;
B.二乙醇胺可吸收反应生成的H2S,由流程可知,二乙醇胺可循环使用,选项正确,B不符合题意;
C.再生塔中加热分解重新获得二乙醇胺和H2S,此时得到的H2S纯度较高,因此再生塔主要的目的是富集H2S,选项正确,C不符合题意;
D.由于H2S和SO2能反应生成S和H2O,因此燃烧室中的O2可以用O2代替,选项正确,D不符合题意;
故答案为:A
【分析】此题是对SO2处理的考查,结合流程和SO2的性质进行分析即可。
10.【答案】D
【解析】【解答】A. B装置中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故A不符合题意;
B. 二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,故B不符合题意;
C. Fe3+氧化二氧化硫生成硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入用稀盐酸酸化的BaCl2溶液生成沉淀说明反应中生成了SO42-,故C不符合题意;
D. SO2、Fe2+都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故D符合题意。
故答案为:D。
【分析】A.B装置中蓝色消失,说明碘单质氧化了二氧化硫,还原产物是碘离子,还原剂的还原性大于还原产物的还原性;
B.二氧化硫使酸性气体,能与碱溶液反应而被吸收;
C.盐酸酸化可排除亚硫酸根离子,加入氯化钡溶液生成白色沉淀,生成硫酸钡;
D.二氧化硫和亚铁离子都有还原性。
11.【答案】D
【解析】【解答】解:A.SO2与与氯水发生氧化还原反应不产生淡黄色沉淀,故A错误;
B.试管②中溶液褪色,因为SO2与KMnO4酸性溶液发生氧化还原反应,表现了SO2的还原性,故B错误;
C.SO2与BaCl2溶液不反应,试管③中不能产生白色沉,故C错误;
D.SO2与氯化铁溶液反应,二氧化硫被氧化生成生成硫酸,铁离子被还原生成亚铁离子,溶液颜色变浅,说明SO2有还原性,故D正确;
故选D.
【分析】A.SO2与与氯水发生氧化还原反应不产生淡黄色沉淀;
B.SO2与KMnO4酸性溶液发生氧化还原反应,表现了SO2的还原性;
C.SO2与BaCl2溶液不反应;
D.SO2与氯化铁溶液反应,二氧化硫被氧化生成生成硫酸,铁离子被还原生成亚铁离子.
12.【答案】D
【解析】【解答】A.常温下浓硫酸与铁、铝发生钝化,在铁、铝表面形成一薄层致密氧化膜阻止反应进行,故A不符合题意;
B.浓硫酸使蔗糖炭化体现其脱水性,故B不符合题意;
C.浓硫酸不能干燥NH3,浓硫酸可作H2的干燥剂体现其吸水性,故C不符合题意;
D.浓硫酸和铜片加热时发生反应生成硫酸铜表现酸性,生成二氧化硫,硫元素化合价由+6价变化为+4价,表现氧化性,故D符合题意;
故答案为:D。
【分析】吸水性与脱水性的区别:吸水性是物质中有现成的水分子,浓硫酸作干燥剂是利用其吸水性;脱水性是物质中没有现成的水分子,按水的组成比,浓硫酸夺取某些有机物中的氢、氧元素形成水分子,浓硫酸使蔗糖炭化体现其脱水性。
13.【答案】C
【解析】【解答】解:A.自然界中存在游离态的硫,如火山口存在游离态的硫,故A错误;
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了酸性氧化物的性质,与漂白性无关,故B错误;
C.二氧化硫的生成可以是浓硫酸被还原生成,也可以是硫单质燃烧被氧化生成,故C正确;
D.浓硫酸具有吸水性,可干燥CO、Cl2等气体,H2S具有还原性可以被浓硫酸氧化,故D错误;
故选C.
【分析】A.火山口存在游离态的硫;
B.发生复分解反应生成亚硫酸钠;
C.二氧化硫中硫元素化合价处于中间价态可以升高也可以降低;
D.浓硫酸具有吸水性,且与SO2、CO、Cl2等不反应.
14.【答案】B
【解析】【解答】解:二者都可与饱和烧碱溶液、饱和纯碱溶液反应,与浓硫酸都不反应;
饱和NaHCO3溶液与SO2反应生成二氧化碳而除去,碳酸氢钠与二氧化碳不反应,
故选B.
【分析】二氧化硫具有还原性,可被氧化,除去混入CO2中的SO2,所选用的试剂能够将二氧化硫除去且不能够与二氧化碳反应、不能引进新的杂质,以此解答该题.
15.【答案】A
【解析】【解答】解:A.铜与浓硫酸反应后溶液中混有剩余的浓硫酸,稀释时,应该将圆底烧瓶中的溶液加入水中,玻璃棒不断搅拌不能直接向反应后的溶液中加水,因浓硫酸溶于水放出大量的热,会造成溶液四溅,A错误;
B.SO2使品红溶液褪色,体现了SO2的漂白性,B正确;
C.SO2具有还原性,溶于水呈酸性,所以SO2通入Ba(NO3)2溶液中会发生氧化还原反应生成硫酸根,与Ba2+结合会产生白色沉淀,C正确;
D.SO2会污染空气,所以需要用NaOH溶液吸收尾气,防止污染空气,D正确;
故答案为:A。
【分析】易错分析:A.浓硫酸稀释过程要注意浓硫酸溶于水放出大量的热,会造成溶液四溅,要将浓硫酸加到水中;不可将浓硫酸加到水中,铜和浓硫酸反应不可能进行彻底,还有很多浓硫酸没有反应。
16.【答案】B
【解析】【解答】A.若观察到溶液呈蓝色,则说明溶液中含有Cu2+,因此可说明反应有CuSO4生成,选项正确,A不符合题意;
B.图乙中试剂为酸性KMnO4溶液,具有强化性,而SO2具有还原性,二者可发生氧化还原反应,使得溶液颜色变浅,该实验未能说明SO2具有漂白性,选项错误,B符合题意;
C.图丙中试剂为滴有KSCN溶液的Fe2(SO4)3溶液,溶液中Fe3+具有氧化性,能与SO2反应,使得溶液中Fe3+含量减小,溶液颜色变浅,该实验能说明SO2具有还原性,选项正确,C不符合题意;
D.图丁中往Na2S溶液中通入SO2,发生反应的离子方程式为:SO2+2S2-+4H+=3S↓+2H2O,因此可说明SO2或H2SO4具有氧化性,选项正确,D不符合题意;
故答案为:B
【分析】加热条件下,Cu与浓硫酸反应生成SO2,SO2中硫元素为+4价,处于中间价态,具有还原性和氧化性。Fe3+为最高价, 具有氧化性,能将SO2氧化成SO42-;Na2S中硫元素为-2价,具有还原性,能与SO2反应生成S沉淀;据此结合选项进行分析。
17.【答案】(1)沸腾炉;b
(2)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2
【解析】【解答】解:(1)A设备是硫铁矿与氧气在高温下煅烧反应在沸腾炉中进行;二氧化硫氧化生成三氧化硫为放热反应,所以b处温度高于a,
故答案为:沸腾炉; b;(2)根据题意可知,高温煅烧时CuFeS2时,反应物为CuFeS2和O2,生成物为CuO、Fe2O3 和SO2,再根据化合价升降法配平氧化还原反应方程式,
故答案为:4CuFeS2+13O2 4CuO+2Fe2O3+8SO2.
【分析】(1)依据接触法制硫酸的工业流程和设备反应分析判断;二氧化硫氧化生成三氧化硫为放热反应分析判断;(2)根据已知信息,确定出反应物和生成物,然后配平化学方程式.
18.【答案】(1)品红溶液;SO2+I2+2H2O═SO42﹣+2I﹣+4H+
(2)不用加热或节约能源或药品;或相对安全;或易于控制反应进行;或反应更充分
【解析】【解答】解:(1)依据装置图可知,铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,C检验二氧化硫的还原性,D检验二氧化硫的氧化性,检验二氧化硫漂白性可以通过品红试液,品红褪色是二氧化硫气体的特性;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;反应的两种方程式为:SO2+I2+2H2O═SO42﹣+2I﹣+4H+;
故答案为:品红溶液; SO2+I2+2H2O═SO42﹣+2I﹣+4H+;(2)装置图分析可知,A2的制取装置来代替A1装置,可以不需要加热或节约能源或药品,用分液漏斗加入硫酸可以控制反应速率,易于控制反应进行;或反应更充分,故答案为:不用加热或节约能源或药品;或相对安全;或易于控制反应进行;或反应更充分.
【分析】(1)铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中C、D分别为碘水和硫化氢的水溶液,检验二氧化硫漂白性可以通过品红试液;二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;(2)依据装置图对比分析不同,总结优点.
19.【答案】(1)隔绝空气,防止绿矾中 被氧化
(2);品红溶液褪色;还原性;
【解析】【解答】(1)绿矾的主要成分为FeSO4·7H2O,Fe2+易被空气中的O2氧化,因此补铁药剂药片外表包有一层糖衣,可起到隔绝空气,防止Fe2+被氧化的作用;
(2)由反应的化学方程式可知,FeSO4分解产生SO2、SO3,SO3能与BaCl2反应生成难溶于酸的白色沉淀BaSO4;SO2通入品红溶液中,能使品红溶液褪色;丙中KMnO4酸性溶液具有氧化性,溶液褪色,说明SO2具有还原性;SO2中硫元素为中间价态,既有氧化性又有还原性,H2S中硫元素为最低价,只具有还原性,二者可发生氧化还原反应生成S,反应的化学方程式为:SO2+2H2S=3S↓+2H2O;
【分析】(1)结合Fe2+易被空气中氧气氧化的性质分析;
(2)结合FeSO4分解产生的气体成分的性质进行分析;
20.【答案】(1)AgNO3=Ag++NO3﹣
(2)NaHCO3═Na++HCO3﹣
(3)Ba(OH)2=Ba2++2OH﹣
(4)SO2+2KOH=K2SO3+H2O
(5)Al(OH)3+3HCl═AlCl3+3H2O
(6)NH4Cl+NaOH NH3↑+H2O+NaCl
【解析】【解答】解:(1)硝酸银是强电解质完全电离出银离子和硝酸根离子,其电离的离子方程式为:AgNO3=Ag++NO3﹣;故答案为:AgNO3=Ag++NO3﹣;(2)碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3﹣;故答案为:NaHCO3═Na++HCO3﹣;(3)氢氧化钡完全电离出钡离子和氢氧根离子,氢氧化钡的电离方程式:Ba(OH)2=Ba2++2OH﹣,故答案为:Ba(OH)2=Ba2++2OH﹣;(4)二氧化硫与足量的氢氧化钾反应生成亚硫酸钾和水,其反应的化学方程式为SO2+2KOH=K2SO3+H2O;故答案为:SO2+2KOH=K2SO3+H2O;(5)氢氧化铝和胃酸中的HCl反应生成氯化铝和水,反应的化学方程式为Al(OH)3+3HCl═AlCl3+3H2O;
故答案为:Al(OH)3+3HCl═AlCl3+3H2O;(6)氯化铵与氢氧化钠热溶液生成氯化钠、氨气和水,反应的化学方程式为:NH4Cl+NaOH NH3↑+H2O+NaCl;
故答案为:NH4Cl+NaOH NH3↑+H2O+NaCl.
【分析】(1)硝酸银是强电解质完全电离出银离子和硝酸根离子;(2)碳酸氢钠为强电解质,完全电离,注意碳酸氢根离子为弱酸的酸式根离子不能拆;(3)氢氧化钡完全电离出钡离子和氢氧根离子;(4)二氧化硫与足量的氢氧化钾反应生成亚硫酸钾和水;(5)氢氧化铝和胃酸中的HCl反应生成氯化铝和水;(6)氯化铵与氢氧化钠热溶液生成氯化钠、氨气和水.
21.【答案】(1)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2
(2)接触室;SO2和O2
(3)可以防止形成酸雾,使三氧化硫吸收完全
(4)A;B;D;E
(5)SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
(6)12.00%
【解析】【解答】解:(1)反应物和生成物已知,结合质量守恒来书写化学方程式为:4CuFeS2+13O2 4CuO+2Fe2O3+8SO2,故答案为:4CuFeS2+13O2 4CuO+2Fe2O3+8SO2;(2)SO2和O2的反应在接触室中进行;由图可知:该设备上部循环使用的气体是SO2和O2,下部是产物SO3;
故答案为:接触室;SO2和O2;(3)SO3与H2O化合时放出大量的热,用水或稀硫酸吸收易形成酸雾,反而不利于成分吸收SO3,所以在吸收塔吸收SO3不用水或稀硫酸,用浓硫酸吸收,
故答案为:可以防止形成酸雾,使三氧化硫吸收完全;(4)A.在沸腾炉中,原料黄铁矿是固体、空气是气体,为了加快反应速率,所以要将黄铁矿粉碎,增大接触面,提高反应速率,故A正确;
B.沸腾炉排出的矿渣有F2O3,F2O3可供炼铁,故B正确;
C.催化剂只能改变反应速率,不能影响转化率,故C错误;
D.因为SO2+2NaOH═Na2SO3+H2O,所以尾气中SO2可用NaOH浓溶液来吸收,故D正确;
E.硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂,所以硫酸厂的厂址宜选在消耗硫酸甚多的工业城市的郊区
故E正确;
故答案为:ABDE;(5)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3 CuSO4中SO3的质量减少导致的,根据2SO2(g)+O2(g) 2SO3(g)△H=﹣98.3kJ mol﹣1 反应制备SO3,该反应为可逆反应,正方向为放热,随着温度升高,平衡逆向移动,导致SO3的量减少,由CuO与SO3在沸腾炉中化合而成CuSO4的量也减少,
故答案为:SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少);(6)根据14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+可得关系式:
3SO2~ Cr2O72﹣
3 1
x 0.02mol/L×0.025L
解得:x= =0.0015mol,
则接触室中所得气体中SO2的体积分数为:0.0015mol÷ ×100%=12.00%,
故答案为:12.00%.
【分析】(1)根据反应物和生成物结合质量守恒来书写化学方程式;(2)SO2和O2的反应在接触室中进行;由图可知:该设备上部循环使用的气体是SO2和O2,下部是产物SO3;(3)SO3与H2O化合时放出大量的热,能形成酸雾,不利于三氧化硫的吸收;(4)第一步:SO2的制取.主要原料是黄铁矿和空气,在高温下煅烧,使硫元素转变成SO2气体,设备为沸腾炉.黄铁矿需要粉碎,以增大和空气的接触面;第二步:SO3的制取,从沸腾炉中出来的气体需经过净化、除尘,进入接触室在催化剂作用下SO2和O2反应生成SO3,设备为接触室,同时涉及热量的交换、催化剂的作用、平衡的移动等问题;第三步:硫酸的生成,从接触室中出来的气体进入吸收塔,为避免酸雾形成需用浓H2SO4吸收;硫酸工业尾气中含二氧化硫,根据二氧化硫的性质可用碱液吸收;硫酸工业生产应考虑综合经济效益问题,同时要考虑当地的需求量情况,硫酸厂是一座具有一定污染性的工厂;(5)由表中数据分析出温度和CuSO4的质量分数之间的关系,而CuSO4的质量取决于SO3 的质量,再由反应2SO2(g)+O2(g) 2SO3(g),△H=﹣98.3kJ mol﹣1分析SO3 的质量和温度之间的关系;(6)二氧化硫与硫酸铁反应生成硫酸亚铁和硫酸,据此写出反应的离子方程式;利用14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O、SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+可知,3SO2~Cr2O72﹣,结合题中数据进行计算.
出卷网(www.chujuan.cn) 1 / 1
