高中化学 人教版(2019) 选择性必修1 第三章 水溶液中的离子反应与平衡 复习课件(共27张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 选择性必修1 第三章 水溶液中的离子反应与平衡 复习课件(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 19:41:59 | ||
图片预览






文档简介
(共27张PPT)
水溶液中的离子反应与平衡复习
(第一课时)
高中化学
漂白剂 亚硫酸钠 食品抗氧化剂
Na SO
高中化学
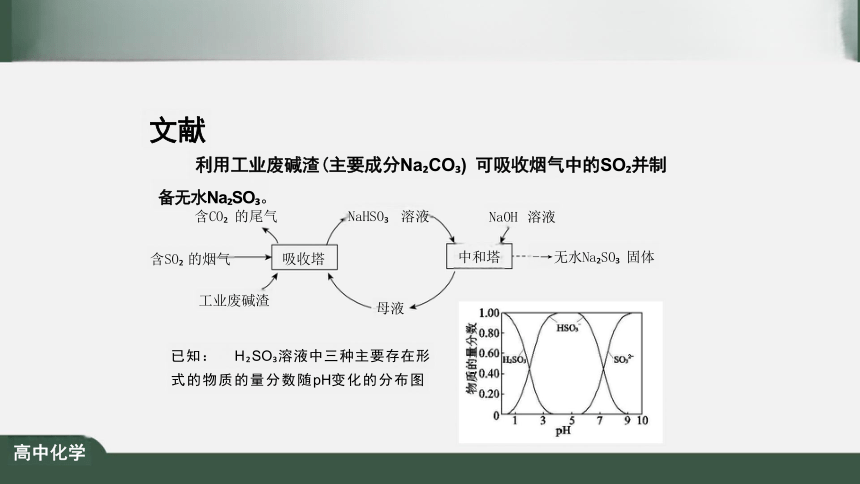
文献
利用工业废碱渣(主要成分Na CO ) 可吸收烟气中的SO 并制
备无水Na SO 。
含CO 的尾气 NaHSO 溶液
含SO 的烟气 吸收塔
NaOH 溶液
中和塔 -→无水Na SO 固体
已知: H SO 溶液中三种主要存在形
式的物质的量分数随pH变化的分布图
高中化学
工业废碱渣
母液
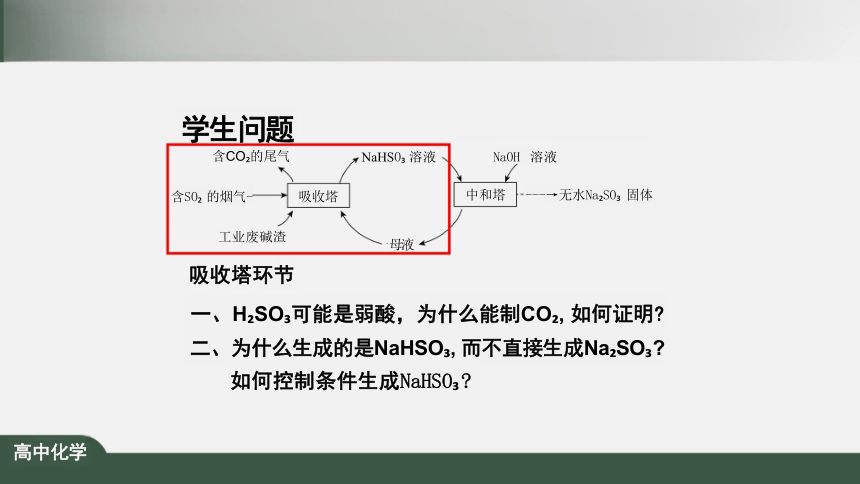
吸收塔环节
一、H SO 可能是弱酸,为什么能制CO , 如何证明
二、为什么生成的是NaHSO , 而不直接生成Na SO
如何控制条件生成NaHSO
高中化学
含CO 的尾气
含SO 的烟气- 吸收塔
工业废碱渣
NaHSO 溶液 NaOH 溶液
中和塔 ---→无水Na SO 固体
学生问题
母液
问题一 H SO 可能是弱酸,为什么能制出CO ,
如何证明
探究活动
1. 如何证明H SO 是弱酸
2. 如何证明H SO 的酸性强于H CO
高中化学
问题一 H SO 可能是弱酸,为什么能制出CO ,
如何证明
活动1 如何证明H SO 是弱酸
高中化学
回顾 如何阐释CH COOH是弱酸的
第三章
本质:水溶液中的离子
反应与平衡
CH COOH
H O
CH COO-+H O
CH COO-+H+
H++OH
CH COOH+OH -
水溶液中的离子 反应与平衡 ●电离平
· 水的电离和溶液的pH
· 盐类的水解
· 沉淀溶解平衡
水溶液广泛存在于生命体及其赖以生存的环境中。
许多化学反应都是在水溶液中进行的,其中,酸、碱和
盐等电解质在水溶液中发生的离子反应,以及弱电解质
的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解
平衡,都与生命活动、日常生活、工农业生产和环境保
护等息息相关。
高中化学
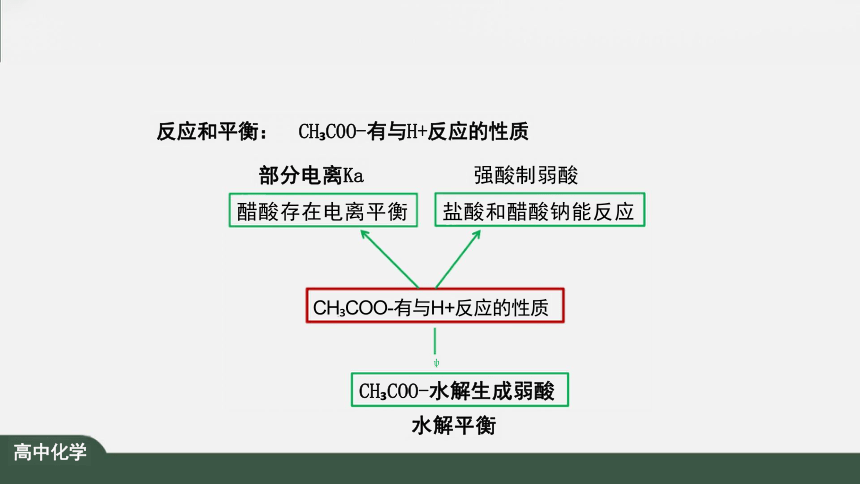
CH COO-有与H+反应的性质
ψ
CH COO-水解生成弱酸
水解平衡
高中化学
反应和平衡: CH C0O-有与H+反应的性质
部分电离Ka 强酸制弱酸
醋酸存在电离平衡 盐酸和醋酸钠能反应
发散 证明CH COOH是弱酸的方法
存在电离平衡:
①查阅Ka
②测一定物质的量浓度CH COOH的pH
③将醋酸加水稀释,分析pH的变化
④比较CH COOH与盐酸
i 等体积、等浓度 分别与少量Zn反应产生气泡的快慢
ii 等体积、等pH 分别与少量Zn反应产生气泡的快慢
iii等体积、等pH 二者的耗碱量
■■■
高中化学
发散 证明CH COOH是弱酸的方法
存在水解平衡:
⑤ 测 CH C0ONa溶 液 的pH
强酸与弱酸盐反应
⑥盐酸可以与CH C0ONa反应
高中化学
■
归纳:证明H SO 是弱酸的思维模型
存在电离平衡: H SO HSO +H+
1.Ka HSO SO3~+H+
2.测pH
H SO 3.等c, 等V 的H SO 与H SO 对比 酸的通性
4.等pH、 等V 的H SO 与H SO 对比
(存在水解平衡:
HSO +H O H SO +OH-
高中化学
质疑
从文献可知NaHSO 溶液显酸性,
能否作为H SO 是弱酸的证据
NaHSO = Na++HSO
电离: HSO3 SO +H+ 主要
水解: HSO +H O H SO +OH- 次要
NaHSO 溶液显酸性,不能作为H SO 是 弱酸的证据
高中化学
扩展
NaHCO 显碱性
电离:HCO CO +H+ 次要
水解: HCO3+H O H CO +OH 主要
NaHCO 水解为主显碱性,能作为H CO 是 弱酸的证据
高中化学
活动1 如何证明H SO 是弱酸
1. 测定0.005 mol·L-1H SO 溶液的pH。
2. 测定0.01 mol·L-1H SO 溶液的导电性。
3. 测定Na SO 溶液的酸碱性。
4. 配制等pH 、 等 V 的H SO 与H SO 稀溶液,分别 用NaOH溶液滴定,消耗NaOH溶液多的为弱酸。
高中化学
问题一 H SO 可能是弱酸,为什么能制出CO ,
如何证明
活动2 如何证明H SO 的酸性强于H CO
高中化学
活动2 如何证明H SO 的酸性强于H CO
方案1 原理:分别测量H SO 与H CO 的pH
SO → 水 → 测pH
CO → 水 → 测pH
高中化学
错误
活动2 如何证明H SO 的酸性强于H CO
方案2 原理:较强酸制备较弱酸
NaHCO 溶 液 酸性KMnO 溶液
SO → 气体 气体
品红溶液 气体 澄清石灰水 → 浑浊
正确
高中化学
活动2 如何证明H SO 的酸性强于H CO
方案3 原理:比较电离常数K
教科书(附录Ⅱ 25 ℃):
H SO Ka=1.4×10-2 Ka =6.0×10-8
H CO Ka =4.5×10-7 Ka =4.7×10-11
正确
高中化学
问题二 为什么生成的是NaHSO , 而不直接生成Na SO
如何控制条件生成NaHSO
活动3 生成NaHSO 比生成Na SO 的优点是什么
活动4 如何控制条件生成NaHSO
高中化学
含CO 的尾气 NaHSO 溶液 NaOH 溶液
含SO 的烟气一 吸收塔 中和塔 -->无水Na SO 固体
工业废碱渣
母液
活动3 生成NaHSO 比生成Na SO 的优点是什么
宏观分析:生成Na SO 的缺点
文献:Na CO 溶液与SO 反应过程中溶液组成变化
高中化学
电离出H+能力: H SO
盐: HSO
微观分析:生成Na SO 的缺点
H SO +CO =—HSO +HCO
高中化学
SO +H O
>H CO >
HSO +H
H SO
HCO
HCO
Co
HSO
S03
>
反应初期, Na CO 大量
H SO +2Na CO ——Na SO +2NaHCO
高中化学
SO +H O
电离出H+能力: H SO
盐: HSO
H SO HSO +H+
HSO SOz-+H+
> H CO > HSO
HCO SO
微观分析:生成Na SO 的缺点
|HCO
Co
>
宏观分析:生成NaHSO 的优点
文献: Na CO 溶液与SO 反应过程中溶液组成变化
活动3 生成NaHSO 比生成Na SO 的优点是什么
高中化学
电离出H+能 力 :H SO >
后
盐: HSO
微观分析:生成NaHSO 的优点
H CO >
HCO
SO +H O H SO HSO +H
HSO
S03
高中化学
>
先
HCO
CO
活动4:如何控制条件生成NaHSO
可控制pH为4~5
pH
高中化学
总结 思路和方法
含CO 的尾气 NaHSO 溶液 NaOH溶液
含SO 的烟气 吸收塔 中和塔 ---->无水Na SO 固体
工业废碱渣 母液
1.00~
HSO
0.80
0.60H só so
0.40-
0.20
o 3 5 7 9 10
pH
高中化学
物质的量分数
总结 思路和方法
宏观:物质、现象 ← 符号:平衡
证据推理 模型认知(弱酸、强制弱)
微观: 粒子 符号:变化
高中化学
水溶液中的离子反应与平衡复习
(第一课时)
高中化学
漂白剂 亚硫酸钠 食品抗氧化剂
Na SO
高中化学
文献
利用工业废碱渣(主要成分Na CO ) 可吸收烟气中的SO 并制
备无水Na SO 。
含CO 的尾气 NaHSO 溶液
含SO 的烟气 吸收塔
NaOH 溶液
中和塔 -→无水Na SO 固体
已知: H SO 溶液中三种主要存在形
式的物质的量分数随pH变化的分布图
高中化学
工业废碱渣
母液
吸收塔环节
一、H SO 可能是弱酸,为什么能制CO , 如何证明
二、为什么生成的是NaHSO , 而不直接生成Na SO
如何控制条件生成NaHSO
高中化学
含CO 的尾气
含SO 的烟气- 吸收塔
工业废碱渣
NaHSO 溶液 NaOH 溶液
中和塔 ---→无水Na SO 固体
学生问题
母液
问题一 H SO 可能是弱酸,为什么能制出CO ,
如何证明
探究活动
1. 如何证明H SO 是弱酸
2. 如何证明H SO 的酸性强于H CO
高中化学
问题一 H SO 可能是弱酸,为什么能制出CO ,
如何证明
活动1 如何证明H SO 是弱酸
高中化学
回顾 如何阐释CH COOH是弱酸的
第三章
本质:水溶液中的离子
反应与平衡
CH COOH
H O
CH COO-+H O
CH COO-+H+
H++OH
CH COOH+OH -
水溶液中的离子 反应与平衡 ●电离平
· 水的电离和溶液的pH
· 盐类的水解
· 沉淀溶解平衡
水溶液广泛存在于生命体及其赖以生存的环境中。
许多化学反应都是在水溶液中进行的,其中,酸、碱和
盐等电解质在水溶液中发生的离子反应,以及弱电解质
的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解
平衡,都与生命活动、日常生活、工农业生产和环境保
护等息息相关。
高中化学
CH COO-有与H+反应的性质
ψ
CH COO-水解生成弱酸
水解平衡
高中化学
反应和平衡: CH C0O-有与H+反应的性质
部分电离Ka 强酸制弱酸
醋酸存在电离平衡 盐酸和醋酸钠能反应
发散 证明CH COOH是弱酸的方法
存在电离平衡:
①查阅Ka
②测一定物质的量浓度CH COOH的pH
③将醋酸加水稀释,分析pH的变化
④比较CH COOH与盐酸
i 等体积、等浓度 分别与少量Zn反应产生气泡的快慢
ii 等体积、等pH 分别与少量Zn反应产生气泡的快慢
iii等体积、等pH 二者的耗碱量
■■■
高中化学
发散 证明CH COOH是弱酸的方法
存在水解平衡:
⑤ 测 CH C0ONa溶 液 的pH
强酸与弱酸盐反应
⑥盐酸可以与CH C0ONa反应
高中化学
■
归纳:证明H SO 是弱酸的思维模型
存在电离平衡: H SO HSO +H+
1.Ka HSO SO3~+H+
2.测pH
H SO 3.等c, 等V 的H SO 与H SO 对比 酸的通性
4.等pH、 等V 的H SO 与H SO 对比
(存在水解平衡:
HSO +H O H SO +OH-
高中化学
质疑
从文献可知NaHSO 溶液显酸性,
能否作为H SO 是弱酸的证据
NaHSO = Na++HSO
电离: HSO3 SO +H+ 主要
水解: HSO +H O H SO +OH- 次要
NaHSO 溶液显酸性,不能作为H SO 是 弱酸的证据
高中化学
扩展
NaHCO 显碱性
电离:HCO CO +H+ 次要
水解: HCO3+H O H CO +OH 主要
NaHCO 水解为主显碱性,能作为H CO 是 弱酸的证据
高中化学
活动1 如何证明H SO 是弱酸
1. 测定0.005 mol·L-1H SO 溶液的pH。
2. 测定0.01 mol·L-1H SO 溶液的导电性。
3. 测定Na SO 溶液的酸碱性。
4. 配制等pH 、 等 V 的H SO 与H SO 稀溶液,分别 用NaOH溶液滴定,消耗NaOH溶液多的为弱酸。
高中化学
问题一 H SO 可能是弱酸,为什么能制出CO ,
如何证明
活动2 如何证明H SO 的酸性强于H CO
高中化学
活动2 如何证明H SO 的酸性强于H CO
方案1 原理:分别测量H SO 与H CO 的pH
SO → 水 → 测pH
CO → 水 → 测pH
高中化学
错误
活动2 如何证明H SO 的酸性强于H CO
方案2 原理:较强酸制备较弱酸
NaHCO 溶 液 酸性KMnO 溶液
SO → 气体 气体
品红溶液 气体 澄清石灰水 → 浑浊
正确
高中化学
活动2 如何证明H SO 的酸性强于H CO
方案3 原理:比较电离常数K
教科书(附录Ⅱ 25 ℃):
H SO Ka=1.4×10-2 Ka =6.0×10-8
H CO Ka =4.5×10-7 Ka =4.7×10-11
正确
高中化学
问题二 为什么生成的是NaHSO , 而不直接生成Na SO
如何控制条件生成NaHSO
活动3 生成NaHSO 比生成Na SO 的优点是什么
活动4 如何控制条件生成NaHSO
高中化学
含CO 的尾气 NaHSO 溶液 NaOH 溶液
含SO 的烟气一 吸收塔 中和塔 -->无水Na SO 固体
工业废碱渣
母液
活动3 生成NaHSO 比生成Na SO 的优点是什么
宏观分析:生成Na SO 的缺点
文献:Na CO 溶液与SO 反应过程中溶液组成变化
高中化学
电离出H+能力: H SO
盐: HSO
微观分析:生成Na SO 的缺点
H SO +CO =—HSO +HCO
高中化学
SO +H O
>H CO >
HSO +H
H SO
HCO
HCO
Co
HSO
S03
>
反应初期, Na CO 大量
H SO +2Na CO ——Na SO +2NaHCO
高中化学
SO +H O
电离出H+能力: H SO
盐: HSO
H SO HSO +H+
HSO SOz-+H+
> H CO > HSO
HCO SO
微观分析:生成Na SO 的缺点
|HCO
Co
>
宏观分析:生成NaHSO 的优点
文献: Na CO 溶液与SO 反应过程中溶液组成变化
活动3 生成NaHSO 比生成Na SO 的优点是什么
高中化学
电离出H+能 力 :H SO >
后
盐: HSO
微观分析:生成NaHSO 的优点
H CO >
HCO
SO +H O H SO HSO +H
HSO
S03
高中化学
>
先
HCO
CO
活动4:如何控制条件生成NaHSO
可控制pH为4~5
pH
高中化学
总结 思路和方法
含CO 的尾气 NaHSO 溶液 NaOH溶液
含SO 的烟气 吸收塔 中和塔 ---->无水Na SO 固体
工业废碱渣 母液
1.00~
HSO
0.80
0.60H só so
0.40-
0.20
o 3 5 7 9 10
pH
高中化学
物质的量分数
总结 思路和方法
宏观:物质、现象 ← 符号:平衡
证据推理 模型认知(弱酸、强制弱)
微观: 粒子 符号:变化
高中化学
