高中化学 人教版(2019) 选择性必修1 3.2 水的电离和溶液的pH 课件(共30张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 选择性必修1 3.2 水的电离和溶液的pH 课件(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 285.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 19:43:25 | ||
图片预览






文档简介
(共30张PPT)
水的电离和溶液的pH(第二课时)
高中化学
“pH”是由丹麦化学家彼得·索仑森1909年提出的。
索仑森当时在一家啤酒厂工作,经常要化验啤酒中所含
H+浓度。每次化验结果都要记录许多个零,这使他感到
很麻烦。经过长期潜心研究,他发现用H+浓度的负对数
来表示酸碱性非常方便,并把它称为溶液的pH(p代表
德语Potenz,意思是浓度,H代表H+)。就这样“pH”
成为表述溶液酸碱度的一种重要数据。
高中化学
化学史话
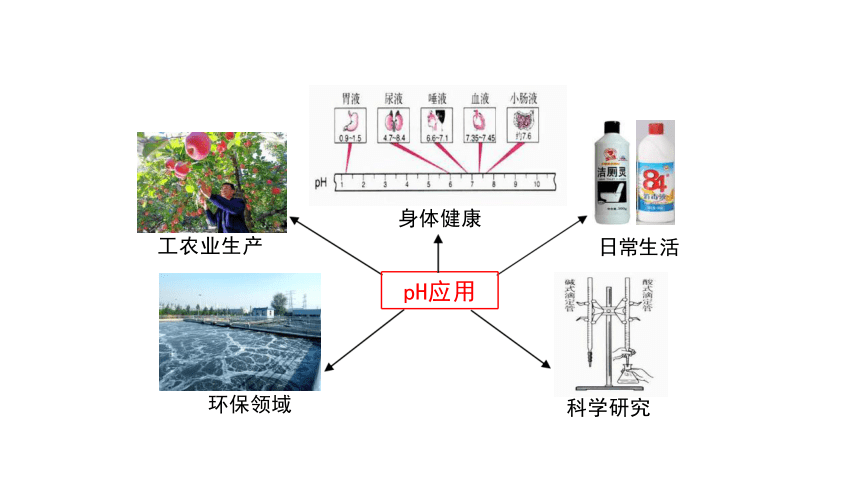
pH应用
工农业生产
环保领域
科学研究
身体健康
日常生活
高中化学
任务一 实验室有一瓶未知浓度的NaOH溶液,一瓶
浓度为0.100 0 mol/L的HCl溶液,如何准
确测出NaOH溶液的浓度?
酸碱中和滴定:
利用酸碱中和反应,用已知浓度的酸(或碱)来
测定未知浓度的碱(或酸)的实验方法。
高中化学
定量分析
测定物质中元素、离子、官能团等各成分的含量,在化学上叫做
定量分析。酸碱中和滴定就是一种重要的定量分析。根据分析方法的 不同,定量分析可分为化学分析法和仪器分析法。化学分析法是指依 特定的化学反应及其计量关系对物质进行分析的方法;仪器分析法是 指利用特定的仪器对物质进行定量分析的方法,根据取样多少的不同, 定量分析可分为常量分析、微量分析和超微量分析等。
在定量分析中,实验误差是客观存在的,所以需要对所得的数
据进行处理和评价。
高中化学
一、滴定原理
1.中和反应的实质: H+ + OH- H2O
2.在酸碱恰好反应时, n(H+)=n(OH- )
若是一元酸和一元碱反应
c酸 ·V酸=c碱 ·V碱
高中化学
酸碱中和滴定实验
已知0.100 0 mol/L
待测定
c(NaOH)= c(HCl) .V[HCl(aq)] V[NaOH(aq)]
量取一定体积
高中化学
【问题1】需测得哪些数据能计算出c(NaOH)?
c(NaOH). V[NaOH(aq)]=c(HCl).V[HCl(aq)]
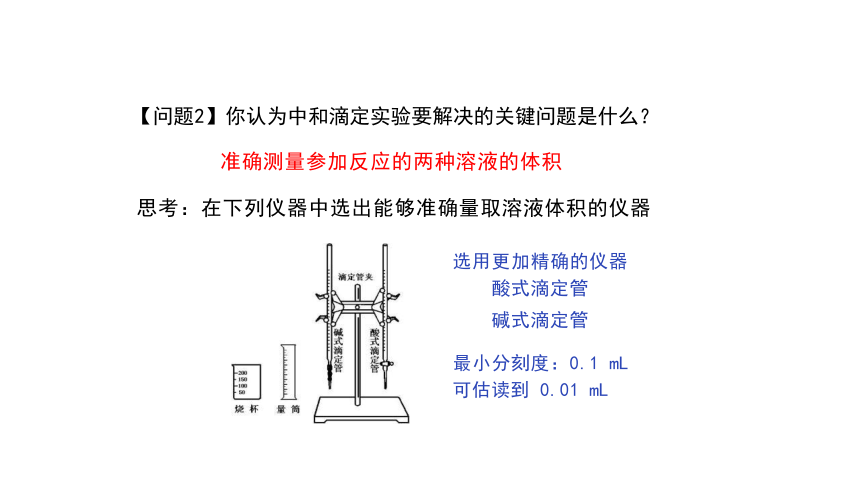
【问题2】你认为中和滴定实验要解决的关键问题是什么?
准确测量参加反应的两种溶液的体积
思考:在下列仪器中选出能够准确量取溶液体积的仪器
选用更加精确的仪器
酸式滴定管
碱式滴定管
最小分刻度:0.1 mL
可估读到 0.01 mL
高中化学
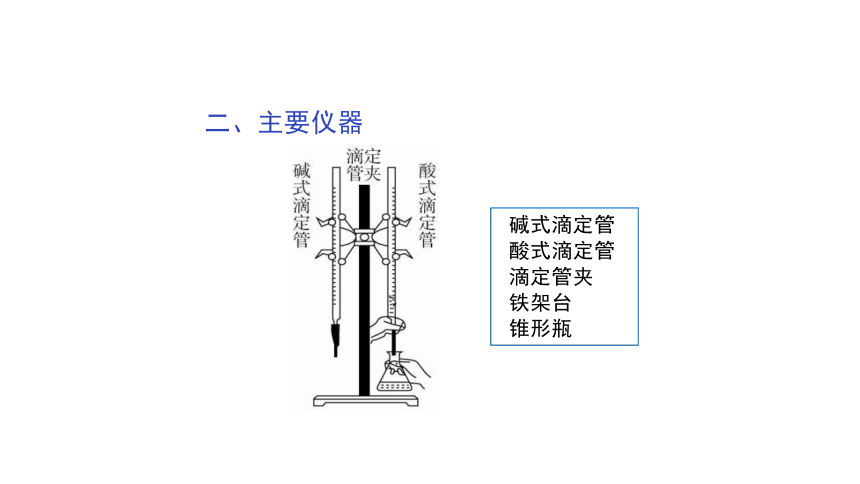
碱式滴定管 酸式滴定管 滴定管夹
铁架台
锥形瓶
二、主要仪器
高中化学
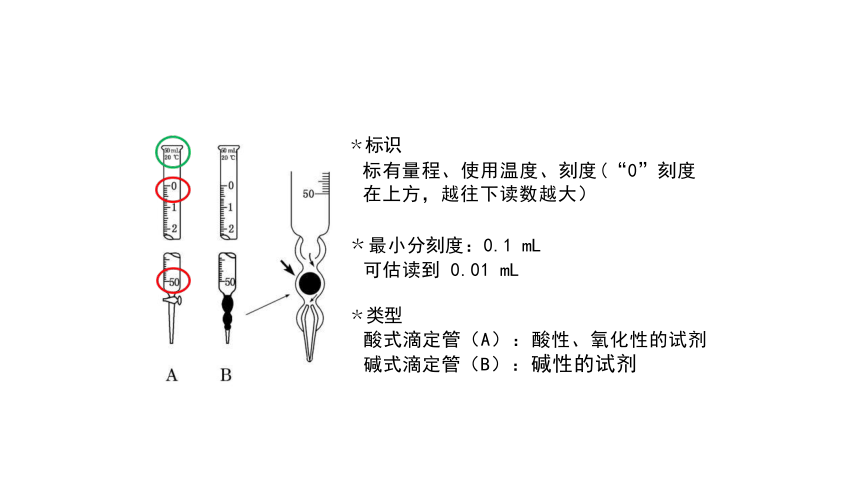
﹡标识
标有量程、使用温度、刻度(“0”刻度 在上方,越往下读数越大)
﹡最小分刻度:0.1 mL
可估读到 0.01 mL
﹡类型
酸式滴定管(A):酸性、氧化性的试剂 碱式滴定管(B):碱性的试剂
高中化学
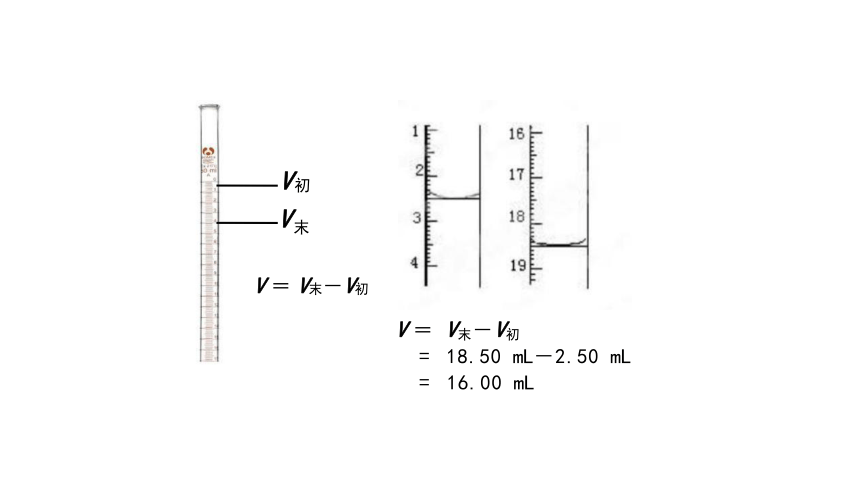
V = V末-V初
= 18.50 mL-2.50 mL = 16.00 mL
V初
V末
V = V末-V初
高中化学
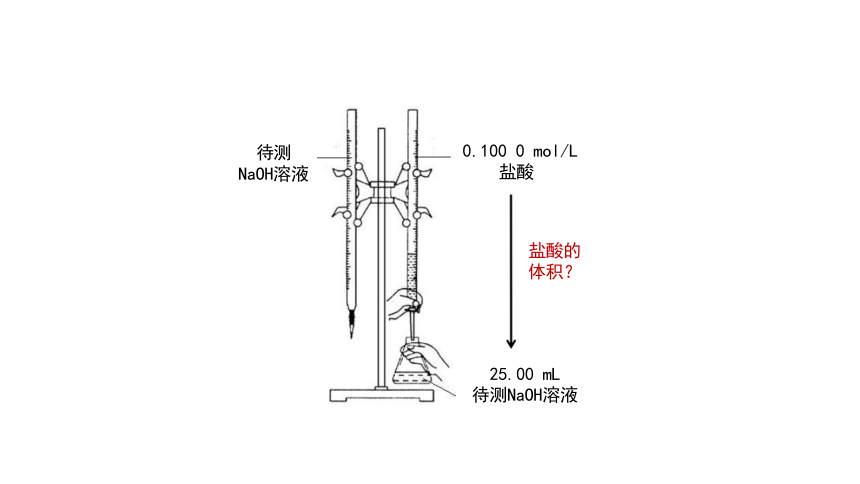
0.100 0 mol/L 盐酸
25.00 mL
待测NaOH溶液
待测
NaOH溶液
盐酸的 体积?
高中化学
【问题3】 如何判断中和反应什么时候“恰好”反应
完全(即判断滴定终点)?
方法:在待测溶液中加入酸碱指示剂
高中化学
pH
高中化学
三、滴定终点的确定
几种常用指示剂的变色范围
甲基橙
石蕊
酚酞
【困惑】强酸与强碱“恰好”反应时,所得溶液
的pH=7,用酚酞作指示剂时,实际滴定终点的
pH=8.2,为什么可以将滴定终点当成“恰好”
反应的点?
高中化学
V[HCl(aq)]/mL 19.98 (少加半滴) 20.00
20.02
(多加半滴)
溶液的pH
任务二 探究滴定终点前后溶液的pH变化
计算:用0.200 0 mol/L盐酸滴定20.00 mL 0.200 0 mol/L
NaOH溶液过程中溶液的pH,填入下表:
滴定时,每滴溶液的体积约为0.04 mL
高中化学
任务二 探究滴定终点前后溶液的pH变化
(1)V[HCl(aq)]=20.00 mL时,酸和碱恰反应完全
n(H+)=n(OH-)
pH=7
高中化学
(2)少加入半滴HCl溶液,即V[HCl(aq)]=19.98 mL时
碱过量:c(OH-) →c(H+) →pH
c(OH-)= V 液)
0.200 0 mol/L×(20.00-19.98) mL×10-3 L/mL
=
(20.00+19.98) mL×10-3 L/mL
≈ 0.200 0 mol/L×0.02 mL×10-3 L/mL 40 mL×10-3 L/mL
= 1×10-4 mol/L
高中化学
混合
(OH-)
(
n
c(OH-)=1×10-4 mol/L
常温下:c(H+)= KW = 1×10-14 =1×10-10 mol/L
pH=- lgc(H+)=- lg10-10 =10
c(OH-) 1×10-4
高中化学
(3)多加入半滴HCl溶液,即V[HCl(aq)]=20.02 mL时
酸过量:c(H+)→pH
V(混合液) (20.00+20.02) mL×10-3 L/mL
≈ 0.200 l ×0- .L LmL×10-3 L/mL
= 1×10-4 mol/L
pH=- lgc(H+)=- lg10-4 =4
高中化学
m
2
/
0
3
0
1
L
40 mL
0 mo
c(H+)= n(H+) = 0.200 0 mol/L×0.02 mL×10-3 L/mL
V[HCl(aq)]/mL 19.98 (少加半滴) 20.00
20.02
(多加半滴)
溶液的pH 10 7
4
任务二 探究滴定终点前后溶液的pH变化
计算:用0.200 0 mol/L盐酸滴定20.00 mL 0.200 0 mol/L
NaOH溶液过程中溶液的pH,填入下表:
高中化学
中和反应过程中的 变化曲线
V[HCl(aq)]/mL 19.98 20.00
20.02
pH 10 7
4
误差 -0.1% 0
+0.1%
反应终点 突变
V[HCl(aq)]/mL
高中化学
范围
8
6
4
pH
40
20
30
10
10
12
0
2
酚酞
石蕊
甲基橙
几种常用指示剂的变色范围
指示剂选择原则:在突变范围内指示剂有明显的颜色变化。
石蕊的紫色和蓝色差别不够明显,不用作指示剂。
0.100 0 mol/L 盐酸
25.00 mL
待测NaOH溶液
高中化学
酚酞
中和反应过程中的pH变化曲线
反应终点 突变范围
0 10 20 30 40
12
10
8
6
4
2
V[HCl(aq)]/mL
甲基橙
高中化学
pH
三、滴定终点的确定
酸碱指示剂的颜色在pH突变范围发生明显的改变,
就能以允许的误差表示反应已完全,即为滴定终点。
高中化学
四、操作步骤
教科书89-90页 实验活动2
用0.100 0 mol/L的HCl溶液测定未知浓度的NaOH溶液
1.滴定前准备
4.读数
2.滴定
5.记录数据
3.判断终点
高中化学
滴定 次数 待测NaOH溶 液的体积/mL 已知浓度HCl溶液 滴定前读数 滴定后读数
体积/mL
1 25.00 0 27.84
27.84
2 25.00 0 27.83
27.83
3 25.00 0 27.85
27.85
平行滴定三次,记录相关数据
高中化学
实验次数 HCl溶液的体积/mL
待测NaOH溶液的体积/mL
1 27.84
25.00
2 27.83
25.00
3 27.85
25.00
实验1: c1 (NaOH)=
=
=
高中化学
V[NaOH(aq)]
0.100 0 mol/L×0.027 84 L
0.025 00 L
0.111 4 mol/L
五、数据计算
c(HCl)·V[HCl(aq)]
同理可得,实验2:c2 (NaOH)=0.111 3 mol/L
实验3:c3 (NaOH)=0.111 4 mol/L
将三次滴定测出的待测NaOH溶液浓度取平均值:
c(NaOH)= 0.111 4 mol/L + 0.111 3 mol/L + 0.111 4 mol/L 3
= 0.111 4 mol/L
实验1:c1 (NaOH)= c(H a·O aq)] =0.111 4 mol/L
]
(
)
l
aq
HC
(
[
H
V
N
)
[
l
V
C
五、数据计算
高中化学
定量分析
依据:中和反应
核心:减少误差
指示剂的选择 数据处理
中和滴定实验
总结提升
仪器选用
高中化学
水的电离和溶液的pH(第二课时)
高中化学
“pH”是由丹麦化学家彼得·索仑森1909年提出的。
索仑森当时在一家啤酒厂工作,经常要化验啤酒中所含
H+浓度。每次化验结果都要记录许多个零,这使他感到
很麻烦。经过长期潜心研究,他发现用H+浓度的负对数
来表示酸碱性非常方便,并把它称为溶液的pH(p代表
德语Potenz,意思是浓度,H代表H+)。就这样“pH”
成为表述溶液酸碱度的一种重要数据。
高中化学
化学史话
pH应用
工农业生产
环保领域
科学研究
身体健康
日常生活
高中化学
任务一 实验室有一瓶未知浓度的NaOH溶液,一瓶
浓度为0.100 0 mol/L的HCl溶液,如何准
确测出NaOH溶液的浓度?
酸碱中和滴定:
利用酸碱中和反应,用已知浓度的酸(或碱)来
测定未知浓度的碱(或酸)的实验方法。
高中化学
定量分析
测定物质中元素、离子、官能团等各成分的含量,在化学上叫做
定量分析。酸碱中和滴定就是一种重要的定量分析。根据分析方法的 不同,定量分析可分为化学分析法和仪器分析法。化学分析法是指依 特定的化学反应及其计量关系对物质进行分析的方法;仪器分析法是 指利用特定的仪器对物质进行定量分析的方法,根据取样多少的不同, 定量分析可分为常量分析、微量分析和超微量分析等。
在定量分析中,实验误差是客观存在的,所以需要对所得的数
据进行处理和评价。
高中化学
一、滴定原理
1.中和反应的实质: H+ + OH- H2O
2.在酸碱恰好反应时, n(H+)=n(OH- )
若是一元酸和一元碱反应
c酸 ·V酸=c碱 ·V碱
高中化学
酸碱中和滴定实验
已知0.100 0 mol/L
待测定
c(NaOH)= c(HCl) .V[HCl(aq)] V[NaOH(aq)]
量取一定体积
高中化学
【问题1】需测得哪些数据能计算出c(NaOH)?
c(NaOH). V[NaOH(aq)]=c(HCl).V[HCl(aq)]
【问题2】你认为中和滴定实验要解决的关键问题是什么?
准确测量参加反应的两种溶液的体积
思考:在下列仪器中选出能够准确量取溶液体积的仪器
选用更加精确的仪器
酸式滴定管
碱式滴定管
最小分刻度:0.1 mL
可估读到 0.01 mL
高中化学
碱式滴定管 酸式滴定管 滴定管夹
铁架台
锥形瓶
二、主要仪器
高中化学
﹡标识
标有量程、使用温度、刻度(“0”刻度 在上方,越往下读数越大)
﹡最小分刻度:0.1 mL
可估读到 0.01 mL
﹡类型
酸式滴定管(A):酸性、氧化性的试剂 碱式滴定管(B):碱性的试剂
高中化学
V = V末-V初
= 18.50 mL-2.50 mL = 16.00 mL
V初
V末
V = V末-V初
高中化学
0.100 0 mol/L 盐酸
25.00 mL
待测NaOH溶液
待测
NaOH溶液
盐酸的 体积?
高中化学
【问题3】 如何判断中和反应什么时候“恰好”反应
完全(即判断滴定终点)?
方法:在待测溶液中加入酸碱指示剂
高中化学
pH
高中化学
三、滴定终点的确定
几种常用指示剂的变色范围
甲基橙
石蕊
酚酞
【困惑】强酸与强碱“恰好”反应时,所得溶液
的pH=7,用酚酞作指示剂时,实际滴定终点的
pH=8.2,为什么可以将滴定终点当成“恰好”
反应的点?
高中化学
V[HCl(aq)]/mL 19.98 (少加半滴) 20.00
20.02
(多加半滴)
溶液的pH
任务二 探究滴定终点前后溶液的pH变化
计算:用0.200 0 mol/L盐酸滴定20.00 mL 0.200 0 mol/L
NaOH溶液过程中溶液的pH,填入下表:
滴定时,每滴溶液的体积约为0.04 mL
高中化学
任务二 探究滴定终点前后溶液的pH变化
(1)V[HCl(aq)]=20.00 mL时,酸和碱恰反应完全
n(H+)=n(OH-)
pH=7
高中化学
(2)少加入半滴HCl溶液,即V[HCl(aq)]=19.98 mL时
碱过量:c(OH-) →c(H+) →pH
c(OH-)= V 液)
0.200 0 mol/L×(20.00-19.98) mL×10-3 L/mL
=
(20.00+19.98) mL×10-3 L/mL
≈ 0.200 0 mol/L×0.02 mL×10-3 L/mL 40 mL×10-3 L/mL
= 1×10-4 mol/L
高中化学
混合
(OH-)
(
n
c(OH-)=1×10-4 mol/L
常温下:c(H+)= KW = 1×10-14 =1×10-10 mol/L
pH=- lgc(H+)=- lg10-10 =10
c(OH-) 1×10-4
高中化学
(3)多加入半滴HCl溶液,即V[HCl(aq)]=20.02 mL时
酸过量:c(H+)→pH
V(混合液) (20.00+20.02) mL×10-3 L/mL
≈ 0.200 l ×0- .L LmL×10-3 L/mL
= 1×10-4 mol/L
pH=- lgc(H+)=- lg10-4 =4
高中化学
m
2
/
0
3
0
1
L
40 mL
0 mo
c(H+)= n(H+) = 0.200 0 mol/L×0.02 mL×10-3 L/mL
V[HCl(aq)]/mL 19.98 (少加半滴) 20.00
20.02
(多加半滴)
溶液的pH 10 7
4
任务二 探究滴定终点前后溶液的pH变化
计算:用0.200 0 mol/L盐酸滴定20.00 mL 0.200 0 mol/L
NaOH溶液过程中溶液的pH,填入下表:
高中化学
中和反应过程中的 变化曲线
V[HCl(aq)]/mL 19.98 20.00
20.02
pH 10 7
4
误差 -0.1% 0
+0.1%
反应终点 突变
V[HCl(aq)]/mL
高中化学
范围
8
6
4
pH
40
20
30
10
10
12
0
2
酚酞
石蕊
甲基橙
几种常用指示剂的变色范围
指示剂选择原则:在突变范围内指示剂有明显的颜色变化。
石蕊的紫色和蓝色差别不够明显,不用作指示剂。
0.100 0 mol/L 盐酸
25.00 mL
待测NaOH溶液
高中化学
酚酞
中和反应过程中的pH变化曲线
反应终点 突变范围
0 10 20 30 40
12
10
8
6
4
2
V[HCl(aq)]/mL
甲基橙
高中化学
pH
三、滴定终点的确定
酸碱指示剂的颜色在pH突变范围发生明显的改变,
就能以允许的误差表示反应已完全,即为滴定终点。
高中化学
四、操作步骤
教科书89-90页 实验活动2
用0.100 0 mol/L的HCl溶液测定未知浓度的NaOH溶液
1.滴定前准备
4.读数
2.滴定
5.记录数据
3.判断终点
高中化学
滴定 次数 待测NaOH溶 液的体积/mL 已知浓度HCl溶液 滴定前读数 滴定后读数
体积/mL
1 25.00 0 27.84
27.84
2 25.00 0 27.83
27.83
3 25.00 0 27.85
27.85
平行滴定三次,记录相关数据
高中化学
实验次数 HCl溶液的体积/mL
待测NaOH溶液的体积/mL
1 27.84
25.00
2 27.83
25.00
3 27.85
25.00
实验1: c1 (NaOH)=
=
=
高中化学
V[NaOH(aq)]
0.100 0 mol/L×0.027 84 L
0.025 00 L
0.111 4 mol/L
五、数据计算
c(HCl)·V[HCl(aq)]
同理可得,实验2:c2 (NaOH)=0.111 3 mol/L
实验3:c3 (NaOH)=0.111 4 mol/L
将三次滴定测出的待测NaOH溶液浓度取平均值:
c(NaOH)= 0.111 4 mol/L + 0.111 3 mol/L + 0.111 4 mol/L 3
= 0.111 4 mol/L
实验1:c1 (NaOH)= c(H a·O aq)] =0.111 4 mol/L
]
(
)
l
aq
HC
(
[
H
V
N
)
[
l
V
C
五、数据计算
高中化学
定量分析
依据:中和反应
核心:减少误差
指示剂的选择 数据处理
中和滴定实验
总结提升
仪器选用
高中化学
