高中化学 人教版(2019) 选择性必修1 2.2 化学平衡 课件(共47张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 选择性必修1 2.2 化学平衡 课件(共47张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 275.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 19:45:08 | ||
图片预览








文档简介
(共47张PPT)
化学平衡(第二课时)
高中化学
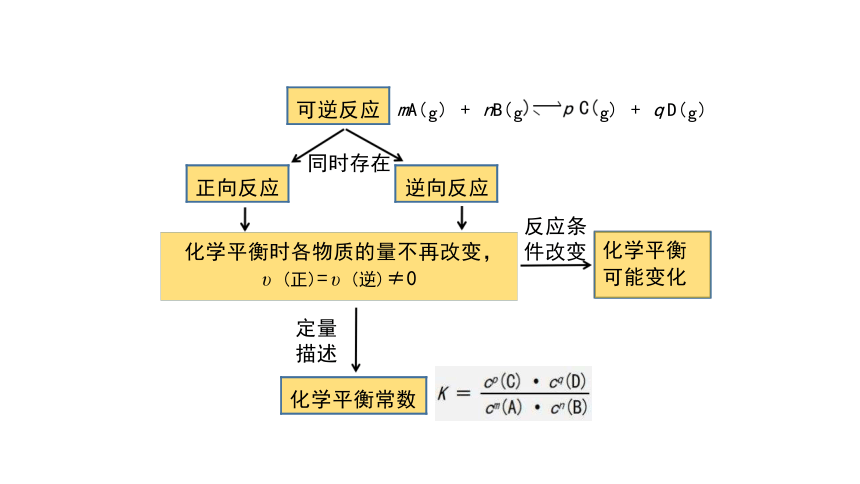
化学平衡时各物质的量不再改变,
υ (正)= υ (逆)≠0
化学平衡
可能变化
同时存在
逆向反应
mA(g) + nB(g g) + q D(g)
化学平衡常数
可逆反应
正向反应
反应条
件改变
定量 描述
高中化学
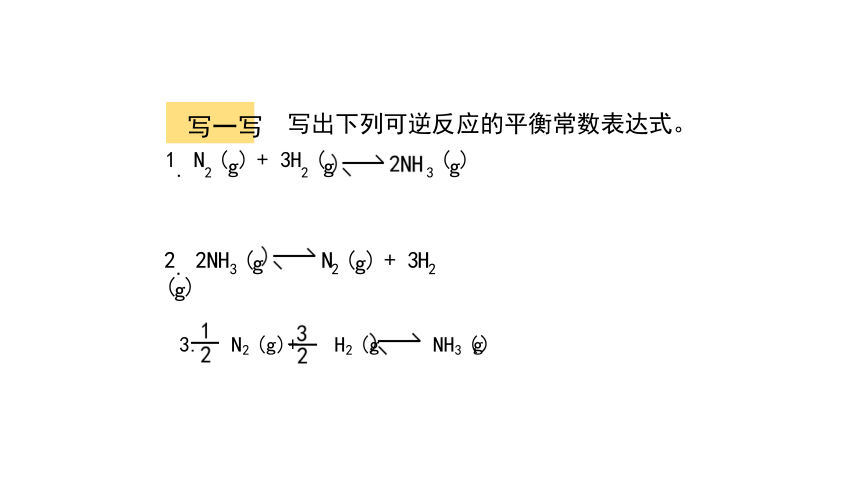
写一写 写出下列可逆反应的平衡常数表达式。
1. N2 (g) + 3H2 (g 3 (g)
3. N2 (g)+ H2 (g NH3 (g)
2. 2NH3 (g N2 (g) + 3H2 (g)
高中化学
写一写 写出下列可逆反应的平衡常数表达式。
1. N2 (g) + 3H2 (g 3 (g) K1 =
2. 2NH3 (g) N2 (g) + 3H2 (g) K2 = c )(H2)
3. N2 (g)+ H2 (g NH3 (g)
NH3
c3
(
)
2
2
c
(N
高中化学
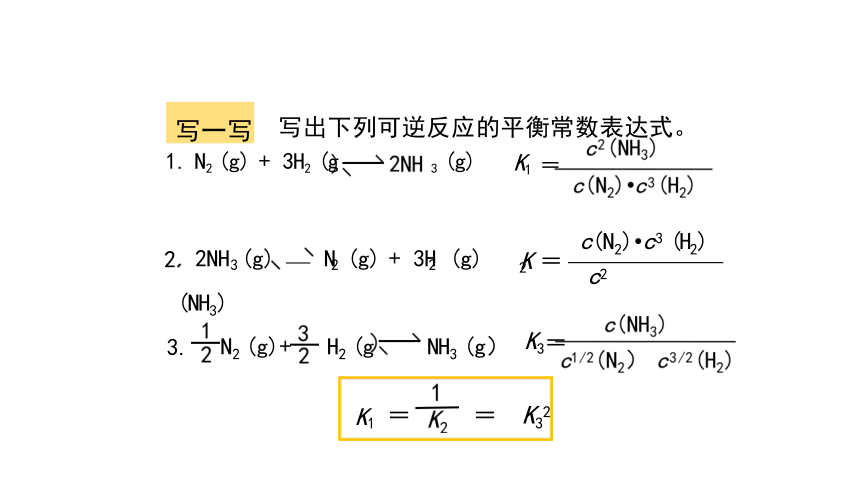
写一写 写出下列可逆反应的平衡常数表达式。 1. N2 (g) + 3H2 (g 3 (g) K1 =
2. 2NH (g) N (g) + 3H (g) K = c(N2) c3 (H2)
3. N2 (g)+ H2 (g NH3 (g) K3=
K1 和K2 、K3是什么关系呢?
高中化学
. 3 2 2 2 c2 (NH3)
写一写 写出下列可逆反应的平衡常数表达式。 1. N2 (g) + 3H2 (g 3 (g) K1 =
2. 2NH (g) N (g) + 3H (g) K = c(N2) c3 (H2)
3. N2 (g)+ H2 (g NH3 (g) K3=
K1 = = K32
高中化学
. 3 2 2 2 c2 (NH3)
写出下列可逆反应的平衡常数表达式。
Fe3O4 (s) + 4H2 (g)
3Fe(s) + 4H2O(g)
写一写
高中化学
高温
写一写 写出下列可逆反应的平衡常数表达式。
Fe3O4 (s) + 4H2 (g) 、 3Fe(s) + 4H2O(g)
K =
(H2 )
c
4
高温
c4 (H2O)
高中化学
1. 表达式中的各物质的浓度必须为平衡浓度。
2. 平衡常数表达式与化学方程式的书写一一对应。
3. 固体、液体纯物质的浓度视为常数,在表达式中不
出现。
书写平衡常数表达式的注意事项
记一记
高中化学
平衡常数受哪些因素影响?
请根据以下资料提供的数据,分析影响平
衡常数的因素。
分析与思考
高中化学
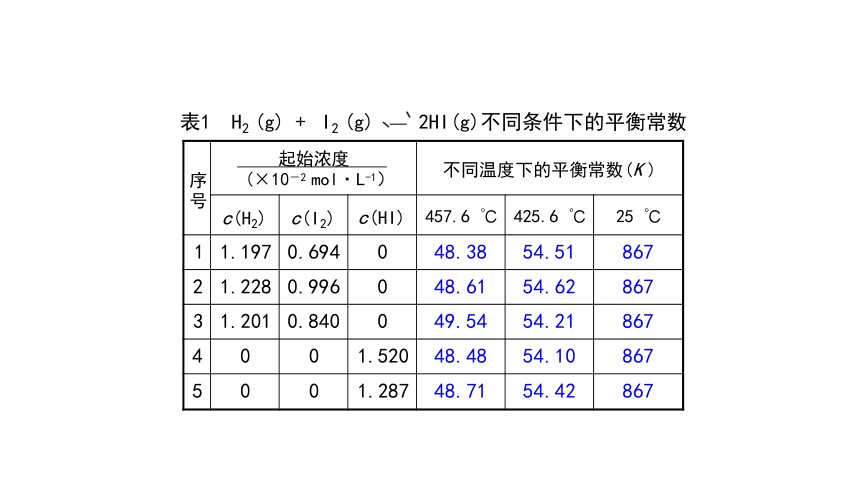
序 号 起始浓度 (×10-2 mol·L-1) 不同温度下的平衡常数(K ) c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃
25 ℃
1 1.197 0.694 0 48.38 54.51
867
2 1.228 0.996 0 48.61 54.62
867
3 1.201 0.840 0 49.54 54.21
867
4 0 0 1.520 48.48 54.10
867
5 0 0 1.287 48.71 54.42
867
表1 H2 (g) + I2 (g) 2HI(g)不同条件下的平衡常数
高中化学
平衡常数不受浓度的影响,受温度影响
分析与思考
高中化学
体系压强改变会影响平衡常数吗?
分析与思考
高中化学
压强改变可能会影响体系中物质的浓度,而
浓度的改变不影响平衡常数。因此压强不影响平 衡常数的大小。
体系压强改变会影响平衡常数吗?
分析与思考
高中化学
化学方程式
平衡常数 ( K )
F2 (g) + H2 (g g)
6.5 ×1095
Cl2 (g) + H2 (g g)
2.57 ×1033
Br2 (g) + H2 (g g)
1.91 ×1019
I2 (g) + H2 (g g)
8.67 ×102
表2 25 ℃ 时,生成卤化氢反应的平衡常数
分析与思考
高中化学
化学方程式
平衡常数 ( K )
F2 (g) + H2 (g g)
6.5 ×1095
Cl2 (g) + H2 (g g)
2.57 ×1033
Br2 (g) + H2 (g g)
1.91 ×1019
I2 (g) + H2 (g g)
8.67 ×102
平衡常数的大小,与反应中物质的性质有关
表2 25 ℃ 时,生成卤化氢反应的平衡常数
分析与思考
高中化学
1.影响化学平衡常数的因素
内因:反应中物质的性质
外因:对于同一可逆反应,化学平衡常数
只与温度有关
高中化学
三.化学平衡常数的应用
结合平衡常数的表达式思考,K 的大小表示 什么含义?
mA(g) + nB(g) 、 p C(g) + q D(g)
cp (C) cq (D)
cm(A) cn(B)
想一想
K =
高中化学
结合平衡常数的表达式思考,K 的大小表示 什么含义?
mA(g) + nB(g) 、 p C(g) + q D(g)
cp (C) cq (D)
cm(A) cn(B)
对于同类型的反应,K 越大,反应进行的程度越大
想一想
K =
高中化学
对于同类型的化学反应,K 越大,反应进行
的程度越大,一般:
K ≥ 105 ,正反应进行得基本完全
2.根据平衡常数的大小,判断反应进行的程度
三.化学平衡常数的应用
高中化学
化学方程式
平衡常数 ( K )
F2 (g) + H2 (g g)
6.5 ×1095
Cl2 (g) + H2 (g g)
2.57 ×1033
Br2 (g) + H2 (g g)
1.91 ×1019
I2 (g) + H2 (g g)
8.67 ×102
表2 25 ℃ 时,生成卤化氢反应的平衡常数
高中化学
注意:化学平衡常数的大小反映的是反应进行的
程度大小,并不涉及反应时间和化学反应速率。也就 是说,某个化学反应的平衡常数很大,可能化学反应 速率却很小。
合成氨 N2 (g) + 3H2 (g)、2NH3 (g)
常温下 K=5×108
常温下限度较大,但化学反应速率很小
高中化学
投料浓度不影响化学反应的平衡常数,仅
改变投料浓度后,平衡时物质的转化率会改变 吗?
想一想
高中化学
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(1)求该反应的平衡常数及平衡时CO的转化率。
算一算
高中化学
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(1)求该反应的平衡常数及平衡时CO的转化率。
【解】依题意可知:
起始时 c(CO) = c(H2O) = 0.01 mol ·L-1
平衡时 c(CO) = 0.005 mol ·L-1 变化量 c(CO) = 0.005 mol ·L-1
高中化学
算一算
列出三段式:
CO(g) + H2O(g)
起始浓度/(mol·L-1 ) 0.01 0.01
变化浓度/(mol·L-1 ) 0.005
平衡浓度/(mol·L-1 ) 0.005
+ H2 (g)
0
CO2 (g)
0
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005 0.005 0.005
平衡浓度/(mol·L-1 ) 0.005
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
平衡浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
高中化学
c(CO2) c(H2) 0.005 × 0.005
c(CO) c(H2O) 0.005 × 0.005
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
平衡浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
K= = =1
CO的转化率为: × 100% = 50%
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
平衡浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(2)在上述温度下,CO的量不变,将气态H2O的投料改 为0.3 mol,达到平衡时, CO的浓度为多少?CO的转化率为 多少?
算一算
高中化学
【解】依题意可知:起始时 c(CO) = 0.01 mol ·L-1 c(H2O) = 0.03 mol ·L-1
平衡常数只与温度有关
高中化学
【解】设达到平衡状态时CO浓度的变化量为x mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 0.01-x 0.03-x x x
高中化学
【解】设达到平衡状态时CO浓度的变化量为x mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 0.01 x 0.03 x x x
K = ) .. = (0.01 . (0.03 x)= 1
x = 0.0075 平衡时CO的浓度为0.0025 mol ·L-1
高中化学
x)
x2
O)
2)
2
H
c(H
c(
O
O
(C
(C
c
c
【解】设达到平衡状态时CO浓度的变化量为x mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 0.01-x 0.03-x x x
解得:x = 0.0075
CO的转化率为: 0 0 5m l··L-L1 × 100% =75%
高中化学
-1
l
o
o
m
1
7
0
0
0
.
序号 起始浓度/(mol·L-1)
平衡时CO 的转化率
CO(g) H2O(g) 1 0.01 0.01
50%
2 0.01 0.03
75%
CO(g) + H2O(g CO2 (g) + H2 (g)
高中化学
投料方式1 投料方式2 投料方式3
化学平衡1 化学平衡2 化学平衡3
转化率可能不同,平衡常数(K)相同
三.化学平衡常数的应用
3.根据平衡常数计算平衡时各物质的浓度及反应物
同一温度下,同一反应
的转化率
高中化学
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(3)在上述温度下, CO的量不变,将气态H2O的投料 改为0.375 mol ,反应一段时间后测得体系中CO的浓度为 0.0025 mol·L-1 ,此时反应是否达到平衡状态?
想一想
高中化学
可通过平衡常数计算出该投料方式下平衡时CO
的浓度,将其与测量值相比。
说一说
高中化学
可将此时各物质的浓度代入平衡常数的表达式
中进行计算,若和该温度时的K相等则达到平衡。
可通过平衡常数计算出该投料方式下平衡时CO
的浓度,将其与测量值相比。
说一说
高中化学
可将此时各物质的浓度代入平衡常数的表达式
中进行计算,若和该温度时的K相等则达到平衡。
可通过平衡常数计算出该投料方式下平衡时CO
的浓度,将其与测量值相比。
说一说
高中化学
【解】起始时 c(CO)=0.01 mol ·L-1
c(H2O)=0.0375 mol ·L-1
某时刻c(CO)=0.0025 mol·L-1 ,减少了0.0075 mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.0375 0 0
变化浓度/(mol·L-1 ) 0.0075 0.0075 0.0075 0.0075
某时刻浓度/(mol·L-1 ) 0.0025 0.03 0.0075 0.0075
高中化学
该温度下,该反应的平衡常数为1
将此刻各物质的浓度,代入平衡常数的表达式计算
c(CO2) c(H2)
c(CO) c(H2O)
0.0025 ×0.03
=0.75 < 1
(0.0075 )2
高中化学
=
该温度下,该反应的平衡常数为1
将此刻各物质的浓度,代入平衡常数的表达式计算
此时不是化学平衡状态,反应在向正反应方向
c(CO2) c(H2)
c(CO) c(H2O)
0.0025 ×0.03
=0.75 < 1
进行之中
(0.0075 )2
高中化学
=
4.利用平衡常数判断化学反应进行的方向
对于可逆反应:mA(g) + nB(g) 、 p C(g) + q D(g)
任意时刻的浓度商 Q =
达到化学平衡状态时浓度商等于该温度下的K
高中化学
三.化学平衡常数的应用
4.利用平衡常数判断化学反应进行的方向
是否平衡或平衡移动的方向,可用该时刻浓度商Q
与K 比较大小来判断。
在同一温度下:
Q = K ,处于化学平衡状态
Q < K ,向正反应方向进行 Q > K ,向逆反应方向进行
三.化学平衡常数的应用
高中化学
)
化
物
浓
时
率
应
的
衡
化
反
质
平
转
和
物
算
的
度
各
计
(K
达
量
态
数
表
定
状
常
衡
衡
平
平
学
衡
否
较
平
是
比
到
断
Q
达
判
与
可逆反应
一定条件下
只受温度影响
小结
高中化学
化学平衡(第二课时)
高中化学
化学平衡时各物质的量不再改变,
υ (正)= υ (逆)≠0
化学平衡
可能变化
同时存在
逆向反应
mA(g) + nB(g g) + q D(g)
化学平衡常数
可逆反应
正向反应
反应条
件改变
定量 描述
高中化学
写一写 写出下列可逆反应的平衡常数表达式。
1. N2 (g) + 3H2 (g 3 (g)
3. N2 (g)+ H2 (g NH3 (g)
2. 2NH3 (g N2 (g) + 3H2 (g)
高中化学
写一写 写出下列可逆反应的平衡常数表达式。
1. N2 (g) + 3H2 (g 3 (g) K1 =
2. 2NH3 (g) N2 (g) + 3H2 (g) K2 = c )(H2)
3. N2 (g)+ H2 (g NH3 (g)
NH3
c3
(
)
2
2
c
(N
高中化学
写一写 写出下列可逆反应的平衡常数表达式。 1. N2 (g) + 3H2 (g 3 (g) K1 =
2. 2NH (g) N (g) + 3H (g) K = c(N2) c3 (H2)
3. N2 (g)+ H2 (g NH3 (g) K3=
K1 和K2 、K3是什么关系呢?
高中化学
. 3 2 2 2 c2 (NH3)
写一写 写出下列可逆反应的平衡常数表达式。 1. N2 (g) + 3H2 (g 3 (g) K1 =
2. 2NH (g) N (g) + 3H (g) K = c(N2) c3 (H2)
3. N2 (g)+ H2 (g NH3 (g) K3=
K1 = = K32
高中化学
. 3 2 2 2 c2 (NH3)
写出下列可逆反应的平衡常数表达式。
Fe3O4 (s) + 4H2 (g)
3Fe(s) + 4H2O(g)
写一写
高中化学
高温
写一写 写出下列可逆反应的平衡常数表达式。
Fe3O4 (s) + 4H2 (g) 、 3Fe(s) + 4H2O(g)
K =
(H2 )
c
4
高温
c4 (H2O)
高中化学
1. 表达式中的各物质的浓度必须为平衡浓度。
2. 平衡常数表达式与化学方程式的书写一一对应。
3. 固体、液体纯物质的浓度视为常数,在表达式中不
出现。
书写平衡常数表达式的注意事项
记一记
高中化学
平衡常数受哪些因素影响?
请根据以下资料提供的数据,分析影响平
衡常数的因素。
分析与思考
高中化学
序 号 起始浓度 (×10-2 mol·L-1) 不同温度下的平衡常数(K ) c(H2) c(I2) c(HI) 457.6 ℃ 425.6 ℃
25 ℃
1 1.197 0.694 0 48.38 54.51
867
2 1.228 0.996 0 48.61 54.62
867
3 1.201 0.840 0 49.54 54.21
867
4 0 0 1.520 48.48 54.10
867
5 0 0 1.287 48.71 54.42
867
表1 H2 (g) + I2 (g) 2HI(g)不同条件下的平衡常数
高中化学
平衡常数不受浓度的影响,受温度影响
分析与思考
高中化学
体系压强改变会影响平衡常数吗?
分析与思考
高中化学
压强改变可能会影响体系中物质的浓度,而
浓度的改变不影响平衡常数。因此压强不影响平 衡常数的大小。
体系压强改变会影响平衡常数吗?
分析与思考
高中化学
化学方程式
平衡常数 ( K )
F2 (g) + H2 (g g)
6.5 ×1095
Cl2 (g) + H2 (g g)
2.57 ×1033
Br2 (g) + H2 (g g)
1.91 ×1019
I2 (g) + H2 (g g)
8.67 ×102
表2 25 ℃ 时,生成卤化氢反应的平衡常数
分析与思考
高中化学
化学方程式
平衡常数 ( K )
F2 (g) + H2 (g g)
6.5 ×1095
Cl2 (g) + H2 (g g)
2.57 ×1033
Br2 (g) + H2 (g g)
1.91 ×1019
I2 (g) + H2 (g g)
8.67 ×102
平衡常数的大小,与反应中物质的性质有关
表2 25 ℃ 时,生成卤化氢反应的平衡常数
分析与思考
高中化学
1.影响化学平衡常数的因素
内因:反应中物质的性质
外因:对于同一可逆反应,化学平衡常数
只与温度有关
高中化学
三.化学平衡常数的应用
结合平衡常数的表达式思考,K 的大小表示 什么含义?
mA(g) + nB(g) 、 p C(g) + q D(g)
cp (C) cq (D)
cm(A) cn(B)
想一想
K =
高中化学
结合平衡常数的表达式思考,K 的大小表示 什么含义?
mA(g) + nB(g) 、 p C(g) + q D(g)
cp (C) cq (D)
cm(A) cn(B)
对于同类型的反应,K 越大,反应进行的程度越大
想一想
K =
高中化学
对于同类型的化学反应,K 越大,反应进行
的程度越大,一般:
K ≥ 105 ,正反应进行得基本完全
2.根据平衡常数的大小,判断反应进行的程度
三.化学平衡常数的应用
高中化学
化学方程式
平衡常数 ( K )
F2 (g) + H2 (g g)
6.5 ×1095
Cl2 (g) + H2 (g g)
2.57 ×1033
Br2 (g) + H2 (g g)
1.91 ×1019
I2 (g) + H2 (g g)
8.67 ×102
表2 25 ℃ 时,生成卤化氢反应的平衡常数
高中化学
注意:化学平衡常数的大小反映的是反应进行的
程度大小,并不涉及反应时间和化学反应速率。也就 是说,某个化学反应的平衡常数很大,可能化学反应 速率却很小。
合成氨 N2 (g) + 3H2 (g)、2NH3 (g)
常温下 K=5×108
常温下限度较大,但化学反应速率很小
高中化学
投料浓度不影响化学反应的平衡常数,仅
改变投料浓度后,平衡时物质的转化率会改变 吗?
想一想
高中化学
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(1)求该反应的平衡常数及平衡时CO的转化率。
算一算
高中化学
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(1)求该反应的平衡常数及平衡时CO的转化率。
【解】依题意可知:
起始时 c(CO) = c(H2O) = 0.01 mol ·L-1
平衡时 c(CO) = 0.005 mol ·L-1 变化量 c(CO) = 0.005 mol ·L-1
高中化学
算一算
列出三段式:
CO(g) + H2O(g)
起始浓度/(mol·L-1 ) 0.01 0.01
变化浓度/(mol·L-1 ) 0.005
平衡浓度/(mol·L-1 ) 0.005
+ H2 (g)
0
CO2 (g)
0
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005 0.005 0.005
平衡浓度/(mol·L-1 ) 0.005
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
平衡浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
高中化学
c(CO2) c(H2) 0.005 × 0.005
c(CO) c(H2O) 0.005 × 0.005
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
平衡浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
K= = =1
CO的转化率为: × 100% = 50%
高中化学
列出三段式:
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.01 0 0
变化浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
平衡浓度/(mol·L-1 ) 0.005 0.005
0.005 0.005
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(2)在上述温度下,CO的量不变,将气态H2O的投料改 为0.3 mol,达到平衡时, CO的浓度为多少?CO的转化率为 多少?
算一算
高中化学
【解】依题意可知:起始时 c(CO) = 0.01 mol ·L-1 c(H2O) = 0.03 mol ·L-1
平衡常数只与温度有关
高中化学
【解】设达到平衡状态时CO浓度的变化量为x mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 0.01-x 0.03-x x x
高中化学
【解】设达到平衡状态时CO浓度的变化量为x mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 0.01 x 0.03 x x x
K = ) .. = (0.01 . (0.03 x)= 1
x = 0.0075 平衡时CO的浓度为0.0025 mol ·L-1
高中化学
x)
x2
O)
2)
2
H
c(H
c(
O
O
(C
(C
c
c
【解】设达到平衡状态时CO浓度的变化量为x mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.03 0 0
变化浓度/(mol·L-1 ) x x x x
平衡浓度/(mol·L-1 ) 0.01-x 0.03-x x x
解得:x = 0.0075
CO的转化率为: 0 0 5m l··L-L1 × 100% =75%
高中化学
-1
l
o
o
m
1
7
0
0
0
.
序号 起始浓度/(mol·L-1)
平衡时CO 的转化率
CO(g) H2O(g) 1 0.01 0.01
50%
2 0.01 0.03
75%
CO(g) + H2O(g CO2 (g) + H2 (g)
高中化学
投料方式1 投料方式2 投料方式3
化学平衡1 化学平衡2 化学平衡3
转化率可能不同,平衡常数(K)相同
三.化学平衡常数的应用
3.根据平衡常数计算平衡时各物质的浓度及反应物
同一温度下,同一反应
的转化率
高中化学
将0.1 mol CO与0.1 mol H2O气体混合充入10 L密闭容 器中,加热到800 ℃ , 充分反应达到平衡后,测得CO的浓 度为0.005 mol ·L-1 。
(3)在上述温度下, CO的量不变,将气态H2O的投料 改为0.375 mol ,反应一段时间后测得体系中CO的浓度为 0.0025 mol·L-1 ,此时反应是否达到平衡状态?
想一想
高中化学
可通过平衡常数计算出该投料方式下平衡时CO
的浓度,将其与测量值相比。
说一说
高中化学
可将此时各物质的浓度代入平衡常数的表达式
中进行计算,若和该温度时的K相等则达到平衡。
可通过平衡常数计算出该投料方式下平衡时CO
的浓度,将其与测量值相比。
说一说
高中化学
可将此时各物质的浓度代入平衡常数的表达式
中进行计算,若和该温度时的K相等则达到平衡。
可通过平衡常数计算出该投料方式下平衡时CO
的浓度,将其与测量值相比。
说一说
高中化学
【解】起始时 c(CO)=0.01 mol ·L-1
c(H2O)=0.0375 mol ·L-1
某时刻c(CO)=0.0025 mol·L-1 ,减少了0.0075 mol ·L-1
CO(g) + H2O(g)、 CO2 (g) + H2 (g)
起始浓度/(mol·L-1 ) 0.01 0.0375 0 0
变化浓度/(mol·L-1 ) 0.0075 0.0075 0.0075 0.0075
某时刻浓度/(mol·L-1 ) 0.0025 0.03 0.0075 0.0075
高中化学
该温度下,该反应的平衡常数为1
将此刻各物质的浓度,代入平衡常数的表达式计算
c(CO2) c(H2)
c(CO) c(H2O)
0.0025 ×0.03
=0.75 < 1
(0.0075 )2
高中化学
=
该温度下,该反应的平衡常数为1
将此刻各物质的浓度,代入平衡常数的表达式计算
此时不是化学平衡状态,反应在向正反应方向
c(CO2) c(H2)
c(CO) c(H2O)
0.0025 ×0.03
=0.75 < 1
进行之中
(0.0075 )2
高中化学
=
4.利用平衡常数判断化学反应进行的方向
对于可逆反应:mA(g) + nB(g) 、 p C(g) + q D(g)
任意时刻的浓度商 Q =
达到化学平衡状态时浓度商等于该温度下的K
高中化学
三.化学平衡常数的应用
4.利用平衡常数判断化学反应进行的方向
是否平衡或平衡移动的方向,可用该时刻浓度商Q
与K 比较大小来判断。
在同一温度下:
Q = K ,处于化学平衡状态
Q < K ,向正反应方向进行 Q > K ,向逆反应方向进行
三.化学平衡常数的应用
高中化学
)
化
物
浓
时
率
应
的
衡
化
反
质
平
转
和
物
算
的
度
各
计
(K
达
量
态
数
表
定
状
常
衡
衡
平
平
学
衡
否
较
平
是
比
到
断
Q
达
判
与
可逆反应
一定条件下
只受温度影响
小结
高中化学
