高中化学 人教版(2019) 选择性必修1 1.2 反应热的计算 课件(共21张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 选择性必修1 1.2 反应热的计算 课件(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 971.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 19:49:58 | ||
图片预览







文档简介
(共21张PPT)
反应热的计算
古代火箭
黑火药
中国古代四大发明之 一
最原始的复合固体推进剂
成分: 木炭 、 硝酸钾 、 硫黄
火箭发动机 一般选用化学推进剂, 它是由燃料和氧
化剂组成的, 反应后产生高温气体用于火箭推进。
问题的提出
高中化学
如何获得火箭推进剂燃烧时的反应热呢
液体推进剂
固体推进剂
固液混合推进剂
问题的提出
高中化学
厂 C(s) +
高中化学
O2(g) CO(g)
ΔH=
难以控制反应的程度
不能直接测定反应热
有些反应热无法通过实验直接测定
反应热测定装置
实验测定
拉普拉斯
法国科学家拉瓦锡和拉普拉斯设计了 一
个简单的冰量热计, 利用被融化的冰的重量 来测定反应热。
拉瓦锡
反应热研究简史
高中化学
G.H.Hess, 1802- 1850
ΔH1 ΔH2 ΔH3
H2 SO4—→ H2 SO4 ·H2O → H2 SO4 ·2H2O —→ H2 SO4 · 3H2O
1 ΔH ↑
ΔH=ΔH1+ΔH2+ΔH3
化学家盖斯改进了拉瓦锡和拉普
拉斯的冰量热计, 从而较为准确地测 量了许多化学反应的热效应 。 通过大 量实验, 盖斯发现:
反应热研究简史
高中化学
一 个化学反应, 不管是 一 步完成的还是分几步完成
的, 其反应热是相同的。
即: 在 一 定条件下, 化学反应的反应热只与反应体
系的始态和终态有关, 而与反应进行的途径无关。
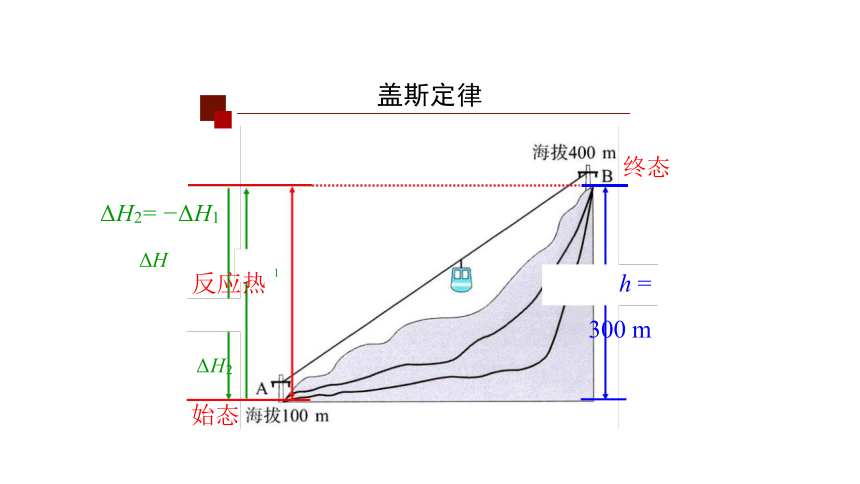
盖斯定律
高中化学
ΔH2= ΔH1
ΔH 反应热 h = 300 m
ΔH2
1
始态
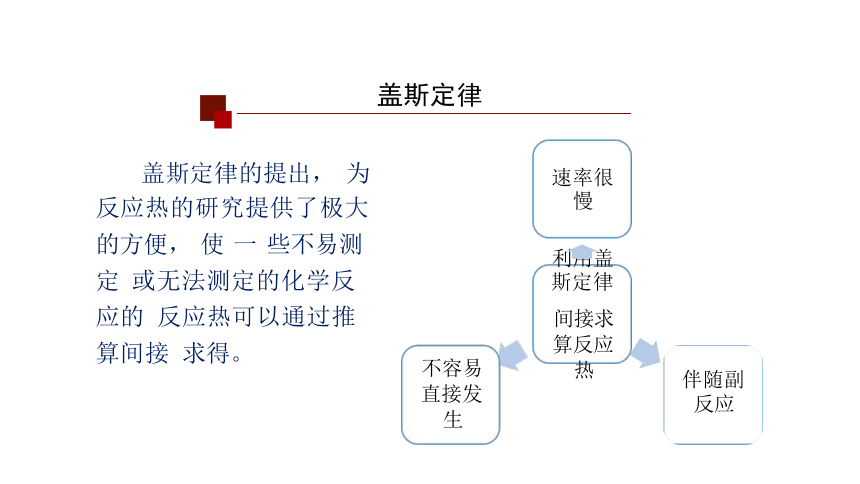
盖斯定律
高中化学
终态
盖斯定律的提出, 为
反应热的研究提供了极大 的方便, 使 一 些不易测定 或无法测定的化学反应的 反应热可以通过推算间接 求得。
不容易
直接发
生
伴随副
反应
速率很 慢
利用盖 斯定律
间接求
算反应
热
盖斯定律
高中化学
ΔH1 = ΔH2 + ΔH3
ΔH3 = ΔH1 ΔH2 = 393.5 kJ/mol ( 283.0 kJ/mol) = 110.5 kJ/mol
高中化学
思路1: 虚拟路径法
路径II CO(g) +
ΔH3=
路径I C(s) + O2(g)
ΔH1
物质
燃烧热
ΔH (kJ/mol)
C(s)
393.5
CO(g)
283.0
任务一 C(s) + O2(g) CO(g) ΔH=
CO2(g)
O2(g)
ΔH2
思路2: 代数运算法
已知 ① C(s) + O2(g) CO2(g) ΔH1= 393.5 kJ/mol
② CO(g) + O2(g) CO2(g) ΔH2= 283.0 kJ/mol
C(s) + O2(g) CO2(g) ΔH1 = 393.5 kJ/mol
+) CO2(g) CO(g) + O2(g) ΔH2 ′ = ΔH2 = +283.0 kJ/mol
任务一 C(s) + O2(g) CO(g) ΔH=
未知反应: C(s) +
高中化学
ΔH3 = ΔH1 ΔH2= 110.5 kJ/mol
O2(g) CO(g)
1
2
设计合理反应路径
核 心: 实现物质转化
求算反应热
运用盖斯定律求算反应热的一般思路:
未知反应 已知反应
高中化学
“ 长征三号乙 ”运载 火箭先后发射过三十 多颗北斗卫星
可进行 一 箭多星发射
是我国执行卫星发射 任务的主力火箭
高中化学
偏 二 甲肼- 四 氧 化二氮推进剂
液氢- 液氧推进剂
长征三号乙布局结构
【资料】 火箭推进剂用偏 二 甲肼(C2 H8N2, l ) 作燃料 , N2O4( l)作氧化剂时, 反应生成CO2 、N2 和水蒸气 。 已知:
① C2H8N2(l) + 4NO2(g) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
② 2NO2(g) N2O4(l) ΔH2
C2H8N2(l) + 2N2O4(l) 2CO2(g) + 3N2(g) + 4H2O (g)
高中化学
任务二 写出偏二甲肼- 四氧化二氮推进剂
燃烧的热化学方程式。
C2H8N2(l) + 2N2O4(l) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH=ΔH1 2ΔH2
C2H8N2(l) + 2N2O4(l) ΔH= 2CO2(g) + 3N2(g) + 4H2O (g)
2×ΔH2 ΔH1 ΔH1= 2ΔH2 + ΔH
C2H8N2(l) + 4NO2(g)
高中化学
任务二 写出偏二甲肼- 四氧化二氮推进剂
燃烧的热化学方程式。
2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
ΔH2
① C2H8N2(l) + 4NO2(g)
② 2NO2(g) N2O4(l)
C2H8N2(l) + 2N2O4(l) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH=ΔH1 2ΔH2
运用盖斯定律计算反应热
高中化学
C2H8N2(l) + 4NO2(g) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
+) 2N2O4(l) 4NO2(g) 2ΔH2
写出偏二甲肼- 四氧化二氮推进剂
燃烧的热化学方程式。
2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
ΔH2
① C2H8N2(l) + 4NO2(g)
② 2NO2(g) N2O4(l)
任务二
任务三 H2(g)的燃烧热ΔH= 285.8 kJ/mol ,要计算 液氢-液氧推进剂反应生成气态水的热效应,
还需哪些变化过程的ΔH
路径I
未知反应 H2(l) + O2(l) ΔH1= H2O (g)
物态 物态
已知反应 H2(g) + O2(g) ΔH2 H2O (l)
基于能量利用需 求设计转化路径
ΔH3 ΔH4
需要液氢 、 液氧和 水气化的热效应
变化 变化
高中化学
路径II
已知: H2(l) H2(g)
O2(l) O2(g)
H2O (l) H2O (g)
ΔH= + 0.92 kJ/mol ΔH= + 6.84 kJ/mol ΔH= + 44.0 kJ/mol
285.8 kJ/mol
H2(g) + O2(g)
H2(l) + O2(l)
2
= 237.46 kJ/mol
ΔH1= (+0.92+6.84×1
ΔH1 = ΔH3 +ΔH2 +ΔH4
285.8+44.0) kJ/mol
H2O (l)
H2O (g)
ΔH1=
高中化学
活动1
ΔH3
ΔH2
ΔH4
根据热化学方程 式计算反应热
活动2 火箭荷载的绝大部分质量来自于推进剂, 产生同
样推力所需要的推进剂质量越小, 火箭的荷载就越低。
计算每克液氢- 液氧推进剂恰好完全反应释放的热量。
H2(l) + O2(l) H2O(g) ΔH = 237.46 kJ/mol
1 mol×2 g/mol + 0.5 mol×32g/mol = 18 g
∴每克推进剂恰好完全反应放出热量 = 13. 19 kJ/g
高中化学
液氢- 液氧 偏 二 甲肼- 四 氧化二氮 煤油- 液氧
甲烷- 液氧
优点 环境友好 高能无毒 来源广泛 常温燃料 运输简单 耐冲击 、 耐摩擦 成本低廉 无毒无害
无毒无害
不易结焦积碳
缺点 价格较高 低温贮存较难 燃料占空间大 有毒性 有腐蚀性 污染环境 液氧需低温贮存 燃烧易结焦积碳
脱硫成本高
低温贮存
燃料占空间大
常见火箭推进剂
高中化学
如何获得火箭推进剂燃烧时的反应热
高中化学
反应热的计算
古代火箭
黑火药
中国古代四大发明之 一
最原始的复合固体推进剂
成分: 木炭 、 硝酸钾 、 硫黄
火箭发动机 一般选用化学推进剂, 它是由燃料和氧
化剂组成的, 反应后产生高温气体用于火箭推进。
问题的提出
高中化学
如何获得火箭推进剂燃烧时的反应热呢
液体推进剂
固体推进剂
固液混合推进剂
问题的提出
高中化学
厂 C(s) +
高中化学
O2(g) CO(g)
ΔH=
难以控制反应的程度
不能直接测定反应热
有些反应热无法通过实验直接测定
反应热测定装置
实验测定
拉普拉斯
法国科学家拉瓦锡和拉普拉斯设计了 一
个简单的冰量热计, 利用被融化的冰的重量 来测定反应热。
拉瓦锡
反应热研究简史
高中化学
G.H.Hess, 1802- 1850
ΔH1 ΔH2 ΔH3
H2 SO4—→ H2 SO4 ·H2O → H2 SO4 ·2H2O —→ H2 SO4 · 3H2O
1 ΔH ↑
ΔH=ΔH1+ΔH2+ΔH3
化学家盖斯改进了拉瓦锡和拉普
拉斯的冰量热计, 从而较为准确地测 量了许多化学反应的热效应 。 通过大 量实验, 盖斯发现:
反应热研究简史
高中化学
一 个化学反应, 不管是 一 步完成的还是分几步完成
的, 其反应热是相同的。
即: 在 一 定条件下, 化学反应的反应热只与反应体
系的始态和终态有关, 而与反应进行的途径无关。
盖斯定律
高中化学
ΔH2= ΔH1
ΔH 反应热 h = 300 m
ΔH2
1
始态
盖斯定律
高中化学
终态
盖斯定律的提出, 为
反应热的研究提供了极大 的方便, 使 一 些不易测定 或无法测定的化学反应的 反应热可以通过推算间接 求得。
不容易
直接发
生
伴随副
反应
速率很 慢
利用盖 斯定律
间接求
算反应
热
盖斯定律
高中化学
ΔH1 = ΔH2 + ΔH3
ΔH3 = ΔH1 ΔH2 = 393.5 kJ/mol ( 283.0 kJ/mol) = 110.5 kJ/mol
高中化学
思路1: 虚拟路径法
路径II CO(g) +
ΔH3=
路径I C(s) + O2(g)
ΔH1
物质
燃烧热
ΔH (kJ/mol)
C(s)
393.5
CO(g)
283.0
任务一 C(s) + O2(g) CO(g) ΔH=
CO2(g)
O2(g)
ΔH2
思路2: 代数运算法
已知 ① C(s) + O2(g) CO2(g) ΔH1= 393.5 kJ/mol
② CO(g) + O2(g) CO2(g) ΔH2= 283.0 kJ/mol
C(s) + O2(g) CO2(g) ΔH1 = 393.5 kJ/mol
+) CO2(g) CO(g) + O2(g) ΔH2 ′ = ΔH2 = +283.0 kJ/mol
任务一 C(s) + O2(g) CO(g) ΔH=
未知反应: C(s) +
高中化学
ΔH3 = ΔH1 ΔH2= 110.5 kJ/mol
O2(g) CO(g)
1
2
设计合理反应路径
核 心: 实现物质转化
求算反应热
运用盖斯定律求算反应热的一般思路:
未知反应 已知反应
高中化学
“ 长征三号乙 ”运载 火箭先后发射过三十 多颗北斗卫星
可进行 一 箭多星发射
是我国执行卫星发射 任务的主力火箭
高中化学
偏 二 甲肼- 四 氧 化二氮推进剂
液氢- 液氧推进剂
长征三号乙布局结构
【资料】 火箭推进剂用偏 二 甲肼(C2 H8N2, l ) 作燃料 , N2O4( l)作氧化剂时, 反应生成CO2 、N2 和水蒸气 。 已知:
① C2H8N2(l) + 4NO2(g) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
② 2NO2(g) N2O4(l) ΔH2
C2H8N2(l) + 2N2O4(l) 2CO2(g) + 3N2(g) + 4H2O (g)
高中化学
任务二 写出偏二甲肼- 四氧化二氮推进剂
燃烧的热化学方程式。
C2H8N2(l) + 2N2O4(l) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH=ΔH1 2ΔH2
C2H8N2(l) + 2N2O4(l) ΔH= 2CO2(g) + 3N2(g) + 4H2O (g)
2×ΔH2 ΔH1 ΔH1= 2ΔH2 + ΔH
C2H8N2(l) + 4NO2(g)
高中化学
任务二 写出偏二甲肼- 四氧化二氮推进剂
燃烧的热化学方程式。
2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
ΔH2
① C2H8N2(l) + 4NO2(g)
② 2NO2(g) N2O4(l)
C2H8N2(l) + 2N2O4(l) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH=ΔH1 2ΔH2
运用盖斯定律计算反应热
高中化学
C2H8N2(l) + 4NO2(g) 2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
+) 2N2O4(l) 4NO2(g) 2ΔH2
写出偏二甲肼- 四氧化二氮推进剂
燃烧的热化学方程式。
2CO2(g) + 3N2(g) + 4H2O (g) ΔH1
ΔH2
① C2H8N2(l) + 4NO2(g)
② 2NO2(g) N2O4(l)
任务二
任务三 H2(g)的燃烧热ΔH= 285.8 kJ/mol ,要计算 液氢-液氧推进剂反应生成气态水的热效应,
还需哪些变化过程的ΔH
路径I
未知反应 H2(l) + O2(l) ΔH1= H2O (g)
物态 物态
已知反应 H2(g) + O2(g) ΔH2 H2O (l)
基于能量利用需 求设计转化路径
ΔH3 ΔH4
需要液氢 、 液氧和 水气化的热效应
变化 变化
高中化学
路径II
已知: H2(l) H2(g)
O2(l) O2(g)
H2O (l) H2O (g)
ΔH= + 0.92 kJ/mol ΔH= + 6.84 kJ/mol ΔH= + 44.0 kJ/mol
285.8 kJ/mol
H2(g) + O2(g)
H2(l) + O2(l)
2
= 237.46 kJ/mol
ΔH1= (+0.92+6.84×1
ΔH1 = ΔH3 +ΔH2 +ΔH4
285.8+44.0) kJ/mol
H2O (l)
H2O (g)
ΔH1=
高中化学
活动1
ΔH3
ΔH2
ΔH4
根据热化学方程 式计算反应热
活动2 火箭荷载的绝大部分质量来自于推进剂, 产生同
样推力所需要的推进剂质量越小, 火箭的荷载就越低。
计算每克液氢- 液氧推进剂恰好完全反应释放的热量。
H2(l) + O2(l) H2O(g) ΔH = 237.46 kJ/mol
1 mol×2 g/mol + 0.5 mol×32g/mol = 18 g
∴每克推进剂恰好完全反应放出热量 = 13. 19 kJ/g
高中化学
液氢- 液氧 偏 二 甲肼- 四 氧化二氮 煤油- 液氧
甲烷- 液氧
优点 环境友好 高能无毒 来源广泛 常温燃料 运输简单 耐冲击 、 耐摩擦 成本低廉 无毒无害
无毒无害
不易结焦积碳
缺点 价格较高 低温贮存较难 燃料占空间大 有毒性 有腐蚀性 污染环境 液氧需低温贮存 燃烧易结焦积碳
脱硫成本高
低温贮存
燃料占空间大
常见火箭推进剂
高中化学
如何获得火箭推进剂燃烧时的反应热
高中化学
