高中化学 人教版(2019) 选择性必修1 1.1 反应热 课件(共29张PPT)
文档属性
| 名称 | 高中化学 人教版(2019) 选择性必修1 1.1 反应热 课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 781.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 19:51:10 | ||
图片预览





文档简介
(共29张PPT)
反应热(第二课时)
高中化学
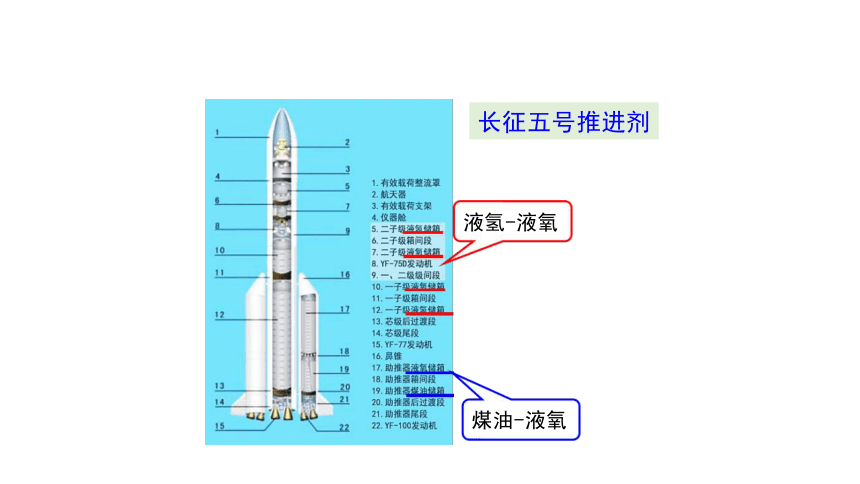
煤油-液氧
液氢-液氧
长征五号推进剂
高中化学
问题1:如何用化学用语来表示化学反应
中吸收或者释放的热量呢 1 mol液态H2和 mol液态O2反应生成 1mol气态H2O放
出237.5 kJ的热量。
热化学方程式:
表明反应所释放或吸收的热量的化学方程式。
高中化学
H2 (l) + O2 (l) H2O(g) H=-237.5 kJ/mol
H H2 =+241.8 kJ/mol
符号
H2O(g) H2 (g) + O2 (g) H2 =+241.8 kJ/mol
高中化学
H2 (g) + O2 (g) H2O(g) H2 (g)+ O2 (g)
思考:热化学方程式与化学方程式书写有何不同
H2O(g) ( 吸收+、释放- )
H1 =-241.8 kJ/mol
H1 =- 241.8 kJ/mol
物质变化
能量变化
H2 (g) + O2 (g) H2O(g)
H2 (g) + O2 (g) H2O(l)
, 反应热一样吗
H1 =-241.8 kJ/mol
H2 =
等质量水的焓:
H2O(s)< H2O(l)< H2O(g)
思考:如果生成的是H2O(l)
高中化学
思考:如果生成的是H2O(l) ,反应热一样吗
H2 (g) + O2 (g) H2O(g) H1 =-241.8 kJ/mol
ΔH2 =-285.8 kJ/mol
O2 (g) H2O(l)
(g)+ O2 (g)
H2 =-285.8 kJ/mol
ΔH1 =-241.8 kJ/mol
H2 (g) +
高中化学
1 2
H2
H2O(l)
H2O(g)
H
H2 (g) + O2 (g) H2O(g)
H2 (g) + O2 (g) H2O(l)
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
, 反应热一样吗
H1 =-241.8 kJ/mol
思考:如果生成的是H2O(l)
H2 =-285.8 kJ/mol
高中化学
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
例:常温下,1 L 1 mol/L HC l和 1 L 1 mol/L
NaOH溶液恰好完全反应放出57.3 kJ的热量。
HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)
H=-57.3 kJ/mol
高中化学
H2 (g) + O2 (g) H2O(g)
H2 (g) + O2 (g) H2O(l)
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
, 反应热一样吗
ΔH1 =-241.8 kJ/mol
思考:如果生成的是H2O(l)
ΔH2 =-285.8 kJ/mol
高中化学
思考:如果H2与O2消耗量增倍,反应热ΔH 一样吗
H2 (g) + O2 (g) H2O(g) H1 =-241.8 kJ/mol 2H2 (g) + O2 (g) 2H2O(l) H2 =-483.6 kJ/mol
注意: 1.化学计量数不表示分子数,仅表示物质的量
(可以是整数,也可以是分数)
2. H 数值与化学计量数相对应
高中化学
比一比:书写热化学方程式还需要注意什么
H2 (g) + I2 (g) k 2HI(g) H=-14.9 kJ/mol
H2 (g) + I2 (g) 1 k 2HI(g) H=-9.48 kJ/mol
注意:若为25 oC、101 kPa时可省略,其他温
度和压强必须注明。
高中化学
a
C
P
o
01
25
a
C
P
o
101
100
H2 (g) + O2 (g) H2O(g) H=-241.8 kJ/mol
问题: ΔH 中的单位mol-1代表什么含义?
阅读
教材
P9
高中化学
固体(s)
气体(g)一— / 放热 -
溶液(aq) 热化学 数值 与化学计量
(整数、分数均可) 条件 kJ/mol
温度 压强
液体(l) 状态 符号 吸热 +
表示物质的量 量数 单位
任务:用结构图梳理书写热化学方程式的注意事项
化学计 方程式 数相对应
与焓变数值对应 /
高中化学
家用燃料的变迁
高中化学
(1)25 ℃ 、101 kPa下,8 g CH4完全燃烧,放出
445.0 kJ热量;
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2 (g)中燃烧,生成CO2 (g)和H2O(l),
放出2219.9 kJ热量;
(3)煤气的主要成分为CO和H2 ,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
高中化学
练一练:写出下列反应的热化学方程式
445.0 kJ热量;
CH4 (g) + O2 (g) CO2 (g) + H2O(l)
H=-445.0 kJ/mol
CH4 (g) + 2O2 (g) CO2 (g) + 2H2O(l)
H=-890 kJ/mol
(1)25 ℃ 、101 kPa下,8 g CH4完全燃烧,放出
查一查:你写对了吗
高中化学
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2 (g)中燃烧,生成CO2 (g)和H2O(l),
放出2219.9 kJ热量;
C3H8 (g) + 5O2 (g) 3CO2 (g) + 4H2O(l)
H=-2219.9 kJ/mol
查一查:你写对了吗
高中化学
(3)煤气的主要成分为CO和H2 ,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
CO(g) + - O2 (g) CO2 (g) H=-283 kJ/mol
2CO(g) + O2 (g) 2CO2 (g) H=-566 kJ/mol
2
1
查一查:你写对了吗
高中化学
练一练:CH4可做火箭推进剂的燃料。常温下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下 列热化学方程式中正确的是 C
A. 2CH4 (g) + 4O2 (g) 2CO2 (g) + 4H2O(l) H= ﹢890 kJ/mol
H=-1780 kJ/mol
B . CH4 + 2O2 CO2 + 2H2O H=-890 kJ/mol
标物质状态
C . CH4 (g) + 2O2 (g) CO2 (g) + 2H2O(l) H=-890 kJ/mol
D . CH4 (g) + O2 (g) CO2 (g) + H2O(l) H=-890 kJ/mol
H=-445 kJ/mol
高中化学
2
N2H4 (g) + O2 (g) N2 (g) + 2H2O(g)
H=-534 kJ/mol
练一练:肼( H2N-NH2 )是一种火箭推进剂的燃料, 有关化学反应的能量变化如下图所示,写出表示肼燃烧
H1 =-534 kJ/mol
的热化学方程式。 能量
反应物 总能量
生成物 总能量
N2 (g) + 2H2O(g)
N2H4 (g) + O2 (g)
高中化学
定义:101 kPa时,1 mol纯物质完全燃烧生成 指定产物时所放出的热量,叫做该物质 的燃烧热,单位为kJ/mol。
燃烧热
高中化学
定义:101 kPa时,1 mol纯物质完全燃烧生成 指定产物时所放出的热量,叫做该物质 的燃烧热,单位为kJ/mol。
注意:碳元素变为CO2 (g) 、氢元素变为H2O(l)、硫 元素变为SO2 (g)、氮元素变为N2 (g)等 。
CO(g) + - O2 (g) CO2 (g) H=-283 kJ/mol
2CO(g) + O2 (g) 2CO2 (g) H=-566 kJ/mol
高中化学
2
1
燃烧热
测定原理:将待测物质放在一个 充满氧气的密封金属容器(称为 氧弹)内,再将此容器置于盛有 一定量水的量热计内筒中,通过 点火装置使氧弹中物质燃烧,反 应放出的热量会使氧弹外面的水 温升高。用温度计测量水温的变 化,即可计算出此反应放出的热 量。
燃烧热的测量
高中化学
ΔH/kJ/mol
- 393.5
- 395.0
- 285.8
- 283.0
H2 (g) + O2 (g) H2O(l) H=-285.8 kJ/mol
甲醇 CH3OH(l) - 726.51 苯 C6H6 (l) - 3267.5
化学式
C(s)
C(s)
H2 (g)
CO(g)
名称
石墨
金刚石
氢气
一氧化碳
ΔH/kJ/mol
- 1559.8
- 1411.0
- 1299.6
- 1366.8
化学式
C2H6 (g)
C2H4 (g)
C2H2 (g)
C2H5OH(l)
某些物质的燃烧热(25 oC,101 kPa)
名称
乙烷
乙烯
乙炔
乙醇
高中化学
某些物质的燃烧热(25 oC,101 kPa)
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) - 393.5 乙烷 C2H6 (g) - 1559.8
金刚石 C(s) - 395.0 乙烯 C2H4 (g) - 1411.0
氢气 H2 (g) - 285.8 乙炔 C2H2 (g) - 1299.6
一氧化碳 CO(g) - 283.0 乙醇 C2H5OH(l) - 1366.8
甲烷 CH4 (g) - 890.31 丙烷 C3H8 (g) - 2219.9
甲醇 CH3OH(l) - 726.51 苯 C6H6 (l) - 3267.5
高中化学
H2 (l) + O2 (l) H2O(g) H=-237.5 kJ/mol
单位质量产生热量: ≈ 13.2 kJ/g
CO(g) + O2 (g) CO2 (g) H=-283 kJ/mol
单位质量产生热量: 282 g ≈ 6.4 kJ/g
高中化学
16
kJ
g
8
火箭推进剂燃料的选择
优点:绿色、高能、推
力大
缺点:低温贮存技术难
度大;液氢密度小,燃 料箱体积大
液氢-液氧推进剂
资料
高中化学
火箭推进剂的发展主要着眼于能量高、排烟少、
污染轻三个方面。
高能推进剂是将来推进剂研究的首选;
无烟推进剂的开发、 应用更是势在必行;
污染少的推进剂将大有发展前途。
高中化学
火箭推进剂的选择
放出热量的多少
反应体系是 吸热还是放热
定量
反应体系吸收或
能量变化
热化学 方程式
质量守恒定律
能量守恒定律
物质变化
小 结
高中化学
定性
遵循
遵循
表示
反应热(第二课时)
高中化学
煤油-液氧
液氢-液氧
长征五号推进剂
高中化学
问题1:如何用化学用语来表示化学反应
中吸收或者释放的热量呢 1 mol液态H2和 mol液态O2反应生成 1mol气态H2O放
出237.5 kJ的热量。
热化学方程式:
表明反应所释放或吸收的热量的化学方程式。
高中化学
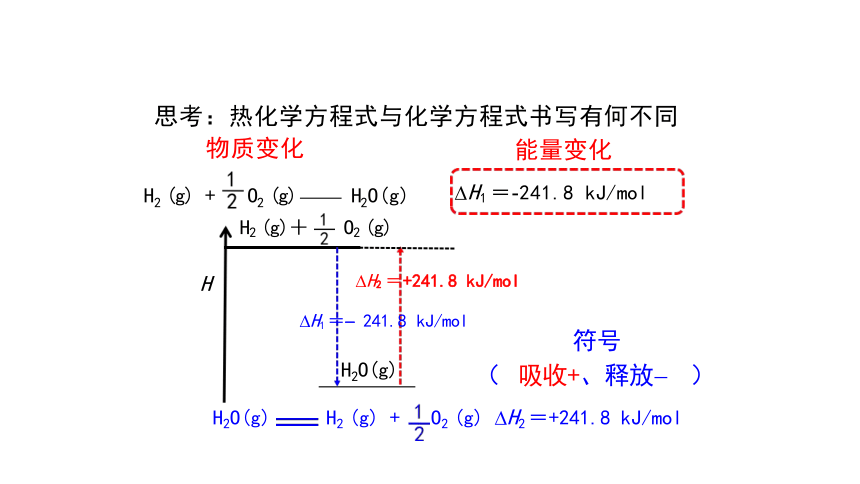
H2 (l) + O2 (l) H2O(g) H=-237.5 kJ/mol
H H2 =+241.8 kJ/mol
符号
H2O(g) H2 (g) + O2 (g) H2 =+241.8 kJ/mol
高中化学
H2 (g) + O2 (g) H2O(g) H2 (g)+ O2 (g)
思考:热化学方程式与化学方程式书写有何不同
H2O(g) ( 吸收+、释放- )
H1 =-241.8 kJ/mol
H1 =- 241.8 kJ/mol
物质变化
能量变化
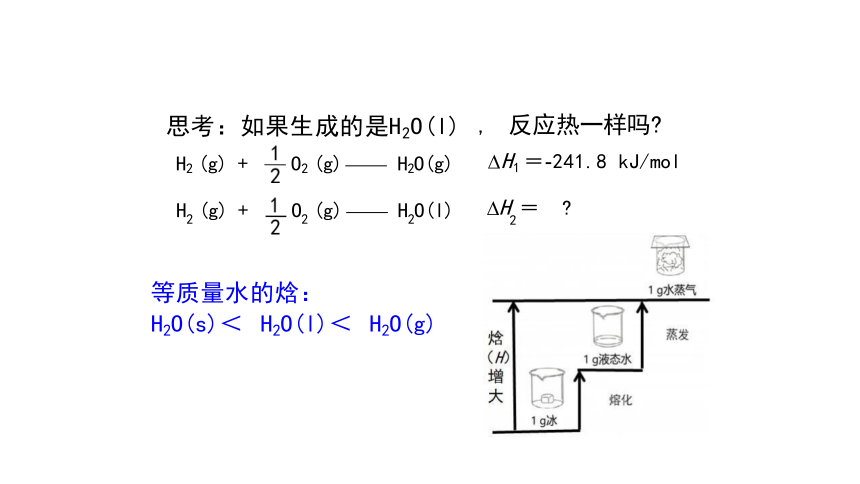
H2 (g) + O2 (g) H2O(g)
H2 (g) + O2 (g) H2O(l)
, 反应热一样吗
H1 =-241.8 kJ/mol
H2 =
等质量水的焓:
H2O(s)< H2O(l)< H2O(g)
思考:如果生成的是H2O(l)
高中化学
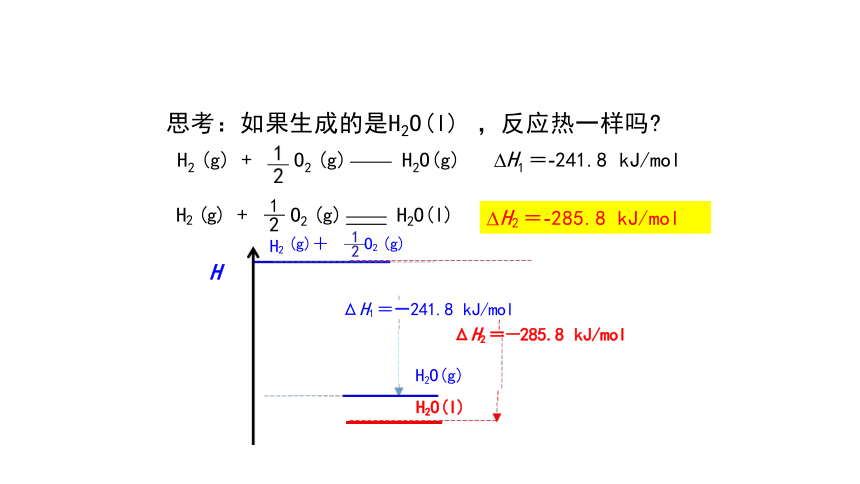
思考:如果生成的是H2O(l) ,反应热一样吗
H2 (g) + O2 (g) H2O(g) H1 =-241.8 kJ/mol
ΔH2 =-285.8 kJ/mol
O2 (g) H2O(l)
(g)+ O2 (g)
H2 =-285.8 kJ/mol
ΔH1 =-241.8 kJ/mol
H2 (g) +
高中化学
1 2
H2
H2O(l)
H2O(g)
H
H2 (g) + O2 (g) H2O(g)
H2 (g) + O2 (g) H2O(l)
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
, 反应热一样吗
H1 =-241.8 kJ/mol
思考:如果生成的是H2O(l)
H2 =-285.8 kJ/mol
高中化学
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
例:常温下,1 L 1 mol/L HC l和 1 L 1 mol/L
NaOH溶液恰好完全反应放出57.3 kJ的热量。
HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)
H=-57.3 kJ/mol
高中化学
H2 (g) + O2 (g) H2O(g)
H2 (g) + O2 (g) H2O(l)
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
, 反应热一样吗
ΔH1 =-241.8 kJ/mol
思考:如果生成的是H2O(l)
ΔH2 =-285.8 kJ/mol
高中化学
思考:如果H2与O2消耗量增倍,反应热ΔH 一样吗
H2 (g) + O2 (g) H2O(g) H1 =-241.8 kJ/mol 2H2 (g) + O2 (g) 2H2O(l) H2 =-483.6 kJ/mol
注意: 1.化学计量数不表示分子数,仅表示物质的量
(可以是整数,也可以是分数)
2. H 数值与化学计量数相对应
高中化学
比一比:书写热化学方程式还需要注意什么
H2 (g) + I2 (g) k 2HI(g) H=-14.9 kJ/mol
H2 (g) + I2 (g) 1 k 2HI(g) H=-9.48 kJ/mol
注意:若为25 oC、101 kPa时可省略,其他温
度和压强必须注明。
高中化学
a
C
P
o
01
25
a
C
P
o
101
100
H2 (g) + O2 (g) H2O(g) H=-241.8 kJ/mol
问题: ΔH 中的单位mol-1代表什么含义?
阅读
教材
P9
高中化学
固体(s)
气体(g)一— / 放热 -
溶液(aq) 热化学 数值 与化学计量
(整数、分数均可) 条件 kJ/mol
温度 压强
液体(l) 状态 符号 吸热 +
表示物质的量 量数 单位
任务:用结构图梳理书写热化学方程式的注意事项
化学计 方程式 数相对应
与焓变数值对应 /
高中化学
家用燃料的变迁
高中化学
(1)25 ℃ 、101 kPa下,8 g CH4完全燃烧,放出
445.0 kJ热量;
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2 (g)中燃烧,生成CO2 (g)和H2O(l),
放出2219.9 kJ热量;
(3)煤气的主要成分为CO和H2 ,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
高中化学
练一练:写出下列反应的热化学方程式
445.0 kJ热量;
CH4 (g) + O2 (g) CO2 (g) + H2O(l)
H=-445.0 kJ/mol
CH4 (g) + 2O2 (g) CO2 (g) + 2H2O(l)
H=-890 kJ/mol
(1)25 ℃ 、101 kPa下,8 g CH4完全燃烧,放出
查一查:你写对了吗
高中化学
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2 (g)中燃烧,生成CO2 (g)和H2O(l),
放出2219.9 kJ热量;
C3H8 (g) + 5O2 (g) 3CO2 (g) + 4H2O(l)
H=-2219.9 kJ/mol
查一查:你写对了吗
高中化学
(3)煤气的主要成分为CO和H2 ,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
CO(g) + - O2 (g) CO2 (g) H=-283 kJ/mol
2CO(g) + O2 (g) 2CO2 (g) H=-566 kJ/mol
2
1
查一查:你写对了吗
高中化学
练一练:CH4可做火箭推进剂的燃料。常温下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下 列热化学方程式中正确的是 C
A. 2CH4 (g) + 4O2 (g) 2CO2 (g) + 4H2O(l) H= ﹢890 kJ/mol
H=-1780 kJ/mol
B . CH4 + 2O2 CO2 + 2H2O H=-890 kJ/mol
标物质状态
C . CH4 (g) + 2O2 (g) CO2 (g) + 2H2O(l) H=-890 kJ/mol
D . CH4 (g) + O2 (g) CO2 (g) + H2O(l) H=-890 kJ/mol
H=-445 kJ/mol
高中化学
2
N2H4 (g) + O2 (g) N2 (g) + 2H2O(g)
H=-534 kJ/mol
练一练:肼( H2N-NH2 )是一种火箭推进剂的燃料, 有关化学反应的能量变化如下图所示,写出表示肼燃烧
H1 =-534 kJ/mol
的热化学方程式。 能量
反应物 总能量
生成物 总能量
N2 (g) + 2H2O(g)
N2H4 (g) + O2 (g)
高中化学
定义:101 kPa时,1 mol纯物质完全燃烧生成 指定产物时所放出的热量,叫做该物质 的燃烧热,单位为kJ/mol。
燃烧热
高中化学
定义:101 kPa时,1 mol纯物质完全燃烧生成 指定产物时所放出的热量,叫做该物质 的燃烧热,单位为kJ/mol。
注意:碳元素变为CO2 (g) 、氢元素变为H2O(l)、硫 元素变为SO2 (g)、氮元素变为N2 (g)等 。
CO(g) + - O2 (g) CO2 (g) H=-283 kJ/mol
2CO(g) + O2 (g) 2CO2 (g) H=-566 kJ/mol
高中化学
2
1
燃烧热
测定原理:将待测物质放在一个 充满氧气的密封金属容器(称为 氧弹)内,再将此容器置于盛有 一定量水的量热计内筒中,通过 点火装置使氧弹中物质燃烧,反 应放出的热量会使氧弹外面的水 温升高。用温度计测量水温的变 化,即可计算出此反应放出的热 量。
燃烧热的测量
高中化学
ΔH/kJ/mol
- 393.5
- 395.0
- 285.8
- 283.0
H2 (g) + O2 (g) H2O(l) H=-285.8 kJ/mol
甲醇 CH3OH(l) - 726.51 苯 C6H6 (l) - 3267.5
化学式
C(s)
C(s)
H2 (g)
CO(g)
名称
石墨
金刚石
氢气
一氧化碳
ΔH/kJ/mol
- 1559.8
- 1411.0
- 1299.6
- 1366.8
化学式
C2H6 (g)
C2H4 (g)
C2H2 (g)
C2H5OH(l)
某些物质的燃烧热(25 oC,101 kPa)
名称
乙烷
乙烯
乙炔
乙醇
高中化学
某些物质的燃烧热(25 oC,101 kPa)
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) - 393.5 乙烷 C2H6 (g) - 1559.8
金刚石 C(s) - 395.0 乙烯 C2H4 (g) - 1411.0
氢气 H2 (g) - 285.8 乙炔 C2H2 (g) - 1299.6
一氧化碳 CO(g) - 283.0 乙醇 C2H5OH(l) - 1366.8
甲烷 CH4 (g) - 890.31 丙烷 C3H8 (g) - 2219.9
甲醇 CH3OH(l) - 726.51 苯 C6H6 (l) - 3267.5
高中化学
H2 (l) + O2 (l) H2O(g) H=-237.5 kJ/mol
单位质量产生热量: ≈ 13.2 kJ/g
CO(g) + O2 (g) CO2 (g) H=-283 kJ/mol
单位质量产生热量: 282 g ≈ 6.4 kJ/g
高中化学
16
kJ
g
8
火箭推进剂燃料的选择
优点:绿色、高能、推
力大
缺点:低温贮存技术难
度大;液氢密度小,燃 料箱体积大
液氢-液氧推进剂
资料
高中化学
火箭推进剂的发展主要着眼于能量高、排烟少、
污染轻三个方面。
高能推进剂是将来推进剂研究的首选;
无烟推进剂的开发、 应用更是势在必行;
污染少的推进剂将大有发展前途。
高中化学
火箭推进剂的选择
放出热量的多少
反应体系是 吸热还是放热
定量
反应体系吸收或
能量变化
热化学 方程式
质量守恒定律
能量守恒定律
物质变化
小 结
高中化学
定性
遵循
遵循
表示
