化学人教版(2019)选择性必修3 2.2.2炔烃(共25张)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2.2炔烃(共25张) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 22:36:38 | ||
图片预览




文档简介
(共25张PPT)
人教版 选择性必修3
第二章 第二节 第2课时
《炔烃》
氧炔焰
乙炔在氧气中燃烧时放出大量的热,氧炔焰温度可达到3000℃以上。因此,常用它来焊接或切割金属。
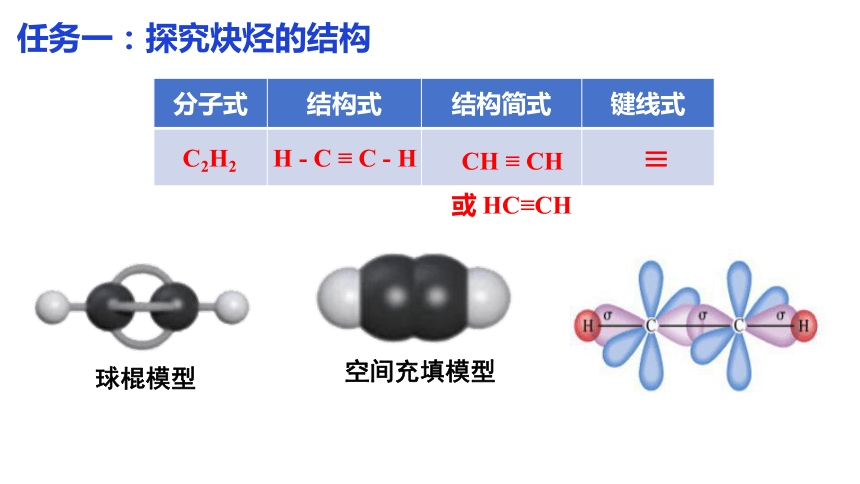
分子式 结构式 结构简式 键线式
C2H2
H - C ≡ C - H
CH ≡ CH
≡
任务一:探究炔烃的结构
球棍模型
空间充填模型
或 HC≡CH
任务一:探究炔烃的结构
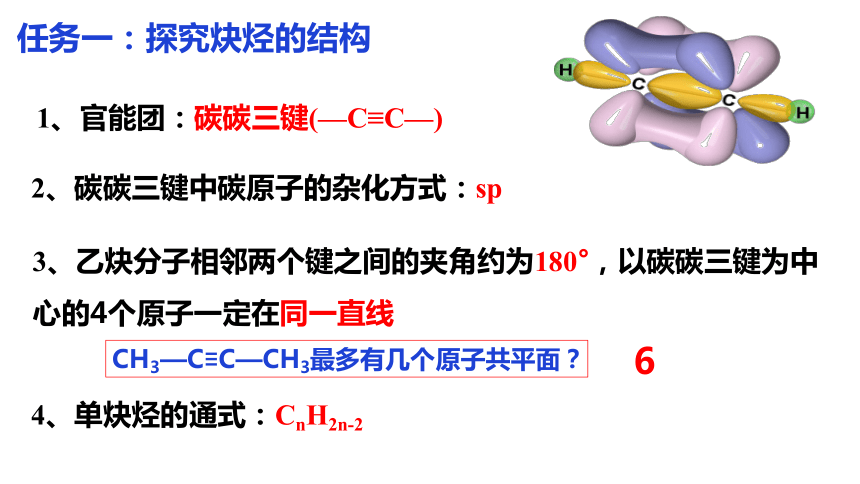
1、官能团:碳碳三键(—C≡C—)
2、碳碳三键中碳原子的杂化方式:sp
3、乙炔分子相邻两个键之间的夹角约为180°,以碳碳三键为中心的4个原子一定在同一直线
4、单炔烃的通式:CnH2n-2
CH3—C≡C—CH3最多有几个原子共平面?
6
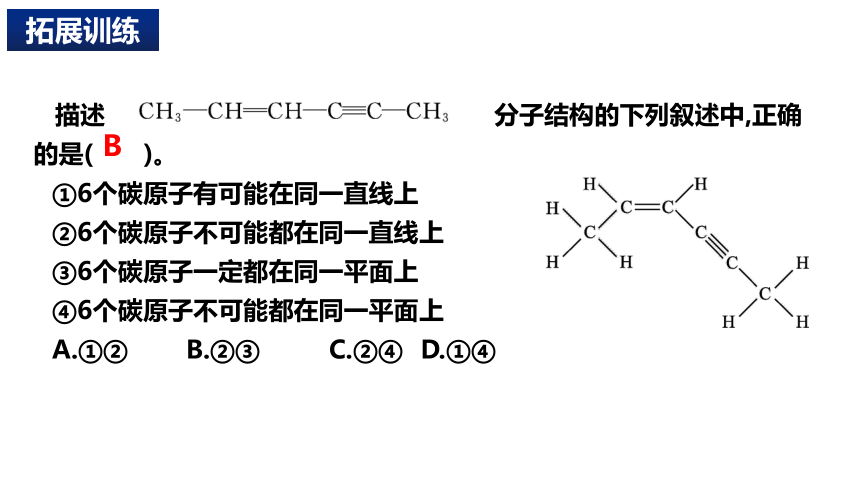
描述 分子结构的下列叙述中,正确的是( )。
①6个碳原子有可能在同一直线上
②6个碳原子不可能都在同一直线上
③6个碳原子一定都在同一平面上
④6个碳原子不可能都在同一平面上
A.①② B.②③ C.②④ D.①④
拓展训练
B
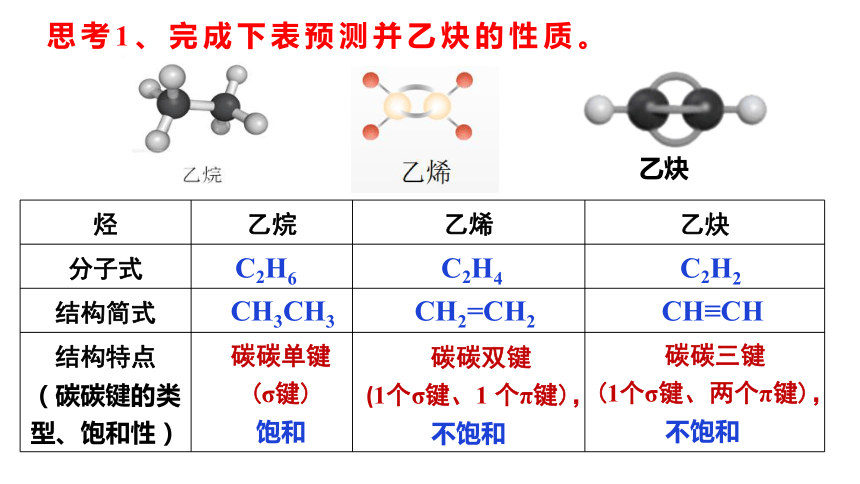
思考1、完成下表预测并乙炔的性质。
烃 乙烷 乙烯 乙炔
分子式
结构简式
结构特点 (碳碳键的类型、饱和性)
C2H6 C2H4 C2H2
CH3CH3 CH2=CH2 CH≡CH
碳碳单键
(σ键)
饱和
碳碳双键
(1个σ键、1 个π键),
不饱和
碳碳三键
(1个σ键、两个π键),
不饱和
乙炔
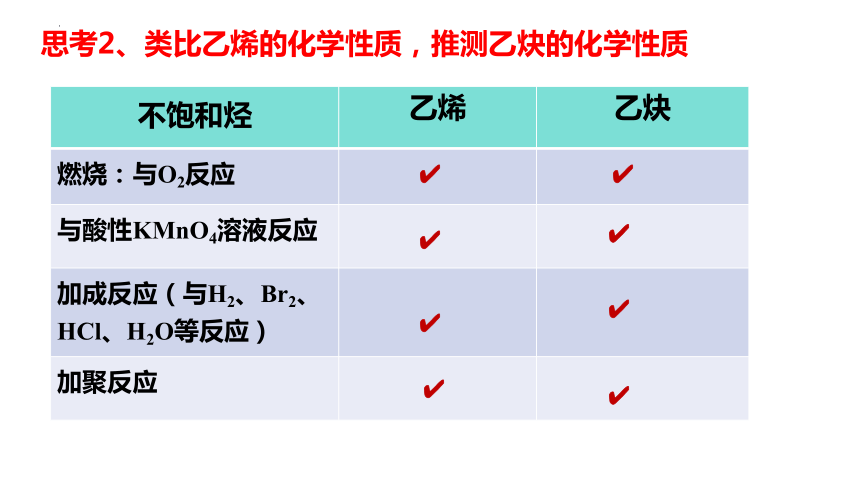
思考2、类比乙烯的化学性质,推测乙炔的化学性质
不饱和烃 乙烯 乙炔
燃烧:与O2反应
与酸性KMnO4溶液反应
加成反应(与H2、Br2、HCl、H2O等反应)
加聚反应
任务二:炔烃的性质
一、物理性质
乙炔俗称电石气,无色、无味气体,密度比空气小,微溶于水,易溶于有机溶剂
炔烃物理性质的递变也与烯烃类似。
二、化学性质
1、乙炔的氧化反应
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
现象:火焰明亮,并伴有浓烟
甲烷
乙烯
乙炔
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象有所不同,可用于三者鉴别
二、化学性质
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2 → 2MnSO4+ K2SO4+2CO2↑+ 4H2O
1、乙炔的氧化反应
二、化学性质
2、加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
1 , 2 —二溴乙烯
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
二、化学性质
2、加成反应
与H2加成生成乙烯
与HCl加成生成氯乙烯
与H2O加成生成乙醛
[注] 乙炔与水加成后的产物乙烯醇
(CH2=CH—OH)不稳定,很快转化为乙醛。
二、化学性质
3、加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
导电塑料——聚乙炔
聚乙炔可用于制备导电高分子材料。经溴或碘掺杂之后导电性会提高到金属水平。白川英树、艾伦·黑格和艾伦·麦克迪尔米德因“发现和发展导电聚合物”获得了2000年的诺贝尔化学奖。
如今聚乙炔已用于制备太阳能电池、半导体材料和电活性聚合物等。
图片来自网络
氧化反应
加成反应
加聚反应
①可燃性
②被强氧化剂氧化:使酸性KMnO4溶液紫红色褪去
①与卤素单质或其溶液(足量)→卤代烃:
②与HX→卤代烃:
③与H2→烷烃:
④与H2O→醛:
炔烃化学性质
炔烃的结构和性质与乙炔的相似
OH
H
CH=CH
烯醇式
CH3CHO
不稳定
分子重组
聚乙炔
→制备导电高分子材料
催化剂
+ 2H2
CH3-CH3
CH≡CH
CH≡CH + HCl 催化剂
CH2=CHCl
CH≡CH + H2O
催化剂
nCH ≡ CH [ CH=CH ]n
催化剂
任务三:乙炔的制备
三、实验室制备
1、反应原理:
CaC2 + 2H2O CH≡CH↑ + Ca(OH)2
(电石)
+ Ca(OH)2
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H↑
固体 +液体 气体
2、实验装置
乙炔的实验室制法
1.反应原理:
CaC2 + 2H2O CH≡CH↑ + Ca(OH)2
(电石)
【练一练】CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的有机产物:
A.ZnC2水解生成 ( ) B.Li2C2水解生成( )
C.Mg2C3水解生成( ) D.Al4C3水解生成( )
C2H2
CH4
C3H4
C2H2
ZnC2 + 2H2O CH≡CH↑ + Zn(OH)2
②用分液漏斗控制水流速率,让食盐水逐滴慢慢滴入。
④因电石中含有P、S等元素,与水反应会生成PH3、H2S等杂质会干扰乙炔的性质检验,常用CuSO4将其除去。
③电石与水剧烈反应会产生大量泡沫,易堵塞管口,应在导气管附近塞入少量棉花。
①电石与水反应剧烈,为了减缓反应速率,用饱和食盐水代替水。
不可用启普发生器
三、实验室制备
思考与交流
问题1. 制取乙炔时能否使用启普发生器?
①反应剧烈,难控制
③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
②反应放热,易使启普发生器炸裂。
实验内容 实验现象
(1)将饱和氯化钠溶液滴入 盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有 酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有 溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,产生大量气泡
火焰明亮,并伴有黑烟
酸性高锰酸钾溶液紫红色褪去
溴的四氯化碳溶液橙红色褪去
氧化反应
加成反应
氧化反应
(1)请写出戊炔的所有属于炔烃的同分异构体的结构简式,并对其命名。
CH≡C-CH2-CH2-CH3
CH3-C≡C-CH2-CH3
CH≡C-CH-CH3
1 2 3 4 5
1 2 3 4 5
P40 - 思考与讨论
1 戊炔
2 戊炔
CH3
3-甲基-1-丁炔
1 2 3 4
(2)请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
CH3-CH2-CH2-CH3
CH≡C-CH2-CH3 + 2H2
催化剂
△
(3)某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
CH3-CH-CH2-CH2-CH3
CH3
2-甲基戊烷
CH3-CH-C≡C-CH3
CH3-CH-CH2-C≡CH
CH3
CH3
图1.氧炔焰切割金属
图3.腈纶线
图4.氯丁橡胶、氯丁橡胶手套
图2.聚氯乙烯产品—PVC管、薄膜
任务四:炔烃的用途
20世纪40年代美国杜邦公司研制了一种合成纤维——聚丙烯腈(腈纶,又称人造毛)。它是乙炔先与氰化氢(HCN)反应生成丙烯腈,然后再进行聚合而合成的。请写出上述过程涉及到的化学反应方程式。
CH2=CHCN
CH CH + HCN
催化剂
nCH2=CH
CN
催化剂
CH2 CH
CN
n
腈纶线
乙炔的应用
①
②
【课堂达标】
1.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
A
【课堂达标】
2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是 ( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
D
3、某炔烃与氢气发生加成反应后得到,则该炔烃的结构有( )
A.1种 B.2种 C. 3种 D.4种
B
【课堂达标】
4.下列物质中,不可能是炔烃的加成产物的是( )
A.乙烷 B.2,3-二甲基戊烷
C.异戊烷 D.异丁烷
D
人教版 选择性必修3
第二章 第二节 第2课时
《炔烃》
氧炔焰
乙炔在氧气中燃烧时放出大量的热,氧炔焰温度可达到3000℃以上。因此,常用它来焊接或切割金属。
分子式 结构式 结构简式 键线式
C2H2
H - C ≡ C - H
CH ≡ CH
≡
任务一:探究炔烃的结构
球棍模型
空间充填模型
或 HC≡CH
任务一:探究炔烃的结构
1、官能团:碳碳三键(—C≡C—)
2、碳碳三键中碳原子的杂化方式:sp
3、乙炔分子相邻两个键之间的夹角约为180°,以碳碳三键为中心的4个原子一定在同一直线
4、单炔烃的通式:CnH2n-2
CH3—C≡C—CH3最多有几个原子共平面?
6
描述 分子结构的下列叙述中,正确的是( )。
①6个碳原子有可能在同一直线上
②6个碳原子不可能都在同一直线上
③6个碳原子一定都在同一平面上
④6个碳原子不可能都在同一平面上
A.①② B.②③ C.②④ D.①④
拓展训练
B
思考1、完成下表预测并乙炔的性质。
烃 乙烷 乙烯 乙炔
分子式
结构简式
结构特点 (碳碳键的类型、饱和性)
C2H6 C2H4 C2H2
CH3CH3 CH2=CH2 CH≡CH
碳碳单键
(σ键)
饱和
碳碳双键
(1个σ键、1 个π键),
不饱和
碳碳三键
(1个σ键、两个π键),
不饱和
乙炔
思考2、类比乙烯的化学性质,推测乙炔的化学性质
不饱和烃 乙烯 乙炔
燃烧:与O2反应
与酸性KMnO4溶液反应
加成反应(与H2、Br2、HCl、H2O等反应)
加聚反应
任务二:炔烃的性质
一、物理性质
乙炔俗称电石气,无色、无味气体,密度比空气小,微溶于水,易溶于有机溶剂
炔烃物理性质的递变也与烯烃类似。
二、化学性质
1、乙炔的氧化反应
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
现象:火焰明亮,并伴有浓烟
甲烷
乙烯
乙炔
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象有所不同,可用于三者鉴别
二、化学性质
②使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2 → 2MnSO4+ K2SO4+2CO2↑+ 4H2O
1、乙炔的氧化反应
二、化学性质
2、加成反应(与反应物的量有关,可分步表示)
①催化加氢
②使溴水褪色
CH≡CH+Br2 CH=CH
Br
Br
1 , 2 —二溴乙烯
CH=CH+Br2 CH—CH
Br
Br
Br
Br
Br
Br
1 , 1 , 2 , 2 —四溴乙烷
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
二、化学性质
2、加成反应
与H2加成生成乙烯
与HCl加成生成氯乙烯
与H2O加成生成乙醛
[注] 乙炔与水加成后的产物乙烯醇
(CH2=CH—OH)不稳定,很快转化为乙醛。
二、化学性质
3、加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
导电塑料——聚乙炔
聚乙炔可用于制备导电高分子材料。经溴或碘掺杂之后导电性会提高到金属水平。白川英树、艾伦·黑格和艾伦·麦克迪尔米德因“发现和发展导电聚合物”获得了2000年的诺贝尔化学奖。
如今聚乙炔已用于制备太阳能电池、半导体材料和电活性聚合物等。
图片来自网络
氧化反应
加成反应
加聚反应
①可燃性
②被强氧化剂氧化:使酸性KMnO4溶液紫红色褪去
①与卤素单质或其溶液(足量)→卤代烃:
②与HX→卤代烃:
③与H2→烷烃:
④与H2O→醛:
炔烃化学性质
炔烃的结构和性质与乙炔的相似
OH
H
CH=CH
烯醇式
CH3CHO
不稳定
分子重组
聚乙炔
→制备导电高分子材料
催化剂
+ 2H2
CH3-CH3
CH≡CH
CH≡CH + HCl 催化剂
CH2=CHCl
CH≡CH + H2O
催化剂
nCH ≡ CH [ CH=CH ]n
催化剂
任务三:乙炔的制备
三、实验室制备
1、反应原理:
CaC2 + 2H2O CH≡CH↑ + Ca(OH)2
(电石)
+ Ca(OH)2
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H↑
固体 +液体 气体
2、实验装置
乙炔的实验室制法
1.反应原理:
CaC2 + 2H2O CH≡CH↑ + Ca(OH)2
(电石)
【练一练】CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的有机产物:
A.ZnC2水解生成 ( ) B.Li2C2水解生成( )
C.Mg2C3水解生成( ) D.Al4C3水解生成( )
C2H2
CH4
C3H4
C2H2
ZnC2 + 2H2O CH≡CH↑ + Zn(OH)2
②用分液漏斗控制水流速率,让食盐水逐滴慢慢滴入。
④因电石中含有P、S等元素,与水反应会生成PH3、H2S等杂质会干扰乙炔的性质检验,常用CuSO4将其除去。
③电石与水剧烈反应会产生大量泡沫,易堵塞管口,应在导气管附近塞入少量棉花。
①电石与水反应剧烈,为了减缓反应速率,用饱和食盐水代替水。
不可用启普发生器
三、实验室制备
思考与交流
问题1. 制取乙炔时能否使用启普发生器?
①反应剧烈,难控制
③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
②反应放热,易使启普发生器炸裂。
实验内容 实验现象
(1)将饱和氯化钠溶液滴入 盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有 酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有 溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,产生大量气泡
火焰明亮,并伴有黑烟
酸性高锰酸钾溶液紫红色褪去
溴的四氯化碳溶液橙红色褪去
氧化反应
加成反应
氧化反应
(1)请写出戊炔的所有属于炔烃的同分异构体的结构简式,并对其命名。
CH≡C-CH2-CH2-CH3
CH3-C≡C-CH2-CH3
CH≡C-CH-CH3
1 2 3 4 5
1 2 3 4 5
P40 - 思考与讨论
1 戊炔
2 戊炔
CH3
3-甲基-1-丁炔
1 2 3 4
(2)请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
CH3-CH2-CH2-CH3
CH≡C-CH2-CH3 + 2H2
催化剂
△
(3)某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
CH3-CH-CH2-CH2-CH3
CH3
2-甲基戊烷
CH3-CH-C≡C-CH3
CH3-CH-CH2-C≡CH
CH3
CH3
图1.氧炔焰切割金属
图3.腈纶线
图4.氯丁橡胶、氯丁橡胶手套
图2.聚氯乙烯产品—PVC管、薄膜
任务四:炔烃的用途
20世纪40年代美国杜邦公司研制了一种合成纤维——聚丙烯腈(腈纶,又称人造毛)。它是乙炔先与氰化氢(HCN)反应生成丙烯腈,然后再进行聚合而合成的。请写出上述过程涉及到的化学反应方程式。
CH2=CHCN
CH CH + HCN
催化剂
nCH2=CH
CN
催化剂
CH2 CH
CN
n
腈纶线
乙炔的应用
①
②
【课堂达标】
1.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
A
【课堂达标】
2.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是 ( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.先加HCl,再加HBr D.先加HCl,再加Br2
D
3、某炔烃与氢气发生加成反应后得到,则该炔烃的结构有( )
A.1种 B.2种 C. 3种 D.4种
B
【课堂达标】
4.下列物质中,不可能是炔烃的加成产物的是( )
A.乙烷 B.2,3-二甲基戊烷
C.异戊烷 D.异丁烷
D
