1.1.1化学反应的焓变(含解析) 同步训练 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1化学反应的焓变(含解析) 同步训练 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 762.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 08:24:05 | ||
图片预览



文档简介
1.1.1.化学反应的焓变同步训练-2023-2024学年高二上学期化学苏教版(2019)选择性必修1
一、单选题
1.肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(l) H=+267kJ mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) H=-133.5kJ mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1
D.N2H4(g)+O2(g)=N2(l)+2H2O(g) H=-534kJ mol-1
2.下列化学反应属于吸热反应的是
A.盐酸与烧碱溶液的反应
B.Al与稀盐酸的反应
C.C+CO22CO
D.葡萄糖在人体内氧化分解
3.化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化如图所示,则下列说法中正确的是
A.该反应是吸热反应,吸收的热量为(y-x)kJ
B.断裂1 mol H—H键和1 mol Cl—Cl键时能放出x kJ的能量
C.断裂2 mol H—Cl键时需要吸收y kJ的能量
D.2 mol HCl(g)的总能量高于1 mol H2(g)和1 mol Cl2(g)的总能量
4.A + B = C + D是化学反应,已知该反应为放热反应,对该反应的说法正确的是
A.A的能量一定高于C 的能量
B.B的能量一定高于D的能量
C.反应物A与B的总能量一定低于生成物C与D的总能量
D.反应物A与B的总能量一定高于生成物C与D的总能量
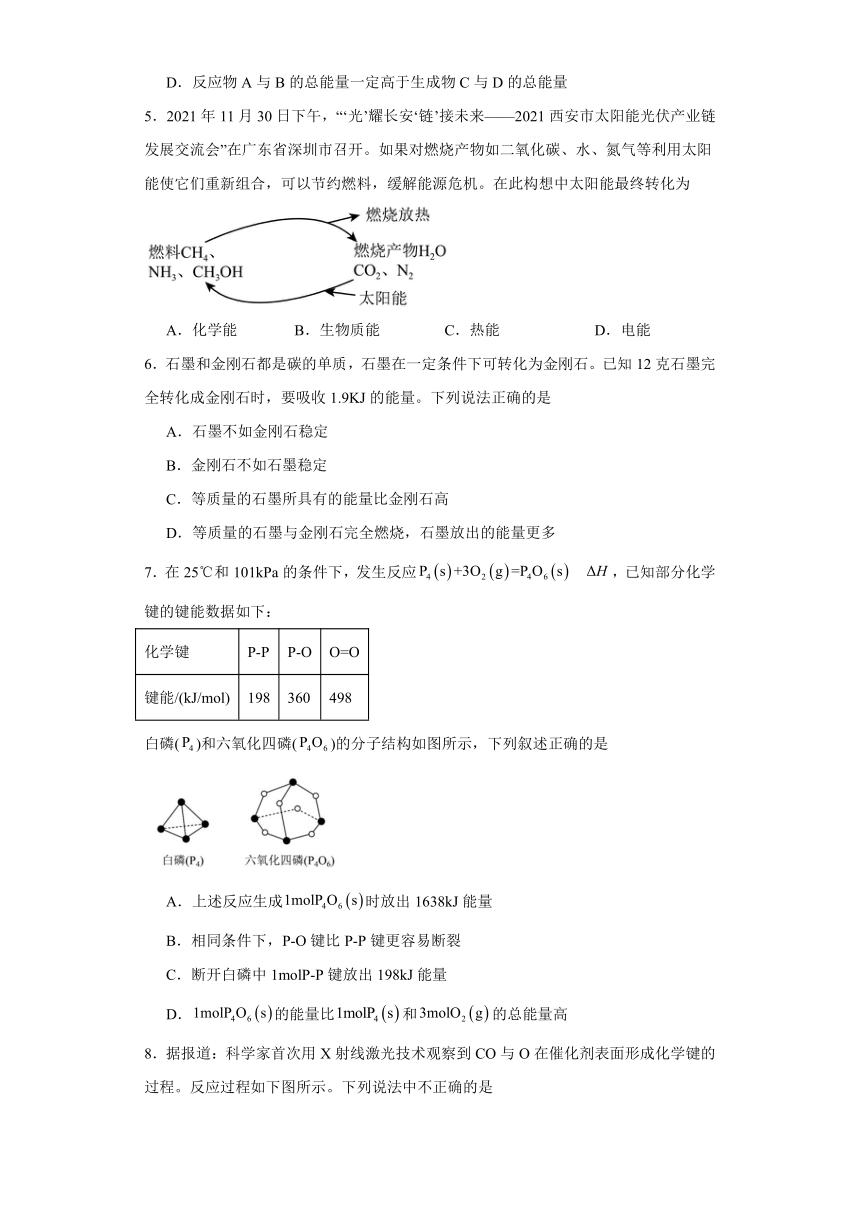
5.2021年11月30日下午,“‘光’耀长安‘链’接未来——2021西安市太阳能光伏产业链发展交流会”在广东省深圳市召开。如果对燃烧产物如二氧化碳、水、氮气等利用太阳能使它们重新组合,可以节约燃料,缓解能源危机。在此构想中太阳能最终转化为
A.化学能 B.生物质能 C.热能 D.电能
6.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知12克石墨完全转化成金刚石时,要吸收1.9KJ的能量。下列说法正确的是
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的石墨所具有的能量比金刚石高
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量更多
7.在25℃和101kPa的条件下,发生反应,已知部分化学键的键能数据如下:
化学键 P-P P-O O=O
键能/(kJ/mol) 198 360 498
白磷()和六氧化四磷()的分子结构如图所示,下列叙述正确的是
A.上述反应生成时放出1638kJ能量
B.相同条件下,P-O键比P-P键更容易断裂
C.断开白磷中1molP-P键放出198kJ能量
D.的能量比和的总能量高
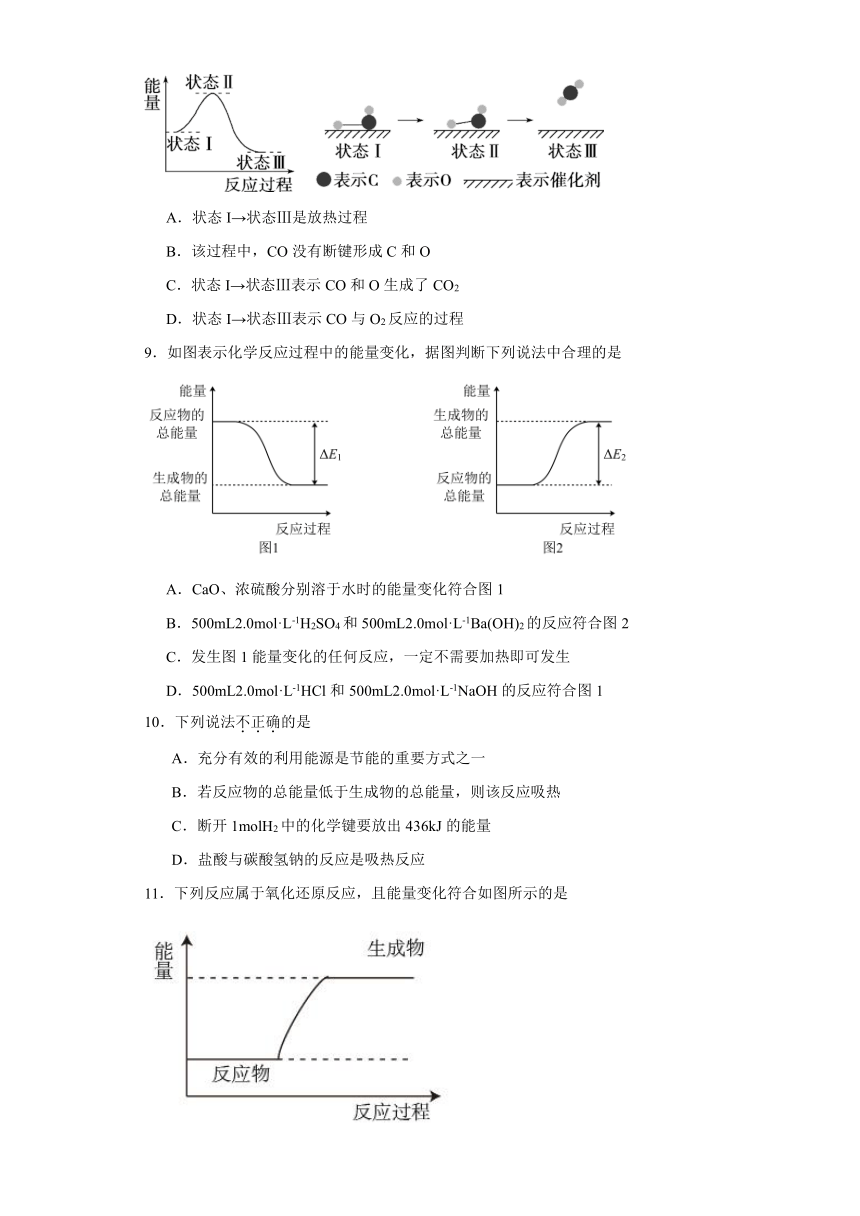
8.据报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如下图所示。下列说法中不正确的是
A.状态I→状态Ⅲ是放热过程
B.该过程中,CO没有断键形成C和O
C.状态I→状态Ⅲ表示CO和O生成了CO2
D.状态I→状态Ⅲ表示CO与O2反应的过程
9.如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是
A.CaO、浓硫酸分别溶于水时的能量变化符合图1
B.500mL2.0mol·L-1H2SO4和500mL2.0mol·L-1Ba(OH)2的反应符合图2
C.发生图1能量变化的任何反应,一定不需要加热即可发生
D.500mL2.0mol·L-1HCl和500mL2.0mol·L-1NaOH的反应符合图1
10.下列说法不正确的是
A.充分有效的利用能源是节能的重要方式之一
B.若反应物的总能量低于生成物的总能量,则该反应吸热
C.断开1molH2中的化学键要放出436kJ的能量
D.盐酸与碳酸氢钠的反应是吸热反应
11.下列反应属于氧化还原反应,且能量变化符合如图所示的是
A.NaOH溶液与H2SO4溶液混合
B.工业上用N2和H2在高温高压有催化剂条件下合成NH3
C.灼热的碳与水蒸气制备水煤气的反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
12.下列变化中,属于吸热反应的是
①KClO3制O2 ②将胆矾加热变为白色粉末 ③干冰升华 ④Ba(OH)2 8H2O与固体NH4Cl混合 ⑤合成氨反应
A.①②③④ B.①②④⑤ C.①④ D.①②④
13.下列反应既是氧化还原反应又是放热反应的是
A.和反应 B.和反应
C.和反应 D.还原的反应
14.近日,氢能汽车纷纷宣布入市,标志着新能源汽车即将进入“氢”时代。如图所示为某储氢合金的吸氢过程,已知储氢合金在吸氢时放出大量热,下列说法正确的是
A.氢气以分子形式存在于储氢合金中
B.储氢合金在吸氢时体系能量升高
C.β相金属氢化物释放氢的过程中不破坏化学键
D.利用储氢合金可制备超高纯氢气
15.人造小太阳、歼- 20、火星探测、海斗一号无人潜水器等均展示了我国科技发展的成果。下列相关叙述正确的是
A.潜水器的材料之一为合成橡胶发泡体,其具有防震、保温、不透水、不透气等特点
B.歼一20发动机的航空燃油是纯净物
C.火星土壤中的质量数为26
D.核聚变是化学能转化为热能的过程
16.下列物质间的能量变化与如图所示的能量变化相符的是
A.钠与水的反应
B.稀盐酸与碳酸氢钠的反应
C.氢氧化钡与氯化铵的反应
D.灼热的炭与二氧化碳的反应
17.下列关于能源和作为能源的物质的叙述中错误的是
A.化石能源物质内部蕴储着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值,放热反应在发生时都不需要加热
18.“神舟十三号”航天员在完成飞行任务的同时还推出了“天宫课堂”。下列有关“天宫课堂”的说法错误的是
A.“泡腾片实验”(碳酸氢钠和柠檬酸反应)产生的“欢乐小气泡”为CO2
B.“冰雪实验”所用的乙酸钠可由小苏打和白醋反应生成
C.“水油分离实验”不经离心操作可直接用分液漏斗将水油分离
D.“冰雪实验”中乙酸钠过饱和溶液结晶形成“热冰”现象,属于放热过程
19.下列叙述正确的是
A.O2和O3互为同素异形体,性质相似
B.常温下,PH=1的水溶液中,Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s);△H>0,所以石墨比金刚石稳定
20.碳中和作为一种新型环保形式,可推动全社会绿色发展。我国争取2060年前实现碳中和,科学家正在研究建立如下图所示的二氧化碳新循环体系:
下列说法正确的是
①减少碳排放有利于缓解全球变暖
②无机物和有机化合物可以相互转化
③光能(或电能)可以转化为化学能
④风电,光伏发电等新能源的开发和使用可减少碳排放
A.①②③④ B.①②④ C.①②③ D.①③④
21.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如图所示。下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.过程①→②吸收能量并形成了C—C键
D.该催化剂提高了反应速率
22.将一块擦去氧化膜的铝片放入20mL0.5mol L-1CuSO4溶液中,观察到实验现象为:铝表面有红色物质析出,同时有少量气泡,铝片上下翻滚,溶液中出现黑色物质。下列方程式不正确的是
A.Cu2+(aq)+2H2O(l)Cu(OH)2(s)+2H+(aq) △H>0
B.2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s) △H<0
C.Cu(OH)2(s)CuO(s)+H2O(l) △H>0
D.2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0
23.研究发现,一定条件下,Pt单原子催化反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的历程如图所示,其中吸附在催化剂表面上的物种用“*”表示,“TS”表示过渡态。下列说法不正确的是
A.该反应的 H<0
B.经历TS1CO2共价键发生了断裂,且生成了羧基
C.六个过渡态中对反应速率影响最大的是TS3
D.要提高该反应的选择性,可以选择合适的催化剂
24.用“循环电沉积”法处理制备锂电池,其中和C在的催化作用下发生电极反应,其反应历程中的能量变化如下图。下列说法不正确的是
A.反应历程中存在极性键和非极性键的断裂和形成
B.反应历程中涉及电子转移的变化均吸收能量
C.催化剂通过降低电极反应的活化能使反应速率加快
D.电极上失去时,生成的体积为2.24L(标况下)
25.化学与生活密切相关。下列说法正确的是
A.工业上通过石油分馏得到大量化工原料苯
B.冬奥场馆建筑应用了新材料碲化镉发电玻璃,碲和镉均属于过渡元素
C.“光化学烟雾”“臭氧空洞”“硝酸型酸雨”的形成都与氮氧化物有关
D.“天宫课堂”实验:乙酸钠过饱和溶液结晶形成温热“冰球”,该过程发生吸热反应
二、填空题
26.反应热
在等温条件下,化学反应体系向环境或从环境的热量,称为化学反应的热效应,简称。
27.化学反应的焓变与反应物和生成物的键能有关。
(1)已知:
共价键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436 247 434
求H2(g)+Cl2(g)=2HCl(g)的ΔH=
(2)已知:C(石墨,s) = C(金刚石,s) ΔH1=+1.9 kJ·mol-1
①石墨和金刚石相比,石墨的稳定性金刚石的稳定性(填“大于”“小于”或“等于”)。
②石墨中C—C键键能金刚石中C—C键键能(填“大于”“小于”或“等于”)。
28.生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用(填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面 (填字母)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水 C.钠和水
(3)已知:2molH2与足量O2充分燃烧生成液态水时放出572kJ热量。
①该反应的能量变化可用图中的(填字母)表示。
②写出燃烧生成液态水的热化学反应方程式:。
(4)表中是部分共价键的键能。
共价键
键能(kJ/mol) 436 946 391
根据表中的数据写出工业合成氨的热化学反应方程式:。
29.中和反应是放热反应。取10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/mL)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 mL稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。
(1)当加入4mL稀盐酸时,烧杯中溶液的溶质为(写化学式) 。
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的原因。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠g(精确到0.1g),
30.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。25 ℃,101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
(1)红磷转化为白磷属于反应(填“放热”或“吸热”)。
(2)等质量的红磷和白磷分别完全燃烧,放出热量较多的是(填“白磷”或“红磷”,下同)。
(3)31 g白磷与31 g红磷的能量较高的是,二者更稳定的是。
试卷第2页,共9页
参考答案:
1.C
【详解】0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,放热 H为小于0,则热化学方程式可表示为N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1,C正确;
选C。
2.C
【详解】A.盐酸与烧碱溶液的反应为酸碱中和,属于放热反应;
B.Al与稀盐酸的反应是活泼金属单质与酸的反应,属于放热反应;
C.C+CO22CO属于吸热反应;
D.葡萄糖在人体内氧化分解是放热的氧化还原反应;
综上所述,属于吸热反应的是C项,故答案为C。
3.C
【详解】A.由图可知反应物的总能量大于生成物的总能量,所以该反应为放热反应,故A错误;
B.断键要吸收能量,所以断裂1mol H-H键和1mol Cl-Cl键吸收x kJ能量,故B错误;
C.由图可知,断裂2mol H-Cl键需要吸收y kJ的能量,故C正确;
D.由图可知反应物的总能量大于生成物的总能量,即2mol HCl的总能量低于1mol H2和1mol Cl2的总能量,故D错误;
故选C。
4.D
【详解】反应物的总能量大于生成物的总能量的反应是放热反应。已知该反应是放热反应,则反应物A和B的总能量大于产物C和D的总能量。
答案选D。
5.C
【详解】由图示可知燃烧产物二氧化碳、水、氮气等利用太阳能使它们重新组合成甲烷,甲醇,氨气等可燃物,这些可然后燃烧过程又生成二氧化碳、水、氮气等,同时释放热量,可知太阳能最终转化成了热能。故C正确;
故选:C。
6.B
【详解】A.能量较低的比较稳定,12克石墨完全转化成金刚石时,要吸收1.9kJ的能量,石墨能量比较低,故石墨比金刚石稳定,A错误;
B.据选项A分析,金刚石不如石墨稳定,B正确;
C.据选项A分析,石墨能量比较低,等质量的石墨所具有的能量比金刚石低,C错误;
D.据选项A分析,石墨能量比较低,则等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多,D错误;
故选B。
7.A
【详解】A.反应的=(6×198+3×498-12×360)kJ/mol =-1638kJ/mol,则生成时放出1638kJ能量,故A正确;
B.键能越大,越不容易断裂,P-O的键能比P-P键大,故B错误;
C.断开化学键需要吸收能量,故C错误;
D.反应的=(6×198+3×498-12×360)kJ/mol =-1638kJ/mol,该反应为放热反应,则的能量比和的总能量低,故D错误;
故选A。
8.D
【详解】A.根据能量—反应过程的图象知,状态I的能量高于状态III的能量,该过程是放热过程,A项正确;
B.根据状态I、II、III可以看出整个过程中CO中的C和O形成的化学键没有断裂,B项正确;
C.状态I→状态Ⅲ表示CO和O生成了CO2,而不是与氧气的反应,C项正确;D项错误;
答案选D。
9.D
【详解】A.浓硫酸溶于水没有发生化学反应,只是放热过程,故A错误;
B.H2SO4和Ba(OH)2的反应为放热反应,反应物的总能量大于生成物的总能量,故B错误;
C.图1表示放热反应,反应是否为放热反应需反应条件无关,如铝热反应属于放热反应,但需要高温条件才能发生,故C错误;
D.酸碱中和反应为放热反应,反应物的总能量高于生成物的总能量,符合图1的能量变化曲线,故D正确;
故选:D。
10.C
【详解】A.充分有效的利用能源是节能的重要方式之一,故A正确;
B.若反应物的总能量低于生成物的总能量,则该反应为吸热反应,故B正确;
C.断开1molH2中的化学键要吸收436kJ的能量,故C错误;
D.盐酸的氢离子与碳酸氢钠水解出的氢氧根离子中和反应是放热反应,但由于二氧化碳以及氯化氢的大量溢出也要吸收热量,如果盐酸浓度大,导致碳酸氢钠的水解持续进行,则吸热效应将超过中和反应导致的放热效应,所以盐酸与碳酸氢钠的反应是吸热反应,故D正确;
故答案:C。
11.C
【分析】由图可知,生成物总能量能量高于反应物总能量,故该图描述的是吸热反应;复分解反应一定不属于氧化还原反应。
【详解】A.NaOH溶液与H2SO4溶液混合,发生酸碱中和反应,属于放热反应,并且属于复分解反应,不属于氧化还原反应,A错误;
B.工业合成氨,N2和H2化合价发生了变化,属于氧化还原反应,但该反应属于放热反应,B错误;
C.C+H2O CO+H2属于吸热反应,C由0价变为+2价,故而属于氧化还原反应,C正确;
D.Ba(OH)2·8H2O晶体与NH4Cl晶体是吸热反应,并且属于复分解反应,不属于氧化还原反应,D错误;
故选C。
12.D
【分析】常见的吸热反应有大多数分解反应、Ba(OH)2 8H2O与NH4Cl的反应,C和水蒸气、C和CO2的反应以及用C、CO或H2还原金属氧化物的反应。
【详解】①2KClO32KCl+3O2属于分解反应,是吸热反应,①符合题意;
②CuSO4 5H2OCuSO4+5H2O属于分解反应,是吸热反应,②符合题意;
③干冰升华需要吸热,但不是化学变化,③不符合题意;
④Ba(OH)2 8H2O与NH4Cl的反应属于吸热反应,④符合题意;
⑤N2+3H22NH3是化合反应,属于放热反应,⑤不符合题意;
综上所述①②④符合题意,故选D。
13.B
【详解】A.酸碱发生的中和反应是放热反应,但由于反应过程中元素化合价都不变,因此不属于氧化还原反应,A错误;
B.该反应是置换反应,反应过程中有元素化合价的升降,属于氧化还原反应;反应发生时放出热量,因此同时属于放热反应,B正确;
C.该反应是复分解反应,发生反应时元素化合价不变,不属于氧化还原反应,同时发生反应时吸收热量,属于吸热反应,C错误;
D.该反应属于置换反应,发生反应时元素化合价发生了变化,属于氧化还原反应;发生该反应时吸收了热量,因此又同时还属于吸热反应,D错误;
答案选B。
14.D
【详解】A.氢气以金属氢化物的形式存在于储氢合金中,故A错误;
B.储氢合金在吸氢时,放出能量,体系能量降低,故B错误;
C.β相金属氢化物释放氢的过程中破坏化学键,故C错误;
D.利用储氢合金的选择性吸收的特性,可制备超高纯氢体,故D正确;
选D。
15.A
【详解】A.潜水器的材料之一为合成橡胶发泡体,该物质体积大,密度小,不溶于水,具有防震、保温、不透水、不透气等特点,A正确;
B.歼一20发动机的航空燃油中含有多种烃,因此属于混合物,而不属于纯净物,B错误;
C.原子符号左下角为质子数,左上角为质量数,火星土壤中的质量数为57,质子数为26,C错误;
D.核聚变是核能转化为热能的过程,D错误;
故合理选项是A。
16.A
【分析】反应物总能量高,生成物总能量低,则相应的反应为放热反应。
【详解】A.钠与水的反应属于放热反应,符合题意,A项正确;
B.稀盐酸与碳酸氢钠的反应为吸热反应,不符合题意,B项错误;
C.氢氧化钡与氯化铵的反应为吸热反应,不符合题意,C项错误;
D.灼热的炭与二氧化碳的反应为吸热反应,不符合题意,D项错误;
答案选A。
17.D
【详解】A.煤、石油、天然气属于化石燃料,其物质内部蕴藏着大量的能量,故A正确;
B.绿色植物进行的光合作用是将太阳能转化为化学能“贮存”起来的过程,故B正确;
C.放热反应能将化学能转化为热能,原电池就是将化学能转化为电能,从而可以被人类利用,故C正确;
D.吸热反应有其利用价值,如炼铁过程中还原剂的生成虽然是吸热反应,但对炼铁过程是必须的,所以吸热反应有其利用价值,铝热反应是放热反应,但必须加热才能发生,故D错误;
故选D。
18.C
【详解】A.碳酸氢钠和柠檬酸反应可生成CO2,选项A正确;
B.乙酸钠(CH3COONa)可由小苏打(NaHCO3)和白醋(主要溶质为CH3COOH)反应生成,选项B正确;
C.太空进行的“水油分离实验”处于微重力环境下,不可直接用分液漏斗将水油分离,选项C错误;
D.乙酸钠过饱和溶液结晶形成“热冰”现象,属于放热过程,选项D正确;
答案选C。
19.D
【详解】A.O2和O3均是氧元素形成的单质,二者互为同素异形体,物理性质性质不同,A错误;
B.常温下,pH=1的水溶液显酸性,NO3-、HCO3-、Fe2+均不能大量共存,B错误;
C.明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理不相同,前者利用的是胶体的吸附作用,后者利用的是氧化性,C错误;
D. C(石墨,s)=C(金刚石,s) △H>0,说明石墨的能量低于金刚石,所以石墨比金刚石稳定,D正确;
答案选D。
20.A
【分析】二氧化碳的转化过程是一个复杂的过程,这一过程中发生的变化都是化学变化,所以满足质量守恒定律.同时在这些变化中化学能和动能、势能之间相互转化,有机物和无机物之间也能相互转化。
【详解】从图示中可以看出,二氧化碳的转化过程是化学变化所以符合质量守恒定律,汽油、甲醇转化为二氧化碳是将化学能转化为热能和光能,同时将有机物转化为无机物,水转化为氢气过程中说明光能(或电能)可以转化为化学能,二氧化碳综合利用减少碳排放有利于缓解全球变暖,风电、光伏发电等新能源的开发和使用可减少碳排放。
答案选A。
21.C
【分析】图中分析,1mol甲烷和1mol二氧化碳反应生成1mol乙酸,方程式为CH4+CO2CH3COOH,①→②过程中能量降低,过程为放热过程。
【详解】A. 图中分析,1mol甲烷和1mol二氧化碳反应生成1mol乙酸,方程式为CH4+CO2CH3COOH,反应物全部转化为生成物生成CH3COOH总反应的原子利用率为100%
B. 图中变化可知甲烷在催化剂作用下经过选择性活化,其中甲烷分子中碳原子会与催化剂形成一个新的共价键,必有C-H键发生断裂,故B正确;
C. 图中可知,①→②过程中能量降低,过程为放热过程,有C-C键形成,故C错误;
D. 催化剂降低反应的活化能,提高了反应速率,故D正确;
故选C。
22.A
【详解】A.CuSO4溶液中存在水解平衡:△H>0,由于Cu2+水解程度较小,不能生成氢氧化铜固体,A错误;
B.加入擦去氧化膜的铝片后,由于Cu2+的氧化性比H+的强,所以发生铝与Cu2+的置换反应:2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s)△H<0,B正确;
C.由于铝与Cu2+及H+的反应均放热,使生成的极少量氢氧化铜受热易分解产生黑色的CuO:△H>0,C正确
D.铝还能与溶液中的H+发生置换反应生成氢气:2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g)△H<0,D正确;
故选:A。
23.B
【详解】A.通过反应历程初始状态可知能量降低,该反应的 H<0,故A正确;
B.经历TS1CO2共价键发生了断裂,生成了HCOO*,经历 TS1才生成羧基,故B错误;
C.六个过渡态中对反应速率影响最大的是TS3,因为能量变化最小,故C正确;
D.不同催化剂能不同程度地改变反应历程,提高该反应的选择性,可以选择合适的催化剂,故D正确;
故选B。
24.D
【分析】从图中可以看出,起始到第一个台阶C与碳酸根反应生成CO和CO2,失去电子,吸收能量;第二个台阶到第三个台阶,CO和碳酸根生成草酸根,吸收能量,过程中有CO2放出;第三个台阶到第四个台阶,草酸根失去电子生成CO2,吸收过量;第四个台阶到终态CO2释放出来,放出能量。
【详解】A.整个过程中有碳酸根中C-O键断裂,CO中C-O键生成,含极性键的断裂和生成;有草酸根中C-C键的生成的断裂,故有非极性键的生成和断裂,A正确;
B.图示中可以看出,涉及电子转移的变化均吸收能量,B正确;
C.催化剂可以降低反应的活化能,故MoS2 催化剂也是通过降低电极反应的活化能使反应速率加快,C正确;
D.从图中可看出,整个电极总反应为,电极上失去0.2mole 时,生成CO2的体积为3.36L(标况下),D错误;
故选D。
25.C
【详解】A.石油分馏一般得到烷烃或环烷烃,煤的干馏可以得到苯,A错误;
B.碲属于主族元素,B错误;
C.氮氧化物可以在光照下发生光化学反应生成二次污染物,形成“光化学烟雾”,可以破坏臭氧层形成“臭氧空洞”,也可以与水结合形成“硝酸型酸雨”,C正确;
D.乙酸钠过饱和溶液结晶形成热冰现象,属于放热反应,D错误;
故答案为:C。
26. 释放 吸收 反应热
【详解】反应热是指等温条件下,化学反应体系向环境释放的热量或从环境吸收的热量,称为化学反应的热效应,简称反应热,常用ΔH表示,故答案为:释放;吸收;反应热。
27.(1)-185 kJ·mol-1
(2) 大于 大于
【详解】(1)△H=反应物键能-生成物键能,H2(g)+Cl2(g)=2HCl(g)的ΔH=436kJ/mol+247kJ/mol-2×434 kJ/mol =-185kJ/mol;
(2)①根据C(石墨,s) = C(金刚石,s) ΔH1=+1.9 kJ·mol-1可知,金刚石所含能量高于石墨,能量越低越稳定,所以墨的稳定性大于金刚石的稳定性;
②C(石墨,s) = C(金刚石,s) ΔH1=+1.9 kJ·mol-1,根据△H=反应物键能-生成物键能可知,反应物键能>生成物键能,即石墨中C—C键键能大于金刚石中C—C键键能。
28.(1)吸热
(2)A
(3) a 2H2(g)+O2(g)=2H2O(l) H=-572kJ/mol
(4)N2(g)+3H2(g) 2NH3(g) H=-92kJ/mol
【详解】(1)冷敷袋能够降低温度,达到保鲜和镇痛的目的,故利用了吸热的性质;
(2)即热饭盒利用放热过程达到加热食物目的,且使用时要安全。
A.生石灰和水生成熟石灰的反应剧烈放热,且生成物为固体,安全性较高,A符合题意;
B.浓硫酸加水稀释可以发热,但浓硫酸为液体,腐蚀性强,加水稀释易受热而使酸液飞溅,危险性大,B不符合题意;
C.钠和水反应放热,但Na在空气中不稳定,且与H2O反应生成的H2容易爆炸,危险性大,C不符合题意;
故选A。
(3)①H2的燃烧为放热反应,放热反应反应物的能量大于生成物的能量,故选a;
②2molH2与足量O2充分燃烧生成液态水时放出572kJ热量,热化学方程式的系数表示物质的量,放热反应的 H<0,故H2燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) H=-572kJ/mol;
(4) H=反应物的键能之和-生成物的键能之和=3×436 kJ/mol +946 kJ/mol -6×391 kJ/mol=-92kJ/mol,故热化学方程式为N2(g)+3H2(g) 2NH3(g) H=-92kJ/mol。
29. NaOH NaCl 中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降。 1.6g
【详解】(1)向氢氧化钠溶液中滴入稀盐酸,两者发生反应生成氯化钠和水,当加入4mL时,根据图象反应温度没有达到最高,说明NaOH有剩余,则烧杯中溶液的溶质为NaOH和NaCl。
(2)中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降,所以温度先升高后降低。
(3) 10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/mL)的物质的量为=0.0275mol,根据钠守恒,生成的NaCl的物质的量也为0.0275mol,所以NaCl的质量为0.0275mol×58.5g/mol=1.6g。
30. 吸热 白磷 白磷 红磷
【详解】(1)已知白磷转化为红磷放出热量,则红磷转化为白磷吸收热量,属于吸热反应;
(2) 白磷转化为红磷放出热量,则等质量的红磷和白磷分别完全燃烧,白磷先转化为红磷放出热量,则放出热量较多的是白磷;
(3) 31 g白磷完全转化为红磷,放出11 kJ的热量,则31 g白磷与31 g红磷的能量较高的是白磷,能量越低物质越稳定,则更稳定的是红磷
一、单选题
1.肼(N2H4)是一种高效清洁的火箭燃料。0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程中正确的是
A.N2H4(g)+O2(g)=N2(g)+2H2O(l) H=+267kJ mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) H=-133.5kJ mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1
D.N2H4(g)+O2(g)=N2(l)+2H2O(g) H=-534kJ mol-1
2.下列化学反应属于吸热反应的是
A.盐酸与烧碱溶液的反应
B.Al与稀盐酸的反应
C.C+CO22CO
D.葡萄糖在人体内氧化分解
3.化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化如图所示,则下列说法中正确的是
A.该反应是吸热反应,吸收的热量为(y-x)kJ
B.断裂1 mol H—H键和1 mol Cl—Cl键时能放出x kJ的能量
C.断裂2 mol H—Cl键时需要吸收y kJ的能量
D.2 mol HCl(g)的总能量高于1 mol H2(g)和1 mol Cl2(g)的总能量
4.A + B = C + D是化学反应,已知该反应为放热反应,对该反应的说法正确的是
A.A的能量一定高于C 的能量
B.B的能量一定高于D的能量
C.反应物A与B的总能量一定低于生成物C与D的总能量
D.反应物A与B的总能量一定高于生成物C与D的总能量
5.2021年11月30日下午,“‘光’耀长安‘链’接未来——2021西安市太阳能光伏产业链发展交流会”在广东省深圳市召开。如果对燃烧产物如二氧化碳、水、氮气等利用太阳能使它们重新组合,可以节约燃料,缓解能源危机。在此构想中太阳能最终转化为
A.化学能 B.生物质能 C.热能 D.电能
6.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知12克石墨完全转化成金刚石时,要吸收1.9KJ的能量。下列说法正确的是
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的石墨所具有的能量比金刚石高
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量更多
7.在25℃和101kPa的条件下,发生反应,已知部分化学键的键能数据如下:
化学键 P-P P-O O=O
键能/(kJ/mol) 198 360 498
白磷()和六氧化四磷()的分子结构如图所示,下列叙述正确的是
A.上述反应生成时放出1638kJ能量
B.相同条件下,P-O键比P-P键更容易断裂
C.断开白磷中1molP-P键放出198kJ能量
D.的能量比和的总能量高
8.据报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如下图所示。下列说法中不正确的是
A.状态I→状态Ⅲ是放热过程
B.该过程中,CO没有断键形成C和O
C.状态I→状态Ⅲ表示CO和O生成了CO2
D.状态I→状态Ⅲ表示CO与O2反应的过程
9.如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是
A.CaO、浓硫酸分别溶于水时的能量变化符合图1
B.500mL2.0mol·L-1H2SO4和500mL2.0mol·L-1Ba(OH)2的反应符合图2
C.发生图1能量变化的任何反应,一定不需要加热即可发生
D.500mL2.0mol·L-1HCl和500mL2.0mol·L-1NaOH的反应符合图1
10.下列说法不正确的是
A.充分有效的利用能源是节能的重要方式之一
B.若反应物的总能量低于生成物的总能量,则该反应吸热
C.断开1molH2中的化学键要放出436kJ的能量
D.盐酸与碳酸氢钠的反应是吸热反应
11.下列反应属于氧化还原反应,且能量变化符合如图所示的是
A.NaOH溶液与H2SO4溶液混合
B.工业上用N2和H2在高温高压有催化剂条件下合成NH3
C.灼热的碳与水蒸气制备水煤气的反应
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
12.下列变化中,属于吸热反应的是
①KClO3制O2 ②将胆矾加热变为白色粉末 ③干冰升华 ④Ba(OH)2 8H2O与固体NH4Cl混合 ⑤合成氨反应
A.①②③④ B.①②④⑤ C.①④ D.①②④
13.下列反应既是氧化还原反应又是放热反应的是
A.和反应 B.和反应
C.和反应 D.还原的反应
14.近日,氢能汽车纷纷宣布入市,标志着新能源汽车即将进入“氢”时代。如图所示为某储氢合金的吸氢过程,已知储氢合金在吸氢时放出大量热,下列说法正确的是
A.氢气以分子形式存在于储氢合金中
B.储氢合金在吸氢时体系能量升高
C.β相金属氢化物释放氢的过程中不破坏化学键
D.利用储氢合金可制备超高纯氢气
15.人造小太阳、歼- 20、火星探测、海斗一号无人潜水器等均展示了我国科技发展的成果。下列相关叙述正确的是
A.潜水器的材料之一为合成橡胶发泡体,其具有防震、保温、不透水、不透气等特点
B.歼一20发动机的航空燃油是纯净物
C.火星土壤中的质量数为26
D.核聚变是化学能转化为热能的过程
16.下列物质间的能量变化与如图所示的能量变化相符的是
A.钠与水的反应
B.稀盐酸与碳酸氢钠的反应
C.氢氧化钡与氯化铵的反应
D.灼热的炭与二氧化碳的反应
17.下列关于能源和作为能源的物质的叙述中错误的是
A.化石能源物质内部蕴储着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转化为热能、电能,为人类所利用
D.吸热反应没有利用价值,放热反应在发生时都不需要加热
18.“神舟十三号”航天员在完成飞行任务的同时还推出了“天宫课堂”。下列有关“天宫课堂”的说法错误的是
A.“泡腾片实验”(碳酸氢钠和柠檬酸反应)产生的“欢乐小气泡”为CO2
B.“冰雪实验”所用的乙酸钠可由小苏打和白醋反应生成
C.“水油分离实验”不经离心操作可直接用分液漏斗将水油分离
D.“冰雪实验”中乙酸钠过饱和溶液结晶形成“热冰”现象,属于放热过程
19.下列叙述正确的是
A.O2和O3互为同素异形体,性质相似
B.常温下,PH=1的水溶液中,Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s);△H>0,所以石墨比金刚石稳定
20.碳中和作为一种新型环保形式,可推动全社会绿色发展。我国争取2060年前实现碳中和,科学家正在研究建立如下图所示的二氧化碳新循环体系:
下列说法正确的是
①减少碳排放有利于缓解全球变暖
②无机物和有机化合物可以相互转化
③光能(或电能)可以转化为化学能
④风电,光伏发电等新能源的开发和使用可减少碳排放
A.①②③④ B.①②④ C.①②③ D.①③④
21.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如图所示。下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂
C.过程①→②吸收能量并形成了C—C键
D.该催化剂提高了反应速率
22.将一块擦去氧化膜的铝片放入20mL0.5mol L-1CuSO4溶液中,观察到实验现象为:铝表面有红色物质析出,同时有少量气泡,铝片上下翻滚,溶液中出现黑色物质。下列方程式不正确的是
A.Cu2+(aq)+2H2O(l)Cu(OH)2(s)+2H+(aq) △H>0
B.2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s) △H<0
C.Cu(OH)2(s)CuO(s)+H2O(l) △H>0
D.2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g) △H<0
23.研究发现,一定条件下,Pt单原子催化反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)的历程如图所示,其中吸附在催化剂表面上的物种用“*”表示,“TS”表示过渡态。下列说法不正确的是
A.该反应的 H<0
B.经历TS1CO2共价键发生了断裂,且生成了羧基
C.六个过渡态中对反应速率影响最大的是TS3
D.要提高该反应的选择性,可以选择合适的催化剂
24.用“循环电沉积”法处理制备锂电池,其中和C在的催化作用下发生电极反应,其反应历程中的能量变化如下图。下列说法不正确的是
A.反应历程中存在极性键和非极性键的断裂和形成
B.反应历程中涉及电子转移的变化均吸收能量
C.催化剂通过降低电极反应的活化能使反应速率加快
D.电极上失去时,生成的体积为2.24L(标况下)
25.化学与生活密切相关。下列说法正确的是
A.工业上通过石油分馏得到大量化工原料苯
B.冬奥场馆建筑应用了新材料碲化镉发电玻璃,碲和镉均属于过渡元素
C.“光化学烟雾”“臭氧空洞”“硝酸型酸雨”的形成都与氮氧化物有关
D.“天宫课堂”实验:乙酸钠过饱和溶液结晶形成温热“冰球”,该过程发生吸热反应
二、填空题
26.反应热
在等温条件下,化学反应体系向环境或从环境的热量,称为化学反应的热效应,简称。
27.化学反应的焓变与反应物和生成物的键能有关。
(1)已知:
共价键 H—H Cl—Cl H—Cl
键能/(kJ·mol-1) 436 247 434
求H2(g)+Cl2(g)=2HCl(g)的ΔH=
(2)已知:C(石墨,s) = C(金刚石,s) ΔH1=+1.9 kJ·mol-1
①石墨和金刚石相比,石墨的稳定性金刚石的稳定性(填“大于”“小于”或“等于”)。
②石墨中C—C键键能金刚石中C—C键键能(填“大于”“小于”或“等于”)。
28.生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用(填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面 (填字母)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水 C.钠和水
(3)已知:2molH2与足量O2充分燃烧生成液态水时放出572kJ热量。
①该反应的能量变化可用图中的(填字母)表示。
②写出燃烧生成液态水的热化学反应方程式:。
(4)表中是部分共价键的键能。
共价键
键能(kJ/mol) 436 946 391
根据表中的数据写出工业合成氨的热化学反应方程式:。
29.中和反应是放热反应。取10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/mL)置于烧杯中(并滴入2滴酚酞),向烧杯中逐滴加入稀盐酸。随着盐酸的滴入,烧杯中溶液颜色从红色逐渐变浅,当加入10 mL稀盐酸时,溶液恰好变为无色。烧杯中溶液温度与加入盐酸体积之间关系如图所示。
(1)当加入4mL稀盐酸时,烧杯中溶液的溶质为(写化学式) 。
(2)试解释烧杯中溶液温度随加入盐酸的体积发生变化的原因。
(3)当盐酸与氢氧化钠恰好中和时生成氯化钠g(精确到0.1g),
30.磷元素有多种性质不同的单质,红磷(结构复杂用“P”表示)和白磷(P4)是磷的两种同素异形体,充分燃烧之后的产物都是五氧化二磷。25 ℃,101 kPa下,31 g白磷完全转化为红磷,放出11 kJ的热量,根据以上事实回答下列问题:
(1)红磷转化为白磷属于反应(填“放热”或“吸热”)。
(2)等质量的红磷和白磷分别完全燃烧,放出热量较多的是(填“白磷”或“红磷”,下同)。
(3)31 g白磷与31 g红磷的能量较高的是,二者更稳定的是。
试卷第2页,共9页
参考答案:
1.C
【详解】0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,放热 H为小于0,则热化学方程式可表示为N2H4(g)+O2(g)=N2(g)+2H2O(g) H=-534kJ mol-1,C正确;
选C。
2.C
【详解】A.盐酸与烧碱溶液的反应为酸碱中和,属于放热反应;
B.Al与稀盐酸的反应是活泼金属单质与酸的反应,属于放热反应;
C.C+CO22CO属于吸热反应;
D.葡萄糖在人体内氧化分解是放热的氧化还原反应;
综上所述,属于吸热反应的是C项,故答案为C。
3.C
【详解】A.由图可知反应物的总能量大于生成物的总能量,所以该反应为放热反应,故A错误;
B.断键要吸收能量,所以断裂1mol H-H键和1mol Cl-Cl键吸收x kJ能量,故B错误;
C.由图可知,断裂2mol H-Cl键需要吸收y kJ的能量,故C正确;
D.由图可知反应物的总能量大于生成物的总能量,即2mol HCl的总能量低于1mol H2和1mol Cl2的总能量,故D错误;
故选C。
4.D
【详解】反应物的总能量大于生成物的总能量的反应是放热反应。已知该反应是放热反应,则反应物A和B的总能量大于产物C和D的总能量。
答案选D。
5.C
【详解】由图示可知燃烧产物二氧化碳、水、氮气等利用太阳能使它们重新组合成甲烷,甲醇,氨气等可燃物,这些可然后燃烧过程又生成二氧化碳、水、氮气等,同时释放热量,可知太阳能最终转化成了热能。故C正确;
故选:C。
6.B
【详解】A.能量较低的比较稳定,12克石墨完全转化成金刚石时,要吸收1.9kJ的能量,石墨能量比较低,故石墨比金刚石稳定,A错误;
B.据选项A分析,金刚石不如石墨稳定,B正确;
C.据选项A分析,石墨能量比较低,等质量的石墨所具有的能量比金刚石低,C错误;
D.据选项A分析,石墨能量比较低,则等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多,D错误;
故选B。
7.A
【详解】A.反应的=(6×198+3×498-12×360)kJ/mol =-1638kJ/mol,则生成时放出1638kJ能量,故A正确;
B.键能越大,越不容易断裂,P-O的键能比P-P键大,故B错误;
C.断开化学键需要吸收能量,故C错误;
D.反应的=(6×198+3×498-12×360)kJ/mol =-1638kJ/mol,该反应为放热反应,则的能量比和的总能量低,故D错误;
故选A。
8.D
【详解】A.根据能量—反应过程的图象知,状态I的能量高于状态III的能量,该过程是放热过程,A项正确;
B.根据状态I、II、III可以看出整个过程中CO中的C和O形成的化学键没有断裂,B项正确;
C.状态I→状态Ⅲ表示CO和O生成了CO2,而不是与氧气的反应,C项正确;D项错误;
答案选D。
9.D
【详解】A.浓硫酸溶于水没有发生化学反应,只是放热过程,故A错误;
B.H2SO4和Ba(OH)2的反应为放热反应,反应物的总能量大于生成物的总能量,故B错误;
C.图1表示放热反应,反应是否为放热反应需反应条件无关,如铝热反应属于放热反应,但需要高温条件才能发生,故C错误;
D.酸碱中和反应为放热反应,反应物的总能量高于生成物的总能量,符合图1的能量变化曲线,故D正确;
故选:D。
10.C
【详解】A.充分有效的利用能源是节能的重要方式之一,故A正确;
B.若反应物的总能量低于生成物的总能量,则该反应为吸热反应,故B正确;
C.断开1molH2中的化学键要吸收436kJ的能量,故C错误;
D.盐酸的氢离子与碳酸氢钠水解出的氢氧根离子中和反应是放热反应,但由于二氧化碳以及氯化氢的大量溢出也要吸收热量,如果盐酸浓度大,导致碳酸氢钠的水解持续进行,则吸热效应将超过中和反应导致的放热效应,所以盐酸与碳酸氢钠的反应是吸热反应,故D正确;
故答案:C。
11.C
【分析】由图可知,生成物总能量能量高于反应物总能量,故该图描述的是吸热反应;复分解反应一定不属于氧化还原反应。
【详解】A.NaOH溶液与H2SO4溶液混合,发生酸碱中和反应,属于放热反应,并且属于复分解反应,不属于氧化还原反应,A错误;
B.工业合成氨,N2和H2化合价发生了变化,属于氧化还原反应,但该反应属于放热反应,B错误;
C.C+H2O CO+H2属于吸热反应,C由0价变为+2价,故而属于氧化还原反应,C正确;
D.Ba(OH)2·8H2O晶体与NH4Cl晶体是吸热反应,并且属于复分解反应,不属于氧化还原反应,D错误;
故选C。
12.D
【分析】常见的吸热反应有大多数分解反应、Ba(OH)2 8H2O与NH4Cl的反应,C和水蒸气、C和CO2的反应以及用C、CO或H2还原金属氧化物的反应。
【详解】①2KClO32KCl+3O2属于分解反应,是吸热反应,①符合题意;
②CuSO4 5H2OCuSO4+5H2O属于分解反应,是吸热反应,②符合题意;
③干冰升华需要吸热,但不是化学变化,③不符合题意;
④Ba(OH)2 8H2O与NH4Cl的反应属于吸热反应,④符合题意;
⑤N2+3H22NH3是化合反应,属于放热反应,⑤不符合题意;
综上所述①②④符合题意,故选D。
13.B
【详解】A.酸碱发生的中和反应是放热反应,但由于反应过程中元素化合价都不变,因此不属于氧化还原反应,A错误;
B.该反应是置换反应,反应过程中有元素化合价的升降,属于氧化还原反应;反应发生时放出热量,因此同时属于放热反应,B正确;
C.该反应是复分解反应,发生反应时元素化合价不变,不属于氧化还原反应,同时发生反应时吸收热量,属于吸热反应,C错误;
D.该反应属于置换反应,发生反应时元素化合价发生了变化,属于氧化还原反应;发生该反应时吸收了热量,因此又同时还属于吸热反应,D错误;
答案选B。
14.D
【详解】A.氢气以金属氢化物的形式存在于储氢合金中,故A错误;
B.储氢合金在吸氢时,放出能量,体系能量降低,故B错误;
C.β相金属氢化物释放氢的过程中破坏化学键,故C错误;
D.利用储氢合金的选择性吸收的特性,可制备超高纯氢体,故D正确;
选D。
15.A
【详解】A.潜水器的材料之一为合成橡胶发泡体,该物质体积大,密度小,不溶于水,具有防震、保温、不透水、不透气等特点,A正确;
B.歼一20发动机的航空燃油中含有多种烃,因此属于混合物,而不属于纯净物,B错误;
C.原子符号左下角为质子数,左上角为质量数,火星土壤中的质量数为57,质子数为26,C错误;
D.核聚变是核能转化为热能的过程,D错误;
故合理选项是A。
16.A
【分析】反应物总能量高,生成物总能量低,则相应的反应为放热反应。
【详解】A.钠与水的反应属于放热反应,符合题意,A项正确;
B.稀盐酸与碳酸氢钠的反应为吸热反应,不符合题意,B项错误;
C.氢氧化钡与氯化铵的反应为吸热反应,不符合题意,C项错误;
D.灼热的炭与二氧化碳的反应为吸热反应,不符合题意,D项错误;
答案选A。
17.D
【详解】A.煤、石油、天然气属于化石燃料,其物质内部蕴藏着大量的能量,故A正确;
B.绿色植物进行的光合作用是将太阳能转化为化学能“贮存”起来的过程,故B正确;
C.放热反应能将化学能转化为热能,原电池就是将化学能转化为电能,从而可以被人类利用,故C正确;
D.吸热反应有其利用价值,如炼铁过程中还原剂的生成虽然是吸热反应,但对炼铁过程是必须的,所以吸热反应有其利用价值,铝热反应是放热反应,但必须加热才能发生,故D错误;
故选D。
18.C
【详解】A.碳酸氢钠和柠檬酸反应可生成CO2,选项A正确;
B.乙酸钠(CH3COONa)可由小苏打(NaHCO3)和白醋(主要溶质为CH3COOH)反应生成,选项B正确;
C.太空进行的“水油分离实验”处于微重力环境下,不可直接用分液漏斗将水油分离,选项C错误;
D.乙酸钠过饱和溶液结晶形成“热冰”现象,属于放热过程,选项D正确;
答案选C。
19.D
【详解】A.O2和O3均是氧元素形成的单质,二者互为同素异形体,物理性质性质不同,A错误;
B.常温下,pH=1的水溶液显酸性,NO3-、HCO3-、Fe2+均不能大量共存,B错误;
C.明矾和漂白粉用于自来水的净化和杀菌消毒,两者的作用原理不相同,前者利用的是胶体的吸附作用,后者利用的是氧化性,C错误;
D. C(石墨,s)=C(金刚石,s) △H>0,说明石墨的能量低于金刚石,所以石墨比金刚石稳定,D正确;
答案选D。
20.A
【分析】二氧化碳的转化过程是一个复杂的过程,这一过程中发生的变化都是化学变化,所以满足质量守恒定律.同时在这些变化中化学能和动能、势能之间相互转化,有机物和无机物之间也能相互转化。
【详解】从图示中可以看出,二氧化碳的转化过程是化学变化所以符合质量守恒定律,汽油、甲醇转化为二氧化碳是将化学能转化为热能和光能,同时将有机物转化为无机物,水转化为氢气过程中说明光能(或电能)可以转化为化学能,二氧化碳综合利用减少碳排放有利于缓解全球变暖,风电、光伏发电等新能源的开发和使用可减少碳排放。
答案选A。
21.C
【分析】图中分析,1mol甲烷和1mol二氧化碳反应生成1mol乙酸,方程式为CH4+CO2CH3COOH,①→②过程中能量降低,过程为放热过程。
【详解】A. 图中分析,1mol甲烷和1mol二氧化碳反应生成1mol乙酸,方程式为CH4+CO2CH3COOH,反应物全部转化为生成物生成CH3COOH总反应的原子利用率为100%
B. 图中变化可知甲烷在催化剂作用下经过选择性活化,其中甲烷分子中碳原子会与催化剂形成一个新的共价键,必有C-H键发生断裂,故B正确;
C. 图中可知,①→②过程中能量降低,过程为放热过程,有C-C键形成,故C错误;
D. 催化剂降低反应的活化能,提高了反应速率,故D正确;
故选C。
22.A
【详解】A.CuSO4溶液中存在水解平衡:△H>0,由于Cu2+水解程度较小,不能生成氢氧化铜固体,A错误;
B.加入擦去氧化膜的铝片后,由于Cu2+的氧化性比H+的强,所以发生铝与Cu2+的置换反应:2Al(s)+3Cu2+(aq)=2Al3+(aq)+3Cu(s)△H<0,B正确;
C.由于铝与Cu2+及H+的反应均放热,使生成的极少量氢氧化铜受热易分解产生黑色的CuO:△H>0,C正确
D.铝还能与溶液中的H+发生置换反应生成氢气:2Al(s)+6H+(aq)=2Al3+(aq)+3H2(g)△H<0,D正确;
故选:A。
23.B
【详解】A.通过反应历程初始状态可知能量降低,该反应的 H<0,故A正确;
B.经历TS1CO2共价键发生了断裂,生成了HCOO*,经历 TS1才生成羧基,故B错误;
C.六个过渡态中对反应速率影响最大的是TS3,因为能量变化最小,故C正确;
D.不同催化剂能不同程度地改变反应历程,提高该反应的选择性,可以选择合适的催化剂,故D正确;
故选B。
24.D
【分析】从图中可以看出,起始到第一个台阶C与碳酸根反应生成CO和CO2,失去电子,吸收能量;第二个台阶到第三个台阶,CO和碳酸根生成草酸根,吸收能量,过程中有CO2放出;第三个台阶到第四个台阶,草酸根失去电子生成CO2,吸收过量;第四个台阶到终态CO2释放出来,放出能量。
【详解】A.整个过程中有碳酸根中C-O键断裂,CO中C-O键生成,含极性键的断裂和生成;有草酸根中C-C键的生成的断裂,故有非极性键的生成和断裂,A正确;
B.图示中可以看出,涉及电子转移的变化均吸收能量,B正确;
C.催化剂可以降低反应的活化能,故MoS2 催化剂也是通过降低电极反应的活化能使反应速率加快,C正确;
D.从图中可看出,整个电极总反应为,电极上失去0.2mole 时,生成CO2的体积为3.36L(标况下),D错误;
故选D。
25.C
【详解】A.石油分馏一般得到烷烃或环烷烃,煤的干馏可以得到苯,A错误;
B.碲属于主族元素,B错误;
C.氮氧化物可以在光照下发生光化学反应生成二次污染物,形成“光化学烟雾”,可以破坏臭氧层形成“臭氧空洞”,也可以与水结合形成“硝酸型酸雨”,C正确;
D.乙酸钠过饱和溶液结晶形成热冰现象,属于放热反应,D错误;
故答案为:C。
26. 释放 吸收 反应热
【详解】反应热是指等温条件下,化学反应体系向环境释放的热量或从环境吸收的热量,称为化学反应的热效应,简称反应热,常用ΔH表示,故答案为:释放;吸收;反应热。
27.(1)-185 kJ·mol-1
(2) 大于 大于
【详解】(1)△H=反应物键能-生成物键能,H2(g)+Cl2(g)=2HCl(g)的ΔH=436kJ/mol+247kJ/mol-2×434 kJ/mol =-185kJ/mol;
(2)①根据C(石墨,s) = C(金刚石,s) ΔH1=+1.9 kJ·mol-1可知,金刚石所含能量高于石墨,能量越低越稳定,所以墨的稳定性大于金刚石的稳定性;
②C(石墨,s) = C(金刚石,s) ΔH1=+1.9 kJ·mol-1,根据△H=反应物键能-生成物键能可知,反应物键能>生成物键能,即石墨中C—C键键能大于金刚石中C—C键键能。
28.(1)吸热
(2)A
(3) a 2H2(g)+O2(g)=2H2O(l) H=-572kJ/mol
(4)N2(g)+3H2(g) 2NH3(g) H=-92kJ/mol
【详解】(1)冷敷袋能够降低温度,达到保鲜和镇痛的目的,故利用了吸热的性质;
(2)即热饭盒利用放热过程达到加热食物目的,且使用时要安全。
A.生石灰和水生成熟石灰的反应剧烈放热,且生成物为固体,安全性较高,A符合题意;
B.浓硫酸加水稀释可以发热,但浓硫酸为液体,腐蚀性强,加水稀释易受热而使酸液飞溅,危险性大,B不符合题意;
C.钠和水反应放热,但Na在空气中不稳定,且与H2O反应生成的H2容易爆炸,危险性大,C不符合题意;
故选A。
(3)①H2的燃烧为放热反应,放热反应反应物的能量大于生成物的能量,故选a;
②2molH2与足量O2充分燃烧生成液态水时放出572kJ热量,热化学方程式的系数表示物质的量,放热反应的 H<0,故H2燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) H=-572kJ/mol;
(4) H=反应物的键能之和-生成物的键能之和=3×436 kJ/mol +946 kJ/mol -6×391 kJ/mol=-92kJ/mol,故热化学方程式为N2(g)+3H2(g) 2NH3(g) H=-92kJ/mol。
29. NaOH NaCl 中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降。 1.6g
【详解】(1)向氢氧化钠溶液中滴入稀盐酸,两者发生反应生成氯化钠和水,当加入4mL时,根据图象反应温度没有达到最高,说明NaOH有剩余,则烧杯中溶液的溶质为NaOH和NaCl。
(2)中和反应放热,随着反应的进行,放出热量增加,溶液温度逐渐升高,加入10毫升稀盐酸时恰好完全反应,溶液温度最高。继续加入盐酸后,溶液被稀释冷却,温度逐渐下降,所以温度先升高后降低。
(3) 10 mL溶质质量分数为10%的NaOH溶液(密度1.10g/mL)的物质的量为=0.0275mol,根据钠守恒,生成的NaCl的物质的量也为0.0275mol,所以NaCl的质量为0.0275mol×58.5g/mol=1.6g。
30. 吸热 白磷 白磷 红磷
【详解】(1)已知白磷转化为红磷放出热量,则红磷转化为白磷吸收热量,属于吸热反应;
(2) 白磷转化为红磷放出热量,则等质量的红磷和白磷分别完全燃烧,白磷先转化为红磷放出热量,则放出热量较多的是白磷;
(3) 31 g白磷完全转化为红磷,放出11 kJ的热量,则31 g白磷与31 g红磷的能量较高的是白磷,能量越低物质越稳定,则更稳定的是红磷
