1.1.1 化学反应的焓变 (含解析)习题训练 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1 化学反应的焓变 (含解析)习题训练 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 717.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 08:26:26 | ||
图片预览


文档简介
1.1.1.化学反应的焓变习题训练-2023-2024学年高二上学期化学苏教版(2019)选择性必修1
一、单选题
1.下列关于电能的特点叙述中错误的是
A.电能较其它能源使用方便 B.电能在现代社会中的使用最为广泛
C.电能使用导致的污染最小 D.电能又称电力,是一种一次能源
2.下列反应或变化过程放热的个数为
①Ba(OH)2晶体与NH4Cl晶体反应
②硫酸和氢氧化钠溶液混合
③硫受热融化
④石灰石高温分解
⑤灼热的炭和二氧化碳反应生成一氧化碳
⑥生石灰和水反应生成熟石灰
⑦镁条在氮气中燃烧
A.3个 B.2个 C.5个 D.4个
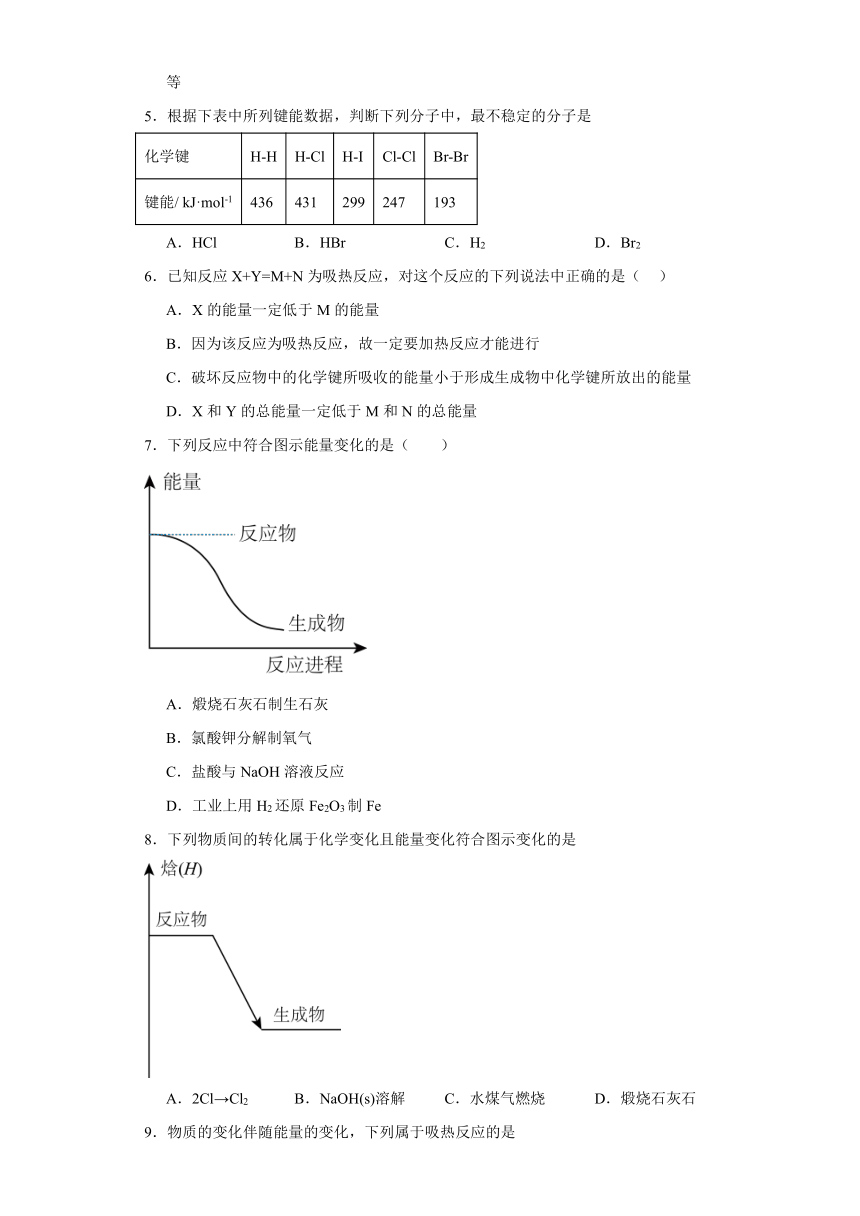
3.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是
A.整个过程实现了光能向化学能的转换
B.过程II有O-O单键生成并放出能量
C.过程III发生的化学反应为: 2H2O2=2H2O+O2
D.整个过程的总反应方程式为: 2H2O→H2+O2
4.关于化学反应与能量的说法正确的是
A.中和反应是吸热反应 B.燃烧属于放热反应
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
5.根据下表中所列键能数据,判断下列分子中,最不稳定的分子是
化学键 H-H H-Cl H-I Cl-Cl Br-Br
键能/ kJ·mol-1 436 431 299 247 193
A.HCl B.HBr C.H2 D.Br2
6.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
7.下列反应中符合图示能量变化的是( )
A.煅烧石灰石制生石灰
B.氯酸钾分解制氧气
C.盐酸与NaOH溶液反应
D.工业上用H2还原Fe2O3制Fe
8.下列物质间的转化属于化学变化且能量变化符合图示变化的是
A.2Cl→Cl2 B.NaOH(s)溶解 C.水煤气燃烧 D.煅烧石灰石
9.物质的变化伴随能量的变化,下列属于吸热反应的是
A.甲烷燃烧 B.铝片与稀盐酸反应
C.木炭与水反应生成和 D.氢原子和氯原子形成键
10.下列反应属于氧化还原反应,并且 H>0的是
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧反应
11.下列反应中,属于吸热反应的是
A.H2在Cl2中燃烧 B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
C.NaOH与稀盐酸反应 D.Al与稀硫酸反应
12.下列关于“化学键与化学反应能量”的叙述正确的是
A.硫酸氢钠加热到熔融状态,需要克服离子键和共价键
B.和完全反应,生成气态水比生成液态水放出的热量多
C.氧气转化成臭氧,既有化学键的断裂,又有化学键的形成
D.已知石墨转化为金刚石为吸热反应,燃烧等质量的金刚石和石墨,石墨放出的热量多
13.下列过程中的能量变化与下图一致的是( )
A.NaOH 固体溶于水 B.氨气液化 C.碳酸钙分解 D.镁条溶于盐酸
14.2022年3月21日,长寿区市场监察局接到举报:酒店员工在垃圾桶里舀废油!后经查实是酒店工作人员将废油舀出来转运至餐厨垃圾处理厂,用于生产生物柴油。下列说法不合理的是
A.生物柴油的燃烧需要点燃,属于吸热反应
B.生物柴油在燃烧的过程中化学能主要转化为热能和光能
C.“地沟油”经过加工处理可用来生物柴油,实现了厨余垃圾的合理利用
D.生物柴油不属于化石能源
15.碳量子点是种新型碳纳米材料,我国化学家研究的一种新型复微合光催化剂[碳量子点/氮化碳(纳米复合物)]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
A.复合光催化反应过程中实现了电能到化学能的转化
B.水分解过程中,H2O2作催化剂
C.若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应
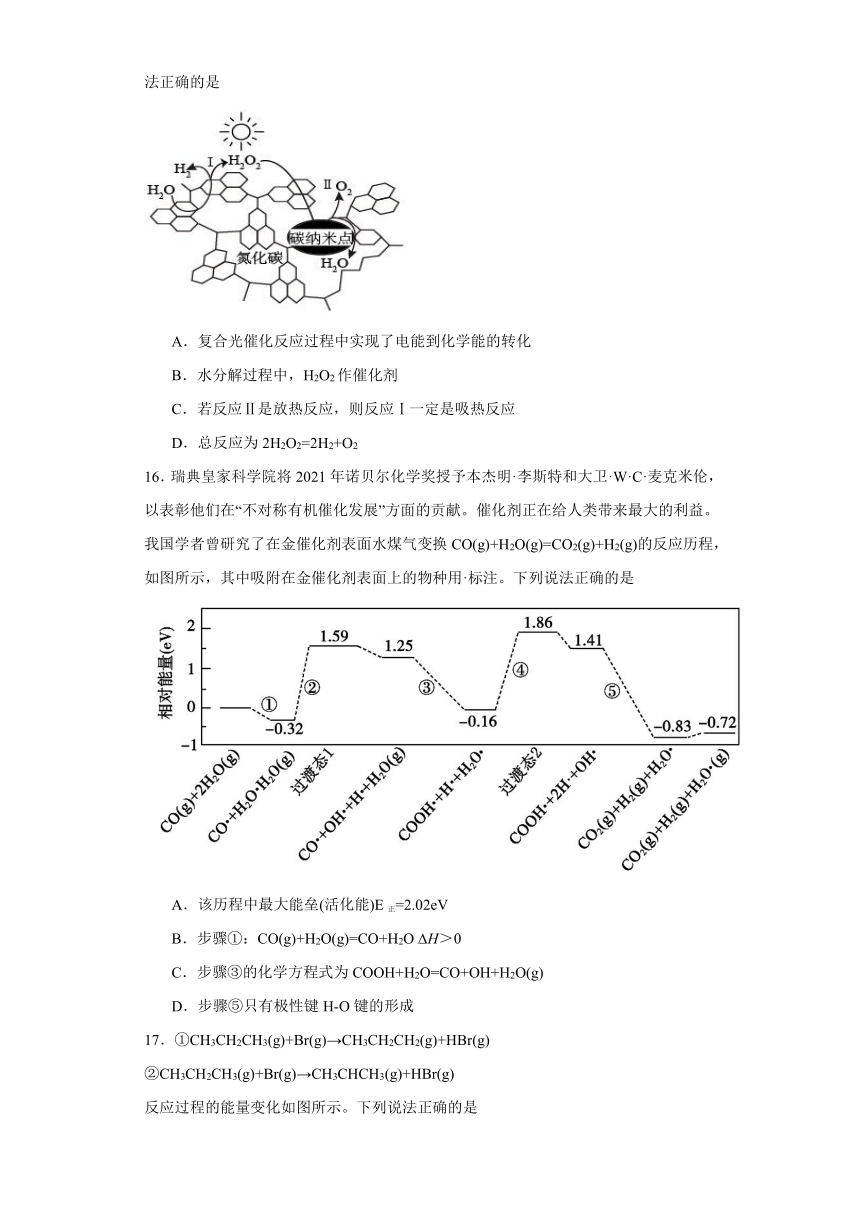
D.总反应为2H2O2=2H2+O2
16.瑞典皇家科学院将2021年诺贝尔化学奖授予本杰明·李斯特和大卫·W·C·麦克米伦,以表彰他们在“不对称有机催化发展”方面的贡献。催化剂正在给人类带来最大的利益。我国学者曾研究了在金催化剂表面水煤气变换CO(g)+H2O(g)=CO2(g)+H2(g)的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是
A.该历程中最大能垒(活化能)E正=2.02eV
B.步骤①:CO(g)+H2O(g)=CO+H2O H>0
C.步骤③的化学方程式为COOH+H2O=CO+OH+H2O(g)
D.步骤⑤只有极性键H-O键的形成
17.①CH3CH2CH3(g)+Br(g)→CH3CH2CH2(g)+HBr(g)
②CH3CH2CH3(g)+Br(g)→CH3CHCH3(g)+HBr(g)
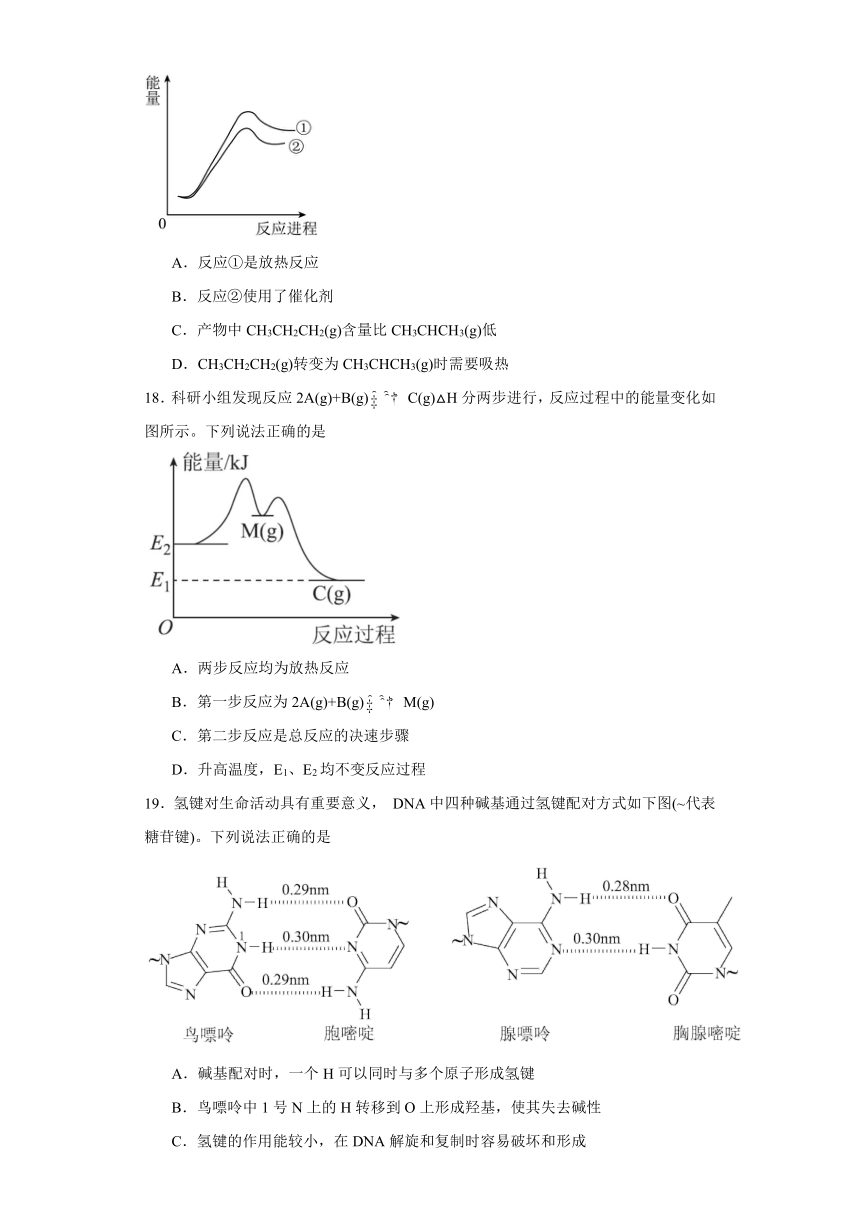
反应过程的能量变化如图所示。下列说法正确的是
A.反应①是放热反应
B.反应②使用了催化剂
C.产物中CH3CH2CH2(g)含量比CH3CHCH3(g)低
D.CH3CH2CH2(g)转变为CH3CHCH3(g)时需要吸热
18.科研小组发现反应2A(g)+B(g)C(g)△H分两步进行,反应过程中的能量变化如图所示。下列说法正确的是
A.两步反应均为放热反应
B.第一步反应为2A(g)+B(g)M(g)
C.第二步反应是总反应的决速步骤
D.升高温度,E1、E2均不变反应过程
19.氢键对生命活动具有重要意义, DNA中四种碱基通过氢键配对方式如下图(~代表糖苷键)。下列说法正确的是
A.碱基配对时,一个H可以同时与多个原子形成氢键
B.鸟嘌呤中1号N上的H转移到O上形成羟基,使其失去碱性
C.氢键的作用能较小,在DNA解旋和复制时容易破坏和形成
D.嘌呤中N-H键的平均键长大于0. 29nm
20.下列反应属于吸热反应的是
A.C6H12O6(葡萄糖aq)+6O26CO2+6H2O
B.CH3COOH+KOH=CH3COOK+H2O
C.A+B=C+D;ΔH <0
D.破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量
21.如图所示,有关化学反应和能量变化的说法正确的是
A.图表示的是吸热反应的能量变化
B.图中反应物比生成物稳定
C.图可以表示氧化钙与水反应的能量变化
D.图不需要加热就一定能发生,图一定需要加热才能发生
22.《厉害了,我的国》展示了我国科技发展的巨大成就,中国近五年来在探索太空、开发深海、开发新材料、开发5G技术等取得了举世瞩目的成就。下列说法不正确的是
A.华为5G手机搭载智能7 nm制程SOC“麒麟980”芯片,芯片的主要成分是单质硅
B.“天宫课堂”实验中,乙酸钠过饱和溶液结晶形成温热“冰球”,该过程发生吸热反应
C.火星车的热控材料纳米气凝胶能产生丁达尔效应
D.“华龙一号”核电项目中核反应堆所用铀棒中含有的与互为同位素
23.下列过程既是氧化还原反应,又是吸热反应的是
A.Na2O2溶于水
B.Ba(OH)2·8H2O与NH4Cl(s)混合并搅拌
C.灼热的炭与CO2反应
D.铝热反应
24.利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q),反应原理为ΔH=+88.62kJ·mol-1。下列叙述不正确的是
A.NBD比Q稳定 B.NBD转化为Q是吸热反应
C.NBD的能量比Q的能量高 D.NBD与Q互为同分异构体
25.下列反应的能量变化与图示相符的是
A.钠在氯气中燃烧 B.氢氧化钡与氯化铵固体的反应
C.铁与稀盐酸的反应 D.氨水与稀硫酸的反应
二、填空题
26.将20gBa(OH)2·8H2O晶体与10gNH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,用手触摸烧杯底部感觉,同时闻到气味。说明Ba(OH)2·8H2O跟NH4Cl的反应是(填“吸热”或“放热”)反应。该反应的化学方程式。
27.为了探究化学反应的热效应,某兴趣小组进行了实验:将纯固体物质X分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
(1)若如图1所示,发生的反应(假设没有气体生成)是(填“放热”或“吸热”)反应。
(2)若如图2所示,发生的反应(假设没有气体生成)是(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是(填字母)。
A.碳与水蒸气的反应
B.CaCO3的分解反应
C.氮气与氢气合成氨的反应
28.放热反应和吸热反应
(1)化学反应中的能量变化
若反应物的能量小于生成物的能量,则反应过程中能量;若反应物的能量大于生成物的能量,则反应过程中能量。
下图中,图1表示反应,图2表示反应。
(2)放热反应和吸热反应
热的反应称为吸热反应,吸热反应的ΔH0。
热的反应称为放热反应,反热反应的ΔH0。
(3)常见的放热反应和吸热反应
根据反应过程中放出或吸收能量,可将化学反应分为放热反应和吸热反应。
常见的放热反应有:①燃烧反应;②中和反应;③金属与水或酸反应放出氢气;④大多数化合反应;⑤铝热反应。
常见的吸热反应有:①大多数分解反应;②需要持续加热的反应;③CO2+C2CO,C+H2OCO+H2;④铵盐与碱的反应,如Ba(OH)2、Ca(OH)2与NH4Cl的反应。
(4)放热过程和吸热过程
物质在发生物理变化时,也会放出或吸收能量。
常见的放热过程有:①浓硫酸稀释、NaOH溶于水;②物态变化:气态→液态→固态
常见的吸热过程有:①NH4NO3溶于水;②弱电解质的电离;③物态变化:固态→液态→气体
29.如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是。
(2)产生上述现象的原因是。
(3)写出有关反应的离子方程式:;反应中转移了0.04mol电子时;标准状况下产生多少mL的H2;生成的MgCl2物质的量浓度为。(溶液体积保持不变)
(4)由实验推知,镁片和盐酸的总能量(填“大于”、“小于”或“等于”)MgCl2溶液和H2的总能量;此反应为(填放热反应或者吸热反应)。
30.回答下列问题
(1)已知C(s,石墨)=C(s,金刚石) △H>0,则稳定性:金刚石石墨(填“>”、“=”或“<”)
(2)已知:2C(s) +2O2(g)=2CO2(g) △H1 2C(s) +O2(g)=2CO(g) △H2
则 △H1△H2 (填“>”、“=”或“<”)
(3)“嫦娥五号”已于2020年11月24日在海南文昌发射中心成功发射。火箭的第一、二级发动机所用的燃料为偏二甲肼和四氧化二氮,其中偏二甲肼可与肼(N2H4)来制备。用肼为燃料,四氧化二氮做氧化剂,二者反应生成氮气和气态水。已知:
①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol
②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol
写出气态肼和四氧化二氮反应的热化学方程式
(4)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热量,写出该反应的热化学方程式
(5)0.50L 2.00mol/LH2SO4溶液与2.0L 1.00mol/LKOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H=
试卷第2页,共9页
参考答案:
1.D
【详解】A.电能可通过导线传输,较其它能源使用方便,A正确;
B.电能在现代社会中的使用随处都在,最为广泛,B正确;
C.电能使用不产生其它污染,导致的污染最小,C正确;
D.电能又称电力,是一种二次能源,D错误;
故选D。
2.A
【详解】①Ba(OH)2晶体与NH4Cl晶体反应是吸热反应,故不选;
②硫酸和氢氧化钠溶液混合放出热量,是放热反应,故选;
③硫受热融化,为吸热变化,故不选;
④石灰石高温分解为分解反应,属于吸热反应,故不选;
⑤灼热的炭和二氧化碳反应生成一氧化碳,为吸热反应,故不选;
⑥生石灰跟水反应生成熟石灰,为放热反应,故选;
⑦镁条在氮气中燃烧是燃烧反应,为放热反应,故选;
故选:A。
3.C
【详解】A.由图可知,太阳能使水分解,则实现了光能向化学能的转化,故A正确;
B.过程II中生成氢气、过氧化氢,形成化学键,过程Ⅱ放出能量并生成了O O键,故B正确;
C.由图可知,过程Ⅲ发生的反应为过氧化氢分解生成氢气和氧气的反应,H2O2═H2+O2,故C错误;
D.总反应为水分解生成氢气和氧气,则总反应2H2O→2H2+O2,故D正确。
故选C。
4.B
【详解】A.中和反应是酸和碱发生的反应,是放热反应,A错误;
B.燃烧是可燃物发生的剧烈的发光放热的反应,是放热反应,B正确;
C.断裂化学键需要吸收能量,C错误;
D.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,D错误;
故本题选B。
5.D
【详解】分子中,键能越小,分子越不稳定,从表中读出键能最小的是溴,故选D。
6.D
【详解】A.该反应为吸热反应,则X、Y的总能量小于M、N的总能量,但无法确定X与M的能量大小,故A错误;
B.该反应为吸热反应,与反应条件无关,该反应可能需要加热,也可能不需要加热,如氢氧化钡晶体与氯化铵晶体的反应为吸热反应,常温就可以进行,故B错误;
C.该反应为吸热反应,则破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,故C错误;
D.反应X+Y=M+N为吸热反应,则X、Y的总能量低于M、N的总能量,故D正确;
故选D。
7.C
【分析】图示反应中反应物的能量比生成物的能量高,发生反应放出热量,因此表示的反应为放热反应。
【详解】A.煅烧石灰石制生石灰的反应是吸热反应,生成物的能量比反应物的高,与图示的放热反应不符合,A不符合题意;
B.氯酸钾分解制氧气的反应为吸热反应,生成物的能量比反应物的高,与图示的放热反应不符合,B不符合题意;
C.盐酸与NaOH溶液反应是放热反应,反应物的能量比生成物的能量高,与图象表示的放热反应符合,C符合题意;
D.工业上用H2还原Fe2O3制Fe的反应为吸热反应,生成物的能量比反应物的高,与图象表示的放热反应不符合,D不符合题意;
故合理选项是C。
8.C
【详解】A.由图示可知:该化学反应为放热反应,是化学键形成过程,不属于化学反应,故A错误;
B.溶解是物理变化过程,故B错误;
C.水煤气燃烧是放热的化学反应,故C正确;
D.煅烧石灰石是吸热的化学反应,故D错误;
故选C
9.C
【详解】A.甲烷燃烧属于放热反应,故A不符合题意;
B.活泼金属与酸的反应是放热反应,故B不符合题意;
C.C与水反应生成和,该反应过程吸收热量,为吸热反应,故C符合题意;
D.氢原子和氯原子形成键,该过程放出热量,故D不符合题意;
故选:C。
10.C
【详解】A.铝片与稀H2SO4的反应为放热反应,A错误;
B.Ba(OH)2 8H2O与NH4Cl的反应为吸热反应,但不属于氧化还原反应,B错误;
C.灼热的炭与CO2的反应中C元素化合价发生变化,属于氧化还原反应,且为吸热反应,C正确;
D.甲烷在O2中的燃烧反应是放热反应,D错误;
答案选C。
11.B
【详解】A.H2在Cl2中燃烧反应产生HCl,同时放出热量,因此该反应是放热反应,A不符合题意;
B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应发生会吸收热量,使体系温度降低,因此该反应是吸热反应,B符合题意;
C.NaOH与稀盐酸发生中和反应会放出热量,使溶液温度升高,因此该反应为放热反应,C不符合题意;
D.Al与稀硫酸发生置换反应产生硫酸铝和氢气,同时放出热量,使溶液温度升高,因此该反应是放热反应,D不符合题意;
故合理选项是B。
12.C
【详解】A.硫酸氢钠加热到熔融状态电离成钠离子和硫酸氢根离子,克服钠离子和硫酸氢根离子之间的离子键,故A错误;
B.和完全反应,由于等物质的量的气态水的能量比液态水的能量高,故生成气态水比生成液态水放出的热量少,故B错误;
C.氧气转化成臭氧,属于化学变化,既有化学键的断裂,又有化学键的形成,故C正确;
D.由石墨转化为金刚石为吸热反应可知,等物质的量的石墨的能量比金刚石低,故燃烧等质量金刚石和石墨,石墨放出热量少,故D错误;
答案选C。
13.D
【详解】由图可知,该过程反应物与生成物的能量不同,且反应物总能量高于生成物,因此说明该过程是放热的化学反应,NaOH 固体溶于水、氨气液化是物理变化;碳酸钙分解是吸热反应;镁条溶于盐酸是放热反应,故答案为D。
14.A
【详解】A.生物柴油的燃烧需要点燃,燃料燃烧反应属于放热反应,物质是放热反应还是吸热反应与反应条件无关,A错误;
B.生物柴油在燃烧的过程中会放出大量热量,同时产生光,物质反应过程中能量转化主要是化学能转化为热能和光能,B正确;
C.“地沟油”主要成分是高级脂肪酸甘油酯,其经过加工处理可用来生物柴油,可以作燃料油使用,因此实现了厨余垃圾的合理利用,C正确;
D.生物柴油是油脂反应产生的,油脂不属于化石燃料;化石能源主要是煤、石油、天然气,可见生物柴油不属于化石能源,D正确;
故合理选项是A。
15.C
【详解】A.复合光催化反应过程中实现了光能到化学能的转化,不是电能到化学能的转化,故A错误;
B.H2O2为中间产物不属于催化剂,故B错误;
C.水分解是吸热反应,在此过程中,水的分解分两步,若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应,故C正确;
D.过程I是水分解为氢气和过氧化氢,过程II时过氧化氢分解生成水和氧气,整个过程是水分解为氢气和氧气,总反应为:,故D错误;
答案选C。
16.A
【详解】A.第④步的正反应活化能最大,即E正=1.86-(-0.16)=2.02eV,A正确;
B.步骤①反应物的能量大于生成物的,为放热反应,CO(g)+H2O(g)=CO+H2O H<0,B错误;
C.步骤③的化学方程式为CO +OH + H2O(g)=COOH +H2O ,C错误;
D.步骤⑤活化分子H 生成H2,也形成H-H键,D错误;
故选:A。
17.C
【详解】A.由图可知,反应①中CH3CH2CH3(g)和Br(g)具有的能量小于CH3CH2CH2(g)和HBr(g)具有的能量,则该反应为吸热反应,A错误;
B.催化剂能降低反应的活化能,加快反应速率,反应②的活化能低,反应②的反应速率快,但反应①和②同时进行,不能确定反应②是否使用了催化剂, B错误;
C.由图可知,活化能:反应①>②,则反应②的反应速率快,生成物含量:CH3CHCH3(g) >CH3CH2CH2(g),C正确;
D.由图可知,1 mol CH3CH2CH2(g)和1 mol HBr(g)具有的能量大于1 mol CH3CHCH3(g)和1 mol HBr(g)具有的能量,所以CH3CH2CH2(g)转变为CH3CHCH3(g)时会放热,D错误;
故合理选项是C。
18.B
【详解】A.由图可知,第一步反应为吸热反应,A项错误;
B.由总反应和第二步反应,推知第一步反应为,B项正确;
C.第一步反应的活化能大于第二步反应的活化能,故第一步反应是总反应的决速步骤,C项错误;
D.升高温度,、均增大,D项错误;
故选B。
19.C
【详解】A.从图中可以看出,碱基配对时,一个H只能与1个原子形成氡键,故A错误;
B.鸟嘌呤中1号N上的H转移到O上形成羟基,氮原子上仍有一孤电子对,还可以吸引水电离的氢离子,使水电离出更多的氢氧根离子,鸟嘌呤没有失去碱性,故B错误;
C.氢键的作用能较小,在DNA解旋和复制时容易破坏和形成,故C正确;
D.N-H……O中的H和O间的距离为0.29nm,是氢键的键长,氢键作用力比化学键弱得多,键长也长得多,所以嘌呤中N-H键的平均键长远小于0. 29nm,故D错误;
故选C。
20.D
【详解】A.该反应为氧化还原反应,氧化还原反应属于放热反应,A错误;
B.该反应为中和反应,中和反应为放热反应,B错误;
C.△H小于0,为放热反应,C错误;
D.破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量,△H大于0,为吸热反应,D正确;
答案选D。
21.B
【详解】A.图反应物的总能量高于生成物,所以为放热反应,故A错误;
B.图中反应物的总能量比生成物低,所以反应物比生成物稳定,故B正确;
C.氧化钙与水反应是放热反应,反应物的总能量高于生成物,故C错误;
D.放热反应有时候需要加热,吸热反应不一定加热,故D错误;
故选B。
22.B
【详解】A.晶体Si的导电性介于导体与绝缘体之间,是良好的半导体采用,芯片的主要成分是单质硅,A正确;
B.乙酸钠在温度较高的水中的溶解度非常大,很容易形成过饱和溶液,暂时处于亚稳态,这种溶液里只要有一点的结晶和颗粒,就能打破它的亚稳态,迅速结晶的同时释放出大量热量,但没有发生吸热反应,B错误;
C.火星车的热控材料纳米气凝胶属于胶体,因此能产生丁达尔效应,C正确;
D.与的质子数相同,而中子数不同,因此二者互为同位素,D正确;
故合理想象是B。
23.C
【详解】A.Na2O2溶于水反应产生NaOH、O2,反应过程中元素化合价发生了变化,因此反应属于氧化还原反应;该反应发生放出热量,因此反应属于放热反应,A不符合题意;
B.Ba(OH)2·8H2O与NH4Cl(s)混合并搅拌发生反应产生BaCl2、NH3、H2O,反应过程中元素化合价没有发生变化,因此反应不属于氧化还原反应;该反应发生吸收热量,因此反应属于吸热反应,B不符合题意;
C.灼热的炭与CO2反应产生CO,反应过程中元素化合价发生了变化,因此反应属于氧化还原反应;该反应发生吸收热量,因此反应属于吸热反应,C符合题意;
D.铝热反应是Al与金属氧化物在高温下反应产生Al2O3和金属单质。反应过程中元素化合价发生了变化,因此反应属于氧化还原反应;该反应发生放出热量,因此反应属于放热反应,D不符合题意;
故合理选项是C。
24.C
【详解】A.吸热反应中物质Q具有的总能量比NBD的高,能量越低越稳定,NBD比Q稳定,故A正确;
B.该反应是吸热反应,因此NBD转化为Q是吸热反应,故B正确;
C.吸热反应中物质Q具有的总能量比NBD的高,故C错误;
D.NBD和Q分子式相同,结构不同,二者属于同分异构体,故D正确;
故选C。
25.B
【分析】生成物总能量高于反应物总能量,为吸热反应,常见的吸热反应有:大多数的分解反应、氢气作还原剂的氧化还原反应、氯化铵与氢氧化钡的反应等。
【详解】A.钠在氯气中燃烧反应为放热反应,A错误;
B.氢氧化钡与氯化铵固体的反应为吸热反应,B正确;
C.铁与稀盐酸的反应是发生了氧化还原反应,为放热反应,C错误;
D.氨水与稀硫酸的反应是酸碱中和反应,为放热反应,D错误;
故选B。
26. 烧杯底部很冷 刺激性气味 吸热
【详解】,该反应是典型的吸热反应,将20gBa(OH)2·8H2O晶体与10gNH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,用手触摸烧杯底部感觉烧杯底部很冷,同时闻到刺激性气味气味。
27.(1)放热
(2) 吸热 AB
【解析】(1)
由于U形管右侧液面升高,说明锥形瓶内气压由于加入物质而增大,则该反应放热;
(2)
由于U形管右侧液面降低,说明锥形瓶内气压由于加入物质而降低,则该反应吸热,碳与水蒸气的反应是吸热反应,CaCO3的分解反应是吸热反应,氮气与氢气合成氨的反应放热反应,故答案为AB。
28. 吸收 放出 放热 吸热 吸收 > 放出 <
【详解】(1)若反应物的能量小于生成物的能量,则反应过程中吸收能量;若反应物的能量大于生成物的能量,则反应过程中放出能量。图中,图1反应物能量高于生成物能量,表示放热反应,图2反应物能量低于生成物能量,表示吸热反应。
(2)吸收热的反应称为吸热反应,吸热反应的ΔH>0。放出热的反应称为放热反应,反热反应的ΔH<0。
29. 镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 448 2.0mol/L 大于 放热反应
【详解】(1)、(2)镁是活泼金属,能与稀盐酸发生反应,在镁片上产生大量气泡,即产生氢气,随着反应的进行,镁片逐渐溶解,该反应放出大量的热,而饱和石灰水随着温度的升高,溶解度逐渐减小,逐渐有Ca(OH)2晶析析出,所以烧杯中溶液变浑浊;
(3)该反应的离子的方程式为;反应中转移了0. 04mol电子时,即生成0.02molH2,标准状况下产生448mL的H2;生成的MgCl2物质的量浓度为;
(4)由实验可知,该反应为放热反应,反应物的总能量大于生成物的总能量,所以镁片溶液和盐酸的总能量大于MgCl2和H2的总能量。
30.(1)<
(2)<
(3)2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol
(4)CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1
(5)-57.3kJ /mol
【详解】(1)物质的能量越高,该物质越不稳定,C(s,石墨)=C(s,金刚石) △H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H < 0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:< ;
(3)①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol;②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol,由盖斯定律②×2 -①得到2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol,故答案为:2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3kJ 的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H =-282.6kJ·mol-1,该反应的热化学方程式为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1,故答案为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1;
(5)0.50L 2.00mol/ L H2SO4溶液与2.00L 1.00mol/ L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为- 11.46kJ/mol,中和热为- 57.3kJ/mol,故答案为:-57.3kJ /mol
一、单选题
1.下列关于电能的特点叙述中错误的是
A.电能较其它能源使用方便 B.电能在现代社会中的使用最为广泛
C.电能使用导致的污染最小 D.电能又称电力,是一种一次能源
2.下列反应或变化过程放热的个数为
①Ba(OH)2晶体与NH4Cl晶体反应
②硫酸和氢氧化钠溶液混合
③硫受热融化
④石灰石高温分解
⑤灼热的炭和二氧化碳反应生成一氧化碳
⑥生石灰和水反应生成熟石灰
⑦镁条在氮气中燃烧
A.3个 B.2个 C.5个 D.4个
3.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是
A.整个过程实现了光能向化学能的转换
B.过程II有O-O单键生成并放出能量
C.过程III发生的化学反应为: 2H2O2=2H2O+O2
D.整个过程的总反应方程式为: 2H2O→H2+O2
4.关于化学反应与能量的说法正确的是
A.中和反应是吸热反应 B.燃烧属于放热反应
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
5.根据下表中所列键能数据,判断下列分子中,最不稳定的分子是
化学键 H-H H-Cl H-I Cl-Cl Br-Br
键能/ kJ·mol-1 436 431 299 247 193
A.HCl B.HBr C.H2 D.Br2
6.已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
A.X的能量一定低于M的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
7.下列反应中符合图示能量变化的是( )
A.煅烧石灰石制生石灰
B.氯酸钾分解制氧气
C.盐酸与NaOH溶液反应
D.工业上用H2还原Fe2O3制Fe
8.下列物质间的转化属于化学变化且能量变化符合图示变化的是
A.2Cl→Cl2 B.NaOH(s)溶解 C.水煤气燃烧 D.煅烧石灰石
9.物质的变化伴随能量的变化,下列属于吸热反应的是
A.甲烷燃烧 B.铝片与稀盐酸反应
C.木炭与水反应生成和 D.氢原子和氯原子形成键
10.下列反应属于氧化还原反应,并且 H>0的是
A.铝片与稀H2SO4反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧反应
11.下列反应中,属于吸热反应的是
A.H2在Cl2中燃烧 B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应
C.NaOH与稀盐酸反应 D.Al与稀硫酸反应
12.下列关于“化学键与化学反应能量”的叙述正确的是
A.硫酸氢钠加热到熔融状态,需要克服离子键和共价键
B.和完全反应,生成气态水比生成液态水放出的热量多
C.氧气转化成臭氧,既有化学键的断裂,又有化学键的形成
D.已知石墨转化为金刚石为吸热反应,燃烧等质量的金刚石和石墨,石墨放出的热量多
13.下列过程中的能量变化与下图一致的是( )
A.NaOH 固体溶于水 B.氨气液化 C.碳酸钙分解 D.镁条溶于盐酸
14.2022年3月21日,长寿区市场监察局接到举报:酒店员工在垃圾桶里舀废油!后经查实是酒店工作人员将废油舀出来转运至餐厨垃圾处理厂,用于生产生物柴油。下列说法不合理的是
A.生物柴油的燃烧需要点燃,属于吸热反应
B.生物柴油在燃烧的过程中化学能主要转化为热能和光能
C.“地沟油”经过加工处理可用来生物柴油,实现了厨余垃圾的合理利用
D.生物柴油不属于化石能源
15.碳量子点是种新型碳纳米材料,我国化学家研究的一种新型复微合光催化剂[碳量子点/氮化碳(纳米复合物)]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
A.复合光催化反应过程中实现了电能到化学能的转化
B.水分解过程中,H2O2作催化剂
C.若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应
D.总反应为2H2O2=2H2+O2
16.瑞典皇家科学院将2021年诺贝尔化学奖授予本杰明·李斯特和大卫·W·C·麦克米伦,以表彰他们在“不对称有机催化发展”方面的贡献。催化剂正在给人类带来最大的利益。我国学者曾研究了在金催化剂表面水煤气变换CO(g)+H2O(g)=CO2(g)+H2(g)的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是
A.该历程中最大能垒(活化能)E正=2.02eV
B.步骤①:CO(g)+H2O(g)=CO+H2O H>0
C.步骤③的化学方程式为COOH+H2O=CO+OH+H2O(g)
D.步骤⑤只有极性键H-O键的形成
17.①CH3CH2CH3(g)+Br(g)→CH3CH2CH2(g)+HBr(g)
②CH3CH2CH3(g)+Br(g)→CH3CHCH3(g)+HBr(g)
反应过程的能量变化如图所示。下列说法正确的是
A.反应①是放热反应
B.反应②使用了催化剂
C.产物中CH3CH2CH2(g)含量比CH3CHCH3(g)低
D.CH3CH2CH2(g)转变为CH3CHCH3(g)时需要吸热
18.科研小组发现反应2A(g)+B(g)C(g)△H分两步进行,反应过程中的能量变化如图所示。下列说法正确的是
A.两步反应均为放热反应
B.第一步反应为2A(g)+B(g)M(g)
C.第二步反应是总反应的决速步骤
D.升高温度,E1、E2均不变反应过程
19.氢键对生命活动具有重要意义, DNA中四种碱基通过氢键配对方式如下图(~代表糖苷键)。下列说法正确的是
A.碱基配对时,一个H可以同时与多个原子形成氢键
B.鸟嘌呤中1号N上的H转移到O上形成羟基,使其失去碱性
C.氢键的作用能较小,在DNA解旋和复制时容易破坏和形成
D.嘌呤中N-H键的平均键长大于0. 29nm
20.下列反应属于吸热反应的是
A.C6H12O6(葡萄糖aq)+6O26CO2+6H2O
B.CH3COOH+KOH=CH3COOK+H2O
C.A+B=C+D;ΔH <0
D.破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量
21.如图所示,有关化学反应和能量变化的说法正确的是
A.图表示的是吸热反应的能量变化
B.图中反应物比生成物稳定
C.图可以表示氧化钙与水反应的能量变化
D.图不需要加热就一定能发生,图一定需要加热才能发生
22.《厉害了,我的国》展示了我国科技发展的巨大成就,中国近五年来在探索太空、开发深海、开发新材料、开发5G技术等取得了举世瞩目的成就。下列说法不正确的是
A.华为5G手机搭载智能7 nm制程SOC“麒麟980”芯片,芯片的主要成分是单质硅
B.“天宫课堂”实验中,乙酸钠过饱和溶液结晶形成温热“冰球”,该过程发生吸热反应
C.火星车的热控材料纳米气凝胶能产生丁达尔效应
D.“华龙一号”核电项目中核反应堆所用铀棒中含有的与互为同位素
23.下列过程既是氧化还原反应,又是吸热反应的是
A.Na2O2溶于水
B.Ba(OH)2·8H2O与NH4Cl(s)混合并搅拌
C.灼热的炭与CO2反应
D.铝热反应
24.利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q),反应原理为ΔH=+88.62kJ·mol-1。下列叙述不正确的是
A.NBD比Q稳定 B.NBD转化为Q是吸热反应
C.NBD的能量比Q的能量高 D.NBD与Q互为同分异构体
25.下列反应的能量变化与图示相符的是
A.钠在氯气中燃烧 B.氢氧化钡与氯化铵固体的反应
C.铁与稀盐酸的反应 D.氨水与稀硫酸的反应
二、填空题
26.将20gBa(OH)2·8H2O晶体与10gNH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,用手触摸烧杯底部感觉,同时闻到气味。说明Ba(OH)2·8H2O跟NH4Cl的反应是(填“吸热”或“放热”)反应。该反应的化学方程式。
27.为了探究化学反应的热效应,某兴趣小组进行了实验:将纯固体物质X分别装入有水的锥形瓶里(发生化学反应),立即塞紧带U形管的塞子,发现U形管内红墨水的液面高度如图所示。
(1)若如图1所示,发生的反应(假设没有气体生成)是(填“放热”或“吸热”)反应。
(2)若如图2所示,发生的反应(假设没有气体生成)是(填“放热”或“吸热”)反应,以下选项中与其能量变化相同的是(填字母)。
A.碳与水蒸气的反应
B.CaCO3的分解反应
C.氮气与氢气合成氨的反应
28.放热反应和吸热反应
(1)化学反应中的能量变化
若反应物的能量小于生成物的能量,则反应过程中能量;若反应物的能量大于生成物的能量,则反应过程中能量。
下图中,图1表示反应,图2表示反应。
(2)放热反应和吸热反应
热的反应称为吸热反应,吸热反应的ΔH0。
热的反应称为放热反应,反热反应的ΔH0。
(3)常见的放热反应和吸热反应
根据反应过程中放出或吸收能量,可将化学反应分为放热反应和吸热反应。
常见的放热反应有:①燃烧反应;②中和反应;③金属与水或酸反应放出氢气;④大多数化合反应;⑤铝热反应。
常见的吸热反应有:①大多数分解反应;②需要持续加热的反应;③CO2+C2CO,C+H2OCO+H2;④铵盐与碱的反应,如Ba(OH)2、Ca(OH)2与NH4Cl的反应。
(4)放热过程和吸热过程
物质在发生物理变化时,也会放出或吸收能量。
常见的放热过程有:①浓硫酸稀释、NaOH溶于水;②物态变化:气态→液态→固态
常见的吸热过程有:①NH4NO3溶于水;②弱电解质的电离;③物态变化:固态→液态→气体
29.如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是。
(2)产生上述现象的原因是。
(3)写出有关反应的离子方程式:;反应中转移了0.04mol电子时;标准状况下产生多少mL的H2;生成的MgCl2物质的量浓度为。(溶液体积保持不变)
(4)由实验推知,镁片和盐酸的总能量(填“大于”、“小于”或“等于”)MgCl2溶液和H2的总能量;此反应为(填放热反应或者吸热反应)。
30.回答下列问题
(1)已知C(s,石墨)=C(s,金刚石) △H>0,则稳定性:金刚石石墨(填“>”、“=”或“<”)
(2)已知:2C(s) +2O2(g)=2CO2(g) △H1 2C(s) +O2(g)=2CO(g) △H2
则 △H1△H2 (填“>”、“=”或“<”)
(3)“嫦娥五号”已于2020年11月24日在海南文昌发射中心成功发射。火箭的第一、二级发动机所用的燃料为偏二甲肼和四氧化二氮,其中偏二甲肼可与肼(N2H4)来制备。用肼为燃料,四氧化二氮做氧化剂,二者反应生成氮气和气态水。已知:
①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol
②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol
写出气态肼和四氧化二氮反应的热化学方程式
(4)25℃、101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热量,写出该反应的热化学方程式
(5)0.50L 2.00mol/LH2SO4溶液与2.0L 1.00mol/LKOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H=
试卷第2页,共9页
参考答案:
1.D
【详解】A.电能可通过导线传输,较其它能源使用方便,A正确;
B.电能在现代社会中的使用随处都在,最为广泛,B正确;
C.电能使用不产生其它污染,导致的污染最小,C正确;
D.电能又称电力,是一种二次能源,D错误;
故选D。
2.A
【详解】①Ba(OH)2晶体与NH4Cl晶体反应是吸热反应,故不选;
②硫酸和氢氧化钠溶液混合放出热量,是放热反应,故选;
③硫受热融化,为吸热变化,故不选;
④石灰石高温分解为分解反应,属于吸热反应,故不选;
⑤灼热的炭和二氧化碳反应生成一氧化碳,为吸热反应,故不选;
⑥生石灰跟水反应生成熟石灰,为放热反应,故选;
⑦镁条在氮气中燃烧是燃烧反应,为放热反应,故选;
故选:A。
3.C
【详解】A.由图可知,太阳能使水分解,则实现了光能向化学能的转化,故A正确;
B.过程II中生成氢气、过氧化氢,形成化学键,过程Ⅱ放出能量并生成了O O键,故B正确;
C.由图可知,过程Ⅲ发生的反应为过氧化氢分解生成氢气和氧气的反应,H2O2═H2+O2,故C错误;
D.总反应为水分解生成氢气和氧气,则总反应2H2O→2H2+O2,故D正确。
故选C。
4.B
【详解】A.中和反应是酸和碱发生的反应,是放热反应,A错误;
B.燃烧是可燃物发生的剧烈的发光放热的反应,是放热反应,B正确;
C.断裂化学键需要吸收能量,C错误;
D.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,D错误;
故本题选B。
5.D
【详解】分子中,键能越小,分子越不稳定,从表中读出键能最小的是溴,故选D。
6.D
【详解】A.该反应为吸热反应,则X、Y的总能量小于M、N的总能量,但无法确定X与M的能量大小,故A错误;
B.该反应为吸热反应,与反应条件无关,该反应可能需要加热,也可能不需要加热,如氢氧化钡晶体与氯化铵晶体的反应为吸热反应,常温就可以进行,故B错误;
C.该反应为吸热反应,则破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量,故C错误;
D.反应X+Y=M+N为吸热反应,则X、Y的总能量低于M、N的总能量,故D正确;
故选D。
7.C
【分析】图示反应中反应物的能量比生成物的能量高,发生反应放出热量,因此表示的反应为放热反应。
【详解】A.煅烧石灰石制生石灰的反应是吸热反应,生成物的能量比反应物的高,与图示的放热反应不符合,A不符合题意;
B.氯酸钾分解制氧气的反应为吸热反应,生成物的能量比反应物的高,与图示的放热反应不符合,B不符合题意;
C.盐酸与NaOH溶液反应是放热反应,反应物的能量比生成物的能量高,与图象表示的放热反应符合,C符合题意;
D.工业上用H2还原Fe2O3制Fe的反应为吸热反应,生成物的能量比反应物的高,与图象表示的放热反应不符合,D不符合题意;
故合理选项是C。
8.C
【详解】A.由图示可知:该化学反应为放热反应,是化学键形成过程,不属于化学反应,故A错误;
B.溶解是物理变化过程,故B错误;
C.水煤气燃烧是放热的化学反应,故C正确;
D.煅烧石灰石是吸热的化学反应,故D错误;
故选C
9.C
【详解】A.甲烷燃烧属于放热反应,故A不符合题意;
B.活泼金属与酸的反应是放热反应,故B不符合题意;
C.C与水反应生成和,该反应过程吸收热量,为吸热反应,故C符合题意;
D.氢原子和氯原子形成键,该过程放出热量,故D不符合题意;
故选:C。
10.C
【详解】A.铝片与稀H2SO4的反应为放热反应,A错误;
B.Ba(OH)2 8H2O与NH4Cl的反应为吸热反应,但不属于氧化还原反应,B错误;
C.灼热的炭与CO2的反应中C元素化合价发生变化,属于氧化还原反应,且为吸热反应,C正确;
D.甲烷在O2中的燃烧反应是放热反应,D错误;
答案选C。
11.B
【详解】A.H2在Cl2中燃烧反应产生HCl,同时放出热量,因此该反应是放热反应,A不符合题意;
B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应发生会吸收热量,使体系温度降低,因此该反应是吸热反应,B符合题意;
C.NaOH与稀盐酸发生中和反应会放出热量,使溶液温度升高,因此该反应为放热反应,C不符合题意;
D.Al与稀硫酸发生置换反应产生硫酸铝和氢气,同时放出热量,使溶液温度升高,因此该反应是放热反应,D不符合题意;
故合理选项是B。
12.C
【详解】A.硫酸氢钠加热到熔融状态电离成钠离子和硫酸氢根离子,克服钠离子和硫酸氢根离子之间的离子键,故A错误;
B.和完全反应,由于等物质的量的气态水的能量比液态水的能量高,故生成气态水比生成液态水放出的热量少,故B错误;
C.氧气转化成臭氧,属于化学变化,既有化学键的断裂,又有化学键的形成,故C正确;
D.由石墨转化为金刚石为吸热反应可知,等物质的量的石墨的能量比金刚石低,故燃烧等质量金刚石和石墨,石墨放出热量少,故D错误;
答案选C。
13.D
【详解】由图可知,该过程反应物与生成物的能量不同,且反应物总能量高于生成物,因此说明该过程是放热的化学反应,NaOH 固体溶于水、氨气液化是物理变化;碳酸钙分解是吸热反应;镁条溶于盐酸是放热反应,故答案为D。
14.A
【详解】A.生物柴油的燃烧需要点燃,燃料燃烧反应属于放热反应,物质是放热反应还是吸热反应与反应条件无关,A错误;
B.生物柴油在燃烧的过程中会放出大量热量,同时产生光,物质反应过程中能量转化主要是化学能转化为热能和光能,B正确;
C.“地沟油”主要成分是高级脂肪酸甘油酯,其经过加工处理可用来生物柴油,可以作燃料油使用,因此实现了厨余垃圾的合理利用,C正确;
D.生物柴油是油脂反应产生的,油脂不属于化石燃料;化石能源主要是煤、石油、天然气,可见生物柴油不属于化石能源,D正确;
故合理选项是A。
15.C
【详解】A.复合光催化反应过程中实现了光能到化学能的转化,不是电能到化学能的转化,故A错误;
B.H2O2为中间产物不属于催化剂,故B错误;
C.水分解是吸热反应,在此过程中,水的分解分两步,若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应,故C正确;
D.过程I是水分解为氢气和过氧化氢,过程II时过氧化氢分解生成水和氧气,整个过程是水分解为氢气和氧气,总反应为:,故D错误;
答案选C。
16.A
【详解】A.第④步的正反应活化能最大,即E正=1.86-(-0.16)=2.02eV,A正确;
B.步骤①反应物的能量大于生成物的,为放热反应,CO(g)+H2O(g)=CO+H2O H<0,B错误;
C.步骤③的化学方程式为CO +OH + H2O(g)=COOH +H2O ,C错误;
D.步骤⑤活化分子H 生成H2,也形成H-H键,D错误;
故选:A。
17.C
【详解】A.由图可知,反应①中CH3CH2CH3(g)和Br(g)具有的能量小于CH3CH2CH2(g)和HBr(g)具有的能量,则该反应为吸热反应,A错误;
B.催化剂能降低反应的活化能,加快反应速率,反应②的活化能低,反应②的反应速率快,但反应①和②同时进行,不能确定反应②是否使用了催化剂, B错误;
C.由图可知,活化能:反应①>②,则反应②的反应速率快,生成物含量:CH3CHCH3(g) >CH3CH2CH2(g),C正确;
D.由图可知,1 mol CH3CH2CH2(g)和1 mol HBr(g)具有的能量大于1 mol CH3CHCH3(g)和1 mol HBr(g)具有的能量,所以CH3CH2CH2(g)转变为CH3CHCH3(g)时会放热,D错误;
故合理选项是C。
18.B
【详解】A.由图可知,第一步反应为吸热反应,A项错误;
B.由总反应和第二步反应,推知第一步反应为,B项正确;
C.第一步反应的活化能大于第二步反应的活化能,故第一步反应是总反应的决速步骤,C项错误;
D.升高温度,、均增大,D项错误;
故选B。
19.C
【详解】A.从图中可以看出,碱基配对时,一个H只能与1个原子形成氡键,故A错误;
B.鸟嘌呤中1号N上的H转移到O上形成羟基,氮原子上仍有一孤电子对,还可以吸引水电离的氢离子,使水电离出更多的氢氧根离子,鸟嘌呤没有失去碱性,故B错误;
C.氢键的作用能较小,在DNA解旋和复制时容易破坏和形成,故C正确;
D.N-H……O中的H和O间的距离为0.29nm,是氢键的键长,氢键作用力比化学键弱得多,键长也长得多,所以嘌呤中N-H键的平均键长远小于0. 29nm,故D错误;
故选C。
20.D
【详解】A.该反应为氧化还原反应,氧化还原反应属于放热反应,A错误;
B.该反应为中和反应,中和反应为放热反应,B错误;
C.△H小于0,为放热反应,C错误;
D.破坏生成物全部化学键所需要的能量小于破坏反应物全部化学键所需要的能量,△H大于0,为吸热反应,D正确;
答案选D。
21.B
【详解】A.图反应物的总能量高于生成物,所以为放热反应,故A错误;
B.图中反应物的总能量比生成物低,所以反应物比生成物稳定,故B正确;
C.氧化钙与水反应是放热反应,反应物的总能量高于生成物,故C错误;
D.放热反应有时候需要加热,吸热反应不一定加热,故D错误;
故选B。
22.B
【详解】A.晶体Si的导电性介于导体与绝缘体之间,是良好的半导体采用,芯片的主要成分是单质硅,A正确;
B.乙酸钠在温度较高的水中的溶解度非常大,很容易形成过饱和溶液,暂时处于亚稳态,这种溶液里只要有一点的结晶和颗粒,就能打破它的亚稳态,迅速结晶的同时释放出大量热量,但没有发生吸热反应,B错误;
C.火星车的热控材料纳米气凝胶属于胶体,因此能产生丁达尔效应,C正确;
D.与的质子数相同,而中子数不同,因此二者互为同位素,D正确;
故合理想象是B。
23.C
【详解】A.Na2O2溶于水反应产生NaOH、O2,反应过程中元素化合价发生了变化,因此反应属于氧化还原反应;该反应发生放出热量,因此反应属于放热反应,A不符合题意;
B.Ba(OH)2·8H2O与NH4Cl(s)混合并搅拌发生反应产生BaCl2、NH3、H2O,反应过程中元素化合价没有发生变化,因此反应不属于氧化还原反应;该反应发生吸收热量,因此反应属于吸热反应,B不符合题意;
C.灼热的炭与CO2反应产生CO,反应过程中元素化合价发生了变化,因此反应属于氧化还原反应;该反应发生吸收热量,因此反应属于吸热反应,C符合题意;
D.铝热反应是Al与金属氧化物在高温下反应产生Al2O3和金属单质。反应过程中元素化合价发生了变化,因此反应属于氧化还原反应;该反应发生放出热量,因此反应属于放热反应,D不符合题意;
故合理选项是C。
24.C
【详解】A.吸热反应中物质Q具有的总能量比NBD的高,能量越低越稳定,NBD比Q稳定,故A正确;
B.该反应是吸热反应,因此NBD转化为Q是吸热反应,故B正确;
C.吸热反应中物质Q具有的总能量比NBD的高,故C错误;
D.NBD和Q分子式相同,结构不同,二者属于同分异构体,故D正确;
故选C。
25.B
【分析】生成物总能量高于反应物总能量,为吸热反应,常见的吸热反应有:大多数的分解反应、氢气作还原剂的氧化还原反应、氯化铵与氢氧化钡的反应等。
【详解】A.钠在氯气中燃烧反应为放热反应,A错误;
B.氢氧化钡与氯化铵固体的反应为吸热反应,B正确;
C.铁与稀盐酸的反应是发生了氧化还原反应,为放热反应,C错误;
D.氨水与稀硫酸的反应是酸碱中和反应,为放热反应,D错误;
故选B。
26. 烧杯底部很冷 刺激性气味 吸热
【详解】,该反应是典型的吸热反应,将20gBa(OH)2·8H2O晶体与10gNH4Cl晶体一起放入烧杯中,用玻璃棒快速搅拌,用手触摸烧杯底部感觉烧杯底部很冷,同时闻到刺激性气味气味。
27.(1)放热
(2) 吸热 AB
【解析】(1)
由于U形管右侧液面升高,说明锥形瓶内气压由于加入物质而增大,则该反应放热;
(2)
由于U形管右侧液面降低,说明锥形瓶内气压由于加入物质而降低,则该反应吸热,碳与水蒸气的反应是吸热反应,CaCO3的分解反应是吸热反应,氮气与氢气合成氨的反应放热反应,故答案为AB。
28. 吸收 放出 放热 吸热 吸收 > 放出 <
【详解】(1)若反应物的能量小于生成物的能量,则反应过程中吸收能量;若反应物的能量大于生成物的能量,则反应过程中放出能量。图中,图1反应物能量高于生成物能量,表示放热反应,图2反应物能量低于生成物能量,表示吸热反应。
(2)吸收热的反应称为吸热反应,吸热反应的ΔH>0。放出热的反应称为放热反应,反热反应的ΔH<0。
29. 镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 448 2.0mol/L 大于 放热反应
【详解】(1)、(2)镁是活泼金属,能与稀盐酸发生反应,在镁片上产生大量气泡,即产生氢气,随着反应的进行,镁片逐渐溶解,该反应放出大量的热,而饱和石灰水随着温度的升高,溶解度逐渐减小,逐渐有Ca(OH)2晶析析出,所以烧杯中溶液变浑浊;
(3)该反应的离子的方程式为;反应中转移了0. 04mol电子时,即生成0.02molH2,标准状况下产生448mL的H2;生成的MgCl2物质的量浓度为;
(4)由实验可知,该反应为放热反应,反应物的总能量大于生成物的总能量,所以镁片溶液和盐酸的总能量大于MgCl2和H2的总能量。
30.(1)<
(2)<
(3)2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol
(4)CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1
(5)-57.3kJ /mol
【详解】(1)物质的能量越高,该物质越不稳定,C(s,石墨)=C(s,金刚石) △H>0,石墨的能量小于金刚石,所以稳定性石墨>金刚石,故答案为:<;
(2)C的燃烧为放热反应,则△H < 0,完全燃烧放出较多能量,放出的能量越多△H越小,则△H1<△H2,故答案为:< ;
(3)①N2(g) + 2O2(g) = N2O4(g) △H=10.7kJ/mol;②N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H=-543kJ/mol,由盖斯定律②×2 -①得到2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol,故答案为:2N2H4(g) + N2O4 (g)= 3N2(g)+ 4H2O(g) △H = -1096.7KJ/mol;
(4)1molCO为28g,14gCO在足量的O2中充分燃烧,放出141.3kJ 的热,则1molCO完全燃烧放出282.6kJ热量,CO的燃烧热为△H =-282.6kJ·mol-1,该反应的热化学方程式为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1,故答案为:CO(g)+O2(g)=CO2(g) △H =-282.6kJ·mol-1;
(5)0.50L 2.00mol/ L H2SO4溶液与2.00L 1.00mol/ L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为- 11.46kJ/mol,中和热为- 57.3kJ/mol,故答案为:-57.3kJ /mol
