专题1 揭示物质结构的奥秘 测试卷(含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题1 揭示物质结构的奥秘 测试卷(含解析)2023-2024学年高二下学期化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 296.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 08:27:45 | ||
图片预览




文档简介
专题1《揭示物质结构的奥秘》测试卷
一、单选题
1.属于同素异形体的一组物质是
A.氧气和液氧 B.水和过氧化氢 C.金刚石和石墨 D.一氧化碳和二氧化碳
2.北京冬奥会成功举办、神舟十三号顺利往返、“天宫课堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是
A.冬奥会“飞扬”火炬所用的燃料为氧化性气体
B.飞船返回舱表层材料中的玻璃纤维属于天然有机高分子
C.探测器使用的硅太阳能电池板,其主要成分是
D.核电站反应堆所用铀棒中含有的与互为同位素
3.科学家运用铝()铍()测年法确定了“北京人”的年龄。下列关于的说法正确的是
A.核外电子数为6 B.中子数为6 C.质子数为14 D.核电荷数为10
4.13C—NMR可以用于含碳化合物的结构分析,13C表示的碳原子
A.核外有13个电子
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
5.下列不同时期原子结构模型的提出时间排列正确的是( )
①电子分层排布模型 ②“葡萄干布丁”模型 ③量子力学模型 ④道尔顿原子学说 ⑤核式模型
A.①③②⑤④ B.④②③①⑤
C.④②⑤①③ D.④⑤②①③
6.2021年我国在科技上不断取得重大成果。下列有关叙述错误的是
A."天问一号"太阳能电池复合材料的主要成分为石墨纤维和二氧化硅
B.无细胞化学酶系统催化CO2合成淀粉是促进碳中和的一种方法
C."神舟"十二号载人飞船中所使用的高强度碳纤维属于新型复合材料
D."嫦娥五号"登月采集的月壤样本中含有的3He,与地球上的2He互为同位素
7.下列各组微粒之间的关系正确的是
A.乙酸、乙二酸:同分异构体 B.H、H:同位素
C.CO2、CO:同素异形体 D.甲醇、苯甲醇:同系物
8.下列说法正确的是
A.和具有相同的中子数
B.和中有相同的阴离子
C.和都属于铁元素,核外电子数相同
D.和有相似的化学性质
9.下列有关科技成果解读错误的是
选项 科技成果 相关解读
A 我国科学家首次利用CO2和H2人工合成淀粉 有助于实现碳达峰、碳中和
B 我国首套吨级氢液化系统研制成功 液氢汽化时因断裂化学键而吸热
C 我国科学家研制出了高强度、高耐蚀镁合金材料(AZ80) AZ80材料属于金属材料
D 我国科学家发现磷酸锆可除去核废水中的Sr Sr的中子数与质子数之差为14
A.A B.B C.C D.D
10.我们可以根据物质的组成,性质,结构或用途等进行分类。下列关于物质的分类正确的是
A.天然气—化石燃料;金刚石和石墨—碳的同位素
B.亚硫酸氢钠—正盐;95%酒精—消毒剂
C.氢氟酸—弱酸;石墨烯—无机非金属材料
D.稀豆浆—胶体;NH4Cl —共价化合物
11.下列说法正确的是
A.乙烯的结构简式:CH2CH2
B.H2NCH2COOH和CH3CH2NO2是同分异构体
C.分子式C3H6和C4H8的烃一定互为同系物
D.C60和C70是具有相同质子数的不同核素
12.下列物质的相互关系描述正确的是
A.、互为同位素
B.和互为同系物
C.金刚石、碳纳米管互为同素异形体
D.新戊烷和2,2-二甲基丙烷互为同分异构体
13.某微粒用Xn+表示,下列关于该微粒的叙述正确的是
A.所含质子数= A-n B.所含电子数=Z+n
C.所含中子数=A-Z D.质量数=Z+A
14.氯只有35Cl和37Cl两种稳定同位素,它们在氯气中的原子个数之比35Cl∶37Cl为3∶1,则相对分子质量为70、72、74的氯气分子数之比可能是
A.5∶2∶3 B.5∶2∶2 C.9∶3∶1 D.9∶3∶2
15.下列说法正确的是
A.Cl与是不同的核素,具有不同的化学性质
B.、 与互为同分异构体
C.木糖醇[]与甘油()具有相同的官能团,二者属于同系物
D.、石墨、互为同素异形体
二、填空题
16.现有下列几种粒子:1H、2H、3H、1H+、234U、235U、238U、40K、40Ca、Cl2、14N、14C。请回答下列问题:
(1)以上粒子属于 种元素,属于氢元素的核素有 种,属于铀元素的核素有 种。互为同位素的原子分别为 , 。
(2)质量数相等的粒子为 , , 。
17.用X表示原子:
(1)中性原子的中子数N= 。
(2)AXn+共有x个电子,则该阳离子的中子数N= 。
(3)AXn-共有x个电子,则该阴离子的中子数 N= 。
(4)12C16O2分子中的中子数N= 。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为 。
18.有下列原子:① 12C;② 39K;③ 40Ca;④ 13C;⑤ 14N;⑥ 40Ar。其中:
(1)互为同位素的是 。
(2)质量数相等,但不能互称同位素的是 。
(3)中子数相等,但质子数不相等的是 、 。
三、实验题
19.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素: (填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
① ;
② ;
③ 。
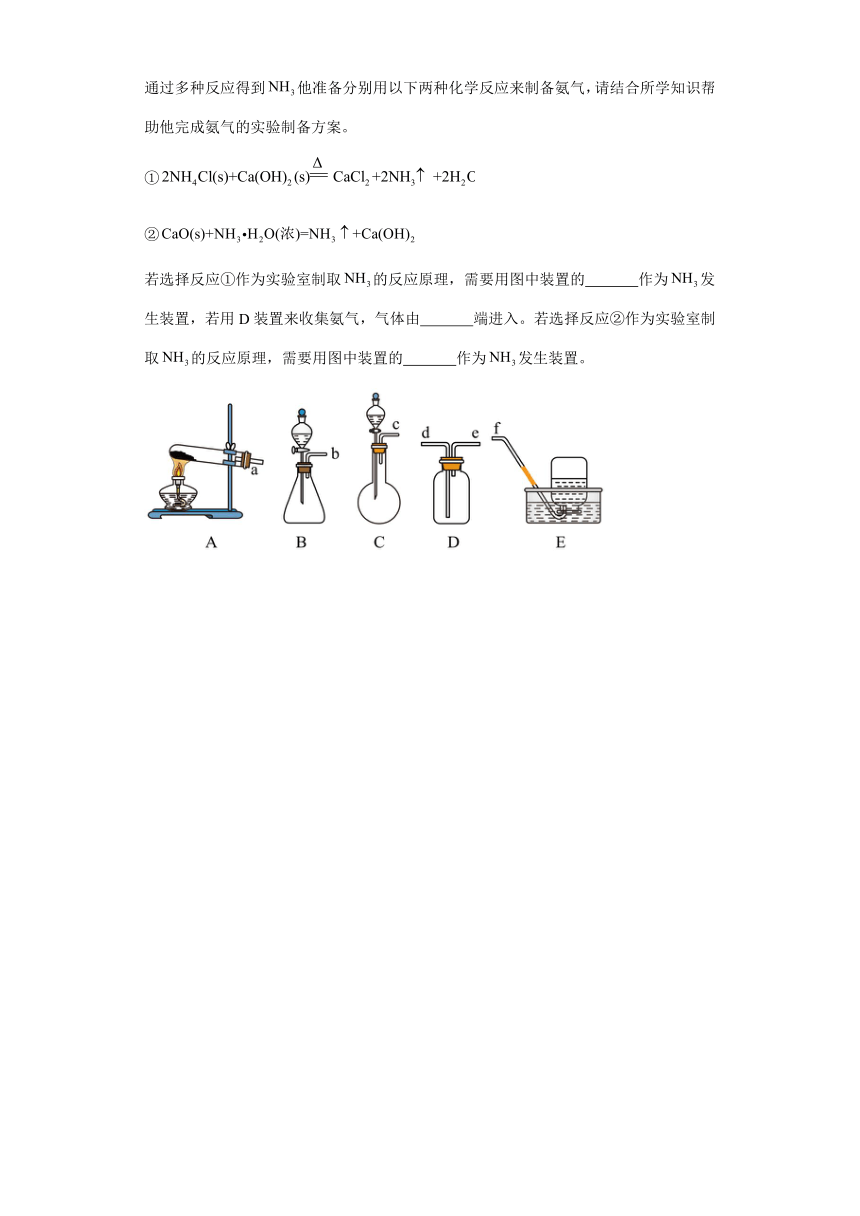
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的 作为发生装置,若用D装置来收集氨气,气体由 端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的 作为发生装置。
试卷第4页,共5页
参考答案:
1.C
【详解】A. 液氧是液态的氧气,与氧气属于是同一种物质,不是同素异形体,故A错误。
B. 水和双氧水都是化合物,不是单质,不属于同素异形体,故B错误。
C. 金刚石和石墨都是由碳元素形成的不同物质,都是单质,互为同素异形体,故C正确。
D. 一氧化碳和二氧化碳都是化合物,不是单质,不属于同素异形体,故D错误。
故答案选:C。
【点睛】解题需注意判断同素异形体的关键把握两点:①同种元素形成的;②不同单质。
2.D
【详解】A.冬奥会“飞扬”火炬所用的燃料为还原性气体,A错误;
B.玻璃纤维属于无机非金属材料,不属于天然有机高分子材料,B错误;
C.探测器使用的硅太阳能电池板,其主要成分是晶体硅,C错误;
D.与的质子数都为92,中子数分别为143、146,是质子数相同、中子数不同的同一元素,两者互称同位素,D正确;
答案选D。
3.B
【详解】A.核外电子数=质子数=4,故A错误;
B.中子数=质量数-质子数=10-4=6,故B正确;
C.质子数为4,故C错误;
D.核电荷数=质子数=4,故D错误。
答案选B。
4.D
【详解】核素C的质子为6,电子数也为6,质量数为13,中子数为7,故选项D符合题意,答案选D。
5.C
【详解】①电子分层排布模型由玻尔1913年提出;
②“葡萄干布丁”模型由汤姆逊1903年提出;
③量子力学模型于1926年提出;
④道尔顿原子学说于1803年提出;
⑤核式模型由卢瑟福于1911年提出;
所以顺序为④②⑤①③,答案选C。
6.A
【详解】A.太阳能电池复合材料的主要成分为石墨纤维和单晶硅,二氧化硅为非金属氧化物,不能导电,选项A错误;
B.由CO2合成淀粉可降低大气中的CO2的含量,对促进碳中和具有积极的意义,选项B正确;
C.碳纤维是一种含碳量达90%以上的高强度纤维,是一种新型复合材料,选项C正确;
D.质子数相同、中子数不同的同种元素互称同位素,3He与2He质子数相同、中子数不同,互为同位素,选项D正确;
答案选A。
7.B
【详解】A.乙酸(CH3COOH)、乙二酸(HOOC-COOH)的分子式不同,不是同分异构体,A错误;
B.、的质子数相同,中子数不同,互为同位素,B正确;
C.同种元素形成的不同单质互为同素异形体,CO2、CO都是化合物,C错误;
D.甲醇、苯甲醇都是醇类,但分子组成不是相差n个CH2,不是同系物,D错误;
故选B。
8.A
【详解】A.和具有相同的中子数,均是10个,A正确;
B.和中的阴离子分别是MnO、MnO,B错误;
C.和都属于铁元素,核外电子数不相同,分别是24、23,C错误;
D.和分别是He、Be,二者的化学性质不相似,D错误;
答案选A。
9.B
【详解】A.我国科学家首次利用CO2和H2人工合成淀粉,可以降低二氧化碳的排放,有助于实现碳达峰、碳中和,故A正确;
B.氢气液化是物理变化,不会断裂化学键,故B错误;
C.高强度、高耐蚀镁合金材料属于合金材料,故C正确;
D.S的质子数为38,中子数为90-38=52,中子数与质子数之差为14,故D正确;
故选B。
10.C
【详解】A.天然气的主要成分为甲烷属于化石燃料;金刚石和石墨组成元素均为C元素,但是是两种不同物质,不是碳的同位素,A错误;
B.亚硫酸氢钠为酸式盐不是正盐;75%酒精为消毒剂,B错误;
C.氢氟酸为弱酸;石墨烯为无机非金属材料,C正确;
D.稀豆浆为胶体;NH4Cl为离子化合物,D错误;
答案选C。
11.B
【详解】A.乙烯含有碳碳双键,其结构简式:CH2=CH2,A错误;
B.H2NCH2COOH和CH3CH2NO2的分子式相同,结构不同,二者互为同分异构体,B正确;
C.分子式C3H6和C4H8的烃结构不一定相同,二者不一定互为同系物,C错误;
D.C60和C70是由同一种元素形成的不同单质,二者互为同素异形体,D错误;
答案选B。
12.C
【详解】A.同位素是具有相同质子数,不同中子数的同一元素的不同核素,、均为单质,不互为同位素,故A错误;
B.属于酚,属于醇,不互为同系物,故B错误;
C.金刚石、碳纳米管为碳元素形成的不同单质,互为同素异形体,故C正确;
D.新戊烷和2,2-二甲基丙烷的结构式均为,是同一种物质,故D错误。
答案为:C。
13.C
【详解】A.Xn+微粒的质子数为Z,故A错误;
B.Xn+微粒的质子数为Z,电子数为Z-n,故B错误;
C.Xn+微粒所含的中子数为A-Z,故C正确;
D.Xn+微粒的质量数为A,故D错误。
故选C。
14.D
【详解】设相对分子质量为70、72、74的Cl2分子个数分别为X、Y、Z个,相对分子质量为70的Cl2是由 2个35Cl组成的,故x个相对分子质量为70的Cl2中含有的35Cl原子个数为 2X个;相对分子质量为72的Cl2是由一个35Cl和一个37Cl组成,故y个相对分子质量为72的Cl2中含有的35Cl原子和37Cl原子个数分别为为Y个;相对分子质量为74的Cl2是由 2个37Cl组成的,故z个相对分子质量为74的Cl2中含有的37Cl原子个数为为2Z个;通过上述分析可知则:35Cl原子有(2X+Y)个,37Cl原子有(Y+2Z)个,已知35Cl和37Cl的个数之比为 3∶1,则(2X+Y)∶(Y+2Z)=3∶1,即3Y+6Z=2X+Y,解得 X=Y+3Z,满足此关系就可。
A.将X=5、Y=2、Z=1分别带入关系式X═Y+3Z,可知该式子不成立,错误;
B.将X=5、Y=2、Z=2分别带入关系式X═Y+3Z,可知该式子不成立,错误;
C.将X=9、Y=3、Z=1分别带入关系式X═Y+3Z,可知该式子不成立,错误;
D.将X=9、Y=3、Z=4分别带入关系式X=Y+3Z,可知该式子成立,正确。
15.B
【详解】A.具有一定数目质子数和一定数目中子数的原子为一种核素,氯离子不是核素,A错误;
B.三者的分子式相同,结构不同,互为同分异构体,B正确;
C.CH2OH(CHOH)3CH2OH中含5个-OH,CH2OHCHOHCH2OH含3个-OH,官能团数目不同,二者不是同系物,C错误;
D.13C是原子,不是单质,石墨、C60是碳元素形成的不同的单质,互为同素异形体,D错误;
故答案选B。
16.(1) 7 3 3 1H、2H、3H 234U、235U、238U
(2) 40K、40Ca 14N、14C 1H、1H+
【分析】(1)
以上微粒中含有H、U、K、Ca、Cl、N、C,共有7种元素;1H、1H+是1H的原子和离子,1H、2H、3H属于氢元素的3种不同核素,且互为同位素,属于氢元素的核素有3种;234U、235U、238U属于铀元素的3种不同核素,也互为同位素;故答案为:7;3;3;1H、2H、3H;234U、235U、238U;
(2)
质量数相等的粒子,即相对原子质量相等的微粒,分别为40K、40Ca;14N、14C;1H、1H+;故答案为:40K、40Ca;14N、14C;1H、1H+。
17. A-Z A-x-n A-x+n 22 mol
【详解】(1)根据“质子数+中子数=质量数”的关系可知:N=A-Z。
(2)AXn+共有x个电子,中性原子X的电子数为x+n,则N=A-x-n。
(3)AXn-共有x个电子,中性原子X的电子数为x-n,则N=A-x+n。
(4)12C16O2分子中的中子数为12-6+(16-8)×2=22。
(5)A2-原子核内有x个中子,其质量数为m,则质子数为m-x,含电子数为m-x+2,则n g A2-所含电子的物质的量为 mol。
18. ①④ ③⑥ ②和③ ④和⑤
【详解】(1)质子数相同而中子数不同的同一种元素的不同核素互为同位素,则互为同位素的是12C和13C。
(2)质量数相等,但不能互称同位素的是40Ca和40Ar。
(3)13C和14N的中子数相等均是7,但质子数不相等,分别是6、7。
19.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【解析】(1)
实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)
根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)
反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C
一、单选题
1.属于同素异形体的一组物质是
A.氧气和液氧 B.水和过氧化氢 C.金刚石和石墨 D.一氧化碳和二氧化碳
2.北京冬奥会成功举办、神舟十三号顺利往返、“天宫课堂”如期开讲及“华龙一号”核电海外投产等,均展示了我国科技发展的巨大成就。下列相关叙述正确的是
A.冬奥会“飞扬”火炬所用的燃料为氧化性气体
B.飞船返回舱表层材料中的玻璃纤维属于天然有机高分子
C.探测器使用的硅太阳能电池板,其主要成分是
D.核电站反应堆所用铀棒中含有的与互为同位素
3.科学家运用铝()铍()测年法确定了“北京人”的年龄。下列关于的说法正确的是
A.核外电子数为6 B.中子数为6 C.质子数为14 D.核电荷数为10
4.13C—NMR可以用于含碳化合物的结构分析,13C表示的碳原子
A.核外有13个电子
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
5.下列不同时期原子结构模型的提出时间排列正确的是( )
①电子分层排布模型 ②“葡萄干布丁”模型 ③量子力学模型 ④道尔顿原子学说 ⑤核式模型
A.①③②⑤④ B.④②③①⑤
C.④②⑤①③ D.④⑤②①③
6.2021年我国在科技上不断取得重大成果。下列有关叙述错误的是
A."天问一号"太阳能电池复合材料的主要成分为石墨纤维和二氧化硅
B.无细胞化学酶系统催化CO2合成淀粉是促进碳中和的一种方法
C."神舟"十二号载人飞船中所使用的高强度碳纤维属于新型复合材料
D."嫦娥五号"登月采集的月壤样本中含有的3He,与地球上的2He互为同位素
7.下列各组微粒之间的关系正确的是
A.乙酸、乙二酸:同分异构体 B.H、H:同位素
C.CO2、CO:同素异形体 D.甲醇、苯甲醇:同系物
8.下列说法正确的是
A.和具有相同的中子数
B.和中有相同的阴离子
C.和都属于铁元素,核外电子数相同
D.和有相似的化学性质
9.下列有关科技成果解读错误的是
选项 科技成果 相关解读
A 我国科学家首次利用CO2和H2人工合成淀粉 有助于实现碳达峰、碳中和
B 我国首套吨级氢液化系统研制成功 液氢汽化时因断裂化学键而吸热
C 我国科学家研制出了高强度、高耐蚀镁合金材料(AZ80) AZ80材料属于金属材料
D 我国科学家发现磷酸锆可除去核废水中的Sr Sr的中子数与质子数之差为14
A.A B.B C.C D.D
10.我们可以根据物质的组成,性质,结构或用途等进行分类。下列关于物质的分类正确的是
A.天然气—化石燃料;金刚石和石墨—碳的同位素
B.亚硫酸氢钠—正盐;95%酒精—消毒剂
C.氢氟酸—弱酸;石墨烯—无机非金属材料
D.稀豆浆—胶体;NH4Cl —共价化合物
11.下列说法正确的是
A.乙烯的结构简式:CH2CH2
B.H2NCH2COOH和CH3CH2NO2是同分异构体
C.分子式C3H6和C4H8的烃一定互为同系物
D.C60和C70是具有相同质子数的不同核素
12.下列物质的相互关系描述正确的是
A.、互为同位素
B.和互为同系物
C.金刚石、碳纳米管互为同素异形体
D.新戊烷和2,2-二甲基丙烷互为同分异构体
13.某微粒用Xn+表示,下列关于该微粒的叙述正确的是
A.所含质子数= A-n B.所含电子数=Z+n
C.所含中子数=A-Z D.质量数=Z+A
14.氯只有35Cl和37Cl两种稳定同位素,它们在氯气中的原子个数之比35Cl∶37Cl为3∶1,则相对分子质量为70、72、74的氯气分子数之比可能是
A.5∶2∶3 B.5∶2∶2 C.9∶3∶1 D.9∶3∶2
15.下列说法正确的是
A.Cl与是不同的核素,具有不同的化学性质
B.、 与互为同分异构体
C.木糖醇[]与甘油()具有相同的官能团,二者属于同系物
D.、石墨、互为同素异形体
二、填空题
16.现有下列几种粒子:1H、2H、3H、1H+、234U、235U、238U、40K、40Ca、Cl2、14N、14C。请回答下列问题:
(1)以上粒子属于 种元素,属于氢元素的核素有 种,属于铀元素的核素有 种。互为同位素的原子分别为 , 。
(2)质量数相等的粒子为 , , 。
17.用X表示原子:
(1)中性原子的中子数N= 。
(2)AXn+共有x个电子,则该阳离子的中子数N= 。
(3)AXn-共有x个电子,则该阴离子的中子数 N= 。
(4)12C16O2分子中的中子数N= 。
(5)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为 。
18.有下列原子:① 12C;② 39K;③ 40Ca;④ 13C;⑤ 14N;⑥ 40Ar。其中:
(1)互为同位素的是 。
(2)质量数相等,但不能互称同位素的是 。
(3)中子数相等,但质子数不相等的是 、 。
三、实验题
19.归纳与演绎是重要的科学方法,也是常用的化学学习方法,请用该方法解决下列问题。
(1)我们已经学过实验室制取、、三种气体的反应原理与收集方法。请你归纳出选择实验室制取气体反应的发生装置主要考虑的因素: (填序号)。
①反应物的状态 ②生成气体的溶解性 ③反应条件 ④原料为纯净物 ⑤气体的密度
(2)探究课上,小明同学为了探究氨气的某些性质,做了如图实验(从左向右依次是他所做实验及现象)。
通过实验,小明同学可得出氨气的三点性质,分别是
① ;
② ;
③ 。
(3)在获得氨气的主要性质后,小明决定自己来制取氨气,他先查阅了有关资料,知道可通过多种反应得到他准备分别用以下两种化学反应来制备氨气,请结合所学知识帮助他完成氨气的实验制备方案。
①
②
若选择反应①作为实验室制取的反应原理,需要用图中装置的 作为发生装置,若用D装置来收集氨气,气体由 端进入。若选择反应②作为实验室制取的反应原理,需要用图中装置的 作为发生装置。
试卷第4页,共5页
参考答案:
1.C
【详解】A. 液氧是液态的氧气,与氧气属于是同一种物质,不是同素异形体,故A错误。
B. 水和双氧水都是化合物,不是单质,不属于同素异形体,故B错误。
C. 金刚石和石墨都是由碳元素形成的不同物质,都是单质,互为同素异形体,故C正确。
D. 一氧化碳和二氧化碳都是化合物,不是单质,不属于同素异形体,故D错误。
故答案选:C。
【点睛】解题需注意判断同素异形体的关键把握两点:①同种元素形成的;②不同单质。
2.D
【详解】A.冬奥会“飞扬”火炬所用的燃料为还原性气体,A错误;
B.玻璃纤维属于无机非金属材料,不属于天然有机高分子材料,B错误;
C.探测器使用的硅太阳能电池板,其主要成分是晶体硅,C错误;
D.与的质子数都为92,中子数分别为143、146,是质子数相同、中子数不同的同一元素,两者互称同位素,D正确;
答案选D。
3.B
【详解】A.核外电子数=质子数=4,故A错误;
B.中子数=质量数-质子数=10-4=6,故B正确;
C.质子数为4,故C错误;
D.核电荷数=质子数=4,故D错误。
答案选B。
4.D
【详解】核素C的质子为6,电子数也为6,质量数为13,中子数为7,故选项D符合题意,答案选D。
5.C
【详解】①电子分层排布模型由玻尔1913年提出;
②“葡萄干布丁”模型由汤姆逊1903年提出;
③量子力学模型于1926年提出;
④道尔顿原子学说于1803年提出;
⑤核式模型由卢瑟福于1911年提出;
所以顺序为④②⑤①③,答案选C。
6.A
【详解】A.太阳能电池复合材料的主要成分为石墨纤维和单晶硅,二氧化硅为非金属氧化物,不能导电,选项A错误;
B.由CO2合成淀粉可降低大气中的CO2的含量,对促进碳中和具有积极的意义,选项B正确;
C.碳纤维是一种含碳量达90%以上的高强度纤维,是一种新型复合材料,选项C正确;
D.质子数相同、中子数不同的同种元素互称同位素,3He与2He质子数相同、中子数不同,互为同位素,选项D正确;
答案选A。
7.B
【详解】A.乙酸(CH3COOH)、乙二酸(HOOC-COOH)的分子式不同,不是同分异构体,A错误;
B.、的质子数相同,中子数不同,互为同位素,B正确;
C.同种元素形成的不同单质互为同素异形体,CO2、CO都是化合物,C错误;
D.甲醇、苯甲醇都是醇类,但分子组成不是相差n个CH2,不是同系物,D错误;
故选B。
8.A
【详解】A.和具有相同的中子数,均是10个,A正确;
B.和中的阴离子分别是MnO、MnO,B错误;
C.和都属于铁元素,核外电子数不相同,分别是24、23,C错误;
D.和分别是He、Be,二者的化学性质不相似,D错误;
答案选A。
9.B
【详解】A.我国科学家首次利用CO2和H2人工合成淀粉,可以降低二氧化碳的排放,有助于实现碳达峰、碳中和,故A正确;
B.氢气液化是物理变化,不会断裂化学键,故B错误;
C.高强度、高耐蚀镁合金材料属于合金材料,故C正确;
D.S的质子数为38,中子数为90-38=52,中子数与质子数之差为14,故D正确;
故选B。
10.C
【详解】A.天然气的主要成分为甲烷属于化石燃料;金刚石和石墨组成元素均为C元素,但是是两种不同物质,不是碳的同位素,A错误;
B.亚硫酸氢钠为酸式盐不是正盐;75%酒精为消毒剂,B错误;
C.氢氟酸为弱酸;石墨烯为无机非金属材料,C正确;
D.稀豆浆为胶体;NH4Cl为离子化合物,D错误;
答案选C。
11.B
【详解】A.乙烯含有碳碳双键,其结构简式:CH2=CH2,A错误;
B.H2NCH2COOH和CH3CH2NO2的分子式相同,结构不同,二者互为同分异构体,B正确;
C.分子式C3H6和C4H8的烃结构不一定相同,二者不一定互为同系物,C错误;
D.C60和C70是由同一种元素形成的不同单质,二者互为同素异形体,D错误;
答案选B。
12.C
【详解】A.同位素是具有相同质子数,不同中子数的同一元素的不同核素,、均为单质,不互为同位素,故A错误;
B.属于酚,属于醇,不互为同系物,故B错误;
C.金刚石、碳纳米管为碳元素形成的不同单质,互为同素异形体,故C正确;
D.新戊烷和2,2-二甲基丙烷的结构式均为,是同一种物质,故D错误。
答案为:C。
13.C
【详解】A.Xn+微粒的质子数为Z,故A错误;
B.Xn+微粒的质子数为Z,电子数为Z-n,故B错误;
C.Xn+微粒所含的中子数为A-Z,故C正确;
D.Xn+微粒的质量数为A,故D错误。
故选C。
14.D
【详解】设相对分子质量为70、72、74的Cl2分子个数分别为X、Y、Z个,相对分子质量为70的Cl2是由 2个35Cl组成的,故x个相对分子质量为70的Cl2中含有的35Cl原子个数为 2X个;相对分子质量为72的Cl2是由一个35Cl和一个37Cl组成,故y个相对分子质量为72的Cl2中含有的35Cl原子和37Cl原子个数分别为为Y个;相对分子质量为74的Cl2是由 2个37Cl组成的,故z个相对分子质量为74的Cl2中含有的37Cl原子个数为为2Z个;通过上述分析可知则:35Cl原子有(2X+Y)个,37Cl原子有(Y+2Z)个,已知35Cl和37Cl的个数之比为 3∶1,则(2X+Y)∶(Y+2Z)=3∶1,即3Y+6Z=2X+Y,解得 X=Y+3Z,满足此关系就可。
A.将X=5、Y=2、Z=1分别带入关系式X═Y+3Z,可知该式子不成立,错误;
B.将X=5、Y=2、Z=2分别带入关系式X═Y+3Z,可知该式子不成立,错误;
C.将X=9、Y=3、Z=1分别带入关系式X═Y+3Z,可知该式子不成立,错误;
D.将X=9、Y=3、Z=4分别带入关系式X=Y+3Z,可知该式子成立,正确。
15.B
【详解】A.具有一定数目质子数和一定数目中子数的原子为一种核素,氯离子不是核素,A错误;
B.三者的分子式相同,结构不同,互为同分异构体,B正确;
C.CH2OH(CHOH)3CH2OH中含5个-OH,CH2OHCHOHCH2OH含3个-OH,官能团数目不同,二者不是同系物,C错误;
D.13C是原子,不是单质,石墨、C60是碳元素形成的不同的单质,互为同素异形体,D错误;
故答案选B。
16.(1) 7 3 3 1H、2H、3H 234U、235U、238U
(2) 40K、40Ca 14N、14C 1H、1H+
【分析】(1)
以上微粒中含有H、U、K、Ca、Cl、N、C,共有7种元素;1H、1H+是1H的原子和离子,1H、2H、3H属于氢元素的3种不同核素,且互为同位素,属于氢元素的核素有3种;234U、235U、238U属于铀元素的3种不同核素,也互为同位素;故答案为:7;3;3;1H、2H、3H;234U、235U、238U;
(2)
质量数相等的粒子,即相对原子质量相等的微粒,分别为40K、40Ca;14N、14C;1H、1H+;故答案为:40K、40Ca;14N、14C;1H、1H+。
17. A-Z A-x-n A-x+n 22 mol
【详解】(1)根据“质子数+中子数=质量数”的关系可知:N=A-Z。
(2)AXn+共有x个电子,中性原子X的电子数为x+n,则N=A-x-n。
(3)AXn-共有x个电子,中性原子X的电子数为x-n,则N=A-x+n。
(4)12C16O2分子中的中子数为12-6+(16-8)×2=22。
(5)A2-原子核内有x个中子,其质量数为m,则质子数为m-x,含电子数为m-x+2,则n g A2-所含电子的物质的量为 mol。
18. ①④ ③⑥ ②和③ ④和⑤
【详解】(1)质子数相同而中子数不同的同一种元素的不同核素互为同位素,则互为同位素的是12C和13C。
(2)质量数相等,但不能互称同位素的是40Ca和40Ar。
(3)13C和14N的中子数相等均是7,但质子数不相等,分别是6、7。
19.(1)①③
(2) 相同条件下,氨气的密度比空气小 氨气极易溶于水 氨气能跟水发生化学反应,反应后的溶液显碱性
(3) A e B或C
【解析】(1)
实验室制取气体反应的发生装置的选择主要考虑反应物的状态是固体还是液体以及反应条件,如加热等;
(2)
根据实验可知,气体是由上到下充满试管的,充满氨气的试管能形成喷泉且形成的溶液使酚酞显红色,从而得出氨气的三点性质:相同条件下,氨气的密度比空气小、氨气极易溶于水、氨气能跟水发生化学反应,反应后的溶液显碱性;
(3)
反应①需要用固固加热型发生装置,则选取A作为发生装置;氨气的密度比空气小,则用D装置收集时,气体由e端进入;若选择反应②作为实验室制取的反应原理,则应选择固液不加热型发生装置,即B或C
