江苏省邗江中学(集团)2014-2015学年高二下学期期中考试化学试题(新疆班)
文档属性
| 名称 | 江苏省邗江中学(集团)2014-2015学年高二下学期期中考试化学试题(新疆班) |  | |
| 格式 | zip | ||
| 文件大小 | 155.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-05-04 15:55:14 | ||
图片预览

文档简介
江苏省邗江中学2014-2015学年度第二学期
新疆高二化学期中试卷
相对原子质量:H:1 C:12 Cl:35.5 O:16 N:14 S:32 Fe:56 K:39
一、单项选择题(每小题只有一个选项符合题意,每小题2分,共8小题,计20分)
1、2009年12月7–18日在丹麦首都哥本哈根,召开了全球气候会议,商讨2012年至2020年的全减排协议。下列行为中不符合“促进低碳经济”宗旨的是
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
B.限制化学发展,关停化工企业,消除污染源头
C.推广煤的气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
2、实验室有一瓶购置时间较长绿矾(FeSO4?7H2O),老师将其交给化学研究小组某同学检验药品是否有变质现象,这位同学取绿矾做了简单的检验,得出的结论是:已经开始氧化。该同学所用的试剂和判断依据是
选项
A
B
C
D
试剂
氯水
氢氧化钠溶液
铁屑
KSCN溶液
现象
出现黄褐色
最终生成红褐色沉淀
绿色
有较浅的血红色
3.下列说法中正确的是
A.硅是人类将太阳能转变为电能的常用材料
B.工业上镁的制备是电解熔融MgO
C.铝热法制铁适用于野外小范围操作,生物炼铜已经大规模用于铜的生产中
D.海水的各种化学资源的开发过程,必须都要发生化学反应
4、下列选项中,符合右图所示关系的是
A.一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系
B.铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系
C.将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系
D.H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系
5.以下物质间的每步转化,存在不能通过一步反应实现的是:
A.SO2→SO3→H2SO4→MgSO4 B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.Si→SiO2→H2SiO3→Na2SiO3 D.Na→NaCl→NaOH→Na2CO3
6.已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于吸收氨气的是
7.NA表示阿伏加德罗常数,下列说法正确的是
A.室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
B.22.4L的二氧化硫气体中含有的氧原子数为2NA
C.1.0L 1.0mol·L-1CH3COOH溶液中含有的CH3COOH分子数为NA
D.1 mol OH—离子中含有的质子数为10NA
8.下列叙述中正确的是( )
A. 草木灰和硫铵混合施用可使肥效更高
B. Mg(OH)2和Al(OH)3受热易分解可作阻燃剂
C. 含氧酸的酸性越强,与铁片反应产生氢气的速率越快
D. 二氧化硫和氯气均可使有色物质褪色且漂白原理相同
9.下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2 中,既可以和盐酸反应也可以和Ba(OH)2溶液反应的是 ( )
A.①③④ B.①②③④ C.②③④ D.①③④⑤
10.下列有关物质的性质和该性质的应用均正确的是( )
A. 氢氟酸具有强酸性,可用于蚀刻玻璃
B. 碳具有还原性,一定条件下能将二氧化硅还原为硅
C. BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐
D. 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚
二、不定项选择题(共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意。)
11、2010年1月13日海地发生里氏7.3级大地震,为防止大灾后疫病流行,需大量各种消毒剂。过碳酸钠化学式为Na2CO3·3H2O2,具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生反应而失效,其中过碳酸钠只发生氧化反应而被氧化的是
A.MnO2 B.稀盐酸 C.Na2SO3溶液 D.KMnO4溶液
12.中学化学教材中,常借助于图像的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是
13.在下列各组离子中,能大量共存的是
A.Al3+、H+、AlO2-、Cl- B.Cu2+、Fe2+、ClO-、SO42-
C.Na+、Ca2+、HCO3-、Cl- D.Cu2+、Fe3+、Cl-、NO3-
14.下列离子方程式中,错误的是 ( )
A.向AlCl3溶液中加入过量氨水:Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
B.向硝酸亚铁溶液中加入稀硫酸:3Fe2+ + NO3-+ 4H+ = 3Fe3+ +2H2O +NO↑
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH+OH-NH3↑+H2O
D.AlCl3溶液中滴加足量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O
15.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
三 填空题
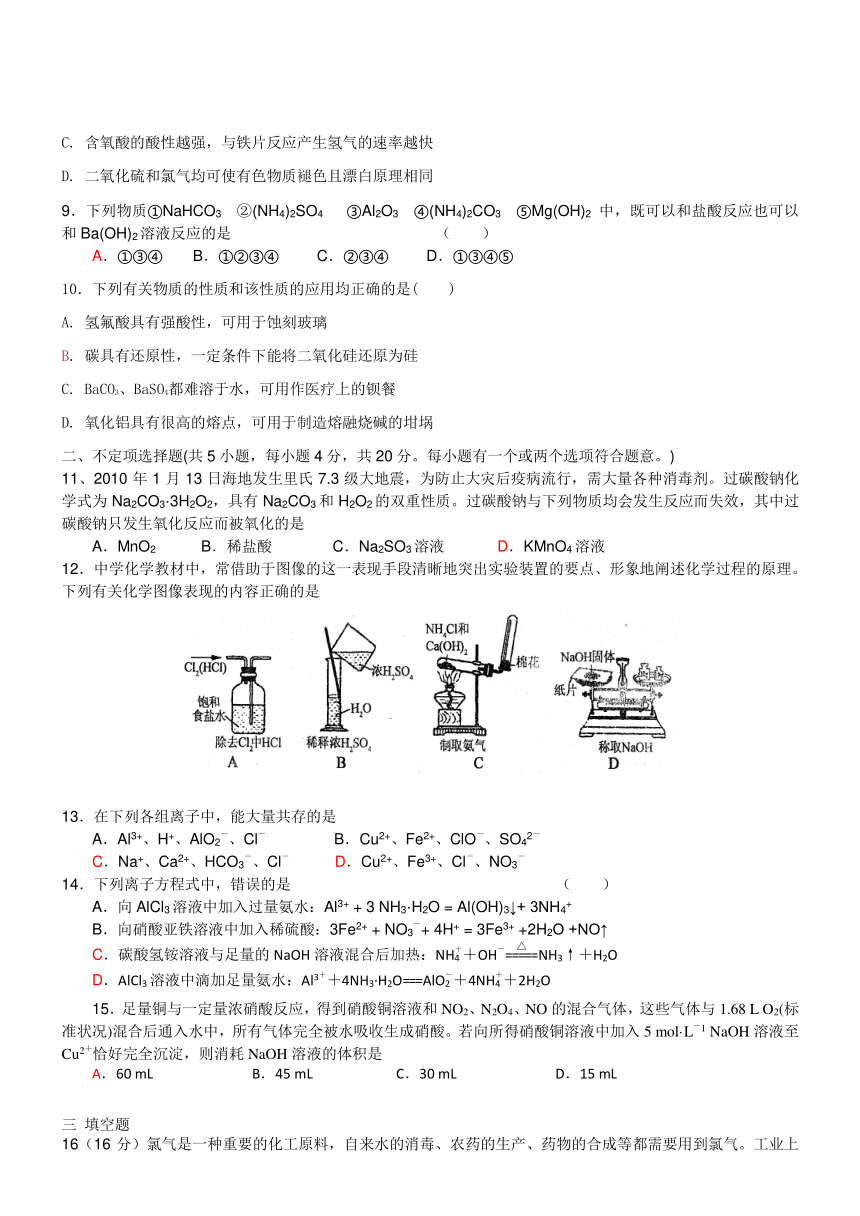
16(16分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示) 。某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
图一
(1)指出图一装置中的错误之处 ,
(2)丙装置的作用 。
丙装置中发生反应的离子方程式 。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序: 。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是 。
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
。为什么? 。
17(12分)Ⅰ 溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr = 2NaCl + Br2,该反应被氧化的元素为 (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 个。
Ⅱ 请按要求书写化学方程式或离子方程式
(1)小明运用化学实验证明了久置于空气中的漂白粉已变质,请用化学方程式表示漂白粉变质的原因 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式 ;然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 _。
18.(8分)某无色透明溶液可能含有K+、Cu2+、Ca2+、SO42-、CO32-、Cl-中的几种,现进行如下实验:
(1)滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
(2)向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解。
(3)向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:该溶液中肯定有 离子,肯定没有 离子,可能有 离子(填离子符号)。
写出步骤(2)的离子方程式 。
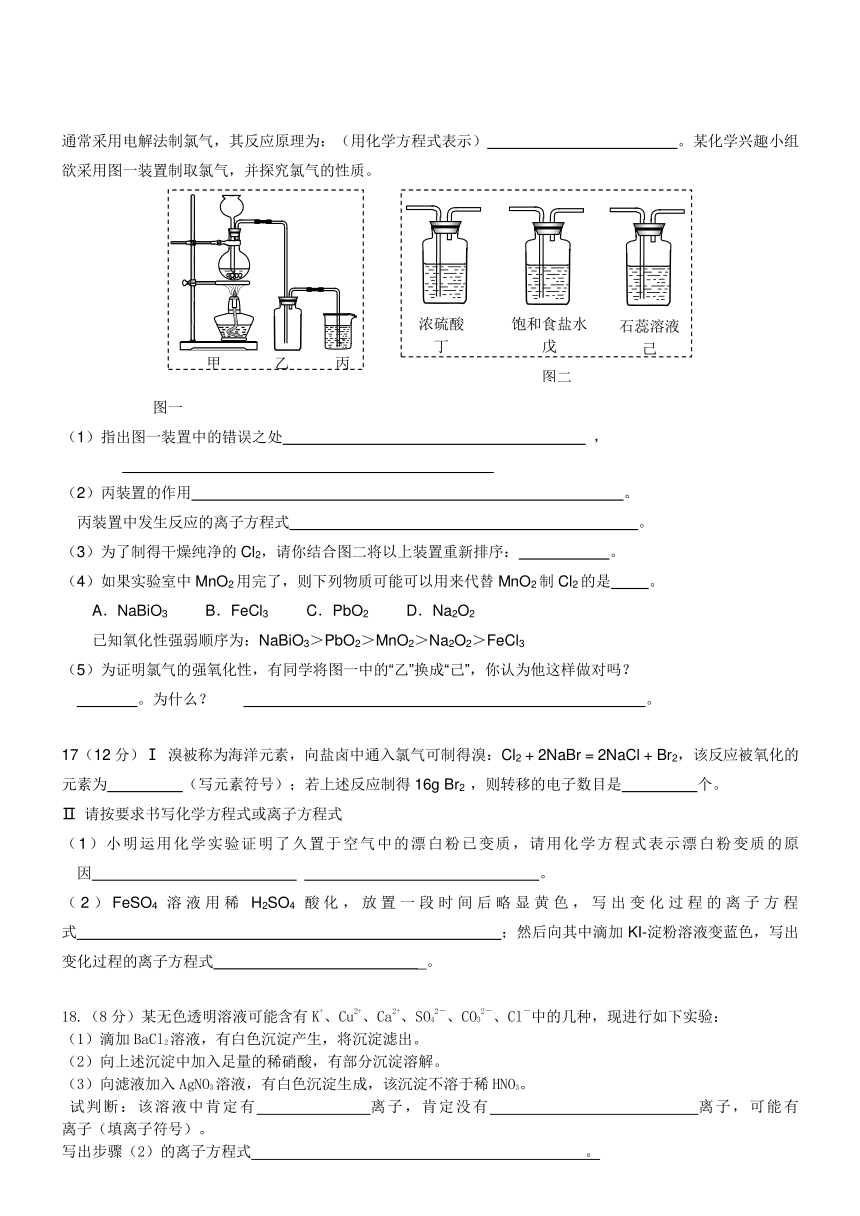
19(12分)下图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式
;
(2)写出E与A的氢化物反应生成A的化学方程式
;
(3)写出一个由D生成B的化学方程式 ;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。写出反应的离子方程式 ;
(5)E溶液久置于空气中,溶液pH将 (填“变大”、“不”变、 “变小”),用化学方程式说明理由 ;
20.(10分)下图表示常见物质的相互转化关系(图中反应条件及部分反应物或生成物略去)。X是黄绿色气体;M、N为金属单质,其中M是地壳中含量最多的金属元素;E为红褐色固体;反应③常用于冶炼金属。试回答下列问题:
(1)物质E的化学式为 。
(2)画出X的组成元素原子结构简图 。
(3)写出反应②的离子方程式 。
(4)分别写出反应①、③的化学方程式 、 。
21(10分)关于硬铝废料(含90%铝、2.5%镁、7.5%铜)的利用,某探究小组进行了下列实验。
试回答下列问题:
(1)写出晶体A的一种用途 ,写出晶体B的化学式 。
(2)写出反应①、②、③的离子方程式。
① ② ③
22.(12)以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]的工艺流程如下:
已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见下表:
待沉淀离子
Fe2+
Fe3+
Zn2+
开始沉淀时pH
5.8
1.1
5.9
完全沉淀时pH
8.8
3.2
8.0
(1)ZnCO3酸溶时的离子方程式为______________________________________
__________________________________________。
(2)用KMnO4溶液除去Mn2+的离子方程式为__________________________ _________________________________________________________。
(3)滤渣2主要成分的化学式是______________________________。
(4)过滤2所得滤液中含有的主要阳离子是___________________________。
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是____________ _____________________________________________________________。
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol·L-1,则该温度下Ksp[Zn(OH)2]的值为__________________。
新疆高二化学答卷纸
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
答案
16. 。
(1) ,
(2) 。
。
(3) 。
(4) 。
(5) 。 。
17、Ⅰ (写元素符号); 个。
Ⅱ(1) 、
。
(2) ;
。
18.该溶液中肯定有 离子,肯定没有 离子,可能有 离子 (填离子符号)。
写出步骤(2)的离子方程式 。
19、(1) ;
(2) ;
(3) ;
(4) ;
(5) , 。
20.(1) 。
(2) 。
(3) 。
(4) 、
。
21.(1) ,
。
(2)①
②
③
22(1)_____________________________________________________________ (2) _________________________________________________________。
(3) ______________________________。
(4) ___________________________。
(5) _____________________________________________________________。
(6) __________________。
新疆高二参考答案
题号
1
2
3
4
5
6
7
8
答案
B
D
A
B
C
B
A
B
题号
9
10
11
12
13
14
15
答案
A
B
D
C
CD
CD
A
16(16分)反应原理为:2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑(2分)
(1)未用石棉网 (2分) ,用长颈漏斗而未用分液漏斗(2分);
(2)吸收多余氯气,防止环境污染(1分)。Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)甲 戊 丁 乙 丙(2分)
(4) AC (2分,少选给1分,错选不给分)
(5)不对(1分), 使石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2(2分)
17(12分每空2分)Ⅰ Br ; 0.2NA或1.204×1023
Ⅱ (1) Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO 2HCl+O2↑
(2)4Fe2++ 4H+ +O2 =4Fe3++ 2H2O (2分) ;2Fe3++2I- = 2Fe2+ + I2
18、8分
19(12分每空2分)(1)H2+SH2S (2)H2SO3 + 2H2S=3S + 3H2O。
(3)C+2H2SO4(浓)CO2 ↑+2SO2 ↑+2H2O
或Cu+ 2H2SO4(浓)CuSO4 +SO2 ↑+ 2H2O等。
(4)H2SO3 +2OH— = SO32— + 2H2O。(2分)(5)变小 2H2SO3 +O2=2H2SO4
20(10分每空2分)(1)Fe(OH)3 (2)略 (3) 2Fe3+ +Fe=3Fe2+
(4)2Al+3Cl2 2AlCl3 2Al +Fe2O3 2Fe + Al2O3
21、(10分(12分每空2分))(1)净水剂 MgCl2·6H2O
(2)①2Al+2H2O+2OH-=2AlO2-+3H2↑ ② AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
③Cu+H2O2+2H+=Cu2++2H2O
22(12分每空2分)
(1)ZnCO3+2H+===Zn2++H2O+CO2↑
(2)2MnO+3Mn2++2H2O===5MnO2↓+4H+
(3)Fe(OH)3 (4)Na+、K+
(5)取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净
(6)10-17
新疆高二化学期中试卷
相对原子质量:H:1 C:12 Cl:35.5 O:16 N:14 S:32 Fe:56 K:39
一、单项选择题(每小题只有一个选项符合题意,每小题2分,共8小题,计20分)
1、2009年12月7–18日在丹麦首都哥本哈根,召开了全球气候会议,商讨2012年至2020年的全减排协议。下列行为中不符合“促进低碳经济”宗旨的是
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
B.限制化学发展,关停化工企业,消除污染源头
C.推广煤的气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
2、实验室有一瓶购置时间较长绿矾(FeSO4?7H2O),老师将其交给化学研究小组某同学检验药品是否有变质现象,这位同学取绿矾做了简单的检验,得出的结论是:已经开始氧化。该同学所用的试剂和判断依据是
选项
A
B
C
D
试剂
氯水
氢氧化钠溶液
铁屑
KSCN溶液
现象
出现黄褐色
最终生成红褐色沉淀
绿色
有较浅的血红色
3.下列说法中正确的是
A.硅是人类将太阳能转变为电能的常用材料
B.工业上镁的制备是电解熔融MgO
C.铝热法制铁适用于野外小范围操作,生物炼铜已经大规模用于铜的生产中
D.海水的各种化学资源的开发过程,必须都要发生化学反应
4、下列选项中,符合右图所示关系的是
A.一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系
B.铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系
C.将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系
D.H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系
5.以下物质间的每步转化,存在不能通过一步反应实现的是:
A.SO2→SO3→H2SO4→MgSO4 B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.Si→SiO2→H2SiO3→Na2SiO3 D.Na→NaCl→NaOH→Na2CO3
6.已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于吸收氨气的是
7.NA表示阿伏加德罗常数,下列说法正确的是
A.室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
B.22.4L的二氧化硫气体中含有的氧原子数为2NA
C.1.0L 1.0mol·L-1CH3COOH溶液中含有的CH3COOH分子数为NA
D.1 mol OH—离子中含有的质子数为10NA
8.下列叙述中正确的是( )
A. 草木灰和硫铵混合施用可使肥效更高
B. Mg(OH)2和Al(OH)3受热易分解可作阻燃剂
C. 含氧酸的酸性越强,与铁片反应产生氢气的速率越快
D. 二氧化硫和氯气均可使有色物质褪色且漂白原理相同
9.下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2 中,既可以和盐酸反应也可以和Ba(OH)2溶液反应的是 ( )
A.①③④ B.①②③④ C.②③④ D.①③④⑤
10.下列有关物质的性质和该性质的应用均正确的是( )
A. 氢氟酸具有强酸性,可用于蚀刻玻璃
B. 碳具有还原性,一定条件下能将二氧化硅还原为硅
C. BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐
D. 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚
二、不定项选择题(共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意。)
11、2010年1月13日海地发生里氏7.3级大地震,为防止大灾后疫病流行,需大量各种消毒剂。过碳酸钠化学式为Na2CO3·3H2O2,具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生反应而失效,其中过碳酸钠只发生氧化反应而被氧化的是
A.MnO2 B.稀盐酸 C.Na2SO3溶液 D.KMnO4溶液
12.中学化学教材中,常借助于图像的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是
13.在下列各组离子中,能大量共存的是
A.Al3+、H+、AlO2-、Cl- B.Cu2+、Fe2+、ClO-、SO42-
C.Na+、Ca2+、HCO3-、Cl- D.Cu2+、Fe3+、Cl-、NO3-
14.下列离子方程式中,错误的是 ( )
A.向AlCl3溶液中加入过量氨水:Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
B.向硝酸亚铁溶液中加入稀硫酸:3Fe2+ + NO3-+ 4H+ = 3Fe3+ +2H2O +NO↑
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH+OH-NH3↑+H2O
D.AlCl3溶液中滴加足量氨水:Al3++4NH3·H2O===AlO+4NH+2H2O
15.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
三 填空题
16(16分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示) 。某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
图一
(1)指出图一装置中的错误之处 ,
(2)丙装置的作用 。
丙装置中发生反应的离子方程式 。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序: 。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是 。
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
。为什么? 。
17(12分)Ⅰ 溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl2 + 2NaBr = 2NaCl + Br2,该反应被氧化的元素为 (写元素符号);若上述反应制得16g Br2 ,则转移的电子数目是 个。
Ⅱ 请按要求书写化学方程式或离子方程式
(1)小明运用化学实验证明了久置于空气中的漂白粉已变质,请用化学方程式表示漂白粉变质的原因 。
(2)FeSO4溶液用稀H2SO4酸化,放置一段时间后略显黄色,写出变化过程的离子方程式 ;然后向其中滴加KI-淀粉溶液变蓝色,写出变化过程的离子方程式 _。
18.(8分)某无色透明溶液可能含有K+、Cu2+、Ca2+、SO42-、CO32-、Cl-中的几种,现进行如下实验:
(1)滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
(2)向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解。
(3)向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:该溶液中肯定有 离子,肯定没有 离子,可能有 离子(填离子符号)。
写出步骤(2)的离子方程式 。
19(12分)下图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式
;
(2)写出E与A的氢化物反应生成A的化学方程式
;
(3)写出一个由D生成B的化学方程式 ;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。写出反应的离子方程式 ;
(5)E溶液久置于空气中,溶液pH将 (填“变大”、“不”变、 “变小”),用化学方程式说明理由 ;
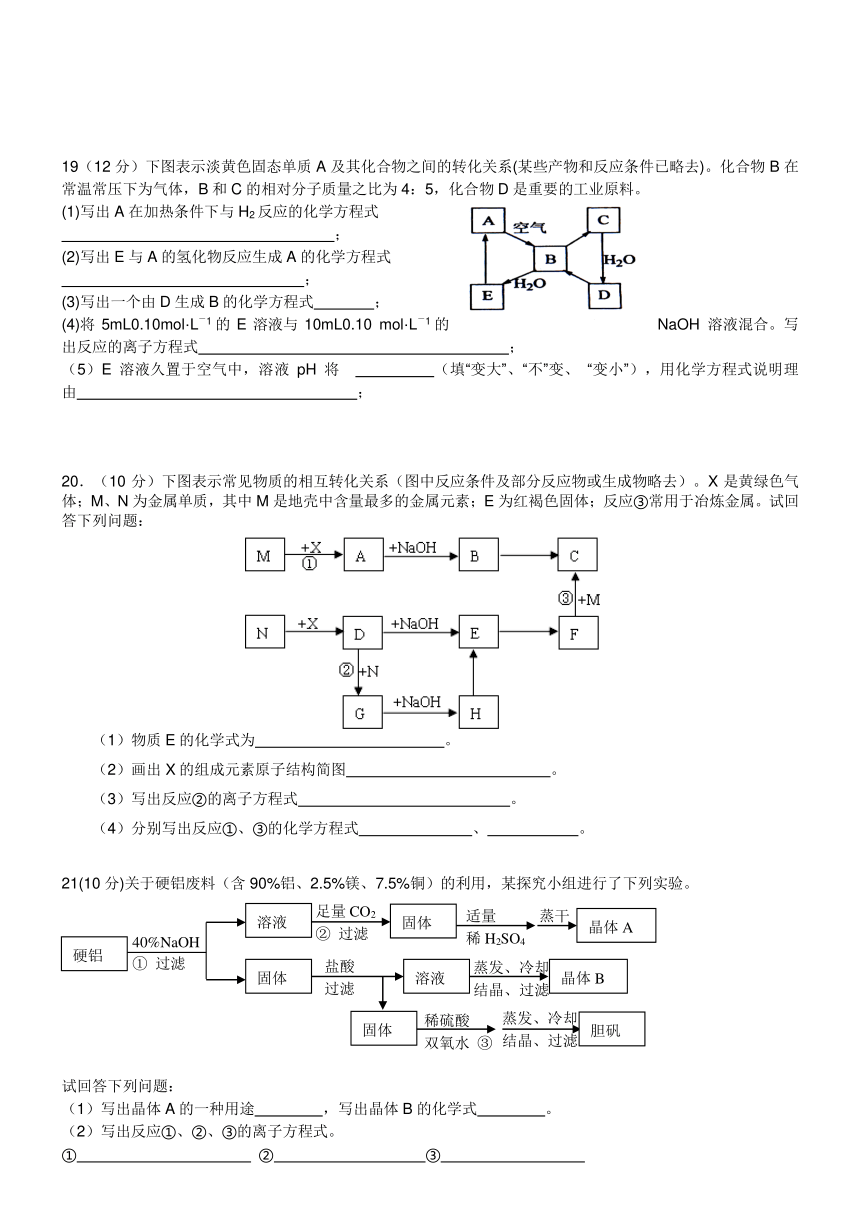
20.(10分)下图表示常见物质的相互转化关系(图中反应条件及部分反应物或生成物略去)。X是黄绿色气体;M、N为金属单质,其中M是地壳中含量最多的金属元素;E为红褐色固体;反应③常用于冶炼金属。试回答下列问题:
(1)物质E的化学式为 。
(2)画出X的组成元素原子结构简图 。
(3)写出反应②的离子方程式 。
(4)分别写出反应①、③的化学方程式 、 。
21(10分)关于硬铝废料(含90%铝、2.5%镁、7.5%铜)的利用,某探究小组进行了下列实验。
试回答下列问题:
(1)写出晶体A的一种用途 ,写出晶体B的化学式 。
(2)写出反应①、②、③的离子方程式。
① ② ③
22.(12)以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]的工艺流程如下:
已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见下表:
待沉淀离子
Fe2+
Fe3+
Zn2+
开始沉淀时pH
5.8
1.1
5.9
完全沉淀时pH
8.8
3.2
8.0
(1)ZnCO3酸溶时的离子方程式为______________________________________
__________________________________________。
(2)用KMnO4溶液除去Mn2+的离子方程式为__________________________ _________________________________________________________。
(3)滤渣2主要成分的化学式是______________________________。
(4)过滤2所得滤液中含有的主要阳离子是___________________________。
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是____________ _____________________________________________________________。
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol·L-1,则该温度下Ksp[Zn(OH)2]的值为__________________。
新疆高二化学答卷纸
题号
1
2
3
4
5
6
7
8
答案
题号
9
10
11
12
13
14
15
答案
16. 。
(1) ,
(2) 。
。
(3) 。
(4) 。
(5) 。 。
17、Ⅰ (写元素符号); 个。
Ⅱ(1) 、
。
(2) ;
。
18.该溶液中肯定有 离子,肯定没有 离子,可能有 离子 (填离子符号)。
写出步骤(2)的离子方程式 。
19、(1) ;
(2) ;
(3) ;
(4) ;
(5) , 。
20.(1) 。
(2) 。
(3) 。
(4) 、
。
21.(1) ,
。
(2)①
②
③
22(1)_____________________________________________________________ (2) _________________________________________________________。
(3) ______________________________。
(4) ___________________________。
(5) _____________________________________________________________。
(6) __________________。
新疆高二参考答案
题号
1
2
3
4
5
6
7
8
答案
B
D
A
B
C
B
A
B
题号
9
10
11
12
13
14
15
答案
A
B
D
C
CD
CD
A
16(16分)反应原理为:2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑(2分)
(1)未用石棉网 (2分) ,用长颈漏斗而未用分液漏斗(2分);
(2)吸收多余氯气,防止环境污染(1分)。Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)甲 戊 丁 乙 丙(2分)
(4) AC (2分,少选给1分,错选不给分)
(5)不对(1分), 使石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2(2分)
17(12分每空2分)Ⅰ Br ; 0.2NA或1.204×1023
Ⅱ (1) Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2HClO 2HCl+O2↑
(2)4Fe2++ 4H+ +O2 =4Fe3++ 2H2O (2分) ;2Fe3++2I- = 2Fe2+ + I2
18、8分
19(12分每空2分)(1)H2+SH2S (2)H2SO3 + 2H2S=3S + 3H2O。
(3)C+2H2SO4(浓)CO2 ↑+2SO2 ↑+2H2O
或Cu+ 2H2SO4(浓)CuSO4 +SO2 ↑+ 2H2O等。
(4)H2SO3 +2OH— = SO32— + 2H2O。(2分)(5)变小 2H2SO3 +O2=2H2SO4
20(10分每空2分)(1)Fe(OH)3 (2)略 (3) 2Fe3+ +Fe=3Fe2+
(4)2Al+3Cl2 2AlCl3 2Al +Fe2O3 2Fe + Al2O3
21、(10分(12分每空2分))(1)净水剂 MgCl2·6H2O
(2)①2Al+2H2O+2OH-=2AlO2-+3H2↑ ② AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
③Cu+H2O2+2H+=Cu2++2H2O
22(12分每空2分)
(1)ZnCO3+2H+===Zn2++H2O+CO2↑
(2)2MnO+3Mn2++2H2O===5MnO2↓+4H+
(3)Fe(OH)3 (4)Na+、K+
(5)取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净
(6)10-17
