第一章第一节(第2课时)(共28页) 物质的分类及转化
文档属性
| 名称 | 第一章第一节(第2课时)(共28页) 物质的分类及转化 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 09:42:35 | ||
图片预览






文档简介
(共28张PPT)
第一章 海水中的重要元素——钠和氯
第一节 物质的分类与转化(第二课时)
掌握物质转化的规律
2
课程学习目标
熟记酸、碱、盐的化学性质
1
导入
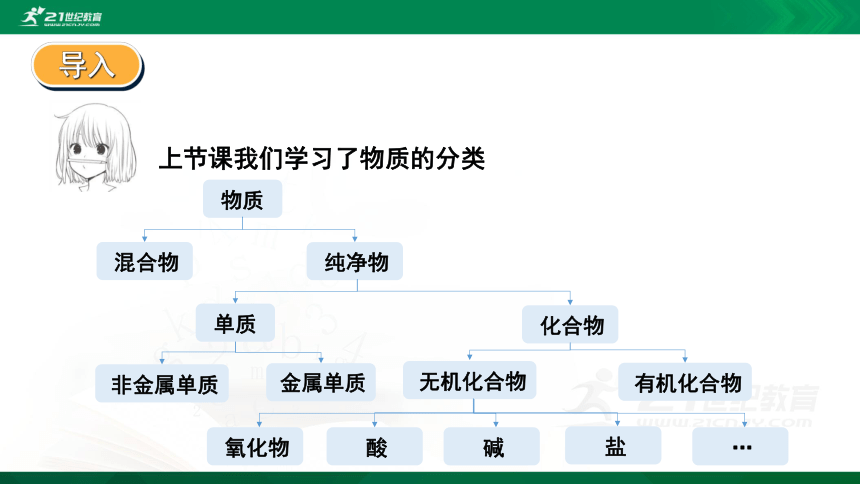
上节课我们学习了物质的分类
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
无机化合物
有机化合物
氧化物
酸
碱
盐
…
导入
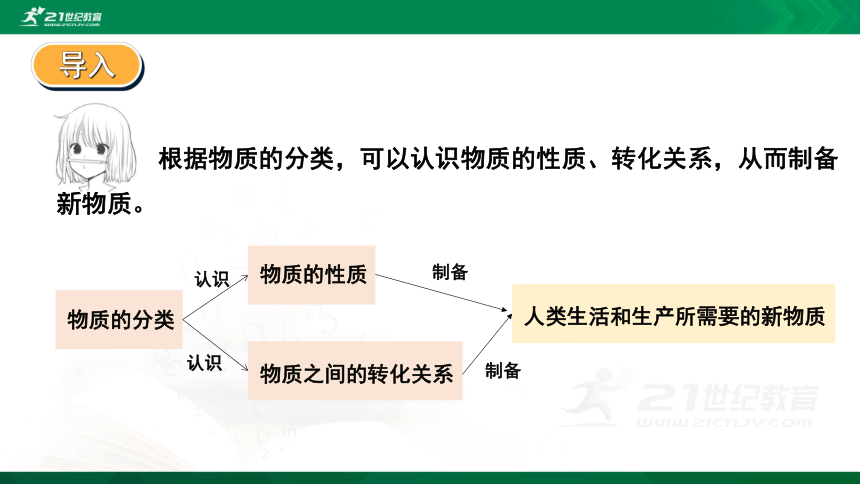
根据物质的分类,可以认识物质的性质、转化关系,从而制备新物质。
物质的分类
物质的性质
物质之间的转化关系
认识
认识
人类生活和生产所需要的新物质
制备
制备
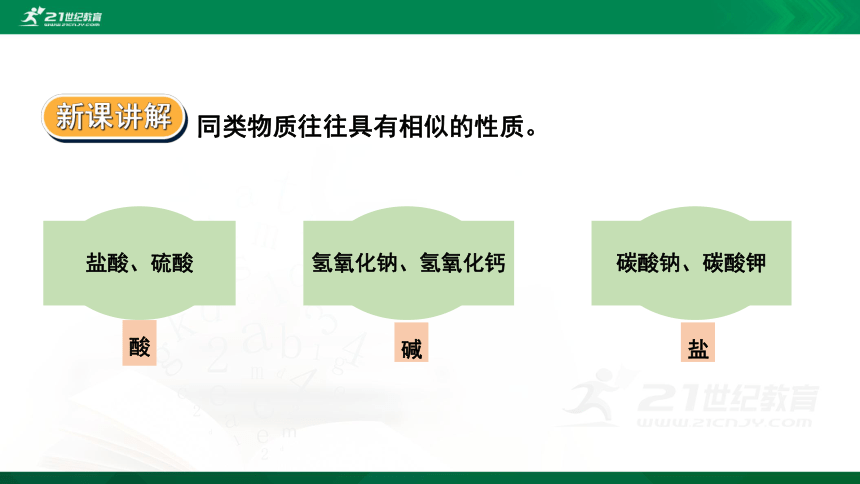
同类物质往往具有相似的性质。
盐酸、硫酸
氢氧化钠、氢氧化钙
碳酸钠、碳酸钾
酸
碱
盐
新课讲解
新课讲解
酸的主要化学性质
①酸可以与活泼金属反应
②酸可以与碱性氧化物反应
③酸可以与碱反应
④酸可以与某些盐反应
注:“酸”是在水溶液中电离时产生的阳离子都是氢离子的化合物。
根据酸的主要化学性质,可以有哪些反应实例呢?
思考·讨论
酸的主要化学性质 反应实例
酸与活泼金属反应 Zn + H2SO4 == ZnSO4 + H2↑
酸与碱性氧化物反应 6HCl + Fe2O3 == 2FeCl3 + 3H2O
酸与碱反应 NaOH + HCl == NaCl + H2O
酸与某些盐反应 HCl + AgNO3 == AgCl↓ + HNO3
新课讲解
碱的主要化学性质
①碱可以与非金属氧化物反应
②碱可以与酸反应
③碱可以与某些盐反应
④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝反应
注:“碱”是在水溶液中电离时产生的阴离子都是氢氧根离子的化合物。
根据碱的主要化学性质,可以有哪些反应实例呢?
思考·讨论
碱的主要化学性质 反应实例
碱与非金属氧化物反应 2NaOH + CO2 == Na2CO3 + H2O
碱与酸反应 NaOH + HCl == NaCl + H2O
碱与某些盐反应 Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
新课讲解
盐的主要化学性质
①盐可以与金属反应
②盐可以与酸反应
③盐可以与碱反应
④盐可以与某些盐反应
注:“盐”是在水溶液中电离时生成金属阳离子(或其他阳离子)和酸根阴离子的化合物
根据盐的主要化学性质,可以有哪些反应实例呢?
思考·讨论
盐的主要化学性质 反应实例
盐与金属反应 Fe + CuSO4 == FeSO4 + Cu↓
盐与酸反应 BaCl2 + H2SO4 == BaSO4↓ + 2HCl
盐与碱反应 FeCl3 + 3NaOH == 3NaCl + Fe(OH)3↓
盐与某些盐反应 BaCl2 + Na2SO4 == BaSO4↓ + 2NaCl
① 为什么不同的酸(或碱)具有相似的化学性质?
思考·讨论
因为它们在组成上具有相似性。
“H+”
酸
“酸根离子”
盐
“OH-”
碱
② 酸、碱、盐的主要化学性质中,涉及哪些反应类型?
思考·讨论
从反应类型来看,初中学过的酸与金属、盐与金属的反应都属于置
换反应,酸与碱、盐与酸、盐与碱、盐与盐之间的反应都属于复分解反
应。
试着写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属到盐的转化关系。
Ca → CaO → Ca(OH)2 → CaSO4
思考·讨论
C → CO2 → H2CO3 → CaCO3
对于上述转化关系,从物质分类的角度看,你发现了什么规律?
思考·讨论
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
思维启迪
制取某类物质的方法
根据物质的组成和性质,以及物质之间的转化关系,我们可以确定制取某类物质的方法。
例如,要想制取某种碱,通常可以采取两种方法:碱性氧化物与水发生反应;盐与另一种碱发生反应。
工业生产中制取NaOH ,是怎么做的呢?
思考·讨论
工业上制取NaOH一般不采用Na2O与H2O反应,而主要采用电解饱和
食盐水的方法。
因为Na2O作为原料、来源少、成本高,因此不适用用批量生产NaOH。
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。在
化学变化过程中,元素是不会改变的,这是考虑如何实现物质之间的转化
时最基本的依据。
在工业生产中要制取某种物质,除了要考虑反应进行的可能性,
还要考虑原料来源、成本高低和设备要求等因素,以选取最适当的方法。
新课讲解
物质的转化
思维启迪
化学科研工作者与化学工程师
化学科研工作者研究的是基本原理,例如怎么合成某种物质,某种物质的结构是什么样的,某种物质具有什么电子、光学、力学、磁学性质。
化学工程师研究的是怎么实现这些基本原理,例如怎么设计化工厂的反应器,选择反应的温度、压强、催化剂。
从基础知识来看,量子力学对化学科研工作者的重
要性远远超过对化学工程师,流体力学对化学工程师的
重要性远远超过对化学科研工作者。
1.下列物质分类正确的是( )
课堂达标
D
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O CO
C NaOH CH3COOH CaF2 CO SO2
D KOH HNO3 CaCO3 CaO SO2
解析 “酸”是在水溶液中电离时产生的阳离子都是氢离子的化合物;“碱”是在水溶液中电离时产生的阴离子都是氢氧根离子的化合物;“盐”是在水溶液中电离时生成金属阳离子(或其他阳离子)和酸根阴离子的化合物;碱性氧化物是指与酸反应而成盐和水的氧化物;酸性氧化物是指与碱作用生成盐和水的氧化物。Na2CO3不是碱,NaOH不是盐,SO2不是碱性氧化物,选项A错误;CO不是酸性氧化物,选项B错误;CO不是碱性氧化物,选项C错误。因此选D。
2.下列各组物质,按照单质、化合物、混合物的顺序排列正确的是
( )
A. 稀有气体、酒、冰水混合物
B. 乙醇、浓硫酸、胆矾
C.金刚石、铁矿石、大理石
D.水银、水蒸气、水煤气
课堂达标
D
解析 酒是混合物,冰水混合物是纯净物,选项A错误;乙醇是化合物,浓硫酸是混合物,胆矾是纯净物,选项B错误;铁矿石是混合物,选项C错误;水银是单质,水蒸气是化合物,水煤气是混合物,选项D正确。因此选D。
3.下列反应方程正确的是( )
A.BaCl2 + H2SO4 == BaSO4 + 2HCl
B.NaOH + CO2 == Na2CO3 + H2O
C.HCl + AgNO3 == AgCl↓ + HNO3
D.4HCl + Fe2O3 == 2FeCl2 + 2H2O
课堂达标
解析 选项A是盐和酸的反应,正确的反应式是BaCl2 + H2SO4 == BaSO4↓ + 2HCl ,选项A错误;选项B是碱和酸性氧化物的反应,正确的反应式是2NaOH + CO2 == Na2CO3 + H2O,选项B错误;选项D是酸和金属氧化物的反应,正确的反应式是6HCl + Fe2O3 == 2FeCl3 + 3H2O,选项D错误。因此选C。
C
4. 同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)
课堂达标
4. 同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)CaO是碱性氧化物
(2)生石灰能够强烈吸收水分,是碱性干燥剂的主要成分,吸水后氧化钙与水生成氢氧化钙:
课堂达标
CaO+H2O===Ca(OH)2(放出大量热)
解析 CaO是碱性氧化物,能与水、酸、酸性氧化物、盐反应,具有碱性氧化物的通性。生石灰能够强烈吸收水分,是碱性干燥剂的主要成分,吸水后氧化钙与水生成氢氧化钙。
物质的分类及转化
课堂小结
同类物质往往具有相似的性质
酸的化学性质:
①酸可以与活泼金属反应;②酸可以与碱性氧化物反应;③酸可以与碱反应;④酸可以与某些盐反应
碱的化学性质:
①碱可以与非金属氧化物反应;②碱可以与酸反应;③碱可以与某些盐反应;④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝反应
盐的化学性质:
①盐可以与金属反应;②盐可以与酸反应;③盐可以与碱反应;④盐可以与某些盐反应
物质的转化:
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。在化学变化过程中,元素是不会改变的,这是考虑如何实现物质之间的转化时最基本的依据。
作业布置
P12:6、7、8
熟记酸、碱、盐的化学性质
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
第一章 海水中的重要元素——钠和氯
第一节 物质的分类与转化(第二课时)
掌握物质转化的规律
2
课程学习目标
熟记酸、碱、盐的化学性质
1
导入
上节课我们学习了物质的分类
物质
混合物
纯净物
单质
化合物
非金属单质
金属单质
无机化合物
有机化合物
氧化物
酸
碱
盐
…
导入
根据物质的分类,可以认识物质的性质、转化关系,从而制备新物质。
物质的分类
物质的性质
物质之间的转化关系
认识
认识
人类生活和生产所需要的新物质
制备
制备
同类物质往往具有相似的性质。
盐酸、硫酸
氢氧化钠、氢氧化钙
碳酸钠、碳酸钾
酸
碱
盐
新课讲解
新课讲解
酸的主要化学性质
①酸可以与活泼金属反应
②酸可以与碱性氧化物反应
③酸可以与碱反应
④酸可以与某些盐反应
注:“酸”是在水溶液中电离时产生的阳离子都是氢离子的化合物。
根据酸的主要化学性质,可以有哪些反应实例呢?
思考·讨论
酸的主要化学性质 反应实例
酸与活泼金属反应 Zn + H2SO4 == ZnSO4 + H2↑
酸与碱性氧化物反应 6HCl + Fe2O3 == 2FeCl3 + 3H2O
酸与碱反应 NaOH + HCl == NaCl + H2O
酸与某些盐反应 HCl + AgNO3 == AgCl↓ + HNO3
新课讲解
碱的主要化学性质
①碱可以与非金属氧化物反应
②碱可以与酸反应
③碱可以与某些盐反应
④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝反应
注:“碱”是在水溶液中电离时产生的阴离子都是氢氧根离子的化合物。
根据碱的主要化学性质,可以有哪些反应实例呢?
思考·讨论
碱的主要化学性质 反应实例
碱与非金属氧化物反应 2NaOH + CO2 == Na2CO3 + H2O
碱与酸反应 NaOH + HCl == NaCl + H2O
碱与某些盐反应 Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
新课讲解
盐的主要化学性质
①盐可以与金属反应
②盐可以与酸反应
③盐可以与碱反应
④盐可以与某些盐反应
注:“盐”是在水溶液中电离时生成金属阳离子(或其他阳离子)和酸根阴离子的化合物
根据盐的主要化学性质,可以有哪些反应实例呢?
思考·讨论
盐的主要化学性质 反应实例
盐与金属反应 Fe + CuSO4 == FeSO4 + Cu↓
盐与酸反应 BaCl2 + H2SO4 == BaSO4↓ + 2HCl
盐与碱反应 FeCl3 + 3NaOH == 3NaCl + Fe(OH)3↓
盐与某些盐反应 BaCl2 + Na2SO4 == BaSO4↓ + 2NaCl
① 为什么不同的酸(或碱)具有相似的化学性质?
思考·讨论
因为它们在组成上具有相似性。
“H+”
酸
“酸根离子”
盐
“OH-”
碱
② 酸、碱、盐的主要化学性质中,涉及哪些反应类型?
思考·讨论
从反应类型来看,初中学过的酸与金属、盐与金属的反应都属于置
换反应,酸与碱、盐与酸、盐与碱、盐与盐之间的反应都属于复分解反
应。
试着写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属到盐的转化关系。
Ca → CaO → Ca(OH)2 → CaSO4
思考·讨论
C → CO2 → H2CO3 → CaCO3
对于上述转化关系,从物质分类的角度看,你发现了什么规律?
思考·讨论
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
盐
O2
H2O
碱或碱性氧化物
思维启迪
制取某类物质的方法
根据物质的组成和性质,以及物质之间的转化关系,我们可以确定制取某类物质的方法。
例如,要想制取某种碱,通常可以采取两种方法:碱性氧化物与水发生反应;盐与另一种碱发生反应。
工业生产中制取NaOH ,是怎么做的呢?
思考·讨论
工业上制取NaOH一般不采用Na2O与H2O反应,而主要采用电解饱和
食盐水的方法。
因为Na2O作为原料、来源少、成本高,因此不适用用批量生产NaOH。
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。在
化学变化过程中,元素是不会改变的,这是考虑如何实现物质之间的转化
时最基本的依据。
在工业生产中要制取某种物质,除了要考虑反应进行的可能性,
还要考虑原料来源、成本高低和设备要求等因素,以选取最适当的方法。
新课讲解
物质的转化
思维启迪
化学科研工作者与化学工程师
化学科研工作者研究的是基本原理,例如怎么合成某种物质,某种物质的结构是什么样的,某种物质具有什么电子、光学、力学、磁学性质。
化学工程师研究的是怎么实现这些基本原理,例如怎么设计化工厂的反应器,选择反应的温度、压强、催化剂。
从基础知识来看,量子力学对化学科研工作者的重
要性远远超过对化学工程师,流体力学对化学工程师的
重要性远远超过对化学科研工作者。
1.下列物质分类正确的是( )
课堂达标
D
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NaCl Na2O CO
C NaOH CH3COOH CaF2 CO SO2
D KOH HNO3 CaCO3 CaO SO2
解析 “酸”是在水溶液中电离时产生的阳离子都是氢离子的化合物;“碱”是在水溶液中电离时产生的阴离子都是氢氧根离子的化合物;“盐”是在水溶液中电离时生成金属阳离子(或其他阳离子)和酸根阴离子的化合物;碱性氧化物是指与酸反应而成盐和水的氧化物;酸性氧化物是指与碱作用生成盐和水的氧化物。Na2CO3不是碱,NaOH不是盐,SO2不是碱性氧化物,选项A错误;CO不是酸性氧化物,选项B错误;CO不是碱性氧化物,选项C错误。因此选D。
2.下列各组物质,按照单质、化合物、混合物的顺序排列正确的是
( )
A. 稀有气体、酒、冰水混合物
B. 乙醇、浓硫酸、胆矾
C.金刚石、铁矿石、大理石
D.水银、水蒸气、水煤气
课堂达标
D
解析 酒是混合物,冰水混合物是纯净物,选项A错误;乙醇是化合物,浓硫酸是混合物,胆矾是纯净物,选项B错误;铁矿石是混合物,选项C错误;水银是单质,水蒸气是化合物,水煤气是混合物,选项D正确。因此选D。
3.下列反应方程正确的是( )
A.BaCl2 + H2SO4 == BaSO4 + 2HCl
B.NaOH + CO2 == Na2CO3 + H2O
C.HCl + AgNO3 == AgCl↓ + HNO3
D.4HCl + Fe2O3 == 2FeCl2 + 2H2O
课堂达标
解析 选项A是盐和酸的反应,正确的反应式是BaCl2 + H2SO4 == BaSO4↓ + 2HCl ,选项A错误;选项B是碱和酸性氧化物的反应,正确的反应式是2NaOH + CO2 == Na2CO3 + H2O,选项B错误;选项D是酸和金属氧化物的反应,正确的反应式是6HCl + Fe2O3 == 2FeCl3 + 3H2O,选项D错误。因此选C。
C
4. 同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰属于哪种类别的物质?
(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)
课堂达标
4. 同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)CaO是碱性氧化物
(2)生石灰能够强烈吸收水分,是碱性干燥剂的主要成分,吸水后氧化钙与水生成氢氧化钙:
课堂达标
CaO+H2O===Ca(OH)2(放出大量热)
解析 CaO是碱性氧化物,能与水、酸、酸性氧化物、盐反应,具有碱性氧化物的通性。生石灰能够强烈吸收水分,是碱性干燥剂的主要成分,吸水后氧化钙与水生成氢氧化钙。
物质的分类及转化
课堂小结
同类物质往往具有相似的性质
酸的化学性质:
①酸可以与活泼金属反应;②酸可以与碱性氧化物反应;③酸可以与碱反应;④酸可以与某些盐反应
碱的化学性质:
①碱可以与非金属氧化物反应;②碱可以与酸反应;③碱可以与某些盐反应;④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝反应
盐的化学性质:
①盐可以与金属反应;②盐可以与酸反应;③盐可以与碱反应;④盐可以与某些盐反应
物质的转化:
根据物质的组成和性质,通过化学变化可以实现物质之间的转化。在化学变化过程中,元素是不会改变的,这是考虑如何实现物质之间的转化时最基本的依据。
作业布置
P12:6、7、8
熟记酸、碱、盐的化学性质
谢谢
21世纪教育网(www.21cnjy.com) 中小学教育资源网站
有大把高质量资料?一线教师?一线教研员?
欢迎加入21世纪教育网教师合作团队!!月薪过万不是梦!!
详情请看:
https://www.21cnjy.com/help/help_extract.php
