1.3 课时3 氧化还原反应的规律及配平 课件(共20张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 1.3 课时3 氧化还原反应的规律及配平 课件(共20张PPT) 2023-2024学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 427.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:00:57 | ||
图片预览








文档简介
(共20张PPT)
第三节 氧化还原反应 课时3
第一章 物质及其变化
1.掌握氧化还原反应的基本规律。
2.掌握氧化还原反应方程式的配平与有关计算。
知识点一:氧化还原反应基本规律
1.守恒规律
(1)氧化剂得电子总数等于还原剂失电子总数,即得失电子守恒。
(2)反应前后各元素种类不变,各元素的原子数目不变,即质量守恒。
(3)在有离子参加的氧化还原反应中,反应前后离子所带电荷的总数相等,即电荷守恒。
应用:有关氧化还原反应的计算及氧化还原反应方程式的配平
练一练
Na3SO3与KMnO4按个数比5:2完全反应,请确定还原产物中被还原元素的价态。
S
+4
→
S
+6
Mn
+7
→
Mn
+x
5×(6-4)=2×(7-x)
x=2
【技巧点拨】解决有关氧化还原反应的计算问题,应遵循守恒规律,即氧化剂和还原剂得失电子总数相等,化合价升高总数等于化合价降低总数。
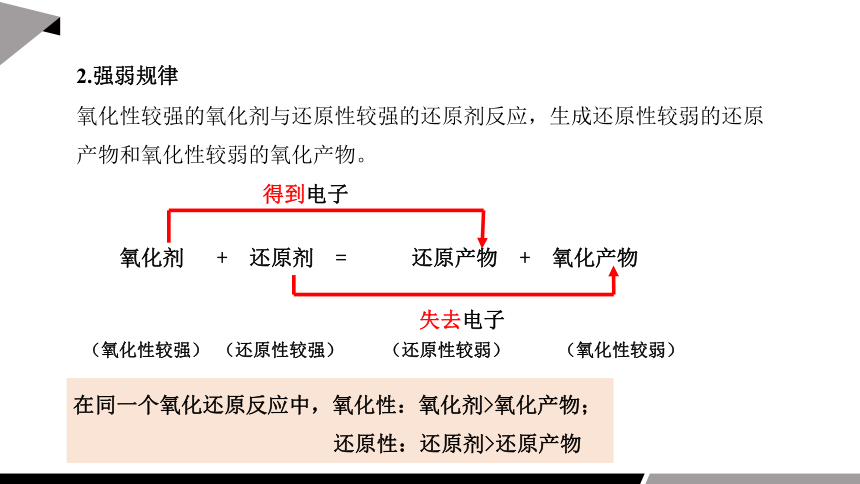
氧化性较强的氧化剂与还原性较强的还原剂反应,生成还原性较弱的还原产物和氧化性较弱的氧化产物。
2.强弱规律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得到电子
失去电子
(氧化性较强) (还原性较强) (还原性较弱) (氧化性较弱)
在同一个氧化还原反应中,氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物
练一练
反应① H2SO3+I2+H2O===2HI+H2SO4
反应② 2FeCl3+2HI===2FeCl2+I2+2HCl
请判断:H2SO3、I-、Fe2+三者还原性的强弱;
Fe3+、I2、H2SO4三者氧化性的强弱。
还原性:H2SO3>I->Fe2+;
氧化性:Fe3+>I2>H2SO4。
同一体系中,当有多个氧化还原反应发生时,强者优先,总是氧化性强(还原性强)的物质优先反应。
3.先后规律
例:(1)向含相同物质的量浓度的S2-、I-、Br-溶液中,缓慢通入氯气,还原性强的离子优先反应,先后顺序为 ;
(2)向含等物质的量浓度的Fe3+、Cu2+、H+、Ag+溶液中,缓慢加入足量的铁粉,氧化性强的离子优先发生反应,先后顺序为 。
S2-、I-、Br-
Ag+、Fe3+、Cu2+、H+
(1)价态归中规律
含同种元素但价态不同的物质间发生氧化还原反应,“两相靠,不相交”。称为价态归中反应。
4.价态规律
例:请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。
H2S + H2SO4(浓) = S↓ + SO2↑+ 2H2O
H2S+H2SO4(浓)===S+SO2↑+H2O
-2
+6
0
+4
得到2e-,化合价降低,被还原
失去2e-,化合价升高,被氧化
高价+低价 中间价
Cl2+2NaOH===NaClO+NaCl+H2O
(2)歧化反应规律
物质所含元素能生成多种价态的产物时,发生的氧化还原反应称为歧化反应。
中间价 高价+低价
例:请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。
Cl2+2NaOH===NaCl+NaClO+H2O
0
-1
+1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
知识点二:氧化还原反应的配平
1.配平依据
(1)得失电子守恒
特征:氧化还原反应中,化合价有升必有降,升降总值相等。
本质:氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
(2)质量守恒:反应前后原子的种类和数目不变。
(3)电荷守恒:对于离子反应,方程式两端阴、阳离子所带电荷总数相等。
2.配平步骤
标
等
定
平
查
标明反应前后化合价有变化的元素的化合价
通过求最小公倍数使化合价升降总数相等
确定氧化剂与还原剂的化学计量数
根据原子守恒,通过观察法确定其他物质的化学计量数(若是离子方程式还要使电荷守恒)
检查电荷、得失电子是否分别守恒
3.配平方法
(1)正向配平法
若参加反应的氧化剂全部被还原,参加反应的还原剂全部被氧化,可根据化合价升降总数相等,确定氧化剂和还原剂的化学计量数,然后用观察法配平其他物质。
例:请完成下列方程式的配平。
H2S + SO2 — S + H2O
H2S + HNO3 — S↓ + NO↑ + H2O
H2S + SO2 — S + H2O
-2
+4
0
2
4
1
2
3
2
2
H2S + HNO3 — S↓ + NO↑ + H2O
-2
+5
0
3
3
2
3
3
2
2
+2
2
4
(2)逆向配平法
部分氧化还原反应、自身氧化还原反应等,应先确定氧化产物和还原产物的化学计量数,然后用观察法确定氧化剂和还原剂的化学计量数。
例:请完成下列方程式的配平。
S + KOH — K2S + K2SO3 + H2O
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
S + KOH — K2S + K2SO3 + H2O
0
-2
+4
6
2
4
2
1
2
3
3
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
+6
-1
+3
0
3 2
1 2
1
3
2
3
14
7
2
(3)缺项配平法
先用“化合价升降法”配平含有变价元素的物质的化学计量数,然后用元素守恒确定未知物,再根据离子守恒和电荷守恒进行配平。
例:请完成下列方程式的配平。
条件 补项原则
酸性条件 缺H(氢)或多O(氧)补H+,少O(氧)补H2O
碱性条件 缺H(氢)或多O(氧)补H2O,少O(氧)补OH-
Cr(OH)4- + + ClO-— CrO42- + Cl- + H2O (碱性条件)
Cr(OH)4- + + ClO-— CrO42- + Cl- + H2O
+3
+1
+6
-1
3
2
3
2
2
2
3
3
OH-
2
5
练一练
1.将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
NaBiO3+__Mn2++__→__Na++__Bi3++__MnO4-+__
【答案】 5 2 14H+ 5 5 2 7H2O
【解析】①先根据得失电子守恒,确定NaBiO3和Mn2+的系数为5、2;Bi3+和MnO4-的系数为5、2;
②原子守恒,确定Na+的系数为5、5、2;
③补项,根据酸性环境,以及方程式右端少氧,确定方程式左端是H+,右端是H2O,原子守恒配平系数。
2.+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O42-还原成Cr3+,该反应的离子方程式为 。
3.一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 。
2:3
第三节 氧化还原反应 课时3
第一章 物质及其变化
1.掌握氧化还原反应的基本规律。
2.掌握氧化还原反应方程式的配平与有关计算。
知识点一:氧化还原反应基本规律
1.守恒规律
(1)氧化剂得电子总数等于还原剂失电子总数,即得失电子守恒。
(2)反应前后各元素种类不变,各元素的原子数目不变,即质量守恒。
(3)在有离子参加的氧化还原反应中,反应前后离子所带电荷的总数相等,即电荷守恒。
应用:有关氧化还原反应的计算及氧化还原反应方程式的配平
练一练
Na3SO3与KMnO4按个数比5:2完全反应,请确定还原产物中被还原元素的价态。
S
+4
→
S
+6
Mn
+7
→
Mn
+x
5×(6-4)=2×(7-x)
x=2
【技巧点拨】解决有关氧化还原反应的计算问题,应遵循守恒规律,即氧化剂和还原剂得失电子总数相等,化合价升高总数等于化合价降低总数。
氧化性较强的氧化剂与还原性较强的还原剂反应,生成还原性较弱的还原产物和氧化性较弱的氧化产物。
2.强弱规律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得到电子
失去电子
(氧化性较强) (还原性较强) (还原性较弱) (氧化性较弱)
在同一个氧化还原反应中,氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物
练一练
反应① H2SO3+I2+H2O===2HI+H2SO4
反应② 2FeCl3+2HI===2FeCl2+I2+2HCl
请判断:H2SO3、I-、Fe2+三者还原性的强弱;
Fe3+、I2、H2SO4三者氧化性的强弱。
还原性:H2SO3>I->Fe2+;
氧化性:Fe3+>I2>H2SO4。
同一体系中,当有多个氧化还原反应发生时,强者优先,总是氧化性强(还原性强)的物质优先反应。
3.先后规律
例:(1)向含相同物质的量浓度的S2-、I-、Br-溶液中,缓慢通入氯气,还原性强的离子优先反应,先后顺序为 ;
(2)向含等物质的量浓度的Fe3+、Cu2+、H+、Ag+溶液中,缓慢加入足量的铁粉,氧化性强的离子优先发生反应,先后顺序为 。
S2-、I-、Br-
Ag+、Fe3+、Cu2+、H+
(1)价态归中规律
含同种元素但价态不同的物质间发生氧化还原反应,“两相靠,不相交”。称为价态归中反应。
4.价态规律
例:请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。
H2S + H2SO4(浓) = S↓ + SO2↑+ 2H2O
H2S+H2SO4(浓)===S+SO2↑+H2O
-2
+6
0
+4
得到2e-,化合价降低,被还原
失去2e-,化合价升高,被氧化
高价+低价 中间价
Cl2+2NaOH===NaClO+NaCl+H2O
(2)歧化反应规律
物质所含元素能生成多种价态的产物时,发生的氧化还原反应称为歧化反应。
中间价 高价+低价
例:请标注出下列反应中元素的化合价,用双线桥分析氧化还原反应。
Cl2+2NaOH===NaCl+NaClO+H2O
0
-1
+1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
知识点二:氧化还原反应的配平
1.配平依据
(1)得失电子守恒
特征:氧化还原反应中,化合价有升必有降,升降总值相等。
本质:氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
(2)质量守恒:反应前后原子的种类和数目不变。
(3)电荷守恒:对于离子反应,方程式两端阴、阳离子所带电荷总数相等。
2.配平步骤
标
等
定
平
查
标明反应前后化合价有变化的元素的化合价
通过求最小公倍数使化合价升降总数相等
确定氧化剂与还原剂的化学计量数
根据原子守恒,通过观察法确定其他物质的化学计量数(若是离子方程式还要使电荷守恒)
检查电荷、得失电子是否分别守恒
3.配平方法
(1)正向配平法
若参加反应的氧化剂全部被还原,参加反应的还原剂全部被氧化,可根据化合价升降总数相等,确定氧化剂和还原剂的化学计量数,然后用观察法配平其他物质。
例:请完成下列方程式的配平。
H2S + SO2 — S + H2O
H2S + HNO3 — S↓ + NO↑ + H2O
H2S + SO2 — S + H2O
-2
+4
0
2
4
1
2
3
2
2
H2S + HNO3 — S↓ + NO↑ + H2O
-2
+5
0
3
3
2
3
3
2
2
+2
2
4
(2)逆向配平法
部分氧化还原反应、自身氧化还原反应等,应先确定氧化产物和还原产物的化学计量数,然后用观察法确定氧化剂和还原剂的化学计量数。
例:请完成下列方程式的配平。
S + KOH — K2S + K2SO3 + H2O
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
S + KOH — K2S + K2SO3 + H2O
0
-2
+4
6
2
4
2
1
2
3
3
K2Cr2O7 + HCl — KCl + CrCl3 + H2O + Cl2↑
+6
-1
+3
0
3 2
1 2
1
3
2
3
14
7
2
(3)缺项配平法
先用“化合价升降法”配平含有变价元素的物质的化学计量数,然后用元素守恒确定未知物,再根据离子守恒和电荷守恒进行配平。
例:请完成下列方程式的配平。
条件 补项原则
酸性条件 缺H(氢)或多O(氧)补H+,少O(氧)补H2O
碱性条件 缺H(氢)或多O(氧)补H2O,少O(氧)补OH-
Cr(OH)4- + + ClO-— CrO42- + Cl- + H2O (碱性条件)
Cr(OH)4- + + ClO-— CrO42- + Cl- + H2O
+3
+1
+6
-1
3
2
3
2
2
2
3
3
OH-
2
5
练一练
1.将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
NaBiO3+__Mn2++__→__Na++__Bi3++__MnO4-+__
【答案】 5 2 14H+ 5 5 2 7H2O
【解析】①先根据得失电子守恒,确定NaBiO3和Mn2+的系数为5、2;Bi3+和MnO4-的系数为5、2;
②原子守恒,确定Na+的系数为5、5、2;
③补项,根据酸性环境,以及方程式右端少氧,确定方程式左端是H+,右端是H2O,原子守恒配平系数。
2.+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O42-还原成Cr3+,该反应的离子方程式为 。
3.一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 。
2:3
