2.3 课时1 物质的量的单位——摩尔 课件(21张)2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.3 课时1 物质的量的单位——摩尔 课件(21张)2023-2024学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:05:35 | ||
图片预览








文档简介
(共21张PPT)
第三节 物质的量 课时1
第二章 海水中的重要元素——钠和氯
化学反应中各物质之间的关系:
质量: 4g 32g 36g
宏观视角
微观视角
分子数:2个 1个 2个
物质可以称量,微观粒子是难以称量的,那么,对反应进行定量研究时,可称量的物质与难以称量的物质之间有什么联系呢?一杯水(180g)的水中含有水分子数目是多少?
【提出问题】
【联系生活】——数纽扣
思考与交流:现有一大包纽扣,如何可以快速估测这包纽扣的数目?
纽扣数目(N)= (纽扣的总质量÷10枚纽扣的质量)×10
【方案】先称取10枚纽扣的质量,再称量纽扣的总质量。
联系“数纽扣”的例子,如何求算出一杯水(180g)的水中含有水分子数目?
【方案】先确定一定数目的水分子所具有的质量(m1),再用水的总质量(m2)除以m1,再乘以上面的一定数目,求出水分子数。
【解决问题的关键】
一定数目的水分子所具有的质量(m1)
?
1.能用自己的话说出什么是物质的量、摩尔质量。
2.分析物质的量与微粒数、物质质量之间的相互关系,能进行简单的化学计算。
知识点一:物质的量、阿伏加德罗常数
1.物质的量
(1)定义:
(3)单位:
n
表示一定数目粒子的集合体。
(2)符号:
摩尔,简称摩,符号为mol。
(4)适用范围:
原子、分子、离子等微观粒子
(3)“物质的量”是计量微观粒子数目的物理量,“摩尔”是单位。
【注意事项】
(1)“物质的量”是一个专有名词,由固定字数组成,不能分割、不能增减。
(2)“物质的量”衡量的对象是微观粒子(分子、原子、离子、中子、质子、电子、原子团),且粒子必须具体明确。
例如:表述为“物质量”或“物质的数量”都是错误的。
例如:“1mol苹果、lmol绿豆”的说法是错误的,苹果、绿豆属于宏观物质;
可以表述为:1molH2、lmolOH-、lmole-等。
我们所学过的物理量还有哪些呢?
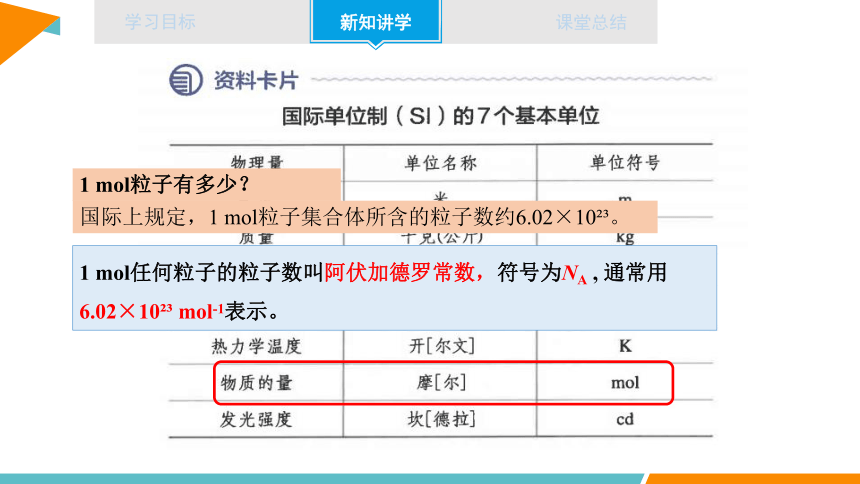
1 mol任何粒子的粒子数叫阿伏加德罗常数,符号为NA , 通常用6.02×10 mol-1表示。
1 mol粒子有多少?
国际上规定,1 mol粒子集合体所含的粒子数约6.02×10 。
2.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数
(2)符号:NA
(3)数值及单位:6.02 ×1023 mol-1
例:1 mol H2 含 个氢分子,0.5 mol H2 含
个氢分子。
6.02 ×1023
3.01 ×1023
粒子数(N)、阿伏加德罗常数(NA)、物质的量(n)之间的关系:
n=
N
NA
变式:
N=n·NA
【小结】
N
n
NA=
练一练
(1)摩尔是国际单位制中七个基本物理量之一。
(2)摩尔是物质的质量单位。
(3)物质的量是一个基本物理量,表示含有一定数目微粒的集合体。
(4)1molCO2和H2的混合气体所含的分子数约为6.02×1023
(5)1mol任何物质含有分子数约为6.02×1023个。
1.判断下列说法是否正确。
(摩尔是物质的量的单位)
(物质可以由分子、离子或原子构成)
(1)0.5molCO2中,含有______molC;含有______molO;含有二氧化碳分子数约为________________;碳原子数为_____________;氧原子数为________________。
(2)1molNa2CO3中约含有_____molNa+、______molCO32-离子,共含有离子的个数为 。
(3)0.1mol NH4+中有 mol电子,有 mol质子。
0.5
1
3.01×1023
3.01×1023
6.02×1023
2
1
1.806×1024
1
1.1
2.计算
我们已经学习了一个计算物质的量的公式
是否就可以解决刚才的那个问题,一杯(180g)水中有多少水分子?我们还需要知道什么数据?
1mol(6.02×1023个)水分子所具有的质量
粒子符号 物质的量(mol) 所含微粒数(N) 每个微粒的质量(g) 质量(g) 相对原子或相对分子质量
12C 1 6.02×1023 1.993×10-23
O 1 6.02×1023 2.657×10-23
Fe 1 6.02×1023 9.302×10-23
Cu 1 6.02×1023 1.059×10-22
H2O 1 6.02×1023 2.990×10-23
12
16
56
64
18
12
16
56
18
64
(1)完成下列表格。
(2)通过表格中的数据分析,你能得出什么结论?
知识点二:摩尔质量
定义:
l mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。
单位物质的量的物质所具有的质量
符号:
M
单位:
g/mol 或 kg/mol
数值:
摩尔质量 = 相对原子(分子)质量
?
相对原子质量(Ar)=
该原子的质量
碳12原子质量×
1
12
g
g
结论:两者含义、单位不相同。
例如:镁的相对原子质量为24,摩尔质量为24g/mol。
概念辨析
1.(1)Na的摩尔质量是__________,
(2)KCl的摩尔质量是__________,
(3)CH4的摩尔质量是___________,0.5molCH4的质量是_________。
(4)CO32-的摩尔质量是__________,2molCO32-的质量是_______。
物质的量(n)、质量(m)、摩尔质量(M)之间有什么关系呢?
23g/mol
74.5g/mol
16g/mol
60g/mol
8g
120g
练一练
n=
m
M
m = n·M
变式:
M =
m
n
2.26.5 g Na2CO3的物质的量是多少?
【解】Na2CO3的相对分子质量为106,摩尔质量为106g/mol。
n(Na2CO3) =
m(Na2CO3)
M(Na2CO3)
26.5g
106g/mol
=
= 0.25mol
答:26.5 g Na2CO3的物质的量是0.25 mol。
【问题回归】
一杯水(180g)水中有多少水分子?
n=
m
M
n=
N
NA
物质的量与粒子数、物质的质量的关系式:
n(H2O)=
m(H2O)
M(H2O)
N(H2O)=n(H2O)·NA
=10mol×6.02×1023
=6.02×1024
180 g
18g/mol
=
=10mol
宏观质量
微观粒子数
桥梁?
n
m
N
M
NA
NA
M
宏观物体的质量
微观粒子的个数
纽带或桥梁
1.204×1024个CH4的质量是多少?
【分析】物质的量是联系宏观质量和微观粒子的桥梁,已知粒子数,求质量,应先求物质的量。
n(CH4)=
N(CH4)
NA
=2mol
=
1.204×1024
6.02×1023mol-1
m(CH4)=2mol×16g/mol=32g
练一练
符号:NA
概念
物质的量
意义:便于表示微粒的多少
单位:摩尔(mol)
符号:n
摩尔质量
阿伏加德罗常数
概念
单位:g·mol-1
符号:M
数值:6.02×1023
n=
m
M
n=
N
NA
第三节 物质的量 课时1
第二章 海水中的重要元素——钠和氯
化学反应中各物质之间的关系:
质量: 4g 32g 36g
宏观视角
微观视角
分子数:2个 1个 2个
物质可以称量,微观粒子是难以称量的,那么,对反应进行定量研究时,可称量的物质与难以称量的物质之间有什么联系呢?一杯水(180g)的水中含有水分子数目是多少?
【提出问题】
【联系生活】——数纽扣
思考与交流:现有一大包纽扣,如何可以快速估测这包纽扣的数目?
纽扣数目(N)= (纽扣的总质量÷10枚纽扣的质量)×10
【方案】先称取10枚纽扣的质量,再称量纽扣的总质量。
联系“数纽扣”的例子,如何求算出一杯水(180g)的水中含有水分子数目?
【方案】先确定一定数目的水分子所具有的质量(m1),再用水的总质量(m2)除以m1,再乘以上面的一定数目,求出水分子数。
【解决问题的关键】
一定数目的水分子所具有的质量(m1)
?
1.能用自己的话说出什么是物质的量、摩尔质量。
2.分析物质的量与微粒数、物质质量之间的相互关系,能进行简单的化学计算。
知识点一:物质的量、阿伏加德罗常数
1.物质的量
(1)定义:
(3)单位:
n
表示一定数目粒子的集合体。
(2)符号:
摩尔,简称摩,符号为mol。
(4)适用范围:
原子、分子、离子等微观粒子
(3)“物质的量”是计量微观粒子数目的物理量,“摩尔”是单位。
【注意事项】
(1)“物质的量”是一个专有名词,由固定字数组成,不能分割、不能增减。
(2)“物质的量”衡量的对象是微观粒子(分子、原子、离子、中子、质子、电子、原子团),且粒子必须具体明确。
例如:表述为“物质量”或“物质的数量”都是错误的。
例如:“1mol苹果、lmol绿豆”的说法是错误的,苹果、绿豆属于宏观物质;
可以表述为:1molH2、lmolOH-、lmole-等。
我们所学过的物理量还有哪些呢?
1 mol任何粒子的粒子数叫阿伏加德罗常数,符号为NA , 通常用6.02×10 mol-1表示。
1 mol粒子有多少?
国际上规定,1 mol粒子集合体所含的粒子数约6.02×10 。
2.阿伏加德罗常数
(1)定义:1 mol任何粒子的粒子数
(2)符号:NA
(3)数值及单位:6.02 ×1023 mol-1
例:1 mol H2 含 个氢分子,0.5 mol H2 含
个氢分子。
6.02 ×1023
3.01 ×1023
粒子数(N)、阿伏加德罗常数(NA)、物质的量(n)之间的关系:
n=
N
NA
变式:
N=n·NA
【小结】
N
n
NA=
练一练
(1)摩尔是国际单位制中七个基本物理量之一。
(2)摩尔是物质的质量单位。
(3)物质的量是一个基本物理量,表示含有一定数目微粒的集合体。
(4)1molCO2和H2的混合气体所含的分子数约为6.02×1023
(5)1mol任何物质含有分子数约为6.02×1023个。
1.判断下列说法是否正确。
(摩尔是物质的量的单位)
(物质可以由分子、离子或原子构成)
(1)0.5molCO2中,含有______molC;含有______molO;含有二氧化碳分子数约为________________;碳原子数为_____________;氧原子数为________________。
(2)1molNa2CO3中约含有_____molNa+、______molCO32-离子,共含有离子的个数为 。
(3)0.1mol NH4+中有 mol电子,有 mol质子。
0.5
1
3.01×1023
3.01×1023
6.02×1023
2
1
1.806×1024
1
1.1
2.计算
我们已经学习了一个计算物质的量的公式
是否就可以解决刚才的那个问题,一杯(180g)水中有多少水分子?我们还需要知道什么数据?
1mol(6.02×1023个)水分子所具有的质量
粒子符号 物质的量(mol) 所含微粒数(N) 每个微粒的质量(g) 质量(g) 相对原子或相对分子质量
12C 1 6.02×1023 1.993×10-23
O 1 6.02×1023 2.657×10-23
Fe 1 6.02×1023 9.302×10-23
Cu 1 6.02×1023 1.059×10-22
H2O 1 6.02×1023 2.990×10-23
12
16
56
64
18
12
16
56
18
64
(1)完成下列表格。
(2)通过表格中的数据分析,你能得出什么结论?
知识点二:摩尔质量
定义:
l mol任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等。
单位物质的量的物质所具有的质量
符号:
M
单位:
g/mol 或 kg/mol
数值:
摩尔质量 = 相对原子(分子)质量
?
相对原子质量(Ar)=
该原子的质量
碳12原子质量×
1
12
g
g
结论:两者含义、单位不相同。
例如:镁的相对原子质量为24,摩尔质量为24g/mol。
概念辨析
1.(1)Na的摩尔质量是__________,
(2)KCl的摩尔质量是__________,
(3)CH4的摩尔质量是___________,0.5molCH4的质量是_________。
(4)CO32-的摩尔质量是__________,2molCO32-的质量是_______。
物质的量(n)、质量(m)、摩尔质量(M)之间有什么关系呢?
23g/mol
74.5g/mol
16g/mol
60g/mol
8g
120g
练一练
n=
m
M
m = n·M
变式:
M =
m
n
2.26.5 g Na2CO3的物质的量是多少?
【解】Na2CO3的相对分子质量为106,摩尔质量为106g/mol。
n(Na2CO3) =
m(Na2CO3)
M(Na2CO3)
26.5g
106g/mol
=
= 0.25mol
答:26.5 g Na2CO3的物质的量是0.25 mol。
【问题回归】
一杯水(180g)水中有多少水分子?
n=
m
M
n=
N
NA
物质的量与粒子数、物质的质量的关系式:
n(H2O)=
m(H2O)
M(H2O)
N(H2O)=n(H2O)·NA
=10mol×6.02×1023
=6.02×1024
180 g
18g/mol
=
=10mol
宏观质量
微观粒子数
桥梁?
n
m
N
M
NA
NA
M
宏观物体的质量
微观粒子的个数
纽带或桥梁
1.204×1024个CH4的质量是多少?
【分析】物质的量是联系宏观质量和微观粒子的桥梁,已知粒子数,求质量,应先求物质的量。
n(CH4)=
N(CH4)
NA
=2mol
=
1.204×1024
6.02×1023mol-1
m(CH4)=2mol×16g/mol=32g
练一练
符号:NA
概念
物质的量
意义:便于表示微粒的多少
单位:摩尔(mol)
符号:n
摩尔质量
阿伏加德罗常数
概念
单位:g·mol-1
符号:M
数值:6.02×1023
n=
m
M
n=
N
NA
