2.2 课时2 氯气的实验室制法、氯离子的检验 课件(共20张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.2 课时2 氯气的实验室制法、氯离子的检验 课件(共20张PPT) 2023-2024学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 41.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:08:20 | ||
图片预览




文档简介
(共20张PPT)
第二节 氯及其化合物 课时2
第二章 海水中的重要元素——钠和氯
还记得舍勒是如何发现氯气的吗?
软锰矿
浓盐酸
1.根据实验室制取气体的一般思路,能设计实验室制取氯气的装置。
2.通过观察、分析实验现象,掌握氯离子的检验方法。
知识点一:氯气的实验室制法
1.反应原理:
① MnO2 + 4HCl(浓)====MnCl2 + Cl2↑ + 2H2O
MnO2与浓HCl反应特点:
①浓盐酸中,一部分Cl-的化合价升高,另一部分Cl-的化合价不变。浓盐酸表现出:酸性、还原性。
②随着反应的进行盐酸浓度变小,故MnO2足量时,盐酸不完全反应。
2e-
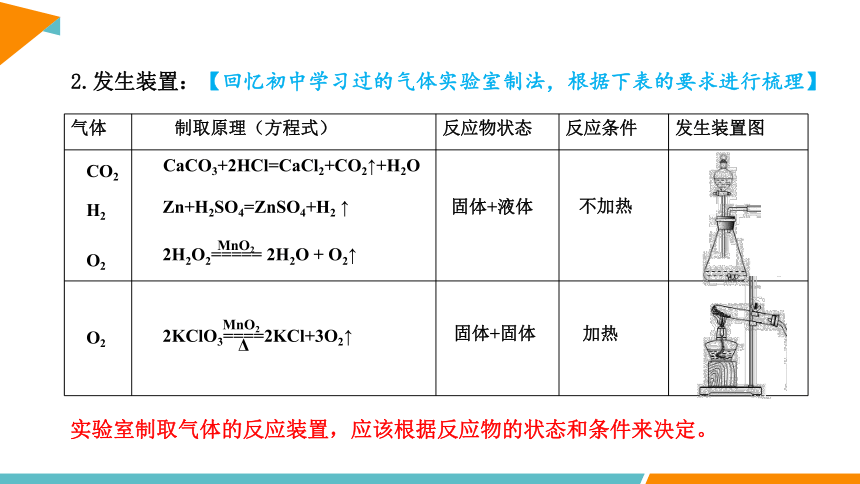
气体 制取原理(方程式) 反应物状态 反应条件 发生装置图
2.发生装置:
【回忆初中学习过的气体实验室制法,根据下表的要求进行梳理】
CO2
CaCO3+2HCl=CaCl2+CO2↑+H2O
固体+液体
固体+固体
不加热
加热
O2
O2
2H2O2===== 2H2O + O2↑
MnO2
H2
Zn+H2SO4=ZnSO4+H2 ↑
实验室制取气体的反应装置,应该根据反应物的状态和条件来决定。
2KClO3====2KCl+3O2↑
Δ
MnO2
固+液 气
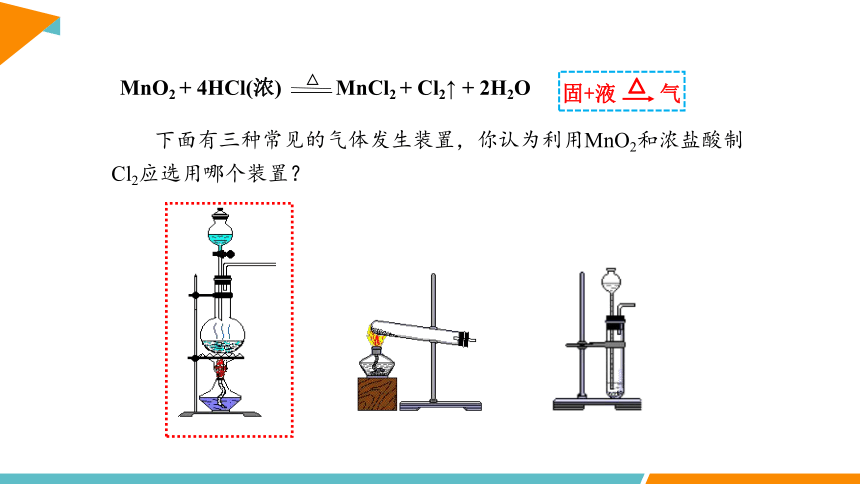
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
下面有三种常见的气体发生装置,你认为利用MnO2和浓盐酸制Cl2应选用哪个装置?
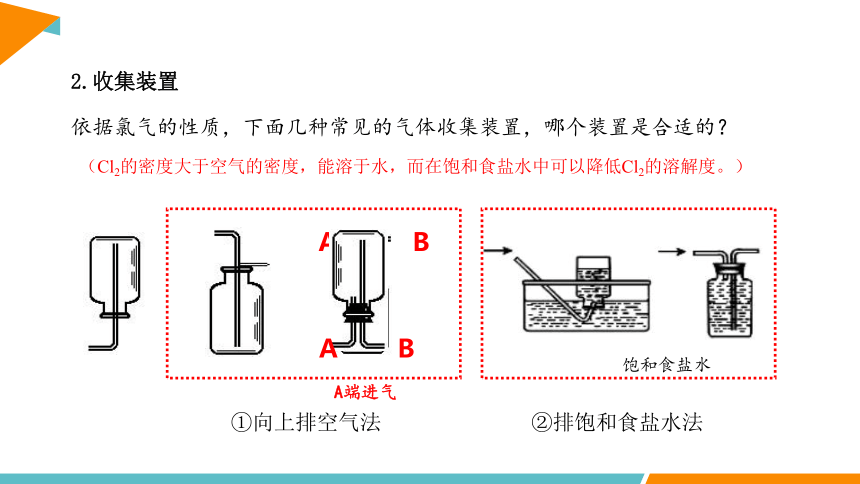
2.收集装置
依据氯气的性质,下面几种常见的气体收集装置,哪个装置是合适的?
(Cl2的密度大于空气的密度,能溶于水,而在饱和食盐水中可以降低Cl2的溶解度。)
A B
A B
A端进气
饱和食盐水
①向上排空气法
②排饱和食盐水法
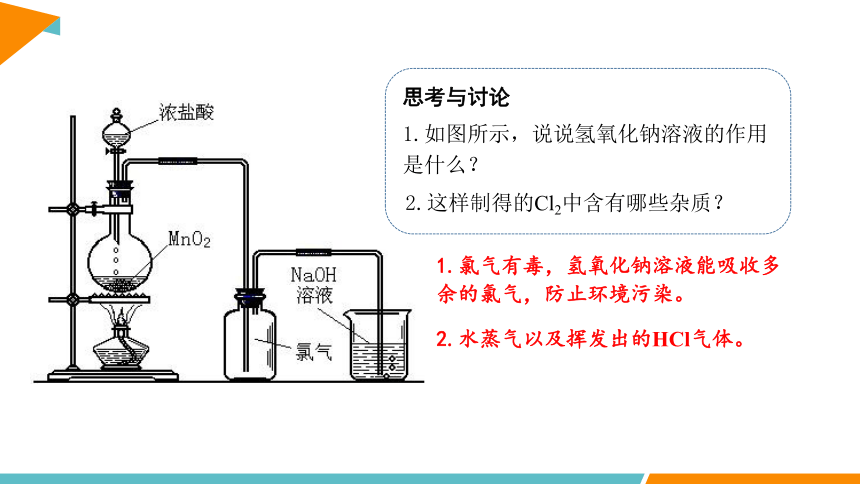
1.如图所示,说说氢氧化钠溶液的作用是什么?
思考与讨论
2.这样制得的Cl2中含有哪些杂质?
1.氯气有毒,氢氧化钠溶液能吸收多余的氯气,防止环境污染。
2.水蒸气以及挥发出的HCl气体。
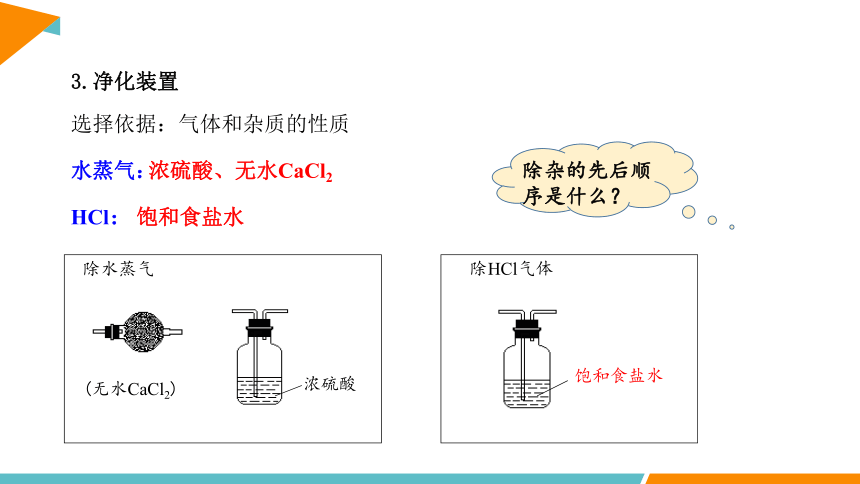
选择依据:气体和杂质的性质
3.净化装置
水蒸气:
HCl:
浓硫酸、无水CaCl2
饱和食盐水
除HCl气体
饱和食盐水
除水蒸气
(无水CaCl2)
浓硫酸
除杂的先后顺序是什么?
氯气的实验室制法整套装置图
4.实验步骤
⑴仪器的安装: 由下而上,从左到右
⑵检查气密性:
⑶添加药品: 先固后液,先下后上
⑷缓缓加热:
【思考】如何验满?
淀粉碘化钾试纸
浓盐酸易挥发,故必须缓慢加热且控制温度,避免Cl2中混有大量的HCl杂质,同时以免降低了HCl的利用率。
湿润的淀粉KI试纸变蓝
①必须用浓盐酸,MnO2与稀盐酸不反应。
②为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,
减少HCl的挥发。
③实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,
避免污染空气。
④尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,
吸收不完全。
5.实验室制备Cl2注意事项
1.某学生设计如下实验装置用于制备纯净的氯气。装置中有六处错误,请指出。
①烧瓶下面缺石棉网 ②铁圈下面缺酒精灯
③原料使用了稀盐酸 ④不应使用长颈漏斗
⑤盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
⑥洗气瓶D的气体入口导管应深插在液面下,而出口导管应靠近瓶塞
练一练
2.在MnO2 + 4HCl(浓) === MnCl2 + Cl2↑+ 2H2O反应中,被氧化的HCl与参加反应的HCl质量关系( )
A.1∶1 B.1∶2 C.2∶1 D.1∶4
△
B
知识点二:氯离子的检验
观看【实验2-2】演示实验,注意观察实验现象并完成下列表格。
视频
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
白色沉淀
白色沉淀
白色沉淀
不溶解
不溶解
产生气泡,白色沉淀溶解
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
2Ag++CO32- =Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2 ↑+H2O
检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
原因: AgNO3溶液与Cl-形成AgCl白色沉淀,还可与CO32-形成Ag2CO3白色沉淀,AgCl不与稀硝酸反应; Ag2CO3可与稀硝酸反应,沉淀溶解。
思考交流
样品 酸化液 白色沉淀
稀硝酸
AgNO3溶液
样品 白色沉淀 沉淀不溶解
稀硝酸
AgNO3溶液
氯离子检验的一般步骤
练一练
有一包白色固体,它可能是KCl、CaCl2、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得到无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体中一定含有的成分是 ,可能含有的成分是 。
(2)请写出上述实验中有关反应的离子方程式:
。
KCl和K2CO3
KNO3
Ag++Cl-=AgCl↓,2Ag++CO32-=Ag2CO3↓,Ag2CO3+2H+=2Ag++H2O+CO2↑
氯及其化合物
氯气的制备
氯离子的检验
原理:
检验试剂:硝酸银溶液、稀硝酸
固液加热装置
现象:生成白色沉淀,且沉淀不溶解
稀硝酸作用:排除碳酸根离子的干扰
装置
饱和食盐水、浓硫酸除杂
氢氧化钠溶液吸收尾气
操作顺序:先加硝酸银溶液,再加稀硝酸
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
第二节 氯及其化合物 课时2
第二章 海水中的重要元素——钠和氯
还记得舍勒是如何发现氯气的吗?
软锰矿
浓盐酸
1.根据实验室制取气体的一般思路,能设计实验室制取氯气的装置。
2.通过观察、分析实验现象,掌握氯离子的检验方法。
知识点一:氯气的实验室制法
1.反应原理:
① MnO2 + 4HCl(浓)====MnCl2 + Cl2↑ + 2H2O
MnO2与浓HCl反应特点:
①浓盐酸中,一部分Cl-的化合价升高,另一部分Cl-的化合价不变。浓盐酸表现出:酸性、还原性。
②随着反应的进行盐酸浓度变小,故MnO2足量时,盐酸不完全反应。
2e-
气体 制取原理(方程式) 反应物状态 反应条件 发生装置图
2.发生装置:
【回忆初中学习过的气体实验室制法,根据下表的要求进行梳理】
CO2
CaCO3+2HCl=CaCl2+CO2↑+H2O
固体+液体
固体+固体
不加热
加热
O2
O2
2H2O2===== 2H2O + O2↑
MnO2
H2
Zn+H2SO4=ZnSO4+H2 ↑
实验室制取气体的反应装置,应该根据反应物的状态和条件来决定。
2KClO3====2KCl+3O2↑
Δ
MnO2
固+液 气
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
下面有三种常见的气体发生装置,你认为利用MnO2和浓盐酸制Cl2应选用哪个装置?
2.收集装置
依据氯气的性质,下面几种常见的气体收集装置,哪个装置是合适的?
(Cl2的密度大于空气的密度,能溶于水,而在饱和食盐水中可以降低Cl2的溶解度。)
A B
A B
A端进气
饱和食盐水
①向上排空气法
②排饱和食盐水法
1.如图所示,说说氢氧化钠溶液的作用是什么?
思考与讨论
2.这样制得的Cl2中含有哪些杂质?
1.氯气有毒,氢氧化钠溶液能吸收多余的氯气,防止环境污染。
2.水蒸气以及挥发出的HCl气体。
选择依据:气体和杂质的性质
3.净化装置
水蒸气:
HCl:
浓硫酸、无水CaCl2
饱和食盐水
除HCl气体
饱和食盐水
除水蒸气
(无水CaCl2)
浓硫酸
除杂的先后顺序是什么?
氯气的实验室制法整套装置图
4.实验步骤
⑴仪器的安装: 由下而上,从左到右
⑵检查气密性:
⑶添加药品: 先固后液,先下后上
⑷缓缓加热:
【思考】如何验满?
淀粉碘化钾试纸
浓盐酸易挥发,故必须缓慢加热且控制温度,避免Cl2中混有大量的HCl杂质,同时以免降低了HCl的利用率。
湿润的淀粉KI试纸变蓝
①必须用浓盐酸,MnO2与稀盐酸不反应。
②为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,
减少HCl的挥发。
③实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,
避免污染空气。
④尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,
吸收不完全。
5.实验室制备Cl2注意事项
1.某学生设计如下实验装置用于制备纯净的氯气。装置中有六处错误,请指出。
①烧瓶下面缺石棉网 ②铁圈下面缺酒精灯
③原料使用了稀盐酸 ④不应使用长颈漏斗
⑤盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
⑥洗气瓶D的气体入口导管应深插在液面下,而出口导管应靠近瓶塞
练一练
2.在MnO2 + 4HCl(浓) === MnCl2 + Cl2↑+ 2H2O反应中,被氧化的HCl与参加反应的HCl质量关系( )
A.1∶1 B.1∶2 C.2∶1 D.1∶4
△
B
知识点二:氯离子的检验
观看【实验2-2】演示实验,注意观察实验现象并完成下列表格。
视频
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
实验现象 解释或离子方程式
加AgNO3 加入稀硝酸
稀盐酸
NaCl溶液
Na2CO3溶液
白色沉淀
白色沉淀
白色沉淀
不溶解
不溶解
产生气泡,白色沉淀溶解
Ag++Cl- =AgCl↓
Ag++Cl- =AgCl↓
2Ag++CO32- =Ag2CO3↓
Ag2CO3+2H+=2Ag++CO2 ↑+H2O
检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
原因: AgNO3溶液与Cl-形成AgCl白色沉淀,还可与CO32-形成Ag2CO3白色沉淀,AgCl不与稀硝酸反应; Ag2CO3可与稀硝酸反应,沉淀溶解。
思考交流
样品 酸化液 白色沉淀
稀硝酸
AgNO3溶液
样品 白色沉淀 沉淀不溶解
稀硝酸
AgNO3溶液
氯离子检验的一般步骤
练一练
有一包白色固体,它可能是KCl、CaCl2、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得到无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体中一定含有的成分是 ,可能含有的成分是 。
(2)请写出上述实验中有关反应的离子方程式:
。
KCl和K2CO3
KNO3
Ag++Cl-=AgCl↓,2Ag++CO32-=Ag2CO3↓,Ag2CO3+2H+=2Ag++H2O+CO2↑
氯及其化合物
氯气的制备
氯离子的检验
原理:
检验试剂:硝酸银溶液、稀硝酸
固液加热装置
现象:生成白色沉淀,且沉淀不溶解
稀硝酸作用:排除碳酸根离子的干扰
装置
饱和食盐水、浓硫酸除杂
氢氧化钠溶液吸收尾气
操作顺序:先加硝酸银溶液,再加稀硝酸
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
△
