2.1 课时3 碳酸钠和碳酸氢钠 课件(共25张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 2.1 课时3 碳酸钠和碳酸氢钠 课件(共25张PPT) 2023-2024学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 55.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
第一节 钠及其化合物 课时3
第二章 海水中的重要元素——钠和氯
1.通过实验探究,比较分析碳酸钠和碳酸氢钠的性质。
2.了解碳酸钠、碳酸氢钠在生产、生活中的应用及相互转化。
3.查阅资料,了解与纯碱有关的化学史,感受化学工业发展中技术进步的重要性,发展社会参与意识。
知识点一:碳酸钠和碳酸氢钠
1.碳酸钠和碳酸氢钠的用途
Na2CO3
(俗名:纯碱、苏打)
纺织
造纸
制皂
制玻璃
NaHCO3
俗名:小苏打
制药
焙制糕点
泡沫灭火器
观看【实验2-4】演示实验,记录实验现象并加以分析,完成表格。
2.碳酸钠和碳酸氢钠的性质比较
视频
现象
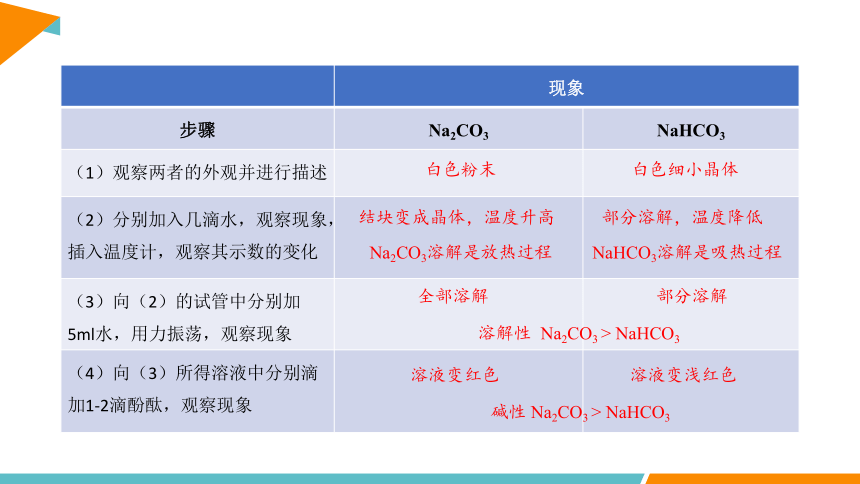
步骤 Na2CO3 NaHCO3
(1)观察两者的外观并进行描述
(2)分别加入几滴水,观察现象,插入温度计,观察其示数的变化
(3)向(2)的试管中分别加5ml水,用力振荡,观察现象
(4)向(3)所得溶液中分别滴加1-2滴酚酞,观察现象
现象
步骤 Na2CO3 NaHCO3
(1)观察两者的外观并进行描述
(2)分别加入几滴水,观察现象,插入温度计,观察其示数的变化
(3)向(2)的试管中分别加5ml水,用力振荡,观察现象
(4)向(3)所得溶液中分别滴加1-2滴酚酞,观察现象
白色粉末
白色细小晶体
结块变成晶体,温度升高
部分溶解,温度降低
Na2CO3溶解是放热过程
NaHCO3溶解是吸热过程
全部溶解
部分溶解
溶液变红色
溶液变浅红色
溶解性 Na2CO3 > NaHCO3
碱性 Na2CO3 > NaHCO3
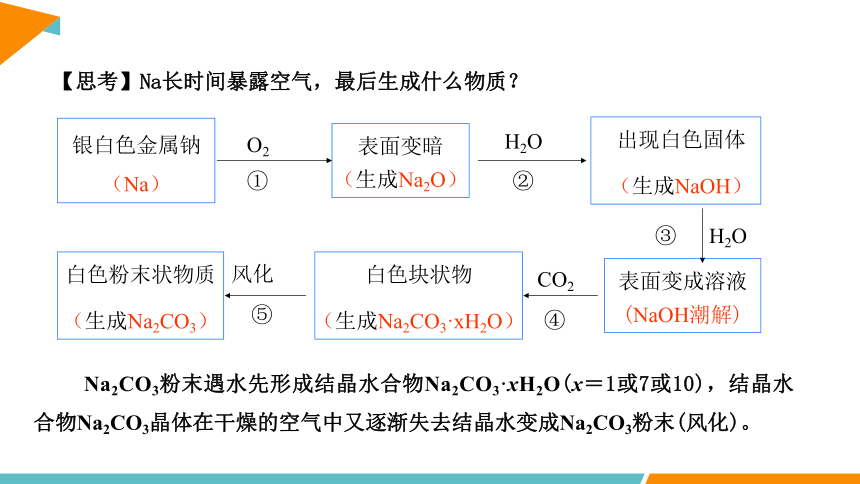
银白色金属钠(Na)
表面变暗(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·xH2O)
O2
风化
CO2
H2O
H2O
【思考】Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
Na2CO3粉末遇水先形成结晶水合物Na2CO3·xH2O(x=1或7或10),结晶水合物Na2CO3晶体在干燥的空气中又逐渐失去结晶水变成Na2CO3粉末(风化)。
3.碳酸钠和碳酸氢钠的鉴别方法
(1)碳酸钠和碳酸氢钠的热稳定性
观看【实验2-4】演示实验,记录实验现象。
视频
现象:加热碳酸氢钠,澄清石灰水变浑浊;加热碳酸钠,无明显现象。
结论:碳酸钠很稳定,受热不易分解;碳酸氢钠不稳定,受热易分解。
热稳定性:Na2CO3 > NaHCO3(鉴别)
2NaHCO3 === Na2CO3+H2O+CO2↑
(2)碳酸钠和碳酸氢钠与盐酸反应
写出碳酸钠、碳酸氢钠与盐酸的反应的化学方程式,请根据反应说说为什么该反应可以鉴别碳酸钠和碳酸氢钠?
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3 + HCl (少量)=NaHCO3 +NaCl(先)
NaHCO3 + HCl=NaCl + CO2 + H2O(后)
碳酸钠和碳酸氢钠都易与酸反应,碳酸氢钠与酸反应比碳酸钠更剧烈。(鉴别)
深度思考
在碳酸钠滴加盐酸与在盐酸中滴加碳酸钠,反应现象会一样吗?
Na2CO3
HCl
Na2CO3 + HCl =NaHCO3 +NaCl
NaHCO3 + HCl=NaCl + CO2↑ + H2O
HCl
Na2CO3
酸少量,先生成NaHCO3
现象:开始无气泡,
滴加一定量后才产生气泡
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
酸足够多,可直接将Na2CO3转化为CO2
现象:一开始就有气泡
(3)碳酸钠和碳酸氢钠与CaCl2溶液反应
Na2CO3+CaCl2=2NaCl+CaCO3
NaHCO3+CaCl2→
实验方案 实验现象 实验结论
滴加CaCl2溶液
分别加热NaHCO3固体和Na2CO3固体
用pH试纸测量相同浓度的碳酸钠溶液和碳酸氢钠溶液的pH
向盛有Na2CO3、NaHCO3固体的试管中分别滴加相同浓度的盐酸
溶液的pH不一样
一个受热分解,一个受热不易分解
NaHCO3与盐酸反应比Na2CO3剧烈,都放出气体
一个产生白色沉淀,
一个无现象
溶液 碱性强的是Na2CO3
稳定的是Na2CO3
受热易分解是NaHCO3
与盐酸反应剧烈的是NaHCO3
产生白色沉淀的是Na2CO3
4.碳酸钠和碳酸氢钠与碱反应
NaHCO3+NaOH =
与NaOH
Na2CO3 +NaOH=
×
Na2CO3+H2O
Na2CO3+Ca(OH)2=
NaHCO3+Ca(OH)2=
?
与Ca(OH)2
CaCO3↓+2NaOH
2OH- + 2HCO3- +Ca2+ = CaCO3↓+CO32-+2H2O
b. NaHCO3+Ca(OH)2(少量)=
a. NaHCO3+Ca(OH)2(过量) =
OH- + HCO3- +Ca2+ = CaCO3↓+H2O
CaCO3↓+NaOH+H2O
CaCO3↓+Na2CO3+2H2O
2
5.碳酸钠和碳酸氢钠相互转化
Na2CO3
NaHCO3
NaOH
△
CO2+H2O
若继续通入CO2,可以得到NaHCO3溶液
Na2CO3+H2O+CO2=2NaHCO3
往氢氧化钠溶液中通入CO2,则得到碳酸钠溶液
2NaOH+CO2=Na2CO3+H2O
1.下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中正确的是( )
A.在水中溶解性:Na2CO3<NaHCO3
B.热稳定性:Na2CO3>NaHCO3
C.与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3
D.CaCl2与Ca(OH)2均能鉴别这两种物质
B
练一练
2.如何除去以下情境中的杂质?
(1)如何除去Na2CO3粉末中少量的NaHCO3?
(2)如何除去Na2CO3溶液中少量的NaHCO3?
(3)如何除去NaHCO3溶液中少量的Na2CO3?
(4) 如何除去CO2中混有HCl气体?
加热
加适量的NaOH
通入足量CO2
将混合气体通过饱和NaHCO3溶液洗气
知识点二:焰色反应
很多金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色
观看【实验2-6】演示实验,观察实验步骤及记录不同溶液灼烧时的颜色。
视频
焰色试验:根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
铂丝在用过以后,上面会残留一些遗留的物质,如果不灼烧,会影响被检测物质的焰色,因此要灼烧至与原来的火焰颜色相同时为止。
②为什么每次在灼烧盐溶液前都要将铂丝蘸取盐酸灼烧至与原来的火焰颜色相同时为止?
思考·讨论
①为什么最好使用煤气灯?
因为煤气灯的火焰颜色浅、温度高。
练一练
下述对焰色试验操作注意事项的说明,正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
①②③④
侯氏制碱法
1.原料: NaCl(饱和)、NH3、CO2等
2.反应原理:
制取碳酸钠:
NaCl(饱和)+NH3+H2O+CO2===NH4Cl+NaHCO3↓
制取碳酸氢钠:
2NaHCO3===Na2CO3+H2O+CO2↑
两者溶解度不同,碳酸氢钠的溶解度低于氯化钠
讨论1 NaHCO3为什么能析出?
NaCl(饱和)+NH3+CO2+H2O===NaHCO3↓+NH4Cl(副产物)
3.生产原理流程:
NH3 CO2
(原料1,由合成氨工业提供)
(原料2)
2NaHCO3===Na2CO3+CO2↑+H2O
(产品)
4.优点:提高了食盐的转化率;缩短了生产流程;减少了对环境的污染。
讨论2 NH4Cl(副产物)能做什么?
做氮肥,所以侯氏制碱法又称联合制碱法(氮肥工业和制碱工业).
NH3在NaCl中的溶解度很大,先通入NH3使食盐水显碱性,能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体。
讨论3 先通氨气还是先通二氧化碳?
钠的重要氧化物
碳酸钠
碳酸氢钠
碳酸钠与碳酸氢钠的鉴别
加热
与酸反应
与氯化钙反应
白色粉末,易溶于水
白色晶体,易溶于水
俗名:纯碱、苏打
俗名:小苏打
与二氧化碳反应
与碱反应
焰色试验
钾为紫色(透过蓝色钴玻璃)
操作方法
第一节 钠及其化合物 课时3
第二章 海水中的重要元素——钠和氯
1.通过实验探究,比较分析碳酸钠和碳酸氢钠的性质。
2.了解碳酸钠、碳酸氢钠在生产、生活中的应用及相互转化。
3.查阅资料,了解与纯碱有关的化学史,感受化学工业发展中技术进步的重要性,发展社会参与意识。
知识点一:碳酸钠和碳酸氢钠
1.碳酸钠和碳酸氢钠的用途
Na2CO3
(俗名:纯碱、苏打)
纺织
造纸
制皂
制玻璃
NaHCO3
俗名:小苏打
制药
焙制糕点
泡沫灭火器
观看【实验2-4】演示实验,记录实验现象并加以分析,完成表格。
2.碳酸钠和碳酸氢钠的性质比较
视频
现象
步骤 Na2CO3 NaHCO3
(1)观察两者的外观并进行描述
(2)分别加入几滴水,观察现象,插入温度计,观察其示数的变化
(3)向(2)的试管中分别加5ml水,用力振荡,观察现象
(4)向(3)所得溶液中分别滴加1-2滴酚酞,观察现象
现象
步骤 Na2CO3 NaHCO3
(1)观察两者的外观并进行描述
(2)分别加入几滴水,观察现象,插入温度计,观察其示数的变化
(3)向(2)的试管中分别加5ml水,用力振荡,观察现象
(4)向(3)所得溶液中分别滴加1-2滴酚酞,观察现象
白色粉末
白色细小晶体
结块变成晶体,温度升高
部分溶解,温度降低
Na2CO3溶解是放热过程
NaHCO3溶解是吸热过程
全部溶解
部分溶解
溶液变红色
溶液变浅红色
溶解性 Na2CO3 > NaHCO3
碱性 Na2CO3 > NaHCO3
银白色金属钠(Na)
表面变暗(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(生成Na2CO3)
白色块状物
(生成Na2CO3·xH2O)
O2
风化
CO2
H2O
H2O
【思考】Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
Na2CO3粉末遇水先形成结晶水合物Na2CO3·xH2O(x=1或7或10),结晶水合物Na2CO3晶体在干燥的空气中又逐渐失去结晶水变成Na2CO3粉末(风化)。
3.碳酸钠和碳酸氢钠的鉴别方法
(1)碳酸钠和碳酸氢钠的热稳定性
观看【实验2-4】演示实验,记录实验现象。
视频
现象:加热碳酸氢钠,澄清石灰水变浑浊;加热碳酸钠,无明显现象。
结论:碳酸钠很稳定,受热不易分解;碳酸氢钠不稳定,受热易分解。
热稳定性:Na2CO3 > NaHCO3(鉴别)
2NaHCO3 === Na2CO3+H2O+CO2↑
(2)碳酸钠和碳酸氢钠与盐酸反应
写出碳酸钠、碳酸氢钠与盐酸的反应的化学方程式,请根据反应说说为什么该反应可以鉴别碳酸钠和碳酸氢钠?
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3 + HCl (少量)=NaHCO3 +NaCl(先)
NaHCO3 + HCl=NaCl + CO2 + H2O(后)
碳酸钠和碳酸氢钠都易与酸反应,碳酸氢钠与酸反应比碳酸钠更剧烈。(鉴别)
深度思考
在碳酸钠滴加盐酸与在盐酸中滴加碳酸钠,反应现象会一样吗?
Na2CO3
HCl
Na2CO3 + HCl =NaHCO3 +NaCl
NaHCO3 + HCl=NaCl + CO2↑ + H2O
HCl
Na2CO3
酸少量,先生成NaHCO3
现象:开始无气泡,
滴加一定量后才产生气泡
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
酸足够多,可直接将Na2CO3转化为CO2
现象:一开始就有气泡
(3)碳酸钠和碳酸氢钠与CaCl2溶液反应
Na2CO3+CaCl2=2NaCl+CaCO3
NaHCO3+CaCl2→
实验方案 实验现象 实验结论
滴加CaCl2溶液
分别加热NaHCO3固体和Na2CO3固体
用pH试纸测量相同浓度的碳酸钠溶液和碳酸氢钠溶液的pH
向盛有Na2CO3、NaHCO3固体的试管中分别滴加相同浓度的盐酸
溶液的pH不一样
一个受热分解,一个受热不易分解
NaHCO3与盐酸反应比Na2CO3剧烈,都放出气体
一个产生白色沉淀,
一个无现象
溶液 碱性强的是Na2CO3
稳定的是Na2CO3
受热易分解是NaHCO3
与盐酸反应剧烈的是NaHCO3
产生白色沉淀的是Na2CO3
4.碳酸钠和碳酸氢钠与碱反应
NaHCO3+NaOH =
与NaOH
Na2CO3 +NaOH=
×
Na2CO3+H2O
Na2CO3+Ca(OH)2=
NaHCO3+Ca(OH)2=
?
与Ca(OH)2
CaCO3↓+2NaOH
2OH- + 2HCO3- +Ca2+ = CaCO3↓+CO32-+2H2O
b. NaHCO3+Ca(OH)2(少量)=
a. NaHCO3+Ca(OH)2(过量) =
OH- + HCO3- +Ca2+ = CaCO3↓+H2O
CaCO3↓+NaOH+H2O
CaCO3↓+Na2CO3+2H2O
2
5.碳酸钠和碳酸氢钠相互转化
Na2CO3
NaHCO3
NaOH
△
CO2+H2O
若继续通入CO2,可以得到NaHCO3溶液
Na2CO3+H2O+CO2=2NaHCO3
往氢氧化钠溶液中通入CO2,则得到碳酸钠溶液
2NaOH+CO2=Na2CO3+H2O
1.下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中正确的是( )
A.在水中溶解性:Na2CO3<NaHCO3
B.热稳定性:Na2CO3>NaHCO3
C.与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3
D.CaCl2与Ca(OH)2均能鉴别这两种物质
B
练一练
2.如何除去以下情境中的杂质?
(1)如何除去Na2CO3粉末中少量的NaHCO3?
(2)如何除去Na2CO3溶液中少量的NaHCO3?
(3)如何除去NaHCO3溶液中少量的Na2CO3?
(4) 如何除去CO2中混有HCl气体?
加热
加适量的NaOH
通入足量CO2
将混合气体通过饱和NaHCO3溶液洗气
知识点二:焰色反应
很多金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色
观看【实验2-6】演示实验,观察实验步骤及记录不同溶液灼烧时的颜色。
视频
焰色试验:根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
铂丝在用过以后,上面会残留一些遗留的物质,如果不灼烧,会影响被检测物质的焰色,因此要灼烧至与原来的火焰颜色相同时为止。
②为什么每次在灼烧盐溶液前都要将铂丝蘸取盐酸灼烧至与原来的火焰颜色相同时为止?
思考·讨论
①为什么最好使用煤气灯?
因为煤气灯的火焰颜色浅、温度高。
练一练
下述对焰色试验操作注意事项的说明,正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
①②③④
侯氏制碱法
1.原料: NaCl(饱和)、NH3、CO2等
2.反应原理:
制取碳酸钠:
NaCl(饱和)+NH3+H2O+CO2===NH4Cl+NaHCO3↓
制取碳酸氢钠:
2NaHCO3===Na2CO3+H2O+CO2↑
两者溶解度不同,碳酸氢钠的溶解度低于氯化钠
讨论1 NaHCO3为什么能析出?
NaCl(饱和)+NH3+CO2+H2O===NaHCO3↓+NH4Cl(副产物)
3.生产原理流程:
NH3 CO2
(原料1,由合成氨工业提供)
(原料2)
2NaHCO3===Na2CO3+CO2↑+H2O
(产品)
4.优点:提高了食盐的转化率;缩短了生产流程;减少了对环境的污染。
讨论2 NH4Cl(副产物)能做什么?
做氮肥,所以侯氏制碱法又称联合制碱法(氮肥工业和制碱工业).
NH3在NaCl中的溶解度很大,先通入NH3使食盐水显碱性,能够吸收大量CO2气体,产生高浓度的HCO3-,才能析出NaHCO3晶体。
讨论3 先通氨气还是先通二氧化碳?
钠的重要氧化物
碳酸钠
碳酸氢钠
碳酸钠与碳酸氢钠的鉴别
加热
与酸反应
与氯化钙反应
白色粉末,易溶于水
白色晶体,易溶于水
俗名:纯碱、苏打
俗名:小苏打
与二氧化碳反应
与碱反应
焰色试验
钾为紫色(透过蓝色钴玻璃)
操作方法
