4.1 课时2 元素周期表 核素 课件(共22张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.1 课时2 元素周期表 核素 课件(共22张PPT) 2023-2024学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 00:00:00 | ||
图片预览





文档简介
(共22张PPT)
第一节 原子结构与元素周期表 课时2
第四章 物质结构 元素周期律
化学元素种类繁多,怎么归类处理能方便我们学习研究它们呢?
1.了解元素周期表的发展历史。
2.说出元素周期表的编排原则和结构,认识原子结构与元素在周期表中位置间的关系。
3.知道元素、核素、同位素的含义,了解核素的应用。
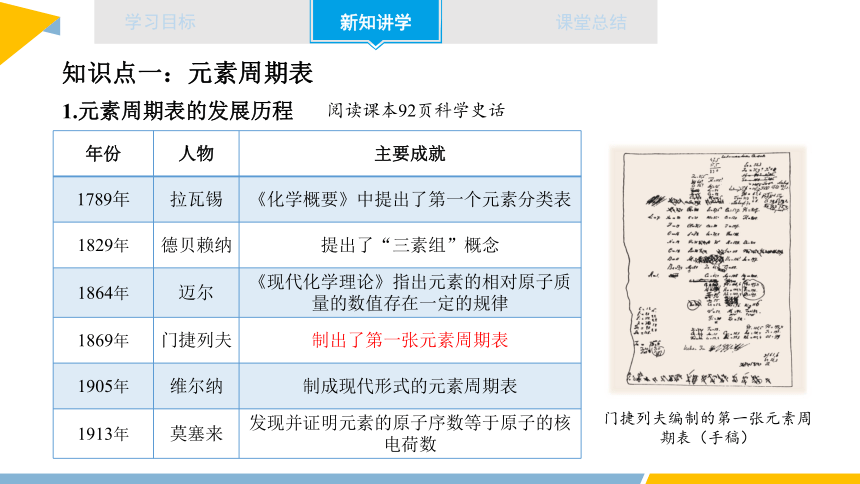
年份 人物 主要成就
1789年 拉瓦锡 《化学概要》中提出了第一个元素分类表
1829年 德贝赖纳 提出了“三素组”概念
1864年 迈尔 《现代化学理论》指出元素的相对原子质量的数值存在一定的规律
1869年 门捷列夫 制出了第一张元素周期表
1905年 维尔纳 制成现代形式的元素周期表
1913年 莫塞来 发现并证明元素的原子序数等于原子的核电荷数
知识点一:元素周期表
1.元素周期表的发展历程
门捷列夫编制的第一张元素周期表(手稿)
阅读课本92页科学史话
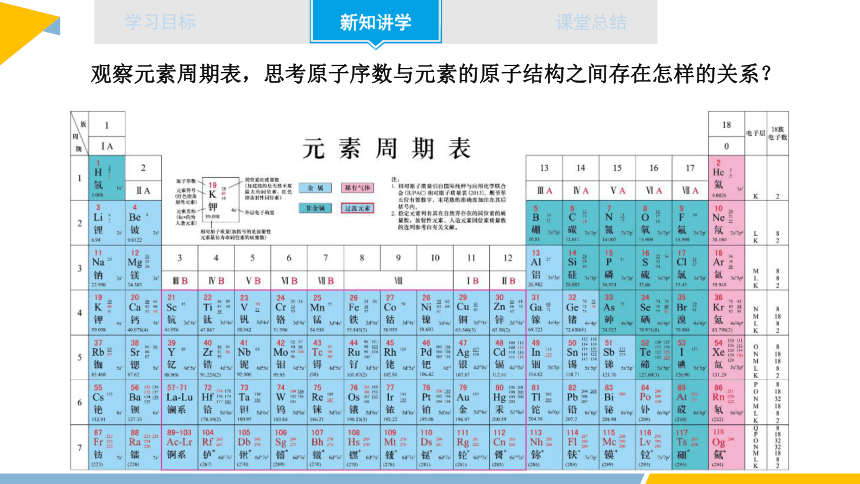
2.元素周期表的排序依据
将元素按照相对原子质量由小到大依次排序,并将化学性质相似的元素放在一个纵列
由相对原子质量改为原子的核电荷数,元素周期表逐渐演变为我们现在常用的形式
原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数
逐渐演变
前期
后期
观察元素周期表,思考原子序数与元素的原子结构之间存在怎样的关系?
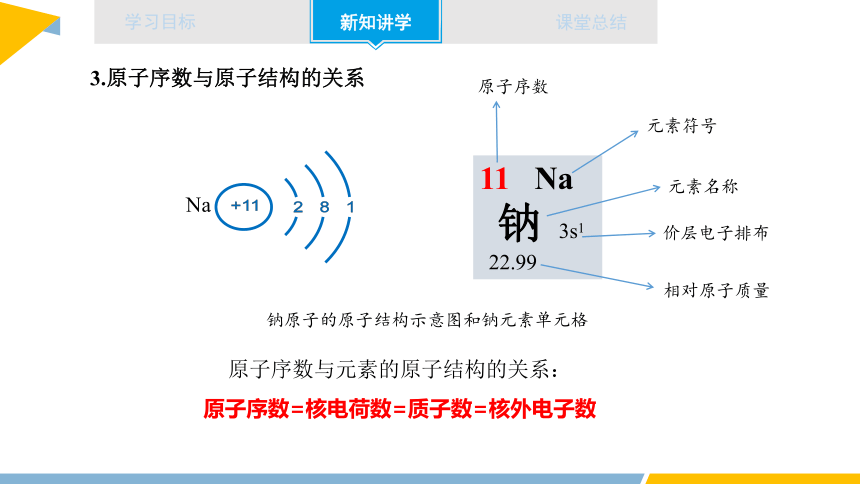
11 Na
钠 3s1
22.99
3.原子序数与原子结构的关系
原子序数与元素的原子结构的关系:
原子序数=核电荷数=质子数=核外电子数
Na
钠原子的原子结构示意图和钠元素单元格
原子序数
元素符号
元素名称
相对原子质量
价层电子排布
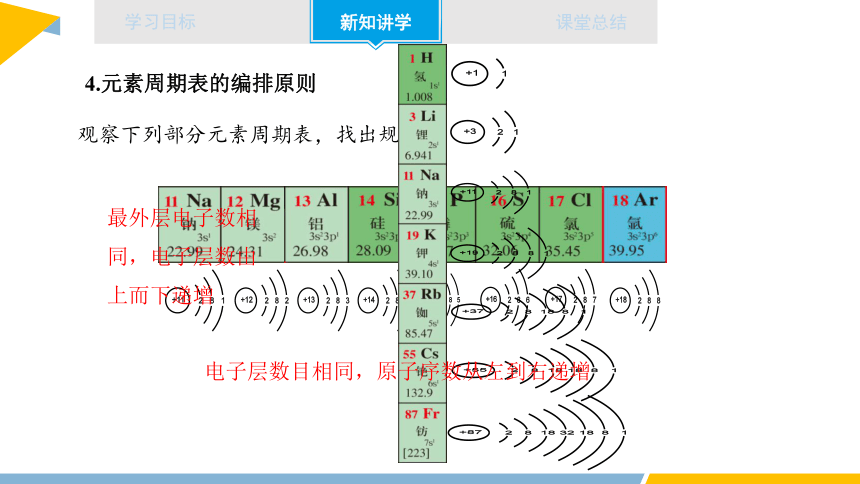
4.元素周期表的编排原则
观察下列部分元素周期表,找出规律
电子层数目相同,原子序数从左到右递增
最外层电子数相同,电子层数由上而下递增
横行原则:
将电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
元素周期表中有七个横行,每一个横行叫做一个周期
纵列原则:
将最外层电子数相同的元素,按电子层数递增顺序由上而下排成纵列。
元素周期表中有18个纵列,每一个纵列叫做一个族(8、9、10三个纵列共同组成第VIII族)
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og 7
观察元素周期表,将相关内容填写在表中,并思考周期序数与原子核外电子层数有什么关系?
Li~Ne 8 2
Na~Ar 8 3
K~Kr 18 4
Rb~Xe 18 5
Cs~Rn 32 6
Fr~Og 32 7
短周期
长周期
每一周期中元素的电子层数相同,周期序数=核外电子层数
主族:主族元素的族序数后标A,共7个
副族:副族元素的族序数后标B,共7个
第VIII族
0族(稀有气体元素)
七个周期
5.元素周期表的结构
1.下列数字表示元素的原子序数,其中属于主族元素的是( )。
A.26 B.37
C.72 D.112
2.已知A和B分别为第IIA族和第IIIA族元素,且A、B为同一周期,它们的原子序数分别为a和b,下列关系式不正确的是( )。
A.b=a+1 B.b=a+11
C.b=a+25 D.b=a+10
B
D
练一练
3.下列关于元素周期表的说法正确的是( )。
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.周期表里,元素所在的周期序数等于原子核外最外层电子数
C.元素周期表有七个主族,七个副族,1个零族,1个VIII族,共16个纵行
D.X2+的核外电子数目为18,则X在第四周期第IIA族
4.某微粒的结构是 ,则该元素在周期表中的位置是( )。
A.第三周期,第VIII族 B.第四周期,第IA族
C.第三周期,第IA族 D.第四周期,第VIII族
D
B
5.下列关于元素周期表的叙述正确的是( )。
A.铁位于元素周期表的第四周期第VIIIB族,属于过渡元素
B.元素周期表有7个横行即7个周期,有18个纵列16个族
C.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电子数
D.某种元素的相对原子质量取整数值,就是其原子序数
6. 在元素周期表中,金属元素与非金属元素分界线附近能找到( )。
A.制半导体元素 B.制农药元素
C.制催化剂元素 D.制耐高温合金的元素
B
A
知识点二:核素
观察右图,H的质量数为什么有三个呢?
【想一想】
1 H
氢
1.008
1
2
3
质量数
元素是具有相同质子数(核电荷数)的一类原子总称。
特点:同种元素的原子一定具有相同的质子数,但是同种元素的原子的中子数不一定相同。
1.核素
概念:具有一定数目质子和一定数目中子的一种原子。如:1H、2H、3H都是H的核素。
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕 piē
H
1 1 氘 dāo
H
1 2 氚 chuān
1
1
2
1
H
3
1
氢元素的不同核素
2.同位素
概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
特点:两同:同种元素,同质子数;两不同:中子数不同,原子不同。
如16O、18O互为同位素。
同位:是指核素的质子数相同,在元素周期表中占有相同的位置
元素、核素、同位素、同素异形体之间的区别
元素 核素 同位素
同素异形体
本质 质子数相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素之间的相互称谓 同种元素形成的不同的单质之间的相互称谓
范畴 同类原子 原子 原子
单质
名称
内容
项目
常见核素 应用
元素有12C、13C、14C等核素 14C用于测定文物年代
氧元素有16O、17O、18O等核素 18O用于示踪原子
氢元素有1H、2H、3H等核素 2H、3H用于制造氢弹
铀元素有234U、235U、238U等核素 235U用于核燃料
放射性同位素 育种、给金属探伤、诊断和治疗疾病
3.常见核素及其应用
衰变测定装置(局部)
2.下列各组中互为同位素的是( )。
A. 与 B.3H2O与1H2O
C. 与 D.金刚石与石墨
C
1.下列叙述中正确的是( )。
A.35Cl2和37Cl2都是氯气单质
B.H3O+和OH-中具有相同的质子数和电子数
C.235U和238U互为同位素,物理性质几乎相同,化学性质不同
D.质子数相同的微粒一定属于同一元素
练一练
A
3.意大利科学家合成一种新型氧分子,它由四个氧原子构成,专家认为它液化后的能量密度比普通氧分子高得多,下列关于该分子叙述正确的是( )。
A.它是氧元素的另外一种同位素
B.它是氧元素的另一种同素异形体
C.它的摩尔质量是64
D.它是一种化合物
B
4.长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是( )。
A.LiH、LiD、LiT的摩尔质量之比为1:2:3
B.H、D、T之间互称为同素异形体
C.他们都是强还原剂
D.氕化锂、氘化锂、氚化锂中H、D、T化合价都为+1价
C
元素周期表
门捷列夫制出了第一张元素周期表
元素周期表编排规则
元素周期表的结构
横行:电子层数相同,从左往右核电荷数增大
纵列:最外层电子数相同,从上到下电子层数增多
周期(7个)
族(16个)
短周期(1-3周期)
长周期(4-7周期)
主族7个
副族7个
零族1个
第VIII族
核素、同位素
概念及联系
同位素
核素:质子数和中子数都一定的原子
同位素:同一元素的不同核素互为同位素
特点:同位素在元素周期表中位置相同
应用:考古;制氢弹等
第一节 原子结构与元素周期表 课时2
第四章 物质结构 元素周期律
化学元素种类繁多,怎么归类处理能方便我们学习研究它们呢?
1.了解元素周期表的发展历史。
2.说出元素周期表的编排原则和结构,认识原子结构与元素在周期表中位置间的关系。
3.知道元素、核素、同位素的含义,了解核素的应用。
年份 人物 主要成就
1789年 拉瓦锡 《化学概要》中提出了第一个元素分类表
1829年 德贝赖纳 提出了“三素组”概念
1864年 迈尔 《现代化学理论》指出元素的相对原子质量的数值存在一定的规律
1869年 门捷列夫 制出了第一张元素周期表
1905年 维尔纳 制成现代形式的元素周期表
1913年 莫塞来 发现并证明元素的原子序数等于原子的核电荷数
知识点一:元素周期表
1.元素周期表的发展历程
门捷列夫编制的第一张元素周期表(手稿)
阅读课本92页科学史话
2.元素周期表的排序依据
将元素按照相对原子质量由小到大依次排序,并将化学性质相似的元素放在一个纵列
由相对原子质量改为原子的核电荷数,元素周期表逐渐演变为我们现在常用的形式
原子序数:按照元素在周期表中的顺序给元素编号,得到原子序数
逐渐演变
前期
后期
观察元素周期表,思考原子序数与元素的原子结构之间存在怎样的关系?
11 Na
钠 3s1
22.99
3.原子序数与原子结构的关系
原子序数与元素的原子结构的关系:
原子序数=核电荷数=质子数=核外电子数
Na
钠原子的原子结构示意图和钠元素单元格
原子序数
元素符号
元素名称
相对原子质量
价层电子排布
4.元素周期表的编排原则
观察下列部分元素周期表,找出规律
电子层数目相同,原子序数从左到右递增
最外层电子数相同,电子层数由上而下递增
横行原则:
将电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
元素周期表中有七个横行,每一个横行叫做一个周期
纵列原则:
将最外层电子数相同的元素,按电子层数递增顺序由上而下排成纵列。
元素周期表中有18个纵列,每一个纵列叫做一个族(8、9、10三个纵列共同组成第VIII族)
周期序数 起止元素 包括元素种数 核外电子层数
1 H~He 2 1
2
3
4
5
6
7 Fr~Og 7
观察元素周期表,将相关内容填写在表中,并思考周期序数与原子核外电子层数有什么关系?
Li~Ne 8 2
Na~Ar 8 3
K~Kr 18 4
Rb~Xe 18 5
Cs~Rn 32 6
Fr~Og 32 7
短周期
长周期
每一周期中元素的电子层数相同,周期序数=核外电子层数
主族:主族元素的族序数后标A,共7个
副族:副族元素的族序数后标B,共7个
第VIII族
0族(稀有气体元素)
七个周期
5.元素周期表的结构
1.下列数字表示元素的原子序数,其中属于主族元素的是( )。
A.26 B.37
C.72 D.112
2.已知A和B分别为第IIA族和第IIIA族元素,且A、B为同一周期,它们的原子序数分别为a和b,下列关系式不正确的是( )。
A.b=a+1 B.b=a+11
C.b=a+25 D.b=a+10
B
D
练一练
3.下列关于元素周期表的说法正确的是( )。
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.周期表里,元素所在的周期序数等于原子核外最外层电子数
C.元素周期表有七个主族,七个副族,1个零族,1个VIII族,共16个纵行
D.X2+的核外电子数目为18,则X在第四周期第IIA族
4.某微粒的结构是 ,则该元素在周期表中的位置是( )。
A.第三周期,第VIII族 B.第四周期,第IA族
C.第三周期,第IA族 D.第四周期,第VIII族
D
B
5.下列关于元素周期表的叙述正确的是( )。
A.铁位于元素周期表的第四周期第VIIIB族,属于过渡元素
B.元素周期表有7个横行即7个周期,有18个纵列16个族
C.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电子数
D.某种元素的相对原子质量取整数值,就是其原子序数
6. 在元素周期表中,金属元素与非金属元素分界线附近能找到( )。
A.制半导体元素 B.制农药元素
C.制催化剂元素 D.制耐高温合金的元素
B
A
知识点二:核素
观察右图,H的质量数为什么有三个呢?
【想一想】
1 H
氢
1.008
1
2
3
质量数
元素是具有相同质子数(核电荷数)的一类原子总称。
特点:同种元素的原子一定具有相同的质子数,但是同种元素的原子的中子数不一定相同。
1.核素
概念:具有一定数目质子和一定数目中子的一种原子。如:1H、2H、3H都是H的核素。
氢元素的原子核 原子名称 原子符号
质子数(Z) 中子数(N)
1 0 氕 piē
H
1 1 氘 dāo
H
1 2 氚 chuān
1
1
2
1
H
3
1
氢元素的不同核素
2.同位素
概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
特点:两同:同种元素,同质子数;两不同:中子数不同,原子不同。
如16O、18O互为同位素。
同位:是指核素的质子数相同,在元素周期表中占有相同的位置
元素、核素、同位素、同素异形体之间的区别
元素 核素 同位素
同素异形体
本质 质子数相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素之间的相互称谓 同种元素形成的不同的单质之间的相互称谓
范畴 同类原子 原子 原子
单质
名称
内容
项目
常见核素 应用
元素有12C、13C、14C等核素 14C用于测定文物年代
氧元素有16O、17O、18O等核素 18O用于示踪原子
氢元素有1H、2H、3H等核素 2H、3H用于制造氢弹
铀元素有234U、235U、238U等核素 235U用于核燃料
放射性同位素 育种、给金属探伤、诊断和治疗疾病
3.常见核素及其应用
衰变测定装置(局部)
2.下列各组中互为同位素的是( )。
A. 与 B.3H2O与1H2O
C. 与 D.金刚石与石墨
C
1.下列叙述中正确的是( )。
A.35Cl2和37Cl2都是氯气单质
B.H3O+和OH-中具有相同的质子数和电子数
C.235U和238U互为同位素,物理性质几乎相同,化学性质不同
D.质子数相同的微粒一定属于同一元素
练一练
A
3.意大利科学家合成一种新型氧分子,它由四个氧原子构成,专家认为它液化后的能量密度比普通氧分子高得多,下列关于该分子叙述正确的是( )。
A.它是氧元素的另外一种同位素
B.它是氧元素的另一种同素异形体
C.它的摩尔质量是64
D.它是一种化合物
B
4.长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是( )。
A.LiH、LiD、LiT的摩尔质量之比为1:2:3
B.H、D、T之间互称为同素异形体
C.他们都是强还原剂
D.氕化锂、氘化锂、氚化锂中H、D、T化合价都为+1价
C
元素周期表
门捷列夫制出了第一张元素周期表
元素周期表编排规则
元素周期表的结构
横行:电子层数相同,从左往右核电荷数增大
纵列:最外层电子数相同,从上到下电子层数增多
周期(7个)
族(16个)
短周期(1-3周期)
长周期(4-7周期)
主族7个
副族7个
零族1个
第VIII族
核素、同位素
概念及联系
同位素
核素:质子数和中子数都一定的原子
同位素:同一元素的不同核素互为同位素
特点:同位素在元素周期表中位置相同
应用:考古;制氢弹等
