3.2 课时1 常见的合金及应用 课件(共28张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 3.2 课时1 常见的合金及应用 课件(共28张PPT) 2023-2024学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 38.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
大家想一想我们身边的金属材料有哪些?
纯金属单质和合金
第二节 金属材料 课时1
第三章 铁 金属材料
1.了解合金的概念,并能联系纯金属与合金的微观结构解释二者性能的差异。
2.以铁合金、铝合金为例,能从元素组成上对合金进行分类,并认识不同类型金属材料组成、性能与应用的联系,强化“性能决定用途”的观念。
3.通过实验探究铝和氧化铝的性质及转化,认识两性氧化物,丰富对金属多样性的认识。
4.了解储氢合金、钛合金等新型合金,感受化学科学对创造等多新材料以满足人类生活需要和促进科技发展的重要作用。
知识点一:合金
1.定义:在金属中加热熔合某些金属或非金属,就可以制得具有金属特性的物质,叫做合金。
物理变化
混合物
2.性质:
具有许多优良的物理、化学或机械性能。
(1) 硬度大于各成分金属
(2) 熔点低于各成分金属
结构决定性质:
合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
纯金属与合金的结构比较
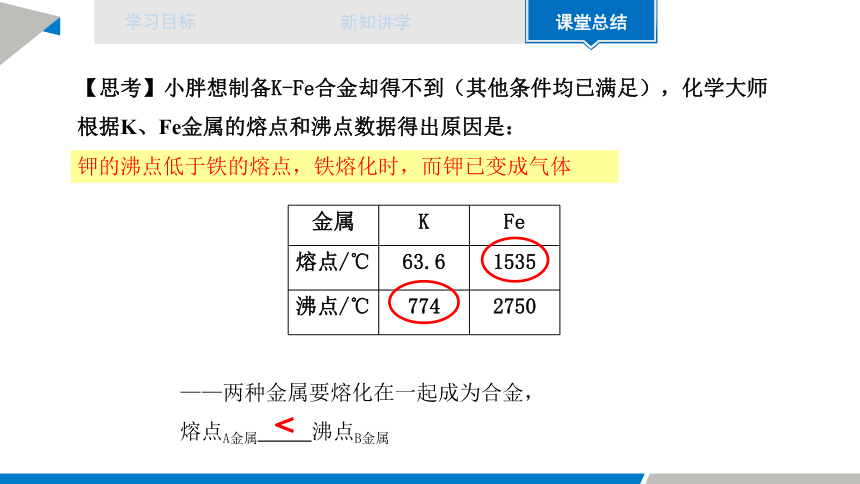
【思考】小胖想制备K-Fe合金却得不到(其他条件均已满足),化学大师根据K、Fe金属的熔点和沸点数据得出原因是:
金属 K Fe
熔点/℃ 63.6 1535
沸点/℃ 774 2750
——两种金属要熔化在一起成为合金,
熔点A金属 沸点B金属
钾的沸点低于铁的熔点,铁熔化时,而钾已变成气体
<
[特别注意]
(1)合金一定是混合物。
(2)合金在许多方面不同于各组成金属,不是简单加合,需加热熔合;
但在化学性质上,一般认为合金体现的是各成分金属的化学性质。
(3)若一种金属的熔点高于另一金属的沸点,则二者不能形成合金。
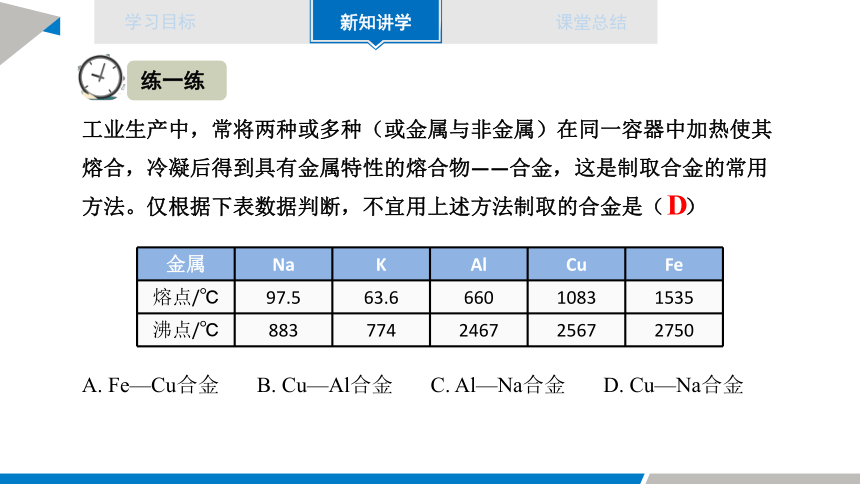
工业生产中,常将两种或多种(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金,这是制取合金的常用方法。仅根据下表数据判断,不宜用上述方法制取的合金是( )
A. Fe—Cu合金 B. Cu—Al合金 C. Al—Na合金 D. Cu—Na合金
金属 Na K Al Cu Fe
熔点/℃ 97.5 63.6 660 1083 1535
沸点/℃ 883 774 2467 2567 2750
练一练
D
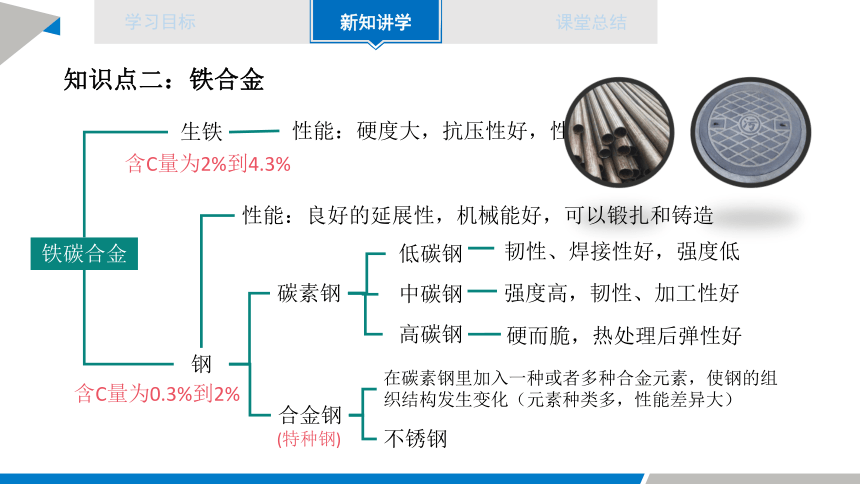
知识点二:铁合金
铁碳合金
生铁
钢
含C量为2%到4.3%
含C量为0.3%到2%
性能:硬度大,抗压性好,性脆
性能:良好的延展性,机械能好,可以锻扎和铸造
碳素钢
合金钢
低碳钢
中碳钢
高碳钢
韧性、焊接性好,强度低
强度高,韧性、加工性好
硬而脆,热处理后弹性好
在碳素钢里加入一种或者多种合金元素,使钢的组织结构发生变化(元素种类多,性能差异大)
不锈钢
(特种钢)
不锈钢是最常用的一种合金钢,它的合金元素是铬(Cr)和镍(Ni)
在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这对你有什么启示?
思考与讨论
1.合金元素不同,其性能不同
2.结构决定性能,性能决定其用途
3.改变合金元素来开发新功能的金属材料
下列有关铁和铁合金的说法错误的是( )
A.生铁比铁软
B.铁有良好的导热性
C.钢是铁的合金
D.铁在潮湿的空气中容易生锈
A
练一练
知识点三:铝和铝合金
铝元素在地壳中的含量排在第三位,是含量最多的金属元素
铝原子的结构
Al-3e-=Al3+
还原性
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg …
铝在金属活动顺序表中的位置
铝属于活泼金属
常温下,铝和氧气反应
4Al+3O2=2Al2O3
想一想同样是活泼金属,钠也能和氧气反应,但为什么钠不能在空气中存放,而铝却可以长时间存放呢?
氧化铝薄膜性质比较稳定,有较好的耐磨、耐腐蚀性,阻止内部金属与空气发生反应,从而可以保护内部的金属。
耐火坩埚
耐火砖
燃器具点火瓷头
Al2O3是一种白色难熔的固体,不溶于水,可作耐火材料(熔点2050℃),硬度也很大。
资料卡
铝制品的表面处理
在空气中,铝的表面自然形成的氧化膜很薄,耐磨性和抗蚀性还不够强。为了使铝制品适应于不同的用途,常采用化学方法对铝的表面进行处理,如增加膜的厚度,对氧化膜进行着色等。例如,化学氧化(用铬酸做氧化剂)可以使氧化膜产生美丽的颜色。市场上有不少铝制品是经过这种方法处理的。
1.铝和氧化铝的性质
【实验3-4】观察实验现象,完成下列表格。
视频
实验现象 实验原理(反应方程式)
反应刚开始,___________
一段时间后,产生_________ 点燃的木条放在试管口, 。
现象不明显
大量气泡
听到爆鸣声
2Al+6HCl=2AlCl3+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
Al和Al2O3都能与酸发生反应
【实验3-5】观察实验现象,完成下列表格。
视频
实验现象 实验原理(反应方程式)
铝片与NaOH溶液反应
铝片(打磨过)与NaOH溶液反应
开始没有气泡,一段时间后产生气泡,将点燃的木条放在试管口可听到爆鸣声。
立即产生气泡,将点燃的木条放在试管口可听到爆鸣声。
Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O =2NaAlO2+3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
【思考】通过实验,你对铝和氧化铝的性质有什么认识?
两性氧化物:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
Al和 A12O3均能与酸、碱反应。
分别属于两性金属和两性氧化物。
【应用】由于Al和A12O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或食物。
2Al+6HCl=2AlCl3+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+2NaOH=2NaAlO2+H2O
1.称取两份铝粉,第一份加入足量的浓NaOH溶液,第二份加入足量的盐酸,如果放出等体积的气体(在同温、同压下),则两份铝粉的质量之比为( )
A.1∶2 B.1∶3 C.3∶2 D.1∶1
D
练一练
2.下列说法正确的是( )
A.金属氧化物都是碱性氧化物,非金属氧化物都是酸性氧化物。
B.Al2O3能与所有的酸、碱溶液反应。
C.Al2O3属于两性氧化物。
D.用Al2O3坩埚加热NaOH固体。
E.擦去表面氧化铝的铝条,在酒精灯上灼烧时,熔化的铝纷纷滴落下来。
C
3.在加入铝粉能放出气体的溶液中,一定能大量共存的离子组是( )
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+6HCl=2AlCl3+3H2↑
C
2.铝合金
为什么生活中很少见到以纯铝为材料的制品?
纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,使用较多的是具有不同组成和性质的铝合金。
硬铝
硬铝中含Cu 4%、Mg 0.5%、Mn 0.5%、Si 0.7%,它密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
知识点四:新型合金
1.储氢合金
一种新型合金,一定条件下能吸收氢气,一定条件能放出氢气:循环寿命性能优异,并可被用于大型电池,尤其是电动车辆、混合动力电动车辆、高功率应用等等。
2.钛合金
钛合金强度高、耐蚀性好、耐热性高。主要用于制作飞机发动机压气机部件,其次为火箭、导弹和高速飞机的结构件
3.耐热合金
人造卫星的天线
4.形状记忆合金
稀土(Rare earth)元素是化学周期表中镧系元素和钪、钇共十七种金属元素的总称。
下列说法正确的是( )
A.用来制造储存氢气所用钢瓶的合金是储氢合金
B.不锈钢是最常见的新型合金
C.新型合金主要应用于航天航空、生物工程等领域
D.碳纤维复合材料属于新型合金材料
C
练一练
金属材料
合金
铁合金
铝和氧化铝
生铁含碳量为:2%~4.3%
钢含碳量为:0.03%~2%
碳素钢
合金钢
高碳钢
中碳钢
低碳钢
铝
氧化铝:
两性氧化物
Al2O3 + 6HCl === 2AlCl3 + 3H2O
Al2O3 + 2NaOH === 2NaAlO2 + H2O
2Al + 6HCl === 2AlCl3 + 3H2↑
2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
新型合金
大家想一想我们身边的金属材料有哪些?
纯金属单质和合金
第二节 金属材料 课时1
第三章 铁 金属材料
1.了解合金的概念,并能联系纯金属与合金的微观结构解释二者性能的差异。
2.以铁合金、铝合金为例,能从元素组成上对合金进行分类,并认识不同类型金属材料组成、性能与应用的联系,强化“性能决定用途”的观念。
3.通过实验探究铝和氧化铝的性质及转化,认识两性氧化物,丰富对金属多样性的认识。
4.了解储氢合金、钛合金等新型合金,感受化学科学对创造等多新材料以满足人类生活需要和促进科技发展的重要作用。
知识点一:合金
1.定义:在金属中加热熔合某些金属或非金属,就可以制得具有金属特性的物质,叫做合金。
物理变化
混合物
2.性质:
具有许多优良的物理、化学或机械性能。
(1) 硬度大于各成分金属
(2) 熔点低于各成分金属
结构决定性质:
合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
纯金属与合金的结构比较
【思考】小胖想制备K-Fe合金却得不到(其他条件均已满足),化学大师根据K、Fe金属的熔点和沸点数据得出原因是:
金属 K Fe
熔点/℃ 63.6 1535
沸点/℃ 774 2750
——两种金属要熔化在一起成为合金,
熔点A金属 沸点B金属
钾的沸点低于铁的熔点,铁熔化时,而钾已变成气体
<
[特别注意]
(1)合金一定是混合物。
(2)合金在许多方面不同于各组成金属,不是简单加合,需加热熔合;
但在化学性质上,一般认为合金体现的是各成分金属的化学性质。
(3)若一种金属的熔点高于另一金属的沸点,则二者不能形成合金。
工业生产中,常将两种或多种(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金,这是制取合金的常用方法。仅根据下表数据判断,不宜用上述方法制取的合金是( )
A. Fe—Cu合金 B. Cu—Al合金 C. Al—Na合金 D. Cu—Na合金
金属 Na K Al Cu Fe
熔点/℃ 97.5 63.6 660 1083 1535
沸点/℃ 883 774 2467 2567 2750
练一练
D
知识点二:铁合金
铁碳合金
生铁
钢
含C量为2%到4.3%
含C量为0.3%到2%
性能:硬度大,抗压性好,性脆
性能:良好的延展性,机械能好,可以锻扎和铸造
碳素钢
合金钢
低碳钢
中碳钢
高碳钢
韧性、焊接性好,强度低
强度高,韧性、加工性好
硬而脆,热处理后弹性好
在碳素钢里加入一种或者多种合金元素,使钢的组织结构发生变化(元素种类多,性能差异大)
不锈钢
(特种钢)
不锈钢是最常用的一种合金钢,它的合金元素是铬(Cr)和镍(Ni)
在碳素钢中,由于含碳量不同,高碳钢、中碳钢和低碳钢的性能有很大差异;向碳素钢中加入不同的合金元素,可制得不同性能的合金钢。这对你有什么启示?
思考与讨论
1.合金元素不同,其性能不同
2.结构决定性能,性能决定其用途
3.改变合金元素来开发新功能的金属材料
下列有关铁和铁合金的说法错误的是( )
A.生铁比铁软
B.铁有良好的导热性
C.钢是铁的合金
D.铁在潮湿的空气中容易生锈
A
练一练
知识点三:铝和铝合金
铝元素在地壳中的含量排在第三位,是含量最多的金属元素
铝原子的结构
Al-3e-=Al3+
还原性
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg …
铝在金属活动顺序表中的位置
铝属于活泼金属
常温下,铝和氧气反应
4Al+3O2=2Al2O3
想一想同样是活泼金属,钠也能和氧气反应,但为什么钠不能在空气中存放,而铝却可以长时间存放呢?
氧化铝薄膜性质比较稳定,有较好的耐磨、耐腐蚀性,阻止内部金属与空气发生反应,从而可以保护内部的金属。
耐火坩埚
耐火砖
燃器具点火瓷头
Al2O3是一种白色难熔的固体,不溶于水,可作耐火材料(熔点2050℃),硬度也很大。
资料卡
铝制品的表面处理
在空气中,铝的表面自然形成的氧化膜很薄,耐磨性和抗蚀性还不够强。为了使铝制品适应于不同的用途,常采用化学方法对铝的表面进行处理,如增加膜的厚度,对氧化膜进行着色等。例如,化学氧化(用铬酸做氧化剂)可以使氧化膜产生美丽的颜色。市场上有不少铝制品是经过这种方法处理的。
1.铝和氧化铝的性质
【实验3-4】观察实验现象,完成下列表格。
视频
实验现象 实验原理(反应方程式)
反应刚开始,___________
一段时间后,产生_________ 点燃的木条放在试管口, 。
现象不明显
大量气泡
听到爆鸣声
2Al+6HCl=2AlCl3+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
Al和Al2O3都能与酸发生反应
【实验3-5】观察实验现象,完成下列表格。
视频
实验现象 实验原理(反应方程式)
铝片与NaOH溶液反应
铝片(打磨过)与NaOH溶液反应
开始没有气泡,一段时间后产生气泡,将点燃的木条放在试管口可听到爆鸣声。
立即产生气泡,将点燃的木条放在试管口可听到爆鸣声。
Al2O3+2NaOH=2NaAlO2+H2O
2Al+2NaOH+2H2O =2NaAlO2+3H2 ↑
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
【思考】通过实验,你对铝和氧化铝的性质有什么认识?
两性氧化物:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物。
Al和 A12O3均能与酸、碱反应。
分别属于两性金属和两性氧化物。
【应用】由于Al和A12O3均能与酸、碱反应,因此铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或食物。
2Al+6HCl=2AlCl3+3H2↑
Al2O3+6HCl=2AlCl3+3H2O
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2O3+2NaOH=2NaAlO2+H2O
1.称取两份铝粉,第一份加入足量的浓NaOH溶液,第二份加入足量的盐酸,如果放出等体积的气体(在同温、同压下),则两份铝粉的质量之比为( )
A.1∶2 B.1∶3 C.3∶2 D.1∶1
D
练一练
2.下列说法正确的是( )
A.金属氧化物都是碱性氧化物,非金属氧化物都是酸性氧化物。
B.Al2O3能与所有的酸、碱溶液反应。
C.Al2O3属于两性氧化物。
D.用Al2O3坩埚加热NaOH固体。
E.擦去表面氧化铝的铝条,在酒精灯上灼烧时,熔化的铝纷纷滴落下来。
C
3.在加入铝粉能放出气体的溶液中,一定能大量共存的离子组是( )
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+6HCl=2AlCl3+3H2↑
C
2.铝合金
为什么生活中很少见到以纯铝为材料的制品?
纯铝的硬度和强度都比较小,不适合作为生产生活中的材料使用,使用较多的是具有不同组成和性质的铝合金。
硬铝
硬铝中含Cu 4%、Mg 0.5%、Mn 0.5%、Si 0.7%,它密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
知识点四:新型合金
1.储氢合金
一种新型合金,一定条件下能吸收氢气,一定条件能放出氢气:循环寿命性能优异,并可被用于大型电池,尤其是电动车辆、混合动力电动车辆、高功率应用等等。
2.钛合金
钛合金强度高、耐蚀性好、耐热性高。主要用于制作飞机发动机压气机部件,其次为火箭、导弹和高速飞机的结构件
3.耐热合金
人造卫星的天线
4.形状记忆合金
稀土(Rare earth)元素是化学周期表中镧系元素和钪、钇共十七种金属元素的总称。
下列说法正确的是( )
A.用来制造储存氢气所用钢瓶的合金是储氢合金
B.不锈钢是最常见的新型合金
C.新型合金主要应用于航天航空、生物工程等领域
D.碳纤维复合材料属于新型合金材料
C
练一练
金属材料
合金
铁合金
铝和氧化铝
生铁含碳量为:2%~4.3%
钢含碳量为:0.03%~2%
碳素钢
合金钢
高碳钢
中碳钢
低碳钢
铝
氧化铝:
两性氧化物
Al2O3 + 6HCl === 2AlCl3 + 3H2O
Al2O3 + 2NaOH === 2NaAlO2 + H2O
2Al + 6HCl === 2AlCl3 + 3H2↑
2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
新型合金
