第二章 章末复习 课件 钠和氯(共30张PPT)2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 第二章 章末复习 课件 钠和氯(共30张PPT)2023-2024学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 649.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:15:04 | ||
图片预览










文档简介
(共30张PPT)
章末复习
第二章 海水中的重要元素——钠和氯
1.能以不同类别物质间的转化为线索,建构钠及其化合物的转化路径。
2.能以含不同价态同种元素的物质间的转化为线索,建构氯及其化合物的转化路径。
3.能建构摩尔、阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量、物质的量浓度等概念的关系。
4.能应用摩尔、阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量、物质的量浓度等概念解决相关实际问题。
知识点一:单质钠
1.物理性质:
2.化学性质:
强还原性金属单质
(1)与氧气的反应:4Na + O2 = 2Na2O
2Na + O2 Na2O2
(2)与水的反应:
2Na + 2H2O = 2NaOH + H2↑
变暗
先熔化后燃烧,发出黄色火焰,生成淡黄色固体
浮、熔、游、响、红
银白色有金属光泽的固体,硬度较小,熔点低(97.8℃),密度小于水大于煤油(0.971g·cm-3)
知识点二:氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 2CO2 = 2Na2CO3+ O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
氧化剂、还原剂都是过氧化钠,反应转移了2个电子
知识点二:氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途 ——
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
4Na + O2 = 2Na2O
2Na + O2 Na2O2
供氧剂、漂白剂
知识点三:碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
物理性质
化学性质 CaCl2
Ca(OH)2
NaOH
加热
CO2
溶液性质
Ca(OH)2 + NaHCO3=CaCO3↓ + H2O + NaOH
CO32- + Ca2+ =CaCO3↓
白色粉末,遇水结晶,放热,溶解度较大
白色晶体,遇水溶解,吸热,溶解度很小
不反应
CO32- + Ca2+ =CaCO3↓
Ca(OH)2 + 2NaHCO3=CaCO3↓ + 2H2O + Na2CO3
不反应
NaHCO3+ NaOH = Na2CO3 + H2O
不分解
2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3+ CO2 +H2O =2NaHCO3
不反应
碱性较强
碱性较弱
知识点四:焰色试验
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称作焰色试验。
2.操作:
洗 —— 将铂丝(或光洁的铁丝)用盐酸 洗净
烧 —— 将洗净的铂丝在火焰上灼烧至与原来火焰颜色相同
蘸 —— 蘸取待测物质
烧 —— 在酒精灯上灼烧,观察焰色
洗 —— 将铂丝(或光洁的铁丝)用盐酸洗净
【实验2-6】灼烧Na2CO3溶液时,火焰呈 ;
灼烧K2CO3溶液时, 。
1.焰色试验:
黄色
透过蓝色钴玻璃片可观察到火焰呈紫色
知识点五:氯气
氯气是黄绿色有刺激性气味的气体,有毒,可溶于水,易液化,密度大于空气
2.化学性质:与金属单质和非金属单质反应
2Na + Cl2 2NaCl
Cu + Cl2 CuCl2
2Fe + 3Cl2 2FeCl3
H2 + Cl2 2HCl
氢气在氯气中安静的燃烧,发出苍白色火焰,在集气瓶口形成白雾。
1.物理性质:
Cl2 + H2O = HCl + HClO
(2)氯水具有的性质是:
酸性、强氧化性和漂白性
Cl2 + 2NaOH= NaCl + NaClO + H2O
3.制漂白液:
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
4.制漂白粉漂粉精:
H+ Cl2 HClO
2.化学性质:与水反应
(3)次氯酸具有的性质是:
(4)氯水的保存:
2HClO 2HCl + O2↑
棕色试剂瓶
一元弱酸,酸性弱于碳酸,见光易分解,具有强氧化性和漂白性
(1)反应化学方程式:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
1.原理:
知识点六:氯气的制备
2.除杂:
3.收集:
4.验满:
5.尾气处理:
用饱和食盐水除去HCl,用浓硫酸除去水
向上排空气法或排饱和食盐水法
将湿润的淀粉碘化钾试纸靠近氯气的集气瓶口,若试纸立即变蓝,则已集满
用氢氧化钠溶液吸收
1.物质的量:
符号是n 单位是mol
2.阿伏加德罗常数:
3.摩尔质量:
物质的摩尔质量与其相对原子质量或相对分子质量的数值相同
知识点七:物质的量
是衡量物质所含微观粒子数目的物理量
1mol任何物质所含的粒子数量为阿伏加德罗常数(符号为NA),NA大约为6.02×1023mol-1
单位物质的量的物质所具有的质量符号为M,单位为g/mol
4.气体摩尔体积:
(1)阿伏加德罗定律:
推论:同温同压下,气体的体积比等于其物质的量的比
标准状况下,任何气体的摩尔体积都约为:
0℃、101 kPa
5.物质的量浓度:
符号为:cB
单位为:mol/L
同温同压下,任何气体一定具有相同的气体摩尔体积 Vm
相同温度和相同压强下,相同体积的任何气体一定具有相同的分子数(物质的量)。
22.4L/mol
单位体积溶液里所含溶质B的物质的量
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
6.配制一定物质的量浓度的溶液
(1)以固体配制为例,用到的仪器有:
一定规格的容量瓶、天平、烧杯、量筒、玻璃棒、胶头滴管
①计算
②称量
③溶解(少量水,搅拌)
④移液(玻璃棒引流)
⑤洗涤(洗涤液一并转移到容量瓶中)
⑥定容(利用胶头滴管进行定容)
⑦摇匀
(2)步骤
容量瓶或烧杯中未干燥
定容时俯视读数
定容时仰视读数
定容时加水多,用滴管吸出
未冷却到室温就注入容量瓶
未洗烧杯和玻璃棒
向容量瓶中注液时少量流出
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
减小
不变
偏小
减小
不变
偏小
不变
减小
不变
不变
不变
减小
不变
增大
减小
不变
偏大
偏小
偏小
偏大
无影响
(3)误差分析
【考点一】Na2CO3和NaHCO3的鉴别
【例1】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示:
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是______________________
_____________________________________________________________________。
无论是Na2CO3还是
NaHCO3均可以与盐酸反应产生CO2,两者的反应现象相同,故达不到鉴别目的
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________________________________________________________。
【例1】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示:
2NaHCO3 ===== Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O
【例2】下列有关NaHCO3和Na2CO3性质的叙述中正确的是( )
A.碳酸钠可用于治疗胃溃疡病人的胃酸过多症
B.发酵粉中主要含有碳酸钠,能使焙制出的糕点疏松多孔
C.在Na2CO3和NaHCO3溶液中滴加澄清石灰水均产生白色沉淀
D.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应
C
【方法归纳】
2.小苏打和苏打分别和等浓度的盐酸反应,下列说法正确的是( )
A.Na2CO3与盐酸反应比NaHCO3与盐酸的反应剧烈得多
B.106 g Na2CO3和84 g NaHCO3与盐酸完全反应,产生CO2的质量相等
C.实验室制取CO2通常用NaHCO3和盐酸反应
D.相同质量的Na2CO3和NaHCO3与盐酸反应完全,耗去盐酸的量一样多
B
1.下列方法中,用于鉴别稀的Na2CO3溶液和NaHCO3溶液的最好的方法是( )
A.加入澄清石灰水 B.分别加热
C.滴加稀盐酸 D.加CaCl2溶液
D
练一练
【考点二】Na2CO3和NaHCO3的转化
【例】欲除去下列物质中的少量杂质,请填写所用方法及反应的化学方程式:
(1)Na2CO3固体中的NaHCO3:
方法是______,反应方程式为__________________________________。
加热
(2)NaHCO3溶液中的Na2CO3:
方法是_______________,反应方程式为_________________________________。
通入足量的CO2
Na2CO3+H2O+CO2===2NaHCO3
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3) 加热至恒重
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
【方法归纳】
1.下列有关Na2CO3与NaHCO3叙述中错误的是( )
A.相同质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2气体体积大
B.同温度时,在水中的溶解度Na2CO3比NaHCO3大
C.可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液
D.Na2CO3溶液中含NaHCO3,可加适量NaOH溶液的方法除去
A
练一练
【例】纯碱(Na2CO3)的主要杂质是NaCl,有同学设计了如下实验检验纯碱中含有 、Cl-,你认为合理吗?为什么?
【考点三】氯离子的检验
实验1:取样品少许,加入稀盐酸,产生无色无味气体,证明有 存在。
实验2:取样品少许,加入AgNO3溶液,产生白色沉淀,证明有Cl-存在。
×
不合理
√
合理
白色沉淀
Ag+ + Cl- AgCl↓
2Ag+ + Ag2CO3↓
需排除干扰
取样品少许,加入足量稀硝酸,再加入AgNO3溶液,产生白色沉淀,证明有Cl-存在。
白色沉淀
核心检验原理、
实验操作细节、
干扰因素排查
离子检验需要考虑:
【方法归纳】
1.下列关于溶液中常见离子的检验及结论正确的是( )
A.加入 溶液有白色沉淀产生,说明有
B.先加入稀盐酸再加入 溶液有白色沉淀产生,说明有
C.先加入稀硝酸再加入 溶液有白色沉淀产生,说明有
D.加入 溶液有白色沉淀产生,再加稀盐酸,沉淀消失,说明有
C
练一练
【考点四】阿伏加德罗定律及其应用
【例1】在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
D
【例2】在同温同压下,A容器中盛有H2,B容器中盛有NH3,若使它们所含的原子总数相等,则两个容器的体积之比是( )
A.2∶1 B.1∶2
C.2∶3 D.1∶3
【方法归纳】
“三同定一同”规律:同温、同压、同体积、同分子数中只要有“三同”则必有第“四同”。
阿伏加德罗定律又称为“四同定律”。
A
1.由CO2、CH4和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、CH4和CO的体积比可能为( )
A.11:4:7 B.4:3:14
C.6:8:29 D.6:16:5
C
2.标准状况下,等质量的下列气体所占有的体积最大的是( )
A.O2 B.CH4 C.CO2 D.N2
B
海水中的重要元素——钠和氯
钠及其化合物
氯及其化合物
物质的量
钠的性质
氧化钠和过氧化钠
碳酸钠和
碳酸氢钠
焰色试验
区分
转化
性质
制备方法
用途
用途
与水反应
氯气的性质
氯气的制备
与金属单质非金属单质反应
与水反应
与碱反应
氯离子的检验
气体摩尔体积
物质的量浓度
阿伏加德罗定律
配制一定物质的量
浓度溶液的误差分析
章末复习
第二章 海水中的重要元素——钠和氯
1.能以不同类别物质间的转化为线索,建构钠及其化合物的转化路径。
2.能以含不同价态同种元素的物质间的转化为线索,建构氯及其化合物的转化路径。
3.能建构摩尔、阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量、物质的量浓度等概念的关系。
4.能应用摩尔、阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量、物质的量浓度等概念解决相关实际问题。
知识点一:单质钠
1.物理性质:
2.化学性质:
强还原性金属单质
(1)与氧气的反应:4Na + O2 = 2Na2O
2Na + O2 Na2O2
(2)与水的反应:
2Na + 2H2O = 2NaOH + H2↑
变暗
先熔化后燃烧,发出黄色火焰,生成淡黄色固体
浮、熔、游、响、红
银白色有金属光泽的固体,硬度较小,熔点低(97.8℃),密度小于水大于煤油(0.971g·cm-3)
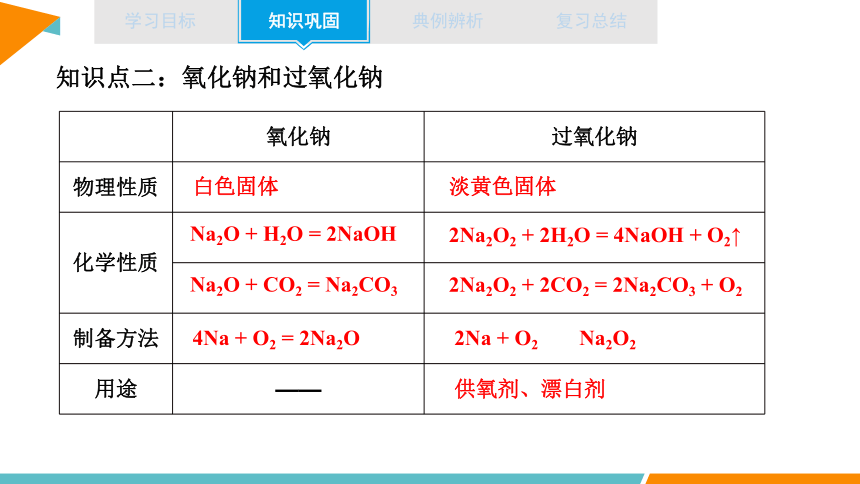
知识点二:氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 2CO2 = 2Na2CO3+ O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
氧化剂、还原剂都是过氧化钠,反应转移了2个电子
知识点二:氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途 ——
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
4Na + O2 = 2Na2O
2Na + O2 Na2O2
供氧剂、漂白剂
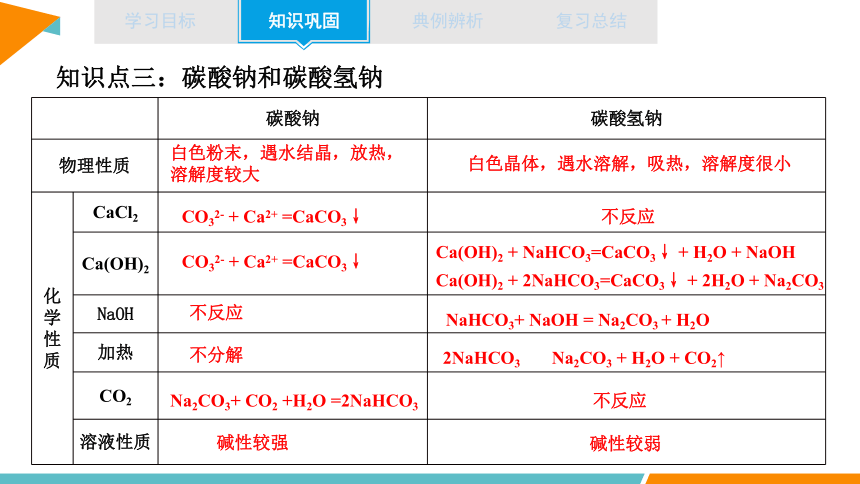
知识点三:碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
物理性质
化学性质 CaCl2
Ca(OH)2
NaOH
加热
CO2
溶液性质
Ca(OH)2 + NaHCO3=CaCO3↓ + H2O + NaOH
CO32- + Ca2+ =CaCO3↓
白色粉末,遇水结晶,放热,溶解度较大
白色晶体,遇水溶解,吸热,溶解度很小
不反应
CO32- + Ca2+ =CaCO3↓
Ca(OH)2 + 2NaHCO3=CaCO3↓ + 2H2O + Na2CO3
不反应
NaHCO3+ NaOH = Na2CO3 + H2O
不分解
2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3+ CO2 +H2O =2NaHCO3
不反应
碱性较强
碱性较弱
知识点四:焰色试验
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称作焰色试验。
2.操作:
洗 —— 将铂丝(或光洁的铁丝)用盐酸 洗净
烧 —— 将洗净的铂丝在火焰上灼烧至与原来火焰颜色相同
蘸 —— 蘸取待测物质
烧 —— 在酒精灯上灼烧,观察焰色
洗 —— 将铂丝(或光洁的铁丝)用盐酸洗净
【实验2-6】灼烧Na2CO3溶液时,火焰呈 ;
灼烧K2CO3溶液时, 。
1.焰色试验:
黄色
透过蓝色钴玻璃片可观察到火焰呈紫色
知识点五:氯气
氯气是黄绿色有刺激性气味的气体,有毒,可溶于水,易液化,密度大于空气
2.化学性质:与金属单质和非金属单质反应
2Na + Cl2 2NaCl
Cu + Cl2 CuCl2
2Fe + 3Cl2 2FeCl3
H2 + Cl2 2HCl
氢气在氯气中安静的燃烧,发出苍白色火焰,在集气瓶口形成白雾。
1.物理性质:
Cl2 + H2O = HCl + HClO
(2)氯水具有的性质是:
酸性、强氧化性和漂白性
Cl2 + 2NaOH= NaCl + NaClO + H2O
3.制漂白液:
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
4.制漂白粉漂粉精:
H+ Cl2 HClO
2.化学性质:与水反应
(3)次氯酸具有的性质是:
(4)氯水的保存:
2HClO 2HCl + O2↑
棕色试剂瓶
一元弱酸,酸性弱于碳酸,见光易分解,具有强氧化性和漂白性
(1)反应化学方程式:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
1.原理:
知识点六:氯气的制备
2.除杂:
3.收集:
4.验满:
5.尾气处理:
用饱和食盐水除去HCl,用浓硫酸除去水
向上排空气法或排饱和食盐水法
将湿润的淀粉碘化钾试纸靠近氯气的集气瓶口,若试纸立即变蓝,则已集满
用氢氧化钠溶液吸收
1.物质的量:
符号是n 单位是mol
2.阿伏加德罗常数:
3.摩尔质量:
物质的摩尔质量与其相对原子质量或相对分子质量的数值相同
知识点七:物质的量
是衡量物质所含微观粒子数目的物理量
1mol任何物质所含的粒子数量为阿伏加德罗常数(符号为NA),NA大约为6.02×1023mol-1
单位物质的量的物质所具有的质量符号为M,单位为g/mol
4.气体摩尔体积:
(1)阿伏加德罗定律:
推论:同温同压下,气体的体积比等于其物质的量的比
标准状况下,任何气体的摩尔体积都约为:
0℃、101 kPa
5.物质的量浓度:
符号为:cB
单位为:mol/L
同温同压下,任何气体一定具有相同的气体摩尔体积 Vm
相同温度和相同压强下,相同体积的任何气体一定具有相同的分子数(物质的量)。
22.4L/mol
单位体积溶液里所含溶质B的物质的量
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
6.配制一定物质的量浓度的溶液
(1)以固体配制为例,用到的仪器有:
一定规格的容量瓶、天平、烧杯、量筒、玻璃棒、胶头滴管
①计算
②称量
③溶解(少量水,搅拌)
④移液(玻璃棒引流)
⑤洗涤(洗涤液一并转移到容量瓶中)
⑥定容(利用胶头滴管进行定容)
⑦摇匀
(2)步骤
容量瓶或烧杯中未干燥
定容时俯视读数
定容时仰视读数
定容时加水多,用滴管吸出
未冷却到室温就注入容量瓶
未洗烧杯和玻璃棒
向容量瓶中注液时少量流出
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
减小
不变
偏小
减小
不变
偏小
不变
减小
不变
不变
不变
减小
不变
增大
减小
不变
偏大
偏小
偏小
偏大
无影响
(3)误差分析
【考点一】Na2CO3和NaHCO3的鉴别
【例1】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示:
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是______________________
_____________________________________________________________________。
无论是Na2CO3还是
NaHCO3均可以与盐酸反应产生CO2,两者的反应现象相同,故达不到鉴别目的
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________________________________________________________。
【例1】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示:
2NaHCO3 ===== Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O
【例2】下列有关NaHCO3和Na2CO3性质的叙述中正确的是( )
A.碳酸钠可用于治疗胃溃疡病人的胃酸过多症
B.发酵粉中主要含有碳酸钠,能使焙制出的糕点疏松多孔
C.在Na2CO3和NaHCO3溶液中滴加澄清石灰水均产生白色沉淀
D.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应
C
【方法归纳】
2.小苏打和苏打分别和等浓度的盐酸反应,下列说法正确的是( )
A.Na2CO3与盐酸反应比NaHCO3与盐酸的反应剧烈得多
B.106 g Na2CO3和84 g NaHCO3与盐酸完全反应,产生CO2的质量相等
C.实验室制取CO2通常用NaHCO3和盐酸反应
D.相同质量的Na2CO3和NaHCO3与盐酸反应完全,耗去盐酸的量一样多
B
1.下列方法中,用于鉴别稀的Na2CO3溶液和NaHCO3溶液的最好的方法是( )
A.加入澄清石灰水 B.分别加热
C.滴加稀盐酸 D.加CaCl2溶液
D
练一练
【考点二】Na2CO3和NaHCO3的转化
【例】欲除去下列物质中的少量杂质,请填写所用方法及反应的化学方程式:
(1)Na2CO3固体中的NaHCO3:
方法是______,反应方程式为__________________________________。
加热
(2)NaHCO3溶液中的Na2CO3:
方法是_______________,反应方程式为_________________________________。
通入足量的CO2
Na2CO3+H2O+CO2===2NaHCO3
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3) 加热至恒重
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
【方法归纳】
1.下列有关Na2CO3与NaHCO3叙述中错误的是( )
A.相同质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2气体体积大
B.同温度时,在水中的溶解度Na2CO3比NaHCO3大
C.可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液
D.Na2CO3溶液中含NaHCO3,可加适量NaOH溶液的方法除去
A
练一练
【例】纯碱(Na2CO3)的主要杂质是NaCl,有同学设计了如下实验检验纯碱中含有 、Cl-,你认为合理吗?为什么?
【考点三】氯离子的检验
实验1:取样品少许,加入稀盐酸,产生无色无味气体,证明有 存在。
实验2:取样品少许,加入AgNO3溶液,产生白色沉淀,证明有Cl-存在。
×
不合理
√
合理
白色沉淀
Ag+ + Cl- AgCl↓
2Ag+ + Ag2CO3↓
需排除干扰
取样品少许,加入足量稀硝酸,再加入AgNO3溶液,产生白色沉淀,证明有Cl-存在。
白色沉淀
核心检验原理、
实验操作细节、
干扰因素排查
离子检验需要考虑:
【方法归纳】
1.下列关于溶液中常见离子的检验及结论正确的是( )
A.加入 溶液有白色沉淀产生,说明有
B.先加入稀盐酸再加入 溶液有白色沉淀产生,说明有
C.先加入稀硝酸再加入 溶液有白色沉淀产生,说明有
D.加入 溶液有白色沉淀产生,再加稀盐酸,沉淀消失,说明有
C
练一练
【考点四】阿伏加德罗定律及其应用
【例1】在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
D
【例2】在同温同压下,A容器中盛有H2,B容器中盛有NH3,若使它们所含的原子总数相等,则两个容器的体积之比是( )
A.2∶1 B.1∶2
C.2∶3 D.1∶3
【方法归纳】
“三同定一同”规律:同温、同压、同体积、同分子数中只要有“三同”则必有第“四同”。
阿伏加德罗定律又称为“四同定律”。
A
1.由CO2、CH4和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、CH4和CO的体积比可能为( )
A.11:4:7 B.4:3:14
C.6:8:29 D.6:16:5
C
2.标准状况下,等质量的下列气体所占有的体积最大的是( )
A.O2 B.CH4 C.CO2 D.N2
B
海水中的重要元素——钠和氯
钠及其化合物
氯及其化合物
物质的量
钠的性质
氧化钠和过氧化钠
碳酸钠和
碳酸氢钠
焰色试验
区分
转化
性质
制备方法
用途
用途
与水反应
氯气的性质
氯气的制备
与金属单质非金属单质反应
与水反应
与碱反应
氯离子的检验
气体摩尔体积
物质的量浓度
阿伏加德罗定律
配制一定物质的量
浓度溶液的误差分析
