第三章 铁 金属材料 章末复习 课件(共30张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 第三章 铁 金属材料 章末复习 课件(共30张PPT) 2023-2024学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:15:07 | ||
图片预览







文档简介
(共30张PPT)
章末复习
第三章 铁 金属材料
1.以铁及其化合物为例,能建立含变价元素物质的转化关系。
2.能描述实验室制备氢氧化亚铁的实验方案。
3.能描述铁离子的检验方法。
4.能运用物质的量及相关物理量根据化学方程式进行简单计算。
知识点一:单质铁
1.物理性质:
2.化学性质
银白色有金属光泽的固体,熔、沸点高,具有磁性。(铁粉为黑色)
(1)Fe与弱氧化剂(如盐酸、硫酸铜等)的反应:
铁失去两个电子,生成Fe2+
铁失去三个电子,生成Fe3+
(3)Fe与水的反应:
(2)Fe与强氧化剂(氯气等)的反应:
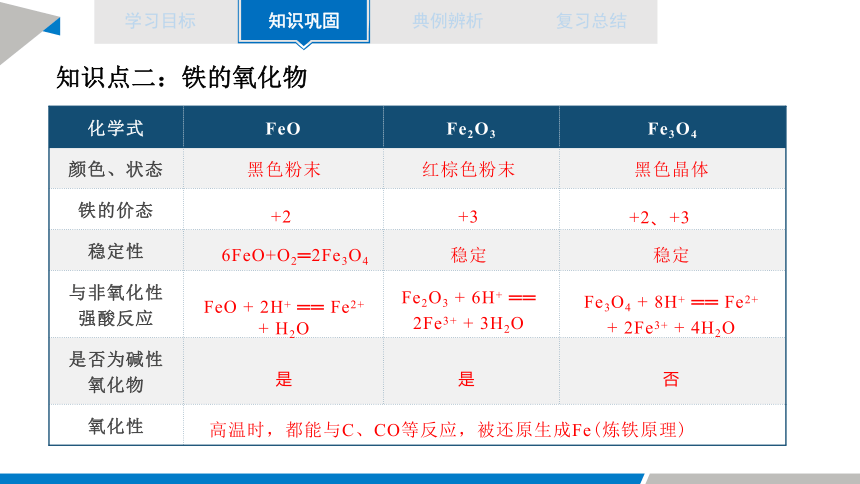
知识点二:铁的氧化物
化学式 FeO Fe2O3 Fe3O4
颜色、状态
铁的价态
稳定性
与非氧化性强酸反应
是否为碱性氧化物
氧化性
+2
+3
+2、+3
6FeO+O2═2Fe3O4
稳定
稳定
FeO + 2H+ ══ Fe2+ + H2O
Fe2O3 + 6H+ ══ 2Fe3+ + 3H2O
Fe3O4 + 8H+ ══ Fe2+ + 2Fe3+ + 4H2O
是
是
否
高温时,都能与C、CO等反应,被还原生成Fe(炼铁原理)
黑色粉末
红棕色粉末
黑色晶体
知识点三:铁的氢氧化物
1.氢氧化铁与氢氧化亚铁的性质
Fe(OH)2 Fe(OH)3
制 法
稳定性
与酸反应
Fe2+ + 2OH- ══ Fe(OH)2↓(隔绝空气)
Fe3+ + 3OH- ══ Fe(OH)3↓
极易被空气中氧气氧化
4Fe(OH)2 + 2H2O + O2 ══ 4Fe(OH)3
Fe(OH)2+2H+ ══ Fe2++2H2O
受热易分解
2Fe(OH)3 ══ Fe2O3 + 3H2O
Δ
Fe(OH)3 + 3H+ ══ Fe3+ + 3H2O
2.氢氧化亚铁的制备方案
(1)将配制溶液的蒸馏水煮沸,除去其中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管内的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如煤油、植物油等。
知识点四:铁盐与亚铁盐
1.Fe3+与Fe2+的检验
Fe3+:
加硫氰化钾溶液,变为血红色。
Fe2+:
加硫氰化钾溶液无现象,再加氯水溶液变为血红色。
2.Fe、Fe2+、Fe3+的转化关系
氧化性
还原性
还原性
氧化性
Fe
Fe2+
Fe3+
氧化剂
( H+、Cu2+等)
还原剂
(C、CO等)
氧化剂
(Cl2、KMnO4 、H2O2等)
还原剂
(Zn、Fe、Cu等)
还原剂
(C、CO等)
氧化剂(Cl2等)
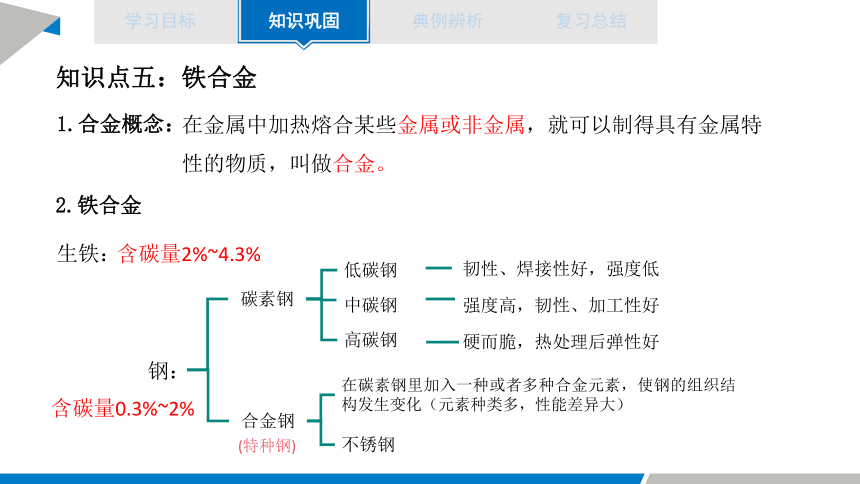
知识点五:铁合金
1.合金概念:
在金属中加热熔合某些金属或非金属,就可以制得具有金属特性的物质,叫做合金。
2.铁合金
含碳量2%~4.3%
生铁:
含碳量0.3%~2%
钢:
碳素钢
合金钢
低碳钢
中碳钢
高碳钢
韧性、焊接性好,强度低
强度高,韧性、加工性好
硬而脆,热处理后弹性好
在碳素钢里加入一种或者多种合金元素,使钢的组织结构发生变化(元素种类多,性能差异大)
不锈钢
(特种钢)
知识点六:铝和氧化铝
1.单质铝的性质
4Al+3O2=2Al2O3
(1)与氧气反应:
2Al+6H+=2Al3++3H2↑
(2)与酸反应:
(3)与碱反应:
2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
2.氧化铝的性质
(1)Al2O3是一种白色固体,不溶于水,比较稳定,有较好的耐磨、耐腐蚀性。
Al2O3+6H+=2Al3++3H2O
(2)与酸反应:
(3)与碱反应:
Al2O3+ 2OH- = 2AlO2- + H2O
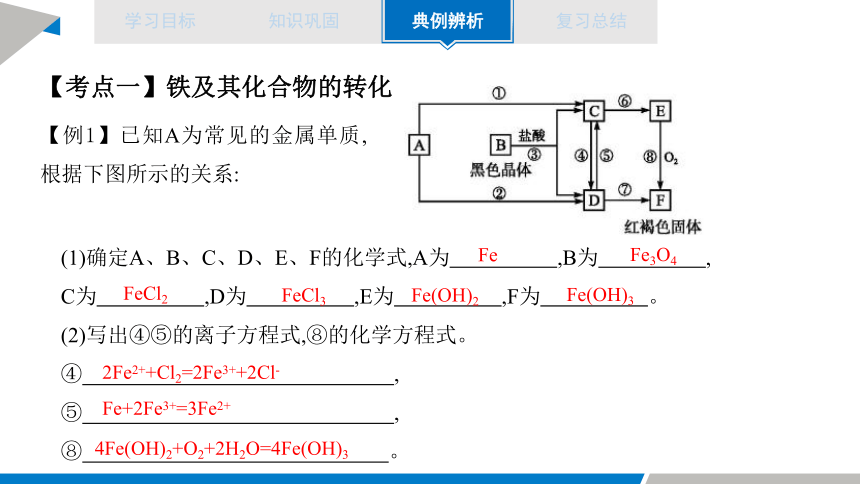
【考点一】铁及其化合物的转化
【例1】已知A为常见的金属单质,根据下图所示的关系:
(1)确定A、B、C、D、E、F的化学式,A为 ,B为 ,
C为 ,D为 ,E为 ,F为 。
(2)写出④⑤的离子方程式,⑧的化学方程式。
④ ,
⑤ ,
⑧ 。
Fe
Fe3O4
FeCl2
FeCl3
Fe(OH)2
Fe(OH)3
2Fe2++Cl2=2Fe3++2Cl-
Fe+2Fe3+=3Fe2+
4Fe(OH)2+O2+2H2O=4Fe(OH)3
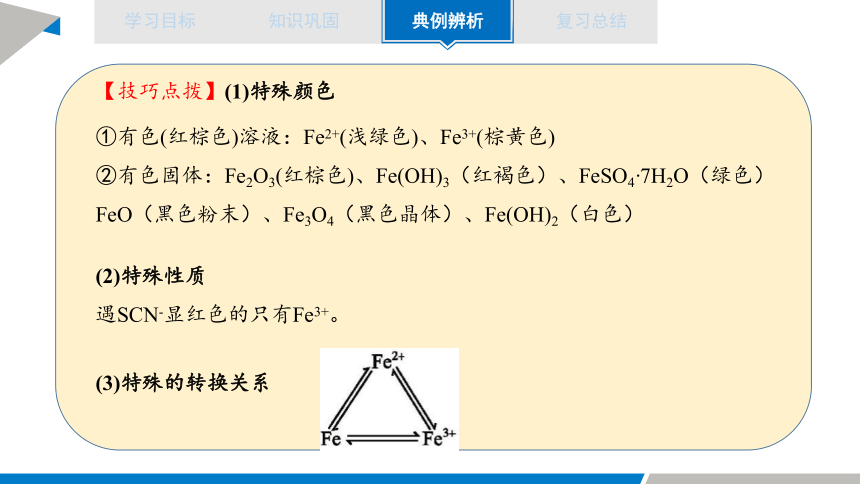
【技巧点拨】(1)特殊颜色
①有色(红棕色)溶液:Fe2+(浅绿色)、Fe3+(棕黄色)
②有色固体:Fe2O3(红棕色)、Fe(OH)3(红褐色)、FeSO4·7H2O(绿色)
FeO(黑色粉末)、Fe3O4(黑色晶体)、Fe(OH)2(白色)
(2)特殊性质
遇SCN-显红色的只有Fe3+。
(3)特殊的转换关系
练一练
1.在含有1 mol FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤,然后在空气中灼烧沉淀得到的固体物质是( )
A.Fe B.FeO
C.Fe(OH)3 D.Fe2O3
D
2.某同学设计如下实验方案,以分离混合溶液中的AlCl3和FeCl2。
(1)沉淀A的化学式为________。
(2)写出AlCl3溶液与过量NaOH溶液反应的离子方程式: 。
(3)写出沉淀A转化为沉淀B的化学方程式: 。
(4)写出检验溶液A中是否含有Fe2+的方法:_________ ,
,
。
Fe(OH)2
Al3++4OH-===AlO2-+2H2O
4Fe(OH)2+O2+2H2O=== 4Fe(OH)3
加入过量盐酸酸化,先滴入几滴KSCN溶液,无明显现象,再滴入适量氯水若溶液变红,则说明含有Fe2+,否则不含(其他合理答案均可)
取少量溶液A 于试管中
3.已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
(1)写出步骤③可能发生反应的离子方程式
____________________________________________________
____________________________________________________(共有3个)。
2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu、
2H++Fe===Fe2++H2↑
(2)若溶液E中只有一种金属离子,则一定是________;若溶液E中含有两种金属离子,则一定是 。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为_________________________________。
3.已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
Fe2+、Cu2+
Fe2+
Cu2
2Fe3++Cu===2Fe2++Cu2+
【考点二】化学常用的计算方法
1.关系式法
【例1】某二价金属碳酸盐和碳酸氢盐的混合物与足量盐酸反应,消耗的H+和产生的CO2的物质的量之比为6∶5,则该混合物中碳酸盐和碳酸氢盐的物质的量之比为( )
A.1∶1 B.1∶2
C.1∶3 D.1∶4
B
【例2】Mg、Zn、Al、Fe四种金属单质分别与足量的稀硫酸反应,放出H2的物质的量与投入金属的质量的关系如图所示,则①②③④所表示的金属分别是( )
A.Al、Mg、Fe、Zn B.Fe、Zn、Mg、Al
C.Mg、Al、Zn、Fe D.Zn、Fe、Mg、Al
A
【技巧点拨】
将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g cm-3,该溶液中溶质的质量分数为( )
练一练
C
2.守恒法
【例1】有两份质量相同的NaHCO3固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积比为( )
A.2:1 B.1:1
C.1:2 D.4:1
B
【例2】甲、乙两烧杯中各盛有100 mL 3 mol L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1:2,则加入的铝粉质量为( )
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
A
【例3】在硫酸、明矾和硫酸铝组成的混合溶液中,c(Al3+)=0.3mol L-1,c(SO2-4)=0.7mol L-1,c(H+)=0.1mol L-1,则c(K+)为( )
A.0.15mol L-1 B.0.2mol L-1
C.0.3mol L-1 D.0.4mol L-1
D
【例4】已知还原性I->Fe2+>Br-。有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-。其中Cl-、Br- 、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+物质的量之比为 ( )
A.9∶1 B.6∶2 C.7∶3 D.7∶4
C
【技巧点拨】
1.将3.6g炭粉和29gFe3O4质量分数为80%的磁铁矿粉混合后,隔绝空气加强热,充分反应后收集到的气体是( )
A.CO2
B.CO
C.CO、CO2的混合物,其中CO的体积占1/2
D.CO、CO2的混合物,其中CO的体积占2/3
练一练
D
2.向一定量的Fe、FeO、Fe2O3的混合物中加入100mL1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况下)的气体。所得溶液中加入KSCN溶液无红色出现,混合物中铁元素的质量分数为( )
A.81.4% B.77.8%
C.68.6% D.无法计算
A
3.差量法
【例1】把足量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO2-4的物质的量浓度之比为( )
A.1∶4 B.2∶7
C.1∶2 D.3∶8
A
【技巧点拨】
1.把4.48L(标准状况) CO2通过一定质量的固体Na2O2后,收集到3.36L(标准状况)气体,则这3.36L气体的质量是( )
A.3.8g B.5.6g
C.4.8g D.6.0g
D
练一练
2.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
B
A.
B.
C.
D.
铁 金属材料
铁及其化合物
金属材料
物质的量在化学方程式计算中的应用
步骤
铁合金
铁单质
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
物理性质
化学性质
氧化铁
四氧化三铁
氧化亚铁
氢氧化铁
氢氧化亚铁
制备
铁盐
亚铁盐
Fe3+只有氧化性
Fe2+既有氧化性又有还原性
生铁:含碳量2%-4.3%
铝及铝合金
新型合金
铝、氧化铝的性质
钢:含碳量0.03%-2%
铝合金
储氢合金
钛合金
耐热合金
记忆合金
方法
化学计量数之比等于物质的量之比
章末复习
第三章 铁 金属材料
1.以铁及其化合物为例,能建立含变价元素物质的转化关系。
2.能描述实验室制备氢氧化亚铁的实验方案。
3.能描述铁离子的检验方法。
4.能运用物质的量及相关物理量根据化学方程式进行简单计算。
知识点一:单质铁
1.物理性质:
2.化学性质
银白色有金属光泽的固体,熔、沸点高,具有磁性。(铁粉为黑色)
(1)Fe与弱氧化剂(如盐酸、硫酸铜等)的反应:
铁失去两个电子,生成Fe2+
铁失去三个电子,生成Fe3+
(3)Fe与水的反应:
(2)Fe与强氧化剂(氯气等)的反应:
知识点二:铁的氧化物
化学式 FeO Fe2O3 Fe3O4
颜色、状态
铁的价态
稳定性
与非氧化性强酸反应
是否为碱性氧化物
氧化性
+2
+3
+2、+3
6FeO+O2═2Fe3O4
稳定
稳定
FeO + 2H+ ══ Fe2+ + H2O
Fe2O3 + 6H+ ══ 2Fe3+ + 3H2O
Fe3O4 + 8H+ ══ Fe2+ + 2Fe3+ + 4H2O
是
是
否
高温时,都能与C、CO等反应,被还原生成Fe(炼铁原理)
黑色粉末
红棕色粉末
黑色晶体
知识点三:铁的氢氧化物
1.氢氧化铁与氢氧化亚铁的性质
Fe(OH)2 Fe(OH)3
制 法
稳定性
与酸反应
Fe2+ + 2OH- ══ Fe(OH)2↓(隔绝空气)
Fe3+ + 3OH- ══ Fe(OH)3↓
极易被空气中氧气氧化
4Fe(OH)2 + 2H2O + O2 ══ 4Fe(OH)3
Fe(OH)2+2H+ ══ Fe2++2H2O
受热易分解
2Fe(OH)3 ══ Fe2O3 + 3H2O
Δ
Fe(OH)3 + 3H+ ══ Fe3+ + 3H2O
2.氢氧化亚铁的制备方案
(1)将配制溶液的蒸馏水煮沸,除去其中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管内的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如煤油、植物油等。
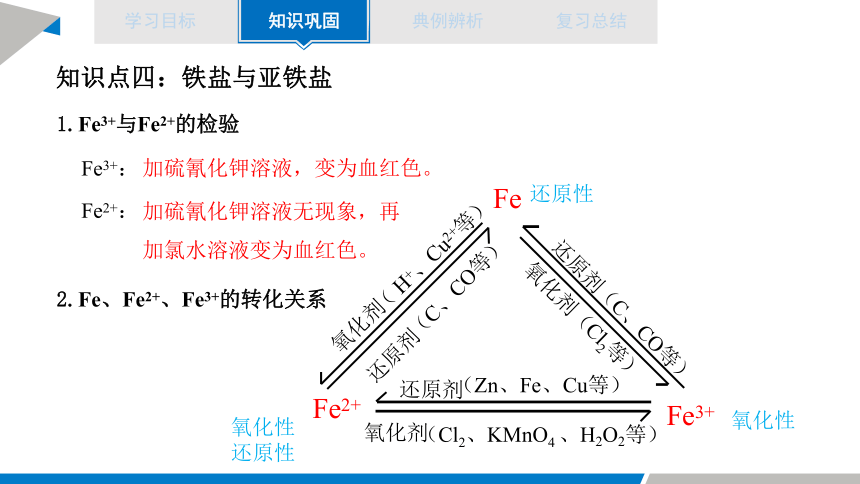
知识点四:铁盐与亚铁盐
1.Fe3+与Fe2+的检验
Fe3+:
加硫氰化钾溶液,变为血红色。
Fe2+:
加硫氰化钾溶液无现象,再加氯水溶液变为血红色。
2.Fe、Fe2+、Fe3+的转化关系
氧化性
还原性
还原性
氧化性
Fe
Fe2+
Fe3+
氧化剂
( H+、Cu2+等)
还原剂
(C、CO等)
氧化剂
(Cl2、KMnO4 、H2O2等)
还原剂
(Zn、Fe、Cu等)
还原剂
(C、CO等)
氧化剂(Cl2等)
知识点五:铁合金
1.合金概念:
在金属中加热熔合某些金属或非金属,就可以制得具有金属特性的物质,叫做合金。
2.铁合金
含碳量2%~4.3%
生铁:
含碳量0.3%~2%
钢:
碳素钢
合金钢
低碳钢
中碳钢
高碳钢
韧性、焊接性好,强度低
强度高,韧性、加工性好
硬而脆,热处理后弹性好
在碳素钢里加入一种或者多种合金元素,使钢的组织结构发生变化(元素种类多,性能差异大)
不锈钢
(特种钢)
知识点六:铝和氧化铝
1.单质铝的性质
4Al+3O2=2Al2O3
(1)与氧气反应:
2Al+6H+=2Al3++3H2↑
(2)与酸反应:
(3)与碱反应:
2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
2.氧化铝的性质
(1)Al2O3是一种白色固体,不溶于水,比较稳定,有较好的耐磨、耐腐蚀性。
Al2O3+6H+=2Al3++3H2O
(2)与酸反应:
(3)与碱反应:
Al2O3+ 2OH- = 2AlO2- + H2O
【考点一】铁及其化合物的转化
【例1】已知A为常见的金属单质,根据下图所示的关系:
(1)确定A、B、C、D、E、F的化学式,A为 ,B为 ,
C为 ,D为 ,E为 ,F为 。
(2)写出④⑤的离子方程式,⑧的化学方程式。
④ ,
⑤ ,
⑧ 。
Fe
Fe3O4
FeCl2
FeCl3
Fe(OH)2
Fe(OH)3
2Fe2++Cl2=2Fe3++2Cl-
Fe+2Fe3+=3Fe2+
4Fe(OH)2+O2+2H2O=4Fe(OH)3
【技巧点拨】(1)特殊颜色
①有色(红棕色)溶液:Fe2+(浅绿色)、Fe3+(棕黄色)
②有色固体:Fe2O3(红棕色)、Fe(OH)3(红褐色)、FeSO4·7H2O(绿色)
FeO(黑色粉末)、Fe3O4(黑色晶体)、Fe(OH)2(白色)
(2)特殊性质
遇SCN-显红色的只有Fe3+。
(3)特殊的转换关系
练一练
1.在含有1 mol FeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤,然后在空气中灼烧沉淀得到的固体物质是( )
A.Fe B.FeO
C.Fe(OH)3 D.Fe2O3
D
2.某同学设计如下实验方案,以分离混合溶液中的AlCl3和FeCl2。
(1)沉淀A的化学式为________。
(2)写出AlCl3溶液与过量NaOH溶液反应的离子方程式: 。
(3)写出沉淀A转化为沉淀B的化学方程式: 。
(4)写出检验溶液A中是否含有Fe2+的方法:_________ ,
,
。
Fe(OH)2
Al3++4OH-===AlO2-+2H2O
4Fe(OH)2+O2+2H2O=== 4Fe(OH)3
加入过量盐酸酸化,先滴入几滴KSCN溶液,无明显现象,再滴入适量氯水若溶液变红,则说明含有Fe2+,否则不含(其他合理答案均可)
取少量溶液A 于试管中
3.已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
(1)写出步骤③可能发生反应的离子方程式
____________________________________________________
____________________________________________________(共有3个)。
2Fe3++Fe===3Fe2+、Cu2++Fe===Fe2++Cu、
2H++Fe===Fe2++H2↑
(2)若溶液E中只有一种金属离子,则一定是________;若溶液E中含有两种金属离子,则一定是 。
(3)若D固体是纯净物,该固体是________(填化学式)。
(4)印刷电路板是由高分子材料和铜箔复合而成的,可用FeCl3溶液作“腐蚀剂”刻制印刷电路板,该过程发生反应的离子方程式为_________________________________。
3.已知X为Fe2O3和CuO的混合物,且氧化性强弱顺序:Fe3+>Cu2+>H+>Fe2+。X样品可发生如图所示的转化关系:
Fe2+、Cu2+
Fe2+
Cu2
2Fe3++Cu===2Fe2++Cu2+
【考点二】化学常用的计算方法
1.关系式法
【例1】某二价金属碳酸盐和碳酸氢盐的混合物与足量盐酸反应,消耗的H+和产生的CO2的物质的量之比为6∶5,则该混合物中碳酸盐和碳酸氢盐的物质的量之比为( )
A.1∶1 B.1∶2
C.1∶3 D.1∶4
B
【例2】Mg、Zn、Al、Fe四种金属单质分别与足量的稀硫酸反应,放出H2的物质的量与投入金属的质量的关系如图所示,则①②③④所表示的金属分别是( )
A.Al、Mg、Fe、Zn B.Fe、Zn、Mg、Al
C.Mg、Al、Zn、Fe D.Zn、Fe、Mg、Al
A
【技巧点拨】
将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g cm-3,该溶液中溶质的质量分数为( )
练一练
C
2.守恒法
【例1】有两份质量相同的NaHCO3固体,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸,充分反应,则它们所耗用的盐酸的体积比为( )
A.2:1 B.1:1
C.1:2 D.4:1
B
【例2】甲、乙两烧杯中各盛有100 mL 3 mol L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1:2,则加入的铝粉质量为( )
A.5.4 g B.3.6 g
C.2.7 g D.1.8 g
A
【例3】在硫酸、明矾和硫酸铝组成的混合溶液中,c(Al3+)=0.3mol L-1,c(SO2-4)=0.7mol L-1,c(H+)=0.1mol L-1,则c(K+)为( )
A.0.15mol L-1 B.0.2mol L-1
C.0.3mol L-1 D.0.4mol L-1
D
【例4】已知还原性I->Fe2+>Br-。有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-。其中Cl-、Br- 、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+物质的量之比为 ( )
A.9∶1 B.6∶2 C.7∶3 D.7∶4
C
【技巧点拨】
1.将3.6g炭粉和29gFe3O4质量分数为80%的磁铁矿粉混合后,隔绝空气加强热,充分反应后收集到的气体是( )
A.CO2
B.CO
C.CO、CO2的混合物,其中CO的体积占1/2
D.CO、CO2的混合物,其中CO的体积占2/3
练一练
D
2.向一定量的Fe、FeO、Fe2O3的混合物中加入100mL1mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况下)的气体。所得溶液中加入KSCN溶液无红色出现,混合物中铁元素的质量分数为( )
A.81.4% B.77.8%
C.68.6% D.无法计算
A
3.差量法
【例1】把足量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO2-4的物质的量浓度之比为( )
A.1∶4 B.2∶7
C.1∶2 D.3∶8
A
【技巧点拨】
1.把4.48L(标准状况) CO2通过一定质量的固体Na2O2后,收集到3.36L(标准状况)气体,则这3.36L气体的质量是( )
A.3.8g B.5.6g
C.4.8g D.6.0g
D
练一练
2.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
B
A.
B.
C.
D.
铁 金属材料
铁及其化合物
金属材料
物质的量在化学方程式计算中的应用
步骤
铁合金
铁单质
铁的氧化物
铁的氢氧化物
铁盐和亚铁盐
物理性质
化学性质
氧化铁
四氧化三铁
氧化亚铁
氢氧化铁
氢氧化亚铁
制备
铁盐
亚铁盐
Fe3+只有氧化性
Fe2+既有氧化性又有还原性
生铁:含碳量2%-4.3%
铝及铝合金
新型合金
铝、氧化铝的性质
钢:含碳量0.03%-2%
铝合金
储氢合金
钛合金
耐热合金
记忆合金
方法
化学计量数之比等于物质的量之比
