4.1 课时3 原子结构与元素的性质 课件(共24张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.1 课时3 原子结构与元素的性质 课件(共24张PPT) 2023-2024学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
第一节 原子结构与元素周期表 课时3
第四章 物质结构 元素周期律
元素的性质
金属性
金属元素原子最外层电子数一般少于4个,化学反应中容易失去电子
非金属性
非金属元素原子最外层电子数一般多于4个,化学反应中容易得到电子
原子结构决定元素的性质
1.能利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其化合物的性质。
2.学习碱金属元素和卤素元素物理和化学性质及其递变规律,能用原子结构理论初步加以解释。
知识点一:碱金属元素
1.碱金属元素的原子结构及特点
碱金属是一类化学性质非常活泼的金属,在自然界中以化合态存在,在元素周期表中处于第IA族。
Li
K
Na
Rb
Cs
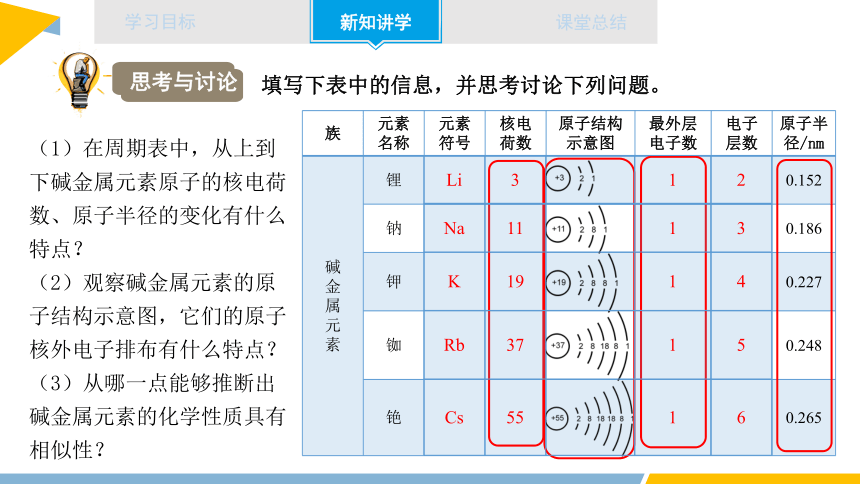
思考与讨论
填写下表中的信息,并思考讨论下列问题。
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?
(3)从哪一点能够推断出碱金属元素的化学性质具有相似性?
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径/nm
碱 金 属 元 素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li 3 1 2
Na 11 1 3
K 19 1 4
Rb 37 1 5
Cs 55 1 6
【答案】(1)从上到下,碱金属元素原子的核电荷数、原子半径依次增大;
(2)从上往下,碱金属元素的原子核外电子排布随原子序数的递增,电子层数也递增,且最外层电子数都为1;
(3)从最外层电子数都为1推断碱金属元素的化学性质具有相似性。
碱金属元素的原子结构及特点
相同点:碱金属元素的原子最外层电子数都为1。
递变性:从上到下随原子序数的递增,碱金属元素的原子核外电子层数递增,原子半径递增。
【归纳总结】
2.碱金属单质的化学性质
(1)回忆第二章学过的知识,钠有哪些化学性质?
钠在空气中燃烧
钠与水反应
问题与推测
(2)结合锂、钠和钾的原子结构特点,推测锂、钾可能具有哪些与钠相似的化学性质?
推测
依据原子结构最外层电子数都是1
都位于元素周期表第IA族
钠
能与水反应
能在空气中燃烧
锂
钾
都能与水反应
都能在空气中燃烧
观看钾、钠在空气中燃烧的实验视频,观察实验现象并描述。
现象:钾、钠都能在空气中燃烧,迅速熔化成光亮小球,钠产生黄色火焰,得到淡黄色固体,钾产生紫色火焰(透过蓝色钴玻璃),得到白色固体,钾燃烧比钠燃烧更剧烈。。
金属性:钾>钠
实验与观察
视频
现象:钾和钠都浮在水面上;均熔成闪亮的小球;小球四处游动;发出嘶嘶响声;加了酚酞的溶液均呈红色。
金属性:钾>钠
钾与水的反应有轻微爆炸并着火燃烧,更加剧烈。
观看钾、钠与水反应的实验视频,观察实验现象并描述。
视频
分析和结论
(1)通过实验、观察,讨论并总结钠、钾有哪些相似的化学性质,与你最初根据原子结构特点进行的预测是否一致?
(2)从实验现象比较钾、钠与水反应的难易程度。由此,你能推断出锂与水反应的难易程度吗?
答:(1)锂、钾能与水反应且能在空气中燃烧,与我们最初预测的一致,
(2)观察实验,发现钾比钠更容易与水反应,推测,锂与水反应程度比钠与水反应程度更慢。
(3)通过比较碱金属元素与水反应的难易程度,你能发现与它们的原子结构有什么关系吗?由此,你能推断出碱金属元素化学性质的相似性和递变规律吗?
①碱金属元素化学性质具有相似性。碱金属元素的最外层电子数相同,都是1个电子,它们的化学性质相似,都能与氧气等非金属单质以及水反应。
②碱金属元素化学性质具有递变性。随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,从锂到铯,金属性逐渐增强。
3.元素的金属性强弱的判断依据
Li、Na、K、Rb、Cs
金属性逐渐增强
推断依据
碱金属元素的化学性质具有相似性和递变性,同时也具有差异性。
①单质与水或酸的反应产生H2的难易
反应越易,金属性越强;
②最高价氧化物的水化物碱性强弱
碱性越强,金属性越强;
③置换反应
较活泼金属置换较不活泼金属。
4.碱金属单质的物理性质
碱金属单质 颜色(常态) 密度(g.cm-3) 熔点(℃) 沸点(℃)
Li 银白色 0.534 180.5 1347
Na 银白色 0.97 97.81 882.9
K 银白色 0.86 63.51 774
Rb 银白色 1.532 38.89 688
Cs 略带金属光泽 1.879 28.40 678.4
观察碱金属单质的主要物理性质,从锂到铯,物理性质是否表现出一定的相似性和规律性?
碱金属单质的主要物理性质
相似性:除铯以外,都是银白色金属光泽,密度较小,熔点较低,质软,有延展性,具有良好的导热性和导电性。液态钠可用作核反应堆的传热介质。
递变性:从上到下,密度有增大的趋势,熔沸点逐渐降低。
知识点二:卤族元素
1.卤族元素单质的主要物理性质
卤素单质 颜色 (常态) 密度 熔点(℃) 沸点(℃)
F2 淡黄绿色(气体) 1.69g/L(15℃) -219.6 -188.1
Cl2 黄绿色(气体) 3.214g/L(0℃) -101 -34.6
Br2 深红棕色(液体) 3.119g/cm3(20℃) -7.2 58.78
I2 紫黑色(固体) 4.93g/cm3 113.5 184.4
卤素单质的主要物理性质
观察下表,从上到下,卤族元素单质的物理性质有什么变化?
卤族元素是典型的非金属元素,它们在自然界中都以化合态存在。
递变性:从上到下,单质颜色逐渐加深,熔点、沸点逐渐升高。
思考与讨论
卤素原子结构示意图
F Cl Br I
根据卤素的原子结构,请你试着推测氟、氯、溴、碘在化学性质上表现出的相似性和递变性。
相似性:卤素原子的最外层电子数都为7。
递变性:从上到下,随原子序数的递增,卤族元素的原子最外层电子层数递增,半径递增。
根据下表卤素单质与氢气的反应事实,讨论随着原子核电荷数的增多,卤素单质与氢气反应的规律性变化。
2.卤族元素的化学性质
在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定
光照或点燃发生反应,生成的氯化氢较稳定
加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定
不断加热才能缓慢反应;碘化氢不稳定,在同一条件下同时分解为H2和I2,是可逆反应
F2 Cl2 Br2 I2
①与氢气反应的难易程度:
②生成的氢化物的稳定性:
③卤素的非金属性强弱:
由易到难
由强到弱
由强到弱
(1)卤素单质与氢气的反应
(2)元素的非金属性强弱的判断依据
F2 Cl2 Br2 I2
非金属性逐渐减弱
①非金属单质与氢气反应生成气态氢化物难易程度(或气态 氢化物的稳定性强弱)
与氢气反应越容易(气态氢化物稳定性越强)非金属性越强
②最高价氧化物的水化物酸性强弱
最高价氧化物的水化物酸性越强,非金属性越强金
依据
(3)卤素单质间的置换反应
类似于金属与盐溶液的置换反应,卤素单质间也可发生置换反应
通过卤素单质间的置换反应,可以比较卤素单质的氧化性强弱
氧化性:Cl2>Br2 → 非金属性:Cl>Br
观察实验现象,填写表格内空缺的内容并比较各卤族元素之间的氧化性强弱。
现象 化学方程式 氧化性强弱
F2 Cl2 Br2 I2
氧化性逐渐减弱
随着核电荷数的增加
视频
溶液变成黄色,颜色比黄绿色氯水深 Cl2>Br2
溶液变成红棕色,颜色比黄绿色氯水深 Cl2>I2
溶液变成棕黄色,颜色比黄色溴水深 Br2>I2
总结概述
①元素的性质主要与原子核外电子的排布,特别是和最外层电子数有关;
②原子结构相似的一族元素,它们在化学性质上表现出相似性和递变性;
③从上到下,原子核外电子层数依次增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱;金属性逐渐增强,非金属性逐渐减弱。
1.下列关于F、Cl、Br、I的比较,正确的是( )。
A. 它们的原子核外电子层数随核电荷数的增加而增加
B. 单质的氧化性随核电荷数的增加而增强
C. 它们的氢化物的稳定性随核电荷数的增加而增强
D. 单质的颜色随核电荷数的增加而变浅
练一练
A
2.有关Li、Na、K、Rb的叙述不正确的是( )。
A. 碱性:KOH > LiOH
B. 原子半径: r(K) > r(Na)
C. 它们的单质燃烧时火焰均呈紫色
D. 实验室中少量的钠可保存在煤油中
C
原子结构与元素性质
碱金属
卤素
结构与性质的关系
相似性
递变性(从上到下)
物理性质:银白色(铯略带金色)、质软、密度小、熔沸点低
化学性质:能与水反应、都能与氧气反应
物理性质:密度呈增大趋势(钠大于钾);熔沸点逐渐降低
化学性质:与氧气和水反应越来越强烈
相似性
递变性(从上到下)
物理性质:都有颜色
化学性质:与氢气反应;同族置换
物理性质:颜色加深、密度增大、熔沸点增大
化学性质:与氢气化合越来越难;气态氢化物稳定性越来越差;单质氧化性逐渐减弱
相似性
递变性(从上到下)
最外层电子数相同
电子层数依次增加;原子半径逐渐增大;
失电子能力逐渐增强;得电子能力逐渐减弱;
金属性逐渐增强;非金属性逐渐减弱
第一节 原子结构与元素周期表 课时3
第四章 物质结构 元素周期律
元素的性质
金属性
金属元素原子最外层电子数一般少于4个,化学反应中容易失去电子
非金属性
非金属元素原子最外层电子数一般多于4个,化学反应中容易得到电子
原子结构决定元素的性质
1.能利用元素在元素周期表中的位置和原子结构,分析、预测、比较元素及其化合物的性质。
2.学习碱金属元素和卤素元素物理和化学性质及其递变规律,能用原子结构理论初步加以解释。
知识点一:碱金属元素
1.碱金属元素的原子结构及特点
碱金属是一类化学性质非常活泼的金属,在自然界中以化合态存在,在元素周期表中处于第IA族。
Li
K
Na
Rb
Cs
思考与讨论
填写下表中的信息,并思考讨论下列问题。
(1)在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
(2)观察碱金属元素的原子结构示意图,它们的原子核外电子排布有什么特点?
(3)从哪一点能够推断出碱金属元素的化学性质具有相似性?
族 元素名称 元素符号 核电荷数 原子结构示意图 最外层电子数 电子层数 原子半径/nm
碱 金 属 元 素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li 3 1 2
Na 11 1 3
K 19 1 4
Rb 37 1 5
Cs 55 1 6
【答案】(1)从上到下,碱金属元素原子的核电荷数、原子半径依次增大;
(2)从上往下,碱金属元素的原子核外电子排布随原子序数的递增,电子层数也递增,且最外层电子数都为1;
(3)从最外层电子数都为1推断碱金属元素的化学性质具有相似性。
碱金属元素的原子结构及特点
相同点:碱金属元素的原子最外层电子数都为1。
递变性:从上到下随原子序数的递增,碱金属元素的原子核外电子层数递增,原子半径递增。
【归纳总结】
2.碱金属单质的化学性质
(1)回忆第二章学过的知识,钠有哪些化学性质?
钠在空气中燃烧
钠与水反应
问题与推测
(2)结合锂、钠和钾的原子结构特点,推测锂、钾可能具有哪些与钠相似的化学性质?
推测
依据原子结构最外层电子数都是1
都位于元素周期表第IA族
钠
能与水反应
能在空气中燃烧
锂
钾
都能与水反应
都能在空气中燃烧
观看钾、钠在空气中燃烧的实验视频,观察实验现象并描述。
现象:钾、钠都能在空气中燃烧,迅速熔化成光亮小球,钠产生黄色火焰,得到淡黄色固体,钾产生紫色火焰(透过蓝色钴玻璃),得到白色固体,钾燃烧比钠燃烧更剧烈。。
金属性:钾>钠
实验与观察
视频
现象:钾和钠都浮在水面上;均熔成闪亮的小球;小球四处游动;发出嘶嘶响声;加了酚酞的溶液均呈红色。
金属性:钾>钠
钾与水的反应有轻微爆炸并着火燃烧,更加剧烈。
观看钾、钠与水反应的实验视频,观察实验现象并描述。
视频
分析和结论
(1)通过实验、观察,讨论并总结钠、钾有哪些相似的化学性质,与你最初根据原子结构特点进行的预测是否一致?
(2)从实验现象比较钾、钠与水反应的难易程度。由此,你能推断出锂与水反应的难易程度吗?
答:(1)锂、钾能与水反应且能在空气中燃烧,与我们最初预测的一致,
(2)观察实验,发现钾比钠更容易与水反应,推测,锂与水反应程度比钠与水反应程度更慢。
(3)通过比较碱金属元素与水反应的难易程度,你能发现与它们的原子结构有什么关系吗?由此,你能推断出碱金属元素化学性质的相似性和递变规律吗?
①碱金属元素化学性质具有相似性。碱金属元素的最外层电子数相同,都是1个电子,它们的化学性质相似,都能与氧气等非金属单质以及水反应。
②碱金属元素化学性质具有递变性。随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,原子失去最外层电子的能力逐渐增强,从锂到铯,金属性逐渐增强。
3.元素的金属性强弱的判断依据
Li、Na、K、Rb、Cs
金属性逐渐增强
推断依据
碱金属元素的化学性质具有相似性和递变性,同时也具有差异性。
①单质与水或酸的反应产生H2的难易
反应越易,金属性越强;
②最高价氧化物的水化物碱性强弱
碱性越强,金属性越强;
③置换反应
较活泼金属置换较不活泼金属。
4.碱金属单质的物理性质
碱金属单质 颜色(常态) 密度(g.cm-3) 熔点(℃) 沸点(℃)
Li 银白色 0.534 180.5 1347
Na 银白色 0.97 97.81 882.9
K 银白色 0.86 63.51 774
Rb 银白色 1.532 38.89 688
Cs 略带金属光泽 1.879 28.40 678.4
观察碱金属单质的主要物理性质,从锂到铯,物理性质是否表现出一定的相似性和规律性?
碱金属单质的主要物理性质
相似性:除铯以外,都是银白色金属光泽,密度较小,熔点较低,质软,有延展性,具有良好的导热性和导电性。液态钠可用作核反应堆的传热介质。
递变性:从上到下,密度有增大的趋势,熔沸点逐渐降低。
知识点二:卤族元素
1.卤族元素单质的主要物理性质
卤素单质 颜色 (常态) 密度 熔点(℃) 沸点(℃)
F2 淡黄绿色(气体) 1.69g/L(15℃) -219.6 -188.1
Cl2 黄绿色(气体) 3.214g/L(0℃) -101 -34.6
Br2 深红棕色(液体) 3.119g/cm3(20℃) -7.2 58.78
I2 紫黑色(固体) 4.93g/cm3 113.5 184.4
卤素单质的主要物理性质
观察下表,从上到下,卤族元素单质的物理性质有什么变化?
卤族元素是典型的非金属元素,它们在自然界中都以化合态存在。
递变性:从上到下,单质颜色逐渐加深,熔点、沸点逐渐升高。
思考与讨论
卤素原子结构示意图
F Cl Br I
根据卤素的原子结构,请你试着推测氟、氯、溴、碘在化学性质上表现出的相似性和递变性。
相似性:卤素原子的最外层电子数都为7。
递变性:从上到下,随原子序数的递增,卤族元素的原子最外层电子层数递增,半径递增。
根据下表卤素单质与氢气的反应事实,讨论随着原子核电荷数的增多,卤素单质与氢气反应的规律性变化。
2.卤族元素的化学性质
在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定
光照或点燃发生反应,生成的氯化氢较稳定
加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定
不断加热才能缓慢反应;碘化氢不稳定,在同一条件下同时分解为H2和I2,是可逆反应
F2 Cl2 Br2 I2
①与氢气反应的难易程度:
②生成的氢化物的稳定性:
③卤素的非金属性强弱:
由易到难
由强到弱
由强到弱
(1)卤素单质与氢气的反应
(2)元素的非金属性强弱的判断依据
F2 Cl2 Br2 I2
非金属性逐渐减弱
①非金属单质与氢气反应生成气态氢化物难易程度(或气态 氢化物的稳定性强弱)
与氢气反应越容易(气态氢化物稳定性越强)非金属性越强
②最高价氧化物的水化物酸性强弱
最高价氧化物的水化物酸性越强,非金属性越强金
依据
(3)卤素单质间的置换反应
类似于金属与盐溶液的置换反应,卤素单质间也可发生置换反应
通过卤素单质间的置换反应,可以比较卤素单质的氧化性强弱
氧化性:Cl2>Br2 → 非金属性:Cl>Br
观察实验现象,填写表格内空缺的内容并比较各卤族元素之间的氧化性强弱。
现象 化学方程式 氧化性强弱
F2 Cl2 Br2 I2
氧化性逐渐减弱
随着核电荷数的增加
视频
溶液变成黄色,颜色比黄绿色氯水深 Cl2>Br2
溶液变成红棕色,颜色比黄绿色氯水深 Cl2>I2
溶液变成棕黄色,颜色比黄色溴水深 Br2>I2
总结概述
①元素的性质主要与原子核外电子的排布,特别是和最外层电子数有关;
②原子结构相似的一族元素,它们在化学性质上表现出相似性和递变性;
③从上到下,原子核外电子层数依次增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱;金属性逐渐增强,非金属性逐渐减弱。
1.下列关于F、Cl、Br、I的比较,正确的是( )。
A. 它们的原子核外电子层数随核电荷数的增加而增加
B. 单质的氧化性随核电荷数的增加而增强
C. 它们的氢化物的稳定性随核电荷数的增加而增强
D. 单质的颜色随核电荷数的增加而变浅
练一练
A
2.有关Li、Na、K、Rb的叙述不正确的是( )。
A. 碱性:KOH > LiOH
B. 原子半径: r(K) > r(Na)
C. 它们的单质燃烧时火焰均呈紫色
D. 实验室中少量的钠可保存在煤油中
C
原子结构与元素性质
碱金属
卤素
结构与性质的关系
相似性
递变性(从上到下)
物理性质:银白色(铯略带金色)、质软、密度小、熔沸点低
化学性质:能与水反应、都能与氧气反应
物理性质:密度呈增大趋势(钠大于钾);熔沸点逐渐降低
化学性质:与氧气和水反应越来越强烈
相似性
递变性(从上到下)
物理性质:都有颜色
化学性质:与氢气反应;同族置换
物理性质:颜色加深、密度增大、熔沸点增大
化学性质:与氢气化合越来越难;气态氢化物稳定性越来越差;单质氧化性逐渐减弱
相似性
递变性(从上到下)
最外层电子数相同
电子层数依次增加;原子半径逐渐增大;
失电子能力逐渐增强;得电子能力逐渐减弱;
金属性逐渐增强;非金属性逐渐减弱
