4.2 课时1 元素性质的周期性变化规律 课件 (共23张PPT)2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.2 课时1 元素性质的周期性变化规律 课件 (共23张PPT)2023-2024学年高一化学人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 50.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:17:35 | ||
图片预览






文档简介
(共23张PPT)
第二节 元素周期律 课时1
第四章 物质结构 元素周期律
通过对碱金属元素、卤素的原子结构和性质的研究,知道元素周期表中同主族元素从上到下原子核外电子层数依次增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,金属性逐渐增强,非金属性逐渐减弱。
那么,周期表中同周期元素的性质有什么变化规律呢?
1.了解1~18号元素原子核外电子排布、原子半径、主要化合价的周期性变化规律。
2.以第三周期的钠、镁、铝、硅、磷、硫、氯为例,掌握同周期主族元素金属性、非金属性的递变规律,建构元素周期律。
知识点一:元素性质的周期性变化规律
【思考】随着同周期原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性变化?
观察课本101页表4-5(1-18号元素的原子核外电子排布、原子半径和主要化合价),思考与讨论上述问题。
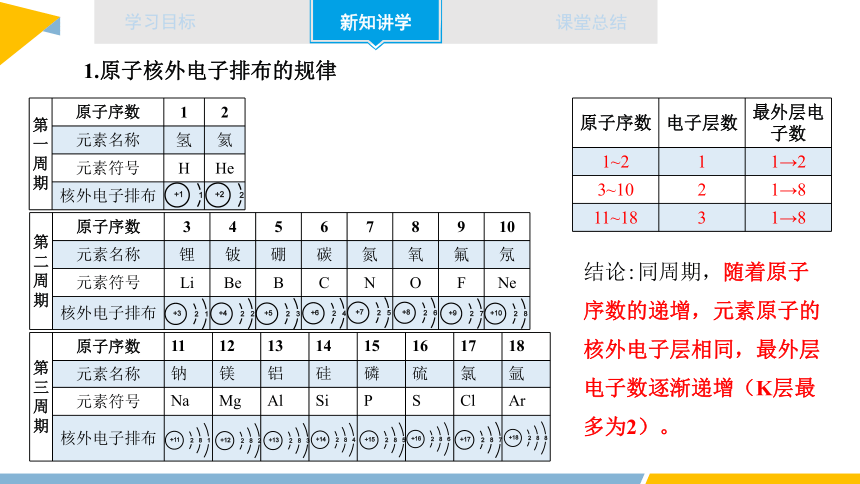
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
核外电子排布
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
核外电子排布
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
核外电子排布
1.原子核外电子排布的规律
原子序数 电子层数 最外层电子数
1~2 1 1→2
3~10 2 1→8
11~18 3 1→8
结论:同周期,随着原子序数的递增,元素原子的核外电子层相同,最外层电子数逐渐递增(K层最多为2)。
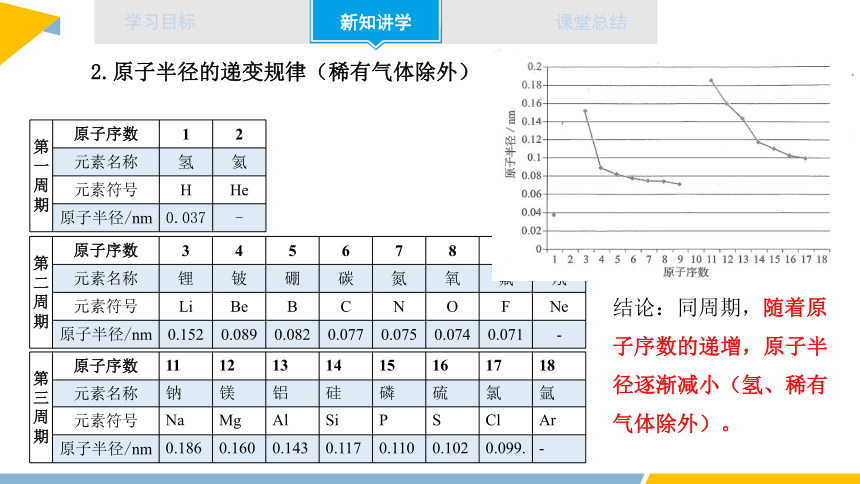
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
原子半径/nm 0.037 -
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
原子半径/nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 -
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
原子半径/nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099. -
2.原子半径的递变规律(稀有气体除外)
结论:同周期,随着原子序数的递增,原子半径逐渐减小(氢、稀有气体除外)。
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
主要化合价 +1 0
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 -2 -1 0
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 +6 -2 +7 -1 0
3.化合价的变化规律
结论:随着原子序数的递增,元素的最高正化合价逐渐递增(除稀有气体外)和最低负化合价逐渐递增。
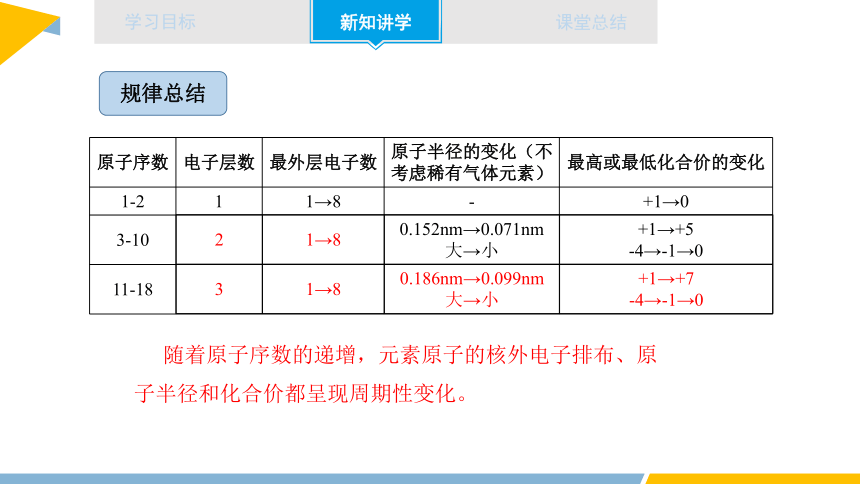
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1-2 1 1→8 - +1→0
3-10 0.152nm→0.071nm 大→小 +1→+5
-4→-1→0
11-18
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性变化。
2 1→8
3 1→8 0.186nm→0.099nm 大→小 +1→+7
-4→-1→0
规律总结
1.下列叙述正确的是( )。
A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现。
B.随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有
气体元素除外)发生周期性变化。
C.随着元素原子序数的递增,元素最高化合价从+1到+7、最低化合价
从-4到-1重复出现。
D.随着元素原子序数的递增,原子半径、元素主要化合价和原子核外电
子排布呈现周期性变化。
练一练
D
2.下列关于粒子半径大小的比较,正确的是( )。
A.Na+Cl->Na+>Al3+
C.NaB
粒子半径大小比较方法
①看电子层数,当电子层数不同时,层数越多,半径越大;
②看核电荷数,当电子层数相同时,核电荷数越大,半径越小;
③看核外电子数,当电子层数和核电荷数均相等时,核外电子数越多,半径越大。
元素的金属性和非金属性是否也随着原子序数的递增而呈现周期性的变化呢?
知识点二:第三周期元素金属性、非金属性的递变规律
金属性:金属元素的原子在化学反应中失去电子的能力
1.第三周期元素金属性的递变规律
金属性强弱判断依据:
①单质与水或酸的反应产生H2的难易——反应越易,金属性越强;
②最高价氧化物的水化物碱性强弱——碱性越强,金属性越强;
③单质间的置换——较活泼金属置换较不活泼金属。
根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性的递变规律吗?
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
核外电子排布
推测
电子层数相同,原子序数增大,半径减小
失去电子能力减弱,金属性减弱
问题讨论
【实验探究】根据金属性强弱的判断依据,我们设计如下实验来验证Na、 Mg、 Al的金属性逐渐减弱。(1)请观看镁与水反应实验视频,并思考:与钠和水的反应相比,镁和水反应难易程度如何?生成了什么新物质?
结论:镁与水反应比较困难
反应方程式:
金属性:钠>镁
视频
(2)观看钠、镁、铝金属性比较的实验视频,对比氢氧化铝沉淀和氢氧化镁沉淀分别与盐酸和氢氧化钠反应的现象,你能得出什么结论?
结论:Al(OH)3能溶于强酸或强碱溶液,属于两性氢氧化物。
Al(OH)3+3H+ = Al3+ + 3H2O
Al(OH)3+OH =AlO2 + 2H2O
视频
【查阅资料】钠、镁、铝是金属元素,都能形成氢氧化物。NaOH是强碱,Mg(OH)2是中强碱,而Al(OH)3是两性氢氧化物。
金属性:钠>镁>铝
Na Mg Al
金属性逐渐减弱
2.第三周期元素非金属性的递变规律
非金属性:非金属元素的原子在化学反应中得到电子的能力。
非金属性判断依据:
①非金属单质与氢气反应生成气态氢化物难易(或气态氢化物的稳定性强弱)
——与氢气反应越容易(气态氢化物稳定性越强),非金属性越强
②最高价氧化物的水化物酸性强弱
—— 最高价氧化物的水化物酸性越强,非金属性越强
③单质间的置换
——活泼非金属置换不活泼非金属金属
推测
电子层数相同,原子序数增大,半径减小
得到电子能力增强,非金属性增强
观察硅、磷、硫、氯是非金属元素,其最高价氧化物对应得水化物(含氧酸)的酸性强弱表,你能得出什么结论?
非金属元素 Si P S Cl
最高价氧化物对应的水化物(含氧酸)的酸性强弱 H2SiO3 (硅酸) 弱酸 H3PO4 (磷酸) 中强酸 H2SO4 (硫酸) 强酸 HClO4
(高氯酸)
强酸(酸性比H2SO4强)
非金属性:硅<磷<硫<氯
Si P S Cl
非金属性逐渐增强
【结论分析】
通过实验比较,你得出的结论是什么?
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
元素周期律:元素的性质随着原子序数的递增而呈现周期性的变化,这一规律叫做元素周期律。
怎么通过原子结构的角度来分析这一规律呢?
用原子结构的角度解释:同周期,从左往右
电子层数相同,核电荷数逐渐增多
原子半径减小
失电子能力逐渐减弱;得电子能力逐渐增强
金属性逐渐减弱;非金属性逐渐增强
元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果
练一练
1.下列关于物质的比较,不正确的是( )。
A.酸性强弱:HIO4>HBrO4>HClO4 B.稳定性:H2O>H2S>PH3
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱:Na>Mg>Al
A
2.下图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )。
F
S Cl
A.单质的氧化性:F2>S>Cl2 B.稳定性:H2S>HCl>HF
C.酸性:HClO4>H2SO4 D.原子半径:F>Cl>S
C
3.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出来①~⑩种元素在周期表中的位置。请回答:
(1)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为 ,还原性最强的是 。(填化学式)
(2)在①、②、③、④四种元素最高价氧化物对应的水化物中,④元素的氢氧化物与四种元素氢氧化物碱性最强反应的化学方式为 ,在⑤、⑦、⑧的三种元素的最高价氧化物对应得水化物中,酸性最强的是 。(填化学式)
HF>HCl>H2S
H2S
HClO4
元素周期律
同周期性
原子核外电子排布和电子层数相同,最外层电子数依次增加
原子半径逐渐减小
化合价逐渐升高
金属性
金属与水、酸反应越来越慢
最高价氧化物对应的水化物的碱性越来越弱
非金属性
非金属单质与氢气化合越来越容易
最高价氧化物对应的水化物(含氧酸)的酸性越来越强
第二节 元素周期律 课时1
第四章 物质结构 元素周期律
通过对碱金属元素、卤素的原子结构和性质的研究,知道元素周期表中同主族元素从上到下原子核外电子层数依次增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,金属性逐渐增强,非金属性逐渐减弱。
那么,周期表中同周期元素的性质有什么变化规律呢?
1.了解1~18号元素原子核外电子排布、原子半径、主要化合价的周期性变化规律。
2.以第三周期的钠、镁、铝、硅、磷、硫、氯为例,掌握同周期主族元素金属性、非金属性的递变规律,建构元素周期律。
知识点一:元素性质的周期性变化规律
【思考】随着同周期原子序数的递增,元素原子的核外电子排布、原子半径和化合价呈现什么规律性变化?
观察课本101页表4-5(1-18号元素的原子核外电子排布、原子半径和主要化合价),思考与讨论上述问题。
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
核外电子排布
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
核外电子排布
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
核外电子排布
1.原子核外电子排布的规律
原子序数 电子层数 最外层电子数
1~2 1 1→2
3~10 2 1→8
11~18 3 1→8
结论:同周期,随着原子序数的递增,元素原子的核外电子层相同,最外层电子数逐渐递增(K层最多为2)。
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
原子半径/nm 0.037 -
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
原子半径/nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 -
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
原子半径/nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099. -
2.原子半径的递变规律(稀有气体除外)
结论:同周期,随着原子序数的递增,原子半径逐渐减小(氢、稀有气体除外)。
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
主要化合价 +1 0
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 -2 -1 0
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 +6 -2 +7 -1 0
3.化合价的变化规律
结论:随着原子序数的递增,元素的最高正化合价逐渐递增(除稀有气体外)和最低负化合价逐渐递增。
原子序数 电子层数 最外层电子数 原子半径的变化(不考虑稀有气体元素) 最高或最低化合价的变化
1-2 1 1→8 - +1→0
3-10 0.152nm→0.071nm 大→小 +1→+5
-4→-1→0
11-18
随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价都呈现周期性变化。
2 1→8
3 1→8 0.186nm→0.099nm 大→小 +1→+7
-4→-1→0
规律总结
1.下列叙述正确的是( )。
A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现。
B.随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有
气体元素除外)发生周期性变化。
C.随着元素原子序数的递增,元素最高化合价从+1到+7、最低化合价
从-4到-1重复出现。
D.随着元素原子序数的递增,原子半径、元素主要化合价和原子核外电
子排布呈现周期性变化。
练一练
D
2.下列关于粒子半径大小的比较,正确的是( )。
A.Na+
C.Na
粒子半径大小比较方法
①看电子层数,当电子层数不同时,层数越多,半径越大;
②看核电荷数,当电子层数相同时,核电荷数越大,半径越小;
③看核外电子数,当电子层数和核电荷数均相等时,核外电子数越多,半径越大。
元素的金属性和非金属性是否也随着原子序数的递增而呈现周期性的变化呢?
知识点二:第三周期元素金属性、非金属性的递变规律
金属性:金属元素的原子在化学反应中失去电子的能力
1.第三周期元素金属性的递变规律
金属性强弱判断依据:
①单质与水或酸的反应产生H2的难易——反应越易,金属性越强;
②最高价氧化物的水化物碱性强弱——碱性越强,金属性越强;
③单质间的置换——较活泼金属置换较不活泼金属。
根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性的递变规律吗?
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
核外电子排布
推测
电子层数相同,原子序数增大,半径减小
失去电子能力减弱,金属性减弱
问题讨论
【实验探究】根据金属性强弱的判断依据,我们设计如下实验来验证Na、 Mg、 Al的金属性逐渐减弱。(1)请观看镁与水反应实验视频,并思考:与钠和水的反应相比,镁和水反应难易程度如何?生成了什么新物质?
结论:镁与水反应比较困难
反应方程式:
金属性:钠>镁
视频
(2)观看钠、镁、铝金属性比较的实验视频,对比氢氧化铝沉淀和氢氧化镁沉淀分别与盐酸和氢氧化钠反应的现象,你能得出什么结论?
结论:Al(OH)3能溶于强酸或强碱溶液,属于两性氢氧化物。
Al(OH)3+3H+ = Al3+ + 3H2O
Al(OH)3+OH =AlO2 + 2H2O
视频
【查阅资料】钠、镁、铝是金属元素,都能形成氢氧化物。NaOH是强碱,Mg(OH)2是中强碱,而Al(OH)3是两性氢氧化物。
金属性:钠>镁>铝
Na Mg Al
金属性逐渐减弱
2.第三周期元素非金属性的递变规律
非金属性:非金属元素的原子在化学反应中得到电子的能力。
非金属性判断依据:
①非金属单质与氢气反应生成气态氢化物难易(或气态氢化物的稳定性强弱)
——与氢气反应越容易(气态氢化物稳定性越强),非金属性越强
②最高价氧化物的水化物酸性强弱
—— 最高价氧化物的水化物酸性越强,非金属性越强
③单质间的置换
——活泼非金属置换不活泼非金属金属
推测
电子层数相同,原子序数增大,半径减小
得到电子能力增强,非金属性增强
观察硅、磷、硫、氯是非金属元素,其最高价氧化物对应得水化物(含氧酸)的酸性强弱表,你能得出什么结论?
非金属元素 Si P S Cl
最高价氧化物对应的水化物(含氧酸)的酸性强弱 H2SiO3 (硅酸) 弱酸 H3PO4 (磷酸) 中强酸 H2SO4 (硫酸) 强酸 HClO4
(高氯酸)
强酸(酸性比H2SO4强)
非金属性:硅<磷<硫<氯
Si P S Cl
非金属性逐渐增强
【结论分析】
通过实验比较,你得出的结论是什么?
Na Mg Al Si P S Cl
金属性逐渐减弱,非金属性逐渐增强
元素周期律:元素的性质随着原子序数的递增而呈现周期性的变化,这一规律叫做元素周期律。
怎么通过原子结构的角度来分析这一规律呢?
用原子结构的角度解释:同周期,从左往右
电子层数相同,核电荷数逐渐增多
原子半径减小
失电子能力逐渐减弱;得电子能力逐渐增强
金属性逐渐减弱;非金属性逐渐增强
元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果
练一练
1.下列关于物质的比较,不正确的是( )。
A.酸性强弱:HIO4>HBrO4>HClO4 B.稳定性:H2O>H2S>PH3
C.碱性强弱:KOH>NaOH>LiOH D.金属性强弱:Na>Mg>Al
A
2.下图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )。
F
S Cl
A.单质的氧化性:F2>S>Cl2 B.稳定性:H2S>HCl>HF
C.酸性:HClO4>H2SO4 D.原子半径:F>Cl>S
C
3.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出来①~⑩种元素在周期表中的位置。请回答:
(1)对于⑦、⑧、⑩元素的氢化物,稳定性由强到弱的顺序为 ,还原性最强的是 。(填化学式)
(2)在①、②、③、④四种元素最高价氧化物对应的水化物中,④元素的氢氧化物与四种元素氢氧化物碱性最强反应的化学方式为 ,在⑤、⑦、⑧的三种元素的最高价氧化物对应得水化物中,酸性最强的是 。(填化学式)
HF>HCl>H2S
H2S
HClO4
元素周期律
同周期性
原子核外电子排布和电子层数相同,最外层电子数依次增加
原子半径逐渐减小
化合价逐渐升高
金属性
金属与水、酸反应越来越慢
最高价氧化物对应的水化物的碱性越来越弱
非金属性
非金属单质与氢气化合越来越容易
最高价氧化物对应的水化物(含氧酸)的酸性越来越强
