4.2 课时2 元素周期表和元素周期律的应用 课件(共15张PPT) 2023-2024学年高一化学人教版(2019)必修一
文档属性
| 名称 | 4.2 课时2 元素周期表和元素周期律的应用 课件(共15张PPT) 2023-2024学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 61.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:18:23 | ||
图片预览




文档简介
(共15张PPT)
第二节 元素周期律 课时2
第四章 物质结构 元素周期律
门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,为它们在周期表中留下空位,例如,他认为在铝的下方有一个与铝相似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。
门捷列夫还预言了锗的存在和性质,多年后也得到了证实。
1.能利用元素在周期表中的位置和原子结构,分析、预测和比较元素的性质。
2.能结合相关资料说明元素周期律(表)对合成新物质,寻找新材料的指导作用。
3.了解元素周期律(表)在学习元素及其化合物知识和科学研究中的重要作用。
知识点一:元素周期表和元素周期律的应用
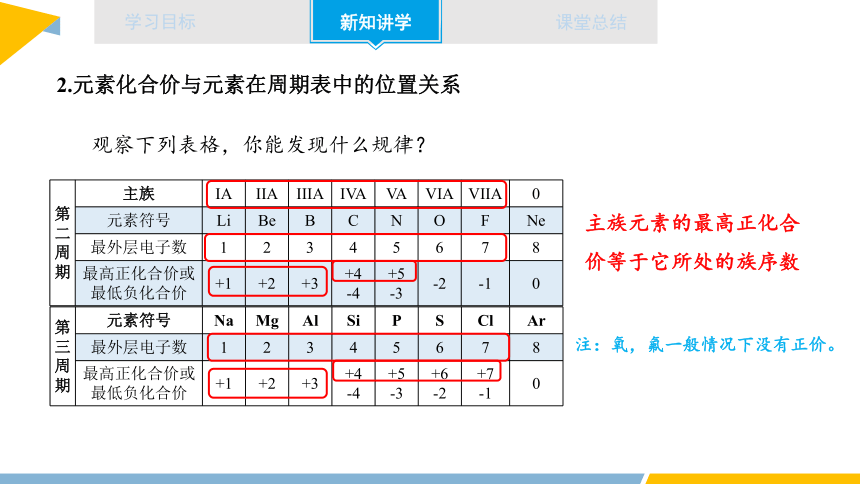
1.原子结构与元素周期表位置的关系
原子序数=核电荷数=质子数=核外电子数
周期序数=核外电子层数
主族序数=最外层电子数
随着原子序数的递增,元素原子的化合价呈现周期性的变化。
第 二 周 期 主族 IA IIA IIIA IVA VA VIA VIIA 0
元素符号 Li Be B C N O F Ne
最外层电子数 1 2 3 4 5 6 7 8
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 -2 -1 0
第 三周 期 元素符号 Na Mg Al Si P S Cl Ar
最外层电子数 1 2 3 4 5 6 7 8
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 +6 -2 +7 -1 0
主族元素的最高正化合价等于它所处的族序数
注:氧,氟一般情况下没有正价。
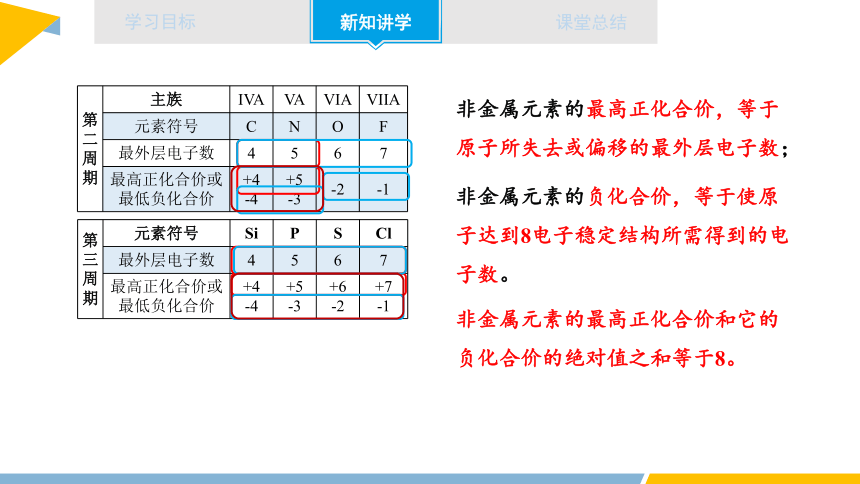
2.元素化合价与元素在周期表中的位置关系
观察下列表格,你能发现什么规律?
第 二 周 期 主族 IVA VA VIA VIIA
元素符号 C N O F
最外层电子数 4 5 6 7
最高正化合价或最低负化合价 +4 -4 +5 -3 -2 -1
第 三周 期 元素符号 Si P S Cl
最外层电子数 4 5 6 7
最高正化合价或最低负化合价 +4 -4 +5 -3 +6 -2 +7
-1
非金属元素的最高正化合价,等于原子所失去或偏移的最外层电子数;
非金属元素的最高正化合价和它的负化合价的绝对值之和等于8。
非金属元素的负化合价,等于使原子达到8电子稳定结构所需得到的电子数。
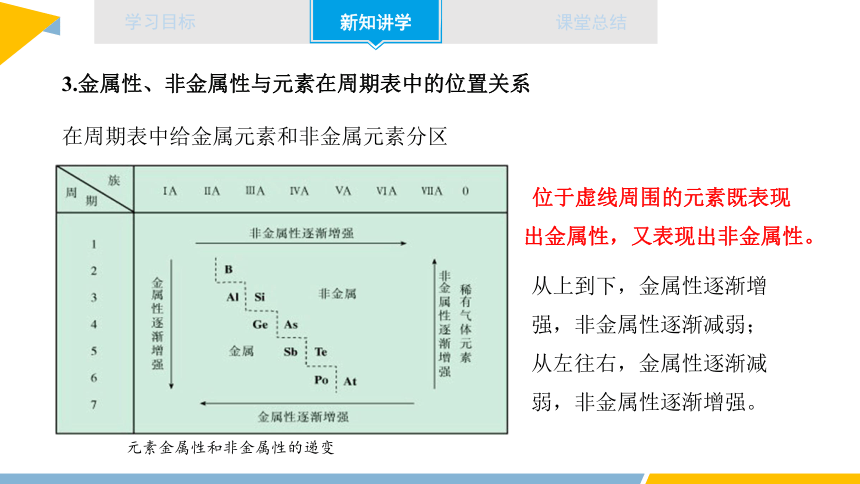
3.金属性、非金属性与元素在周期表中的位置关系
元素金属性和非金属性的递变
在周期表中给金属元素和非金属元素分区
位于虚线周围的元素既表现出金属性,又表现出非金属性。
从上到下,金属性逐渐增强,非金属性逐渐减弱;
从左往右,金属性逐渐减弱,非金属性逐渐增强。
观察下列视频,想一想元素周期表和元素周期律有哪些应用?
视频
4.元素周期表(律)的应用
(1)对于其他与化学相关的科学技术的指导作用
①启发人们在元素周期表一定区域内寻找元素,发现物质的新用途;
②周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗、镓等;
③通常农药所含有的氟、氯、硫、磷、砷等元素在周期表中位置靠近;
④人们还在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素。
耐高温、耐腐蚀的铱合金用于制造发动机的火花塞
(2)学习化学的重要工具
预测新元素、为发现新元素,并预测其原子结构和性质提供线索。
视频
练一练
1.下列说法正确的是( )。
A.原子最外层电子数等于或大于3(小于8)的元素一定是金属元素
B.原子最外层只有一个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
C
2.天然存在的Fr(钫)极其微量,它的21种同位素都有放射性,它是碱金属元素中最重的元素,根据它在元素周期表中的位置预测其性质,其中不正确的是( )。
A.在已知碱金属元素中,它具有最多的电子层数
B.在空气中燃烧的时候,生成氧化物Fr2O
C.最高价氧化物对应得水化物是极强的碱
D.单质的熔点不如钠的高
B
3.元素周期表可以指导人们进行规律性的推测和判断,下列说法不正确的是( )。
A.若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3
B.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F
C.锗与硅位于金属与非金属的交界处,都能作半导体材料
D.S和Se分别位于第ⅥA的第三、四周期,则氢化物的稳定性H2S>H2Se
B
4.应用元素周期律分析,下列推断正确的是( )。
A.砹(At)是第ⅦA族元素,其氢化物的稳定性强于HCl
B.铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
C.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
D.第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
D
元素周期表(律)的应用
化合价
应用
主族元素最高正价=族序数=最外层电子数
非金属元素:
最高正化合价 + 最低负化合价 =8
预测元素性质
寻找半导体材料
寻找制造新品种农药元素
寻找催化剂元素
寻找耐高温、耐腐蚀的合金元素
第二节 元素周期律 课时2
第四章 物质结构 元素周期律
门捷列夫在研究元素周期表时,科学地预言了11种当时尚未发现的元素,为它们在周期表中留下空位,例如,他认为在铝的下方有一个与铝相似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。
门捷列夫还预言了锗的存在和性质,多年后也得到了证实。
1.能利用元素在周期表中的位置和原子结构,分析、预测和比较元素的性质。
2.能结合相关资料说明元素周期律(表)对合成新物质,寻找新材料的指导作用。
3.了解元素周期律(表)在学习元素及其化合物知识和科学研究中的重要作用。
知识点一:元素周期表和元素周期律的应用
1.原子结构与元素周期表位置的关系
原子序数=核电荷数=质子数=核外电子数
周期序数=核外电子层数
主族序数=最外层电子数
随着原子序数的递增,元素原子的化合价呈现周期性的变化。
第 二 周 期 主族 IA IIA IIIA IVA VA VIA VIIA 0
元素符号 Li Be B C N O F Ne
最外层电子数 1 2 3 4 5 6 7 8
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 -2 -1 0
第 三周 期 元素符号 Na Mg Al Si P S Cl Ar
最外层电子数 1 2 3 4 5 6 7 8
最高正化合价或最低负化合价 +1 +2 +3 +4 -4 +5 -3 +6 -2 +7 -1 0
主族元素的最高正化合价等于它所处的族序数
注:氧,氟一般情况下没有正价。
2.元素化合价与元素在周期表中的位置关系
观察下列表格,你能发现什么规律?
第 二 周 期 主族 IVA VA VIA VIIA
元素符号 C N O F
最外层电子数 4 5 6 7
最高正化合价或最低负化合价 +4 -4 +5 -3 -2 -1
第 三周 期 元素符号 Si P S Cl
最外层电子数 4 5 6 7
最高正化合价或最低负化合价 +4 -4 +5 -3 +6 -2 +7
-1
非金属元素的最高正化合价,等于原子所失去或偏移的最外层电子数;
非金属元素的最高正化合价和它的负化合价的绝对值之和等于8。
非金属元素的负化合价,等于使原子达到8电子稳定结构所需得到的电子数。
3.金属性、非金属性与元素在周期表中的位置关系
元素金属性和非金属性的递变
在周期表中给金属元素和非金属元素分区
位于虚线周围的元素既表现出金属性,又表现出非金属性。
从上到下,金属性逐渐增强,非金属性逐渐减弱;
从左往右,金属性逐渐减弱,非金属性逐渐增强。
观察下列视频,想一想元素周期表和元素周期律有哪些应用?
视频
4.元素周期表(律)的应用
(1)对于其他与化学相关的科学技术的指导作用
①启发人们在元素周期表一定区域内寻找元素,发现物质的新用途;
②周期表中金属与非金属的分界处可以找到半导体材料,如硅、锗、镓等;
③通常农药所含有的氟、氯、硫、磷、砷等元素在周期表中位置靠近;
④人们还在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素。
耐高温、耐腐蚀的铱合金用于制造发动机的火花塞
(2)学习化学的重要工具
预测新元素、为发现新元素,并预测其原子结构和性质提供线索。
视频
练一练
1.下列说法正确的是( )。
A.原子最外层电子数等于或大于3(小于8)的元素一定是金属元素
B.原子最外层只有一个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
C
2.天然存在的Fr(钫)极其微量,它的21种同位素都有放射性,它是碱金属元素中最重的元素,根据它在元素周期表中的位置预测其性质,其中不正确的是( )。
A.在已知碱金属元素中,它具有最多的电子层数
B.在空气中燃烧的时候,生成氧化物Fr2O
C.最高价氧化物对应得水化物是极强的碱
D.单质的熔点不如钠的高
B
3.元素周期表可以指导人们进行规律性的推测和判断,下列说法不正确的是( )。
A.若aX2+和bY-的核外电子层结构相同,则原子序数:a=b+3
B.由水溶液的酸性:HCl>HF,可推断出元素的非金属性:Cl>F
C.锗与硅位于金属与非金属的交界处,都能作半导体材料
D.S和Se分别位于第ⅥA的第三、四周期,则氢化物的稳定性H2S>H2Se
B
4.应用元素周期律分析,下列推断正确的是( )。
A.砹(At)是第ⅦA族元素,其氢化物的稳定性强于HCl
B.铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
C.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
D.第三周期金属元素的最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
D
元素周期表(律)的应用
化合价
应用
主族元素最高正价=族序数=最外层电子数
非金属元素:
最高正化合价 + 最低负化合价 =8
预测元素性质
寻找半导体材料
寻找制造新品种农药元素
寻找催化剂元素
寻找耐高温、耐腐蚀的合金元素
