7.3溶液稀释的表示同步练习(含解析) 科粤版(2012)化学九年级下册
文档属性
| 名称 | 7.3溶液稀释的表示同步练习(含解析) 科粤版(2012)化学九年级下册 |  | |
| 格式 | docx | ||
| 文件大小 | 208.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:50:15 | ||
图片预览



文档简介
7.3溶液稀释的表示
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.15℃时,甲和乙的饱和溶液中溶质质量相等
B.35℃时,30g甲加入50g水中,得到80g甲溶液
C.从乙溶液中获得乙晶体,常用蒸发结晶的方法
D.降低温度,甲溶液中溶质的质量分数一定减小
2.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.P点表示t1℃时,a、c饱和溶液中溶质质量相等
B.t2℃时,将30g a物质加入到50g水中充分搅拌,得到80g a的饱和溶液
C.将t1℃时a、b、c三种物质的溶液分别升温至t2℃,其溶质质量分数都不可能发生变化
D.t2℃时等质量的三种饱和溶液降温至t1℃,所得溶液中溶剂质量c>b>a
3.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
4.如下图所示,60℃时,向 100 g 水中加入 61.6g KNO3,得①中溶液,降温至 20℃,得②中溶液。不同温度下 KNO3 的溶解度如下表。
温度/℃ 20 30 40 50 60
溶解度/g 31.6 45.8 63.9 85.5 110
下列说法正确的是
A.①中溶液是 KNO3 饱和溶液 B.开始析出固体时的温度为 20℃
C.②中析出固体的质量为 30 g D.②中溶液的溶质质量分数为 31.6%
5.t℃时,向w g饱和CuSO4溶液中加入a g无水硫酸铜,析出b g胆矾。下列说法正确的是( )
A.t℃时,CuSO4的溶解度为100%
B.t℃时,CuSO4的溶解度为100%
C.该饱和CuSO4溶液的质量分数为100%
D.该饱和CuSO4溶液的质量分数为100%
6.甲、乙两种固体物质的溶解度曲线如图所示,下列叙述正确的是( )
A.甲的溶解度大于乙的溶解度
B.时时,用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲
C.将甲、乙的饱和溶液从升温至,甲溶液中溶质的质量分数比乙大
D.将甲和乙的饱和溶液从降温至,甲析出的晶体多
7.白酒的 “度数”指的是白酒中酒精的含量。这里的含量不是指质量分数,而是体积分数。例如,52度(52°)的白酒表示100ml白酒中含有52ml酒精(常温时)。蒸馏水密度为1g/cm3,酒精密度为0.8g/cm3,若为40度(40°)的白酒溶液中溶质的质量分数约为
A.40% B.60% C.34.8% D.无法判断
8.将100g20%的硫酸溶液,质量分数变为10%,则加水的质量
A.80g B.100g C.200g D.50g
9.下列做法或说法中不合理的是( )
A.硬水易生水垢,日常生活中可以用肥皂水区分硬水和软水
B.利用洗洁精的乳化作用可以洗去餐具上的油污
C.人体缺少必需微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
D.将10g 98%的浓硫酸沿烧杯壁缓慢地注入盛有90g水的烧杯中,用玻璃棒不断搅拌,即可配得9.8%的稀硫酸(不考虑水受热蒸发)
10.40 g溶质质量分数为20%的NaCl溶液变为10%,下列方法正确的是
A.加入8 g NaCl固体 B.加入40 g水
C.倒掉40 g溶液 D.加入40 g 5%的NaCl溶液
二、判断题
11.浓溶液中的溶质质量一定不稀溶液的溶质质量大。
12.某实验小组用质量分数为6%的氯化钠溶液(密度约为1.04g/cm3)和水(密度约为1g/cm3)配制50g质量分数为3%的氯化钠溶液,计算需要6%的氯化钠溶液的质量是25g(约24.0mL),水的质量是25g( )
13.某饱和溶液升高温度之后,溶质质量分数一定不变。( )
14.20℃时,NaCl的溶解度是36g.20℃时,将25gNaCl投入到50g水中,充分搅拌,所得溶液中溶质的质量分数是33.3%( )
15.用20g氯化钠和100g水配制的120g食盐水,其溶质质量分数为20%。( )
三、综合应用题
16.认真分析下列各图,回答相关问题:
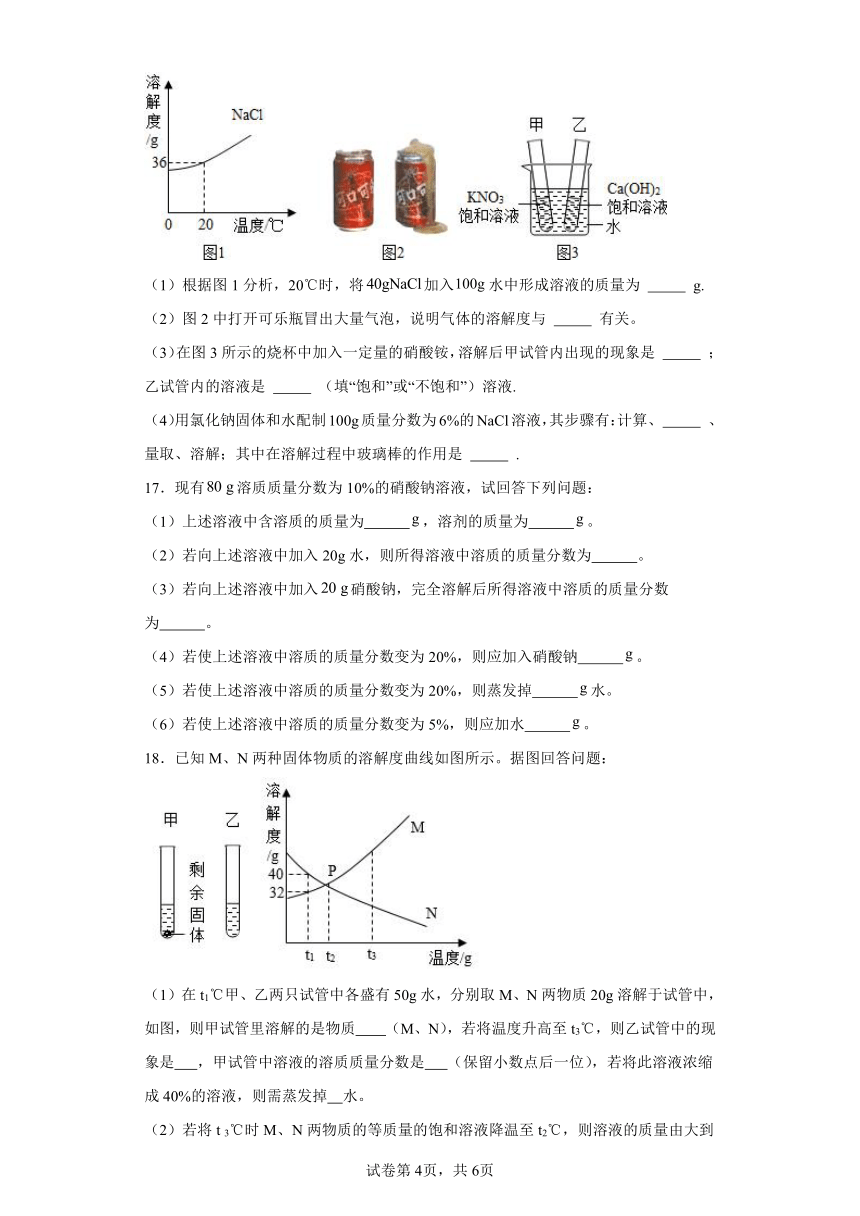
(1)根据图1分析,20℃时,将加入水中形成溶液的质量为 g.
(2)图2中打开可乐瓶冒出大量气泡,说明气体的溶解度与 有关。
(3)在图3所示的烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的现象是 ;乙试管内的溶液是 (填“饱和”或“不饱和”)溶液.
(4)用氯化钠固体和水配制100g质量分数为6%的NaCl溶液,其步骤有:计算、 、量取、溶解;其中在溶解过程中玻璃棒的作用是 .
17.现有溶质质量分数为10%的硝酸钠溶液,试回答下列问题:
(1)上述溶液中含溶质的质量为 ,溶剂的质量为 。
(2)若向上述溶液中加入20g水,则所得溶液中溶质的质量分数为 。
(3)若向上述溶液中加入硝酸钠,完全溶解后所得溶液中溶质的质量分数为 。
(4)若使上述溶液中溶质的质量分数变为20%,则应加入硝酸钠 。
(5)若使上述溶液中溶质的质量分数变为20%,则蒸发掉 水。
(6)若使上述溶液中溶质的质量分数变为5%,则应加水 。
18.已知M、N两种固体物质的溶解度曲线如图所示。据图回答问题:
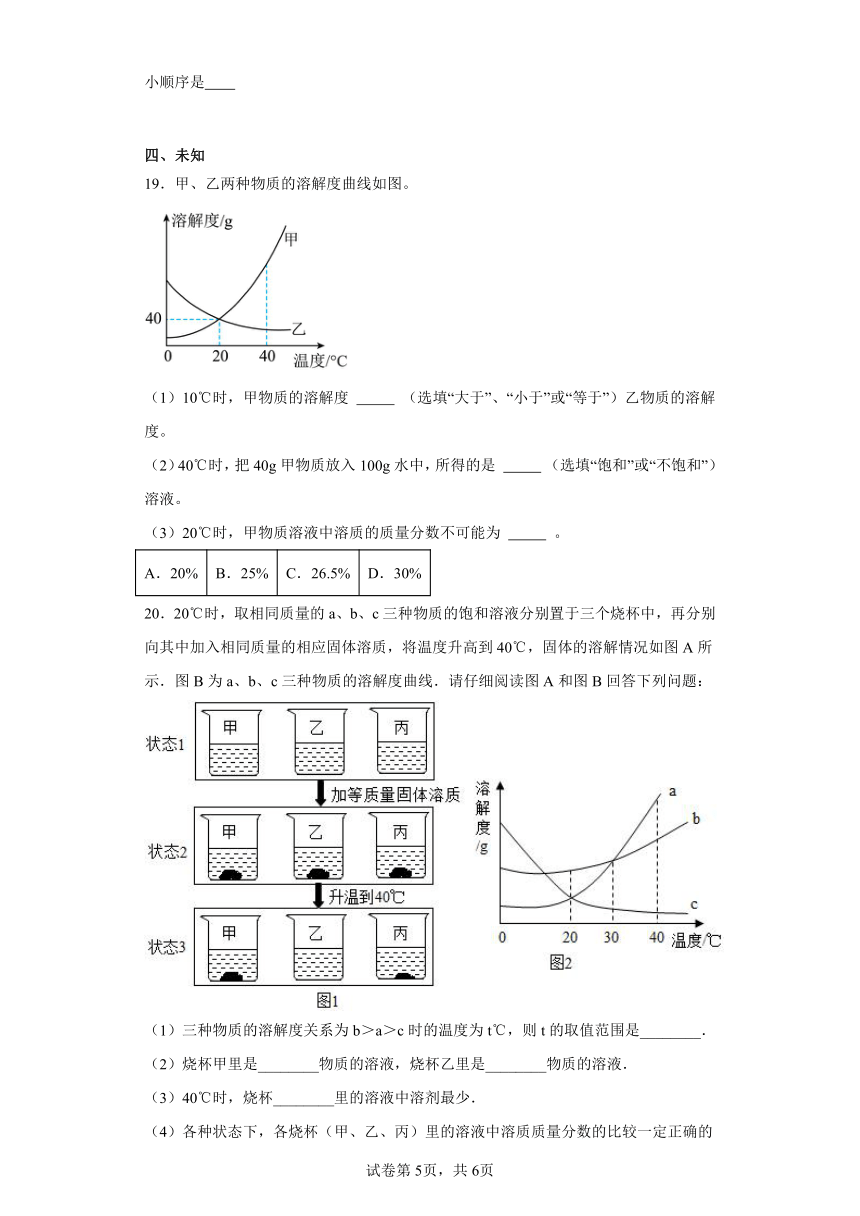
(1)在t1℃甲、乙两只试管中各盛有50g水,分别取M、N两物质20g溶解于试管中,如图,则甲试管里溶解的是物质 (M、N),若将温度升高至t3℃,则乙试管中的现象是 ,甲试管中溶液的溶质质量分数是 (保留小数点后一位),若将此溶液浓缩成40%的溶液,则需蒸发掉 水。
(2)若将t 3℃时M、N两物质的等质量的饱和溶液降温至t2℃,则溶液的质量由大到小顺序是
四、未知
19.甲、乙两种物质的溶解度曲线如图。
(1)10℃时,甲物质的溶解度 (选填“大于”、“小于”或“等于”)乙物质的溶解度。
(2)40℃时,把40g甲物质放入100g水中,所得的是 (选填“饱和”或“不饱和”)溶液。
(3)20℃时,甲物质溶液中溶质的质量分数不可能为 。
A.20% B.25% C.26.5% D.30%
20.20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图A所示.图B为a、b、c三种物质的溶解度曲线.请仔细阅读图A和图B回答下列问题:
(1)三种物质的溶解度关系为b>a>c时的温度为t℃,则t的取值范围是________.
(2)烧杯甲里是________物质的溶液,烧杯乙里是________物质的溶液.
(3)40℃时,烧杯________里的溶液中溶剂最少.
(4)各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是________.
A 甲(状态2)>甲(状态1)
B 乙(状态1)>甲(状态3)
C 甲(状态1)=乙(状态2)
D 乙(状态3)>丙(状态3)
21.如图是甲、乙、丙三种物质的溶解度曲线。t2℃时,配制等质量的甲、乙、丙三种物质的饱和溶液,所需水的质量大小关系为 ;将t1℃时甲、乙、丙三种物质的饱和溶液升温至t2℃,得溶液的溶质质量分数的大小关系为 ;t2℃时,将60g乙的饱和溶液稀释成溶质质量分数为20%的溶液,需加水的质量为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 15℃时,甲和乙的溶解度相等,只能说明它们的饱和溶液中溶质质量分数相等,但溶质质量需要知道溶液质量或者溶剂质量才可确定,此选项错误;B. 35℃时,甲的溶解度是40g,即35℃时,100g水中最多能溶解40g甲,则50g水中最多能溶解20g甲,得到50g+20g=70g甲溶液,此选项错误;C. 乙的溶解度受温度影响不大,对于溶解度受温度影响不大的物质,常用蒸发结晶的方法将溶质从溶液中结晶析出,此选项正确;D. 降低温度,甲的饱和溶液中溶质的质量分数一定减小,此选项错误。故选C。
【点睛】要顺利解答此题,就要理解溶解度的概念,知道溶解度曲线的表示的意义。
2.D
【详解】A、P点表示t1℃时,a、c溶解度相等,饱和溶液中溶质质量不一定相等,是因为不知道饱和溶液质量,该选项说法不正确;
B、t2℃时a的溶解度是50g,将30g物质加入到50g水中充分搅拌,能够溶解25g,得到75ga的饱和溶液,该选项说法不正确;
C、将t1℃时a、b、c三种物质的溶液分别升温至t2℃,如果t1℃时c是饱和溶液,升温至t2℃析出固体,溶质质量分数减小,该选项说法不正确;
D、t2℃时a的溶解度大于b,b的溶解度大于c,等质量的三种饱和溶液中c中水的质量最大,a中水的质量最小,降温至t1℃,水的质量不变,所得溶液中溶剂质量c>b>a,该选项说法正确。
故选D。
3.C
【详解】A. 加入5g氯化钠,所得溶液质量分数为×100%≈18.2% ,故选项错误;
B. 蒸发20g水,所得溶液质量分数为×100%≈16.7% ,故选项错误;
C. 加入50g的30%氯化钠溶液,所得溶液质量分数为×100%=20%,故选项正确;
D. 溶液是均一、稳定的混合物,将溶液取出25g,所得溶液质量分数仍为10% ,故选项错误。
故选C。
4.C
【详解】A.60℃时KNO3的溶解度是110g,向 100g 水中加入 61.6g KNO3,得①溶液,则①溶液是 KNO3 不饱和溶液,此选项错误;
B. 30℃时,KNO3的溶解度是45.8g,40℃时,KNO3的溶解度是63.9g,则开始析出固体时的温度在30℃~40℃,此选项错误;
C. 20℃,KNO3的溶解度是31.6g,则②中析出固体的质量为:61.6g-31.6g=30g,此选项正确;
D. ②中溶液有未溶解的固体物质,则该溶液是 20℃时的饱和溶液,其溶质质量分数为:=24%,此选项错误。
故选C。
5.C
【详解】由于剩余的溶液为饱和溶液,则析出的晶体中的水和除去加入的硫酸铜之外的硫酸铜组成饱和溶液。
设t℃时,CuSO4的溶解度为x。则:
(ba):x=(b ):100g,解得x,故A和B选项都是错误;
析出的晶体中的水和除去加入的硫酸铜之外的硫酸铜组成饱和溶液中CuSO4溶液的质量分数为:
100%100%,故C选项正确,D选项错误。
故选C。
6.B
【详解】A、在比较物质的溶解度时,需要指明温度,故A错误;
B、t2℃时,甲物质的溶解度大于乙物质的溶解度,所以用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲,故B正确;
C、t1℃时,甲物质的溶解度等于乙物质的溶解度,升高温度,不会析出晶体,所以将甲、乙的饱和溶液从t1℃升温至t2℃,甲溶液中溶质的质量分数等于乙,故C错误;
D、将甲和乙的饱和溶液从t2℃降温至t1℃,溶液的质量不能确定,所以析出的晶体也不能确定,故D错误。
故选B
7.C
【详解】设40度白酒体积为100mL,则100mL白酒中水的质量为:1g/cm3×60mL=60g,酒精的质量为:0.8g/cm3×40mL=32g,40度(40°)的白酒溶液中溶质的质量分数约为:×100%=34.8%。故选C。
8.B
【详解】解:设需加水的质量为,
则
解得。
故选:B。
9.C
【详解】A.通常区别硬水与软水用肥皂水:向等量水中分别滴入等量的肥皂水,搅拌,泡沫多浮渣少的为软水,泡沫少浮渣多的为硬水。该选项说法合理,不符合题意;
B.洗洁精具有乳化作用,能使油污与水形成相对稳定的乳浊液而洗去油污,所以洗涤灵起到的作用是乳化作用。该选项说法合理,不符合题意;
C.微量元素摄入过量也不利人体健康,所以人体缺少必需的微量元素要合理摄入,摄入不足或摄入过量均不利于人体健康。该选项说法错误,符合题意;
D.根据溶液稀释时溶质的质量不变,可计算出所得溶液的溶质质量分数: 。该选项说法正确,不符合题意。故选C。
【点睛】明确硬水和软水的区别、鉴别方法和转化方法、乳化作用的原理、微量元素与人体健康的关系和溶液的稀释中溶质质量不变就能顺利解答此类试题
10.B
【详解】A. 加入8 g NaCl固体,溶质质量分数为 100%=33.335。
根据溶液溶质质量分数的概念知,40 g溶质质量分数为20%的NaCl溶液变为10%,可采用B. 加入40 g水,溶质质量分数为×100%=10%。C. 倒掉40 g溶液, 溶质质量分数仍为20%。 D. 加入40 g 5%的NaCl溶液, =15%。
点睛∶本题主要考查溶液溶质质量分数的概念。
11.错
【详解】根据溶质质量分数=,由于未指定溶液质量,因此浓溶液中的溶质质量不一定比稀溶液的溶质质量大。原说法错误。
12.正确
【详解】解:设所需6%的氯化钠溶液的质量是x,根据稀释前后,溶质的质量不变,可得:50g×3%=6%x,x=25,所需水的质量为:50g-25g=25g,正确。
13.错误
【详解】根据饱和溶液中溶质的质量分数 = 可知:溶质的质量变化、溶液的质量变化、溶解度大小变化都会影响溶液的溶质质量分数,而题中温度升高可使物质的溶解度增大或减小、并且温度升高也可能会使部分溶剂蒸发;
温度升高,物质的溶解度增大,溶剂的量不变时,溶质的量不会增大,溶剂的量不变,则溶质的质量分数不变;
温度升高时,溶解度增大,溶剂被蒸发了一部分,则有溶质的量不变,溶剂的量减小,则溶质的质量分数增大;
温度升高时,物质的溶解度减小,则溶质的量减小,溶质质量分数减小。
14.错误
【详解】20℃时,NaCl的溶解度是36g,即在20℃时,100g水中最多溶解36g氯化钠,所以此温度下50g水最多溶解18g氯化钠,所得溶液的溶质质量分数为:,故题中说法错误。
15.错误
【详解】用20g氯化钠和l00g水配制的l20g食盐水,其溶质质量分数=,错误。
16. 136 压强 有晶体析出 不饱和 称量 加快溶解速率
【详解】(1)根据图1分析可知,20℃时,氯化钠的溶解度是36g,即在20℃时,100g水中最多溶解36g的氯化钠就达到饱和状态,若将40g氯化钠加入100g水中,最多溶解氯化钠36g,则形成溶液的质量为136g,故填:136;
(2)气体的溶解度随着压强的增大而增大,随温度的升高而减小,可乐是在加压的条件下溶解大量二氧化碳制成的,当打开可乐瓶盖,压强减少,气体的溶解度减小,会冒出大量气泡,这说明气体的溶解度与压强有关,故填:压强;
(3)氢氧化钙的溶解度随温度降低而增大,硝酸钾的溶解度随温度降低而减小,当硝酸铵溶于水,温度降低,硝酸钾的溶解度降低,会有晶体析出,甲试管内出现的现象故填:有晶体析出;乙试管内的溶液变为不饱和溶液,故填:不饱和;
(4)用一定量固体配置一定溶质质量分数的溶液,需要经过计算(溶质和溶剂的量)、称量(固体质量)、量取(容剂体积)、溶解,操作步骤故填:称量;在溶解过程中利用玻璃棒搅拌,加速溶解,玻璃棒的的作用,故填:加快溶解速率。
【点睛】熟悉硝酸钾和氢氧化钙溶解度随温度变化的趋势,结合硝酸铵溶于水吸热,溶液温度降低,即相当于对硝酸钾饱和溶液和氢氧化钙饱和溶液进行降温操作,进行解题即可。
17. 8 72 8% 28% 10 40 80
【详解】(1)80g质量分数为10%的硝酸钠溶液中含溶质的质量为:;溶剂质量=溶液质量-溶质质量=80g-8g=72g;
(2)若向上述溶液中加入20g水,则所得溶液中溶质的质量分数为若向上述溶液中加入20g水,则所得溶液中溶质的质量分数为:;
(3)若向上述溶液中加入硝酸钠,完全溶解后所得溶液中溶质的质量分数为:;
(4)设应加入硝酸钠的质量为x, ,解得x=10g;
(5)设蒸发掉水的质量为y, ,解得y=40g;
(6)设应加水的质量为z,则 ,解得z=80g。
【点睛】,向不饱和溶液中加溶质或蒸发溶剂,溶质质量分数增大,加入溶剂,溶质质量分数减小。
18. M 有固体结晶出来 28.6% 20g M<N
【详解】(1)据图可知,t1℃时,甲试管中有剩余固体,此时50g水中溶解溶质小于20g,即100g水溶解小于40g,结合固体物质溶解度曲线分析,此时溶解度小于40g的是M物质。若将温度升高至t3℃,M物质的溶解度增加,故其溶液中溶质不变,而N的溶解度降低,故其有溶质晶体析出;则乙试管中的现象是溶质晶体析出。此时,M物质的溶解度大于40g,故其剩余固体全部溶解;此时溶液中溶质质量分数=;
设此溶液浓缩成40%的溶液,需蒸发掉g水,则:
(2)根据t3℃降温至t2℃时,M的溶解度降低,N的溶解度的升高,故M溶液中有溶质结晶出来,N中无晶体析出,故此时M物质等质量的溶液质量少于N溶液。即:M<N。
19. 小于 不饱和 D
【详解】(1)根据溶解度曲线可知,10℃时,甲物质的溶解度小于乙物质的溶解度。
(2)40℃时,把40g甲物质放入100g水中,所得的是不饱和溶液。因为在该温度下甲物质的溶解度大于40g;
(3)20℃时,甲物质饱和溶液溶质的质量分数为 。故答案选择D。
20.(1)20<t<30 (2)c ;a (3)丙 (4)BC
【详解】(1)从溶解度曲线可知,温度大于20℃时,溶解度a>c,温度小于30℃时,溶解度b>a.t的取值范围是20<t<30;
(2)由于烧杯甲里的物质在温度升高时析出溶质,显然其中溶质的溶解度应随着温度的升高而减小,符合c的特点,而乙与丙烧杯里的固体溶质在温度升高时都在减少(即溶解),说明乙与丙烧杯里的固体溶质的溶解度都随温度的升高而增大.乙烧杯里的固体溶质全部溶解,说明乙烧杯里的固体溶质的溶解度受温度变化的影响较大,对照溶解度曲线,可判断出乙烧杯里的固体溶质是a.
(3)烧杯丙里是b物质的溶液,由于20℃时,b物质的溶解度最大,此时,相同质量的三种物质的饱和溶液中,b物质的饱和溶液中溶剂最少,而升高温度,溶剂量并无变化(这里溶剂的蒸发量忽略不计),因此40℃时,烧杯丙里的溶液中溶剂最少.
(4)
A、根据分析可知甲(状态2)和甲(状态1)都是20℃时的饱和溶液,质量分数应相等,错误;
B、乙是a,甲是c,20℃a的溶解度大于40℃c的溶解度,即质量分数大小是乙(状态1)>甲(状态3),正确;
C、乙是a,甲是c,20℃a和c的溶解度相等,甲(状态1)和乙(状态2)都是20℃时的饱和溶液,则质量分数相等,正确;
D、乙是a,丙是b,乙(状态3)不能确定是否饱和,则质量分数不一定大于丙(状态3)的质量分数,错误;故填BC。
21. 甲<乙=丙/乙=丙>甲 甲=乙<丙/丙>甲=乙 40g
【详解】本题考查溶解度曲线。由曲线可知,t2 ℃时,甲、乙、丙三种物质的溶解度的大小关系为甲>乙=丙,故当配制等质量的甲、乙、丙三种物质的饱和溶液时,所需水的质量关系为甲<乙=丙;t1℃时,甲、乙、丙三种物质的溶解度的大小关系为甲=乙<丙,根据饱和溶液的溶质质量分数= 可知,甲、乙、丙三种物质的饱和溶液的溶质质量分数的大小关系为丙>甲=乙,升温至t2 ℃,甲、乙两物质的溶解度增大,溶质质量不变,溶剂质量不变,溶质质量分数也不变;丙物质的溶解度减小,但t2℃时丙物质的溶解度大于t1℃时甲、乙两物质的溶解度,故升温到t2℃,所得溶液的溶质质量分数的大小关系为甲=乙<丙;根据稀释前后溶液中溶质的质量不变,设需加水的质量为x,可得,解得x=40g。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.15℃时,甲和乙的饱和溶液中溶质质量相等
B.35℃时,30g甲加入50g水中,得到80g甲溶液
C.从乙溶液中获得乙晶体,常用蒸发结晶的方法
D.降低温度,甲溶液中溶质的质量分数一定减小
2.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.P点表示t1℃时,a、c饱和溶液中溶质质量相等
B.t2℃时,将30g a物质加入到50g水中充分搅拌,得到80g a的饱和溶液
C.将t1℃时a、b、c三种物质的溶液分别升温至t2℃,其溶质质量分数都不可能发生变化
D.t2℃时等质量的三种饱和溶液降温至t1℃,所得溶液中溶剂质量c>b>a
3.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
4.如下图所示,60℃时,向 100 g 水中加入 61.6g KNO3,得①中溶液,降温至 20℃,得②中溶液。不同温度下 KNO3 的溶解度如下表。
温度/℃ 20 30 40 50 60
溶解度/g 31.6 45.8 63.9 85.5 110
下列说法正确的是
A.①中溶液是 KNO3 饱和溶液 B.开始析出固体时的温度为 20℃
C.②中析出固体的质量为 30 g D.②中溶液的溶质质量分数为 31.6%
5.t℃时,向w g饱和CuSO4溶液中加入a g无水硫酸铜,析出b g胆矾。下列说法正确的是( )
A.t℃时,CuSO4的溶解度为100%
B.t℃时,CuSO4的溶解度为100%
C.该饱和CuSO4溶液的质量分数为100%
D.该饱和CuSO4溶液的质量分数为100%
6.甲、乙两种固体物质的溶解度曲线如图所示,下列叙述正确的是( )
A.甲的溶解度大于乙的溶解度
B.时时,用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲
C.将甲、乙的饱和溶液从升温至,甲溶液中溶质的质量分数比乙大
D.将甲和乙的饱和溶液从降温至,甲析出的晶体多
7.白酒的 “度数”指的是白酒中酒精的含量。这里的含量不是指质量分数,而是体积分数。例如,52度(52°)的白酒表示100ml白酒中含有52ml酒精(常温时)。蒸馏水密度为1g/cm3,酒精密度为0.8g/cm3,若为40度(40°)的白酒溶液中溶质的质量分数约为
A.40% B.60% C.34.8% D.无法判断
8.将100g20%的硫酸溶液,质量分数变为10%,则加水的质量
A.80g B.100g C.200g D.50g
9.下列做法或说法中不合理的是( )
A.硬水易生水垢,日常生活中可以用肥皂水区分硬水和软水
B.利用洗洁精的乳化作用可以洗去餐具上的油污
C.人体缺少必需微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
D.将10g 98%的浓硫酸沿烧杯壁缓慢地注入盛有90g水的烧杯中,用玻璃棒不断搅拌,即可配得9.8%的稀硫酸(不考虑水受热蒸发)
10.40 g溶质质量分数为20%的NaCl溶液变为10%,下列方法正确的是
A.加入8 g NaCl固体 B.加入40 g水
C.倒掉40 g溶液 D.加入40 g 5%的NaCl溶液
二、判断题
11.浓溶液中的溶质质量一定不稀溶液的溶质质量大。
12.某实验小组用质量分数为6%的氯化钠溶液(密度约为1.04g/cm3)和水(密度约为1g/cm3)配制50g质量分数为3%的氯化钠溶液,计算需要6%的氯化钠溶液的质量是25g(约24.0mL),水的质量是25g( )
13.某饱和溶液升高温度之后,溶质质量分数一定不变。( )
14.20℃时,NaCl的溶解度是36g.20℃时,将25gNaCl投入到50g水中,充分搅拌,所得溶液中溶质的质量分数是33.3%( )
15.用20g氯化钠和100g水配制的120g食盐水,其溶质质量分数为20%。( )
三、综合应用题
16.认真分析下列各图,回答相关问题:
(1)根据图1分析,20℃时,将加入水中形成溶液的质量为 g.
(2)图2中打开可乐瓶冒出大量气泡,说明气体的溶解度与 有关。
(3)在图3所示的烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的现象是 ;乙试管内的溶液是 (填“饱和”或“不饱和”)溶液.
(4)用氯化钠固体和水配制100g质量分数为6%的NaCl溶液,其步骤有:计算、 、量取、溶解;其中在溶解过程中玻璃棒的作用是 .
17.现有溶质质量分数为10%的硝酸钠溶液,试回答下列问题:
(1)上述溶液中含溶质的质量为 ,溶剂的质量为 。
(2)若向上述溶液中加入20g水,则所得溶液中溶质的质量分数为 。
(3)若向上述溶液中加入硝酸钠,完全溶解后所得溶液中溶质的质量分数为 。
(4)若使上述溶液中溶质的质量分数变为20%,则应加入硝酸钠 。
(5)若使上述溶液中溶质的质量分数变为20%,则蒸发掉 水。
(6)若使上述溶液中溶质的质量分数变为5%,则应加水 。
18.已知M、N两种固体物质的溶解度曲线如图所示。据图回答问题:
(1)在t1℃甲、乙两只试管中各盛有50g水,分别取M、N两物质20g溶解于试管中,如图,则甲试管里溶解的是物质 (M、N),若将温度升高至t3℃,则乙试管中的现象是 ,甲试管中溶液的溶质质量分数是 (保留小数点后一位),若将此溶液浓缩成40%的溶液,则需蒸发掉 水。
(2)若将t 3℃时M、N两物质的等质量的饱和溶液降温至t2℃,则溶液的质量由大到小顺序是
四、未知
19.甲、乙两种物质的溶解度曲线如图。
(1)10℃时,甲物质的溶解度 (选填“大于”、“小于”或“等于”)乙物质的溶解度。
(2)40℃时,把40g甲物质放入100g水中,所得的是 (选填“饱和”或“不饱和”)溶液。
(3)20℃时,甲物质溶液中溶质的质量分数不可能为 。
A.20% B.25% C.26.5% D.30%
20.20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图A所示.图B为a、b、c三种物质的溶解度曲线.请仔细阅读图A和图B回答下列问题:
(1)三种物质的溶解度关系为b>a>c时的温度为t℃,则t的取值范围是________.
(2)烧杯甲里是________物质的溶液,烧杯乙里是________物质的溶液.
(3)40℃时,烧杯________里的溶液中溶剂最少.
(4)各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是________.
A 甲(状态2)>甲(状态1)
B 乙(状态1)>甲(状态3)
C 甲(状态1)=乙(状态2)
D 乙(状态3)>丙(状态3)
21.如图是甲、乙、丙三种物质的溶解度曲线。t2℃时,配制等质量的甲、乙、丙三种物质的饱和溶液,所需水的质量大小关系为 ;将t1℃时甲、乙、丙三种物质的饱和溶液升温至t2℃,得溶液的溶质质量分数的大小关系为 ;t2℃时,将60g乙的饱和溶液稀释成溶质质量分数为20%的溶液,需加水的质量为 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A. 15℃时,甲和乙的溶解度相等,只能说明它们的饱和溶液中溶质质量分数相等,但溶质质量需要知道溶液质量或者溶剂质量才可确定,此选项错误;B. 35℃时,甲的溶解度是40g,即35℃时,100g水中最多能溶解40g甲,则50g水中最多能溶解20g甲,得到50g+20g=70g甲溶液,此选项错误;C. 乙的溶解度受温度影响不大,对于溶解度受温度影响不大的物质,常用蒸发结晶的方法将溶质从溶液中结晶析出,此选项正确;D. 降低温度,甲的饱和溶液中溶质的质量分数一定减小,此选项错误。故选C。
【点睛】要顺利解答此题,就要理解溶解度的概念,知道溶解度曲线的表示的意义。
2.D
【详解】A、P点表示t1℃时,a、c溶解度相等,饱和溶液中溶质质量不一定相等,是因为不知道饱和溶液质量,该选项说法不正确;
B、t2℃时a的溶解度是50g,将30g物质加入到50g水中充分搅拌,能够溶解25g,得到75ga的饱和溶液,该选项说法不正确;
C、将t1℃时a、b、c三种物质的溶液分别升温至t2℃,如果t1℃时c是饱和溶液,升温至t2℃析出固体,溶质质量分数减小,该选项说法不正确;
D、t2℃时a的溶解度大于b,b的溶解度大于c,等质量的三种饱和溶液中c中水的质量最大,a中水的质量最小,降温至t1℃,水的质量不变,所得溶液中溶剂质量c>b>a,该选项说法正确。
故选D。
3.C
【详解】A. 加入5g氯化钠,所得溶液质量分数为×100%≈18.2% ,故选项错误;
B. 蒸发20g水,所得溶液质量分数为×100%≈16.7% ,故选项错误;
C. 加入50g的30%氯化钠溶液,所得溶液质量分数为×100%=20%,故选项正确;
D. 溶液是均一、稳定的混合物,将溶液取出25g,所得溶液质量分数仍为10% ,故选项错误。
故选C。
4.C
【详解】A.60℃时KNO3的溶解度是110g,向 100g 水中加入 61.6g KNO3,得①溶液,则①溶液是 KNO3 不饱和溶液,此选项错误;
B. 30℃时,KNO3的溶解度是45.8g,40℃时,KNO3的溶解度是63.9g,则开始析出固体时的温度在30℃~40℃,此选项错误;
C. 20℃,KNO3的溶解度是31.6g,则②中析出固体的质量为:61.6g-31.6g=30g,此选项正确;
D. ②中溶液有未溶解的固体物质,则该溶液是 20℃时的饱和溶液,其溶质质量分数为:=24%,此选项错误。
故选C。
5.C
【详解】由于剩余的溶液为饱和溶液,则析出的晶体中的水和除去加入的硫酸铜之外的硫酸铜组成饱和溶液。
设t℃时,CuSO4的溶解度为x。则:
(ba):x=(b ):100g,解得x,故A和B选项都是错误;
析出的晶体中的水和除去加入的硫酸铜之外的硫酸铜组成饱和溶液中CuSO4溶液的质量分数为:
100%100%,故C选项正确,D选项错误。
故选C。
6.B
【详解】A、在比较物质的溶解度时,需要指明温度,故A错误;
B、t2℃时,甲物质的溶解度大于乙物质的溶解度,所以用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲,故B正确;
C、t1℃时,甲物质的溶解度等于乙物质的溶解度,升高温度,不会析出晶体,所以将甲、乙的饱和溶液从t1℃升温至t2℃,甲溶液中溶质的质量分数等于乙,故C错误;
D、将甲和乙的饱和溶液从t2℃降温至t1℃,溶液的质量不能确定,所以析出的晶体也不能确定,故D错误。
故选B
7.C
【详解】设40度白酒体积为100mL,则100mL白酒中水的质量为:1g/cm3×60mL=60g,酒精的质量为:0.8g/cm3×40mL=32g,40度(40°)的白酒溶液中溶质的质量分数约为:×100%=34.8%。故选C。
8.B
【详解】解:设需加水的质量为,
则
解得。
故选:B。
9.C
【详解】A.通常区别硬水与软水用肥皂水:向等量水中分别滴入等量的肥皂水,搅拌,泡沫多浮渣少的为软水,泡沫少浮渣多的为硬水。该选项说法合理,不符合题意;
B.洗洁精具有乳化作用,能使油污与水形成相对稳定的乳浊液而洗去油污,所以洗涤灵起到的作用是乳化作用。该选项说法合理,不符合题意;
C.微量元素摄入过量也不利人体健康,所以人体缺少必需的微量元素要合理摄入,摄入不足或摄入过量均不利于人体健康。该选项说法错误,符合题意;
D.根据溶液稀释时溶质的质量不变,可计算出所得溶液的溶质质量分数: 。该选项说法正确,不符合题意。故选C。
【点睛】明确硬水和软水的区别、鉴别方法和转化方法、乳化作用的原理、微量元素与人体健康的关系和溶液的稀释中溶质质量不变就能顺利解答此类试题
10.B
【详解】A. 加入8 g NaCl固体,溶质质量分数为 100%=33.335。
根据溶液溶质质量分数的概念知,40 g溶质质量分数为20%的NaCl溶液变为10%,可采用B. 加入40 g水,溶质质量分数为×100%=10%。C. 倒掉40 g溶液, 溶质质量分数仍为20%。 D. 加入40 g 5%的NaCl溶液, =15%。
点睛∶本题主要考查溶液溶质质量分数的概念。
11.错
【详解】根据溶质质量分数=,由于未指定溶液质量,因此浓溶液中的溶质质量不一定比稀溶液的溶质质量大。原说法错误。
12.正确
【详解】解:设所需6%的氯化钠溶液的质量是x,根据稀释前后,溶质的质量不变,可得:50g×3%=6%x,x=25,所需水的质量为:50g-25g=25g,正确。
13.错误
【详解】根据饱和溶液中溶质的质量分数 = 可知:溶质的质量变化、溶液的质量变化、溶解度大小变化都会影响溶液的溶质质量分数,而题中温度升高可使物质的溶解度增大或减小、并且温度升高也可能会使部分溶剂蒸发;
温度升高,物质的溶解度增大,溶剂的量不变时,溶质的量不会增大,溶剂的量不变,则溶质的质量分数不变;
温度升高时,溶解度增大,溶剂被蒸发了一部分,则有溶质的量不变,溶剂的量减小,则溶质的质量分数增大;
温度升高时,物质的溶解度减小,则溶质的量减小,溶质质量分数减小。
14.错误
【详解】20℃时,NaCl的溶解度是36g,即在20℃时,100g水中最多溶解36g氯化钠,所以此温度下50g水最多溶解18g氯化钠,所得溶液的溶质质量分数为:,故题中说法错误。
15.错误
【详解】用20g氯化钠和l00g水配制的l20g食盐水,其溶质质量分数=,错误。
16. 136 压强 有晶体析出 不饱和 称量 加快溶解速率
【详解】(1)根据图1分析可知,20℃时,氯化钠的溶解度是36g,即在20℃时,100g水中最多溶解36g的氯化钠就达到饱和状态,若将40g氯化钠加入100g水中,最多溶解氯化钠36g,则形成溶液的质量为136g,故填:136;
(2)气体的溶解度随着压强的增大而增大,随温度的升高而减小,可乐是在加压的条件下溶解大量二氧化碳制成的,当打开可乐瓶盖,压强减少,气体的溶解度减小,会冒出大量气泡,这说明气体的溶解度与压强有关,故填:压强;
(3)氢氧化钙的溶解度随温度降低而增大,硝酸钾的溶解度随温度降低而减小,当硝酸铵溶于水,温度降低,硝酸钾的溶解度降低,会有晶体析出,甲试管内出现的现象故填:有晶体析出;乙试管内的溶液变为不饱和溶液,故填:不饱和;
(4)用一定量固体配置一定溶质质量分数的溶液,需要经过计算(溶质和溶剂的量)、称量(固体质量)、量取(容剂体积)、溶解,操作步骤故填:称量;在溶解过程中利用玻璃棒搅拌,加速溶解,玻璃棒的的作用,故填:加快溶解速率。
【点睛】熟悉硝酸钾和氢氧化钙溶解度随温度变化的趋势,结合硝酸铵溶于水吸热,溶液温度降低,即相当于对硝酸钾饱和溶液和氢氧化钙饱和溶液进行降温操作,进行解题即可。
17. 8 72 8% 28% 10 40 80
【详解】(1)80g质量分数为10%的硝酸钠溶液中含溶质的质量为:;溶剂质量=溶液质量-溶质质量=80g-8g=72g;
(2)若向上述溶液中加入20g水,则所得溶液中溶质的质量分数为若向上述溶液中加入20g水,则所得溶液中溶质的质量分数为:;
(3)若向上述溶液中加入硝酸钠,完全溶解后所得溶液中溶质的质量分数为:;
(4)设应加入硝酸钠的质量为x, ,解得x=10g;
(5)设蒸发掉水的质量为y, ,解得y=40g;
(6)设应加水的质量为z,则 ,解得z=80g。
【点睛】,向不饱和溶液中加溶质或蒸发溶剂,溶质质量分数增大,加入溶剂,溶质质量分数减小。
18. M 有固体结晶出来 28.6% 20g M<N
【详解】(1)据图可知,t1℃时,甲试管中有剩余固体,此时50g水中溶解溶质小于20g,即100g水溶解小于40g,结合固体物质溶解度曲线分析,此时溶解度小于40g的是M物质。若将温度升高至t3℃,M物质的溶解度增加,故其溶液中溶质不变,而N的溶解度降低,故其有溶质晶体析出;则乙试管中的现象是溶质晶体析出。此时,M物质的溶解度大于40g,故其剩余固体全部溶解;此时溶液中溶质质量分数=;
设此溶液浓缩成40%的溶液,需蒸发掉g水,则:
(2)根据t3℃降温至t2℃时,M的溶解度降低,N的溶解度的升高,故M溶液中有溶质结晶出来,N中无晶体析出,故此时M物质等质量的溶液质量少于N溶液。即:M<N。
19. 小于 不饱和 D
【详解】(1)根据溶解度曲线可知,10℃时,甲物质的溶解度小于乙物质的溶解度。
(2)40℃时,把40g甲物质放入100g水中,所得的是不饱和溶液。因为在该温度下甲物质的溶解度大于40g;
(3)20℃时,甲物质饱和溶液溶质的质量分数为 。故答案选择D。
20.(1)20<t<30 (2)c ;a (3)丙 (4)BC
【详解】(1)从溶解度曲线可知,温度大于20℃时,溶解度a>c,温度小于30℃时,溶解度b>a.t的取值范围是20<t<30;
(2)由于烧杯甲里的物质在温度升高时析出溶质,显然其中溶质的溶解度应随着温度的升高而减小,符合c的特点,而乙与丙烧杯里的固体溶质在温度升高时都在减少(即溶解),说明乙与丙烧杯里的固体溶质的溶解度都随温度的升高而增大.乙烧杯里的固体溶质全部溶解,说明乙烧杯里的固体溶质的溶解度受温度变化的影响较大,对照溶解度曲线,可判断出乙烧杯里的固体溶质是a.
(3)烧杯丙里是b物质的溶液,由于20℃时,b物质的溶解度最大,此时,相同质量的三种物质的饱和溶液中,b物质的饱和溶液中溶剂最少,而升高温度,溶剂量并无变化(这里溶剂的蒸发量忽略不计),因此40℃时,烧杯丙里的溶液中溶剂最少.
(4)
A、根据分析可知甲(状态2)和甲(状态1)都是20℃时的饱和溶液,质量分数应相等,错误;
B、乙是a,甲是c,20℃a的溶解度大于40℃c的溶解度,即质量分数大小是乙(状态1)>甲(状态3),正确;
C、乙是a,甲是c,20℃a和c的溶解度相等,甲(状态1)和乙(状态2)都是20℃时的饱和溶液,则质量分数相等,正确;
D、乙是a,丙是b,乙(状态3)不能确定是否饱和,则质量分数不一定大于丙(状态3)的质量分数,错误;故填BC。
21. 甲<乙=丙/乙=丙>甲 甲=乙<丙/丙>甲=乙 40g
【详解】本题考查溶解度曲线。由曲线可知,t2 ℃时,甲、乙、丙三种物质的溶解度的大小关系为甲>乙=丙,故当配制等质量的甲、乙、丙三种物质的饱和溶液时,所需水的质量关系为甲<乙=丙;t1℃时,甲、乙、丙三种物质的溶解度的大小关系为甲=乙<丙,根据饱和溶液的溶质质量分数= 可知,甲、乙、丙三种物质的饱和溶液的溶质质量分数的大小关系为丙>甲=乙,升温至t2 ℃,甲、乙两物质的溶解度增大,溶质质量不变,溶剂质量不变,溶质质量分数也不变;丙物质的溶解度减小,但t2℃时丙物质的溶解度大于t1℃时甲、乙两物质的溶解度,故升温到t2℃,所得溶液的溶质质量分数的大小关系为甲=乙<丙;根据稀释前后溶液中溶质的质量不变,设需加水的质量为x,可得,解得x=40g。
答案第1页,共2页
答案第1页,共2页
