1.1 化学反应的热效应 同步练习题 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1 化学反应的热效应 同步练习题 (含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 648.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:31:36 | ||
图片预览




文档简介
1.1 化学反应的热效应 同步练习题
一、选择题
1.关于化学反应与能量的说法正确的是
A.中和反应是吸热反应 B.燃烧属于放热反应
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
2.化学家发现物质的能量变化与其反应路径无关。依据图示关系,下列说法错误的是
A.石墨燃烧是放热反应
B.
C.化学反应的,只与反应体系的始态和终态有关,与反应途径无关
D.1 mol C(石墨)和1mol CO分别在足量中燃烧,全部转化为,前者放热多
3.已知含四个碳原子的部分烃类与氢气的相对能量如图所示:
下列说法正确的是
A.断开1,3-丁二烯中的两个碳碳双键需要的能量为断开一个碳碳双键的2倍
B.反应的
C.1,3-丁二烯中的两个碳碳双键存在相互作用
D.因烯烃加氢是碳碳双键断键的过程,故是吸热反应
4.下列反应过程中的能量变化符合下图的是
①酸碱中和;②镁与盐酸的反应;③生石灰变成熟石灰的反应;④食物因缓慢氧化腐烂;⑤石灰石分解;⑥甲烷燃烧;⑦灼热的炭与二氧化碳反应
A.①②③⑤ B.④⑤⑦ C.③④⑦ D.⑤⑦
5.已知:100kPa下,1mol石墨完全燃烧生成1mol二氧化碳气体放热393.5kJ;1mol金刚石完全燃烧生成1mol二氧化碳气体放热395.4kJ,下列说法正确的是
A.金刚石比石墨稳定
B.石墨与金刚石互为同位素
C.石墨转化为金刚石是物理变化
D.100kPa下,1molCO2(g)完全分解为石墨和O2(g)吸热393.5kJ
6.下列能正确地表示燃烧热的热化学方程式是
A.
B.
C.
D.
7.标准状况下将1L纯净的在空气中完全燃烧,生成和液态水,放出39.75kJ热量,则燃烧的热化学方程式为
A.
B.
C.
D.
8.HCl(g)溶于大量水的过程放热,循环关系如图所示:下列说法不正确的是
A.,
B.若将循环图中元素改成元素,相应的
C.
D.
9.根据如图提供的信息,下列所得结论正确的是
A.该反应为吸热反应
B.该反应为放热反应
C.如果发生图示的逆反应,反应条件一定加热
D.反应物的总能量小于生成物的总能量
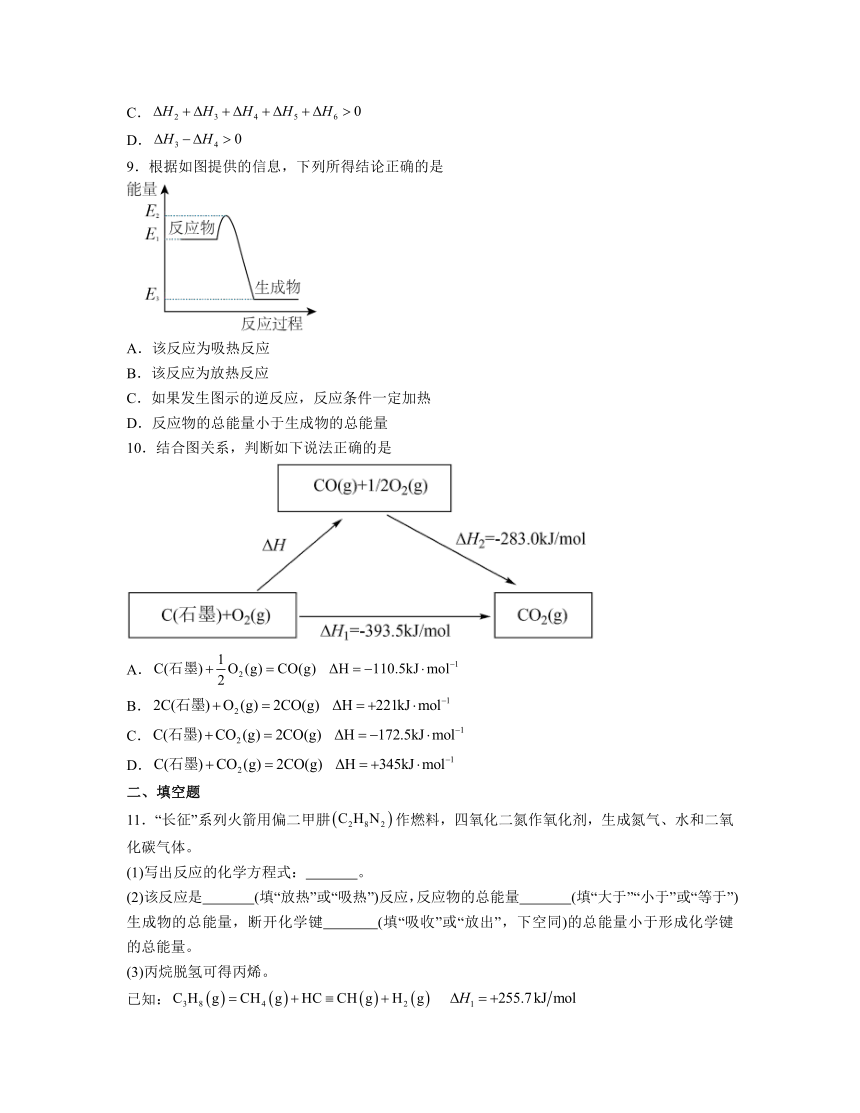
10.结合图关系,判断如下说法正确的是
A.
B.
C.
D.
二、填空题
11.“长征”系列火箭用偏二甲肼作燃料,四氧化二氮作氧化剂,生成氮气、水和二氧化碳气体。
(1)写出反应的化学方程式: 。
(2)该反应是 (填“放热”或“吸热”)反应,反应物的总能量 (填“大于”“小于”或“等于”)生成物的总能量,断开化学键 (填“吸收”或“放出”,下空同)的总能量小于形成化学键 的总能量。
(3)丙烷脱氢可得丙烯。
已知:
则相同条件下,丙烷脱氢得丙烯的热化学方程式为 。
12.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:
反应Ⅲ:
(1)反应Ⅱ的热化学方程式: 。
(2)用将转化为,可提高效益,减少污染。
传统上该转化通过如图所示的催化循环实现。其中,反应①为,反应②生成的反应热为,则总反应的热化学方程式为 (反应热用和表示)。
13.汽车内燃机工作时引起反应:,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
断裂的共价键 O=O N≡N N-O
需要的能量
(1)机动车发动机工作时会引发和的反应,该反应是 (填“放热”或“吸热”)反应。
(2)与合成NO的热化学方程式可以表示为 ,则 。
(3)NO与CO反应的热化学方程式可以表示为 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a (填“增大”“减小”或“不变”)。
(4)已知:① ;
② 。
Al和FeO发生铝热反应的热化学方程式是 。
14.(1)P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol
(2)P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 。相同状况下,能量较低的是 ;红磷的稳定性比白磷
15.(1)实验测得16 g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)合成氨反应N(g)+3H2(g)2NH3(g) △H=a kJ·mol-1,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中E (填“变大”“变小”或“不变”,下同),图中△H 。
②有关键能数据如下:
化学键 H—H N—H N≡N
键能(kJ mol-1) 436 391 945
试根据表中所列键能数据计算a为 。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氯为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H1=a kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=b kJ·mol-1
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式: 。
16.根据要求,回答下列问题:
(1)已知甲烷的燃烧热为, 。写出CO燃烧的热化学方程式: ,若、键的键能分别为、,则使1molCO转化为相应的原子时需要的能量是 ;1mol按上述方式燃烧时损失的热能是 (保留1位小数)。
(2)煤的气化反应之一为
已知:①
②
③
则上述煤的生成的气化反应的 。实际生产中该气化反应需要加入催化剂,其主要原因是 (填“速率问题”或“平衡问题”)。
17.A、B、C、D、E是四种短周期元素,A是原子半径最小的元素;B原子M层上的电子数是原子核外电子层数的2倍;C原子最外层电子数是次外层电子数的2倍;D的氢化物水溶液呈碱性;E元素的最高价氧化物的水化物是酸性最强的含氧酸。用元素符号或化学式回答下列问题:
(1)元素B的离子结构示意图为 。
(2)B的最高价氧化物的水化物与D的气态氢化物形成的盐中含有的化学键: 。
(3)用电子式表示A2B的形成过程 。A2B与H2O沸点更高的是 。
(4)DE3常温下呈液态,可与水反应生成一种酸和一种碱,写出对应的化学方程式为 。
(5)CB2的结构式 。
(6)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
(7)工业上用H2和Cl2反应制HCl,各共价键键能数据为H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式为
18.某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管往其中滴加5 mL盐酸。
试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式 。
(4)由实验推知,MgCl2和H2的总能量 (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25℃的饱和石灰水”换成“20℃碳酸饮料”进行实验探究,实验中观察到的另一现象是 ,其原因是 。
【参考答案】
一、选择题
1.B
解析:A.中和反应是酸和碱发生的反应,是放热反应,A错误;
B.燃烧是可燃物发生的剧烈的发光放热的反应,是放热反应,B正确;
C.断裂化学键需要吸收能量,C错误;
D.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,D错误;
故本题选B。
2.B
解析:A.从图看C(石墨)与O2变为CO2的ΔH <0,则石墨的燃烧为放热反应,A项正确;
B.由盖斯定律得ΔH+ΔH2=ΔH1得出 2C(石墨)+O2(g)=2CO(g) ΔH3=2ΔH1-2ΔH2,B项错误;
C.由盖斯定律可知,反应的焓变与路径无关,只与反应物和生成物有关,C项正确;
D.从图看石墨转变为CO2的ΔH1=-393.5kJ/mol而CO转变为CO2的ΔH2=-283kJ/mol,则前者放出的热量更多,D项正确;
故选B。
3.C
解析:A.由图表中相对能量可知,1,3-丁二烯中第一个碳碳双键和氢气加成放出能量121.1kJ/mol,1,3-丁二烯中第二个碳碳双键和氢气加成放出能量115.5kJ/mol,能量不相等,故A错误;
B.C4H6可能代表1,3-丁二烯,也可能代表1-丁炔,故不能得出反应的,故B错误;
C.1,3-丁二烯中的两个碳碳双键存在相互作用,使两个双键和氢气加成放出的能量不同,故C正确;
D.由图表中相对能量可知,烯烃加氢是放热反应,故D错误;
故选C。
4.D
解析:观察图像可知,反应物总能量小于生成物总能量,为吸热反应,题中⑤石灰石分解、⑦灼热的炭与二氧化碳反应。都属于吸热反应,其余均为放热反应,符合条件的是⑤⑦。
故答案选D。
5.D
解析:A.金刚石燃烧时放热更多,说明金刚石的能量高,则金刚石不如石墨稳定,A错误;
B.石墨与金刚石为碳元素形成的不同单质,互为同素异形体,B错误;
C.石墨而金刚石为不同物质,石墨转化为金刚石是化学变化,C错误;
D.100kPa下,1mol石墨完全燃烧生成1mol二氧化碳气体放热393.5kJ,则其逆过程吸热,即1molCO2(g)完全分解为石墨和O2(g)吸热393.5kJ,D正确;
综上所述答案为D。
6.A
解析:燃烧热是指1mol可燃物完全燃烧生成稳定化合物放出的热量,的燃烧热为,则完全燃烧生成1mol二氧化碳和2mol液态水放出的热量,所以燃烧的热化学方程式为: ,故A正确。
7.C
解析:标准状况下将1L纯净的在空气中完全燃烧,生成和液态水,放出39.75kJ热量,则1mol甲烷在空气中完全燃烧,生成和液态水,放出的热量为39.75kJ×22.4=890.4 kJ,放热反应,焓变为负值,甲烷燃烧的热化学方程式为 ,选C。
8.C
解析:A.H+(g)→H+(aq)、Cl-(g)→Cl-(aq)为放热过程,ΔH5<0,ΔH6<0,A正确;
B.Cl的非金属性强于Br,氢氯键键能大于氢溴键,断开共价键吸热,则ΔH2(Cl)>ΔH2(Br),B正确;
C.根据题干可知,HCl(g)溶于大量水过程放热,ΔH1<0,根据盖斯定律,ΔH1=,C错误;
D.氢原子失电子吸热,氯原子得电子放热,ΔH3>0,ΔH4<0,则ΔH3-ΔH4>0,D正确;
故答案选C。
9.B
解析:A.反应物的总能量高于生成物,该反应为放热反应,A错误;
B.反应物的总能量高于生成物,该反应为放热反应,B正确;
C.图示反应的逆反应为吸热反应,反应条件不一定要加热,常温下也可以进行,C错误;
D.反应物总能量在上,生成物总能量在下,反应物的总能量高于生成物,D错误;
故选B。
10.A
【分析】根据图中信息得到,。
解析:A.根据两个方程式相减得到,故A正确;
B.根据两个方程式相减再乘以2得到,故B错误;
C.减去的2倍,得到,故C错误;
D.根据C分析得到,故D错误。
综上所述,答案为A。
二、填空题
11.(1);
(2) 放热; 大于; 吸收; 放出;
(3) 。
解析:(1)结合题干材料,偏二甲肼作燃料,四氧化二氮作氧化剂,生成氮气、水和二氧化碳气体即可写出相应化学方程式。
(2)该反应通过燃料燃烧可提供飞船飞行所需能量,故该反应为放热反应,则反应物总能量大于生成物总能量;在化学反应中,断开化学键需要吸收能量,形成化学键需要放出能量。
(3)① ,② ,根据盖斯定律①-②得 。
12.(1)
(2)
解析:(1)由于反应Ⅱ是二氧化硫的催化歧化反应,且由题意可知其氧化产物和还原产物分别为和,根据得失电子守恒和元素守恒可写出反应Ⅱ的化学方程式:。根据盖斯定律,反应Ⅱ与反应Ⅲ的热化学方程式相加得,所以反应Ⅱ的热化学方程式为;
(2)根据图示写出反应②,由①+②可写出总反应的热化学方程式为。
13.(1)吸热
(2)
(3)不变
(4)
解析:(1)反应物键能之和-生成物键能之和,根据题给数据可知,+-=>0,为吸热反应;
(2)根据(1)可知,,根据盖斯定律,;
(3)催化剂只改变化学反应速率,不改变反应的反应热,所以 ,使用“催化转化器”后,a不变;
(4)① ;② ,根据盖斯定律,由②-①×3可得 。
14.P4(白磷,s)=4 P(红磷,s)ΔH=-29.2 kJ/mol 红磷 强
解析:根据盖斯定律可知,①-②×4即得到P4(白磷,s)=4P(红磷,s),所以该反应的反应热ΔH=-2983.2kJ/mol+738.5kJ/mol×4=-29.2 kJ/mol;这说明白磷的总能量高于红磷的总能量,所以红磷稳定性强于白磷的;即相同状况下,能量较低的是红磷;红磷的稳定性比白磷强;故答案为P4(白磷,s)=4P(红磷,s)ΔH=-29.2 kJ/mol;红磷;强。
15. CH3OH(l)+ O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol 变小 不变 -93 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=(2b-a) kJ/mol
【分析】(1)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,据此分析书写;
(2)①催化剂降低反应的活化能,但不改变焓变;②根据△H=反应物总键能-生成物总键能计算;
(3)根据盖斯定律分析解答。
解析:(1)16gCH3OH在氧气中燃烧生成CO2和液态水,放出363.25kJ热量,则32gCH3OH即1molCH3OH在氧气中燃烧生成CO2和液态水,放出726.5kJ热量,则△H=-726.5kJ/mol,则甲醇燃烧热的热化学方程式为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ/mol,故答案为:CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ/mol;
(2)①催化剂能够降低反应的活化能,加快反应速率,但不改变焓变,则加催化剂会使图中E变小,图中△H不变,故答案为:变小;不变;
②N2(g)+3H2(g) 2NH3(g)△H=反应物总键能-生成物总键能=945kJ mol-1+436kJ mol-1×3-391kJ mol-1×6=-93kJ mol-1=akJ mol-1,解得a=-93,故答案为:-93;
(3) ①N2(g)+2O2(g)=2NO2(g) △H1=a kJ·mol-1,②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=b kJ·mol-1,根据盖斯定律,将②×2-①得:2N2H4(g)-N2(g)=2N2(g)+4H2O(g)-2NO2(g) △H=2△H2-△H1,整理得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=(2b-a) kJ/mol,故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=(2b-a) kJ/mol。
16.(1) 188.7kJ
(2) 速率问题
解析:(1)题中已知①
已知甲烷的燃烧热为,可写出热化学方程式
②
由方程式(②×3-①) × 可得CO燃烧的热化学方程式
;
根据=反应物总键能-生成物总键能,键能+×-2×=,求得键能为,则使1molCO转化为相应的原子时需要的能量是;
1mol按上述方式燃烧时放出热量为kJ≈701.3 kJ,损失的热能是890kJ -701.3kJ=188.7kJ;
(2)根据盖斯定律,方程式①×2+③×2-②,可得 ==;催化剂能加快反应速率,但不影响平衡状态,实际生产中该气化反应需要加入催化剂,其主要原因是速率问题。
17. 离子键和共价键 H2O NCl3+4H2O=NH3·H2O +3HClO S=C=S H2(g)+O2(g)= H2O(g)△H=-241.8kJ/mol H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
【分析】A、B、C、D、E是四种短周期元素,A是原子半径最小的元素故为H元素;B原子M层上的电子数是原子核外电子层数的2倍故为S元素;C原子最外层电子数是次外层电子数的2倍,故为C元素;D的氢化物水溶液呈碱性,故为N元素;E元素的最高价氧化物的水化物是酸性最强的含氧酸,则为Cl元素,据此解题。
解析:(1)元素B为S,其离子结构示意图为;
(2)B的最高价氧化物的水化物为硫酸, D的气态氢化物为NH3,两者形成的盐为硫酸铵,其中含有的化学键:离子键和共价键;
(3) A2B为硫化氢,电子式表示形成过程:;硫化氢与H2O沸点更高的是水,因为水分子间有氢键;
(4)DE3常温下呈液态,可与水反应生成一种酸和一种碱,写出对应的化学方程式为NCl3+4H2O=NH3·H2O +3HClO;
(5)CB2为CS2,结构式:S=C=S;
(6)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:H2(g)+O2(g)= H2O(g)△H=-241.8kJ/mol。
(7)工业上用H2和Cl2反应制HCl,各共价键键能数据为H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol,该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g) △H=(-436+234-2×431)=-183 kJ/mol。
18.试管中镁片逐渐溶解,并有气体产生,烧杯中石灰水变浑浊 镁与稀盐酸反应是放热反应,该反应放出的热量使石灰水温度升高,Ca(OH)2的溶解度随温度的升高而减小,故变浑浊 Mg+2H+===Mg2++H2↑ 小于 烧杯中液体放出气泡的速率逐渐加快 气体的溶解度随着温度的升高而减小
解析:(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊,故此处填:试管中镁片逐渐溶解,并有气体产生,烧杯中石灰水变浑浊;
(2)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状,故此处填:镁与盐酸反应是放热反应,该反应放出的热量使石灰水温度升高,Ca(OH)2的溶解度随温度升高而减小,故变浑浊;
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl=MgCl2+H2↑,离子方程式为:Mg+2H+=Mg2++H2↑;
(4)当反应物的能量高于生成物的能量时,反应是放热反应,故MgCl2溶液和H2的总能量小于镁片和盐酸的总能量;
(5)气体的溶解度随着温度的升高而减小,换成“20℃碳酸饮料”,实验(1)中观察到的另一现象是:烧杯中液体放出气泡的速率逐渐加快;其原因是:气体的溶解度随着温度的升高而减小
一、选择题
1.关于化学反应与能量的说法正确的是
A.中和反应是吸热反应 B.燃烧属于放热反应
C.化学键断裂放出能量 D.反应物总能量与生成物总能量一定相等
2.化学家发现物质的能量变化与其反应路径无关。依据图示关系,下列说法错误的是
A.石墨燃烧是放热反应
B.
C.化学反应的,只与反应体系的始态和终态有关,与反应途径无关
D.1 mol C(石墨)和1mol CO分别在足量中燃烧,全部转化为,前者放热多
3.已知含四个碳原子的部分烃类与氢气的相对能量如图所示:
下列说法正确的是
A.断开1,3-丁二烯中的两个碳碳双键需要的能量为断开一个碳碳双键的2倍
B.反应的
C.1,3-丁二烯中的两个碳碳双键存在相互作用
D.因烯烃加氢是碳碳双键断键的过程,故是吸热反应
4.下列反应过程中的能量变化符合下图的是
①酸碱中和;②镁与盐酸的反应;③生石灰变成熟石灰的反应;④食物因缓慢氧化腐烂;⑤石灰石分解;⑥甲烷燃烧;⑦灼热的炭与二氧化碳反应
A.①②③⑤ B.④⑤⑦ C.③④⑦ D.⑤⑦
5.已知:100kPa下,1mol石墨完全燃烧生成1mol二氧化碳气体放热393.5kJ;1mol金刚石完全燃烧生成1mol二氧化碳气体放热395.4kJ,下列说法正确的是
A.金刚石比石墨稳定
B.石墨与金刚石互为同位素
C.石墨转化为金刚石是物理变化
D.100kPa下,1molCO2(g)完全分解为石墨和O2(g)吸热393.5kJ
6.下列能正确地表示燃烧热的热化学方程式是
A.
B.
C.
D.
7.标准状况下将1L纯净的在空气中完全燃烧,生成和液态水,放出39.75kJ热量,则燃烧的热化学方程式为
A.
B.
C.
D.
8.HCl(g)溶于大量水的过程放热,循环关系如图所示:下列说法不正确的是
A.,
B.若将循环图中元素改成元素,相应的
C.
D.
9.根据如图提供的信息,下列所得结论正确的是
A.该反应为吸热反应
B.该反应为放热反应
C.如果发生图示的逆反应,反应条件一定加热
D.反应物的总能量小于生成物的总能量
10.结合图关系,判断如下说法正确的是
A.
B.
C.
D.
二、填空题
11.“长征”系列火箭用偏二甲肼作燃料,四氧化二氮作氧化剂,生成氮气、水和二氧化碳气体。
(1)写出反应的化学方程式: 。
(2)该反应是 (填“放热”或“吸热”)反应,反应物的总能量 (填“大于”“小于”或“等于”)生成物的总能量,断开化学键 (填“吸收”或“放出”,下空同)的总能量小于形成化学键 的总能量。
(3)丙烷脱氢可得丙烯。
已知:
则相同条件下,丙烷脱氢得丙烯的热化学方程式为 。
12.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:
反应Ⅲ:
(1)反应Ⅱ的热化学方程式: 。
(2)用将转化为,可提高效益,减少污染。
传统上该转化通过如图所示的催化循环实现。其中,反应①为,反应②生成的反应热为,则总反应的热化学方程式为 (反应热用和表示)。
13.汽车内燃机工作时引起反应:,是导致汽车尾气中含有NO的原因之一、已知断裂某些共价键需要的能量如表:
断裂的共价键 O=O N≡N N-O
需要的能量
(1)机动车发动机工作时会引发和的反应,该反应是 (填“放热”或“吸热”)反应。
(2)与合成NO的热化学方程式可以表示为 ,则 。
(3)NO与CO反应的热化学方程式可以表示为 ,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排封。上述反应在使用“催化转化器”后,a (填“增大”“减小”或“不变”)。
(4)已知:① ;
② 。
Al和FeO发生铝热反应的热化学方程式是 。
14.(1)P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol
(2)P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 。相同状况下,能量较低的是 ;红磷的稳定性比白磷
15.(1)实验测得16 g甲醇CH3OH(l)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧的热化学方程式: 。
(2)合成氨反应N(g)+3H2(g)2NH3(g) △H=a kJ·mol-1,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中E (填“变大”“变小”或“不变”,下同),图中△H 。
②有关键能数据如下:
化学键 H—H N—H N≡N
键能(kJ mol-1) 436 391 945
试根据表中所列键能数据计算a为 。
(3)发射卫星时可用肼(N2H4)为燃料,用二氧化氯为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) △H1=a kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=b kJ·mol-1
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式: 。
16.根据要求,回答下列问题:
(1)已知甲烷的燃烧热为, 。写出CO燃烧的热化学方程式: ,若、键的键能分别为、,则使1molCO转化为相应的原子时需要的能量是 ;1mol按上述方式燃烧时损失的热能是 (保留1位小数)。
(2)煤的气化反应之一为
已知:①
②
③
则上述煤的生成的气化反应的 。实际生产中该气化反应需要加入催化剂,其主要原因是 (填“速率问题”或“平衡问题”)。
17.A、B、C、D、E是四种短周期元素,A是原子半径最小的元素;B原子M层上的电子数是原子核外电子层数的2倍;C原子最外层电子数是次外层电子数的2倍;D的氢化物水溶液呈碱性;E元素的最高价氧化物的水化物是酸性最强的含氧酸。用元素符号或化学式回答下列问题:
(1)元素B的离子结构示意图为 。
(2)B的最高价氧化物的水化物与D的气态氢化物形成的盐中含有的化学键: 。
(3)用电子式表示A2B的形成过程 。A2B与H2O沸点更高的是 。
(4)DE3常温下呈液态,可与水反应生成一种酸和一种碱,写出对应的化学方程式为 。
(5)CB2的结构式 。
(6)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
(7)工业上用H2和Cl2反应制HCl,各共价键键能数据为H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol。该反应的热化学方程式为
18.某学习小组设计以下实验,探究化学反应中的热效应,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管往其中滴加5 mL盐酸。
试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式 。
(4)由实验推知,MgCl2和H2的总能量 (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
(5)如果将本题中“25℃的饱和石灰水”换成“20℃碳酸饮料”进行实验探究,实验中观察到的另一现象是 ,其原因是 。
【参考答案】
一、选择题
1.B
解析:A.中和反应是酸和碱发生的反应,是放热反应,A错误;
B.燃烧是可燃物发生的剧烈的发光放热的反应,是放热反应,B正确;
C.断裂化学键需要吸收能量,C错误;
D.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,D错误;
故本题选B。
2.B
解析:A.从图看C(石墨)与O2变为CO2的ΔH <0,则石墨的燃烧为放热反应,A项正确;
B.由盖斯定律得ΔH+ΔH2=ΔH1得出 2C(石墨)+O2(g)=2CO(g) ΔH3=2ΔH1-2ΔH2,B项错误;
C.由盖斯定律可知,反应的焓变与路径无关,只与反应物和生成物有关,C项正确;
D.从图看石墨转变为CO2的ΔH1=-393.5kJ/mol而CO转变为CO2的ΔH2=-283kJ/mol,则前者放出的热量更多,D项正确;
故选B。
3.C
解析:A.由图表中相对能量可知,1,3-丁二烯中第一个碳碳双键和氢气加成放出能量121.1kJ/mol,1,3-丁二烯中第二个碳碳双键和氢气加成放出能量115.5kJ/mol,能量不相等,故A错误;
B.C4H6可能代表1,3-丁二烯,也可能代表1-丁炔,故不能得出反应的,故B错误;
C.1,3-丁二烯中的两个碳碳双键存在相互作用,使两个双键和氢气加成放出的能量不同,故C正确;
D.由图表中相对能量可知,烯烃加氢是放热反应,故D错误;
故选C。
4.D
解析:观察图像可知,反应物总能量小于生成物总能量,为吸热反应,题中⑤石灰石分解、⑦灼热的炭与二氧化碳反应。都属于吸热反应,其余均为放热反应,符合条件的是⑤⑦。
故答案选D。
5.D
解析:A.金刚石燃烧时放热更多,说明金刚石的能量高,则金刚石不如石墨稳定,A错误;
B.石墨与金刚石为碳元素形成的不同单质,互为同素异形体,B错误;
C.石墨而金刚石为不同物质,石墨转化为金刚石是化学变化,C错误;
D.100kPa下,1mol石墨完全燃烧生成1mol二氧化碳气体放热393.5kJ,则其逆过程吸热,即1molCO2(g)完全分解为石墨和O2(g)吸热393.5kJ,D正确;
综上所述答案为D。
6.A
解析:燃烧热是指1mol可燃物完全燃烧生成稳定化合物放出的热量,的燃烧热为,则完全燃烧生成1mol二氧化碳和2mol液态水放出的热量,所以燃烧的热化学方程式为: ,故A正确。
7.C
解析:标准状况下将1L纯净的在空气中完全燃烧,生成和液态水,放出39.75kJ热量,则1mol甲烷在空气中完全燃烧,生成和液态水,放出的热量为39.75kJ×22.4=890.4 kJ,放热反应,焓变为负值,甲烷燃烧的热化学方程式为 ,选C。
8.C
解析:A.H+(g)→H+(aq)、Cl-(g)→Cl-(aq)为放热过程,ΔH5<0,ΔH6<0,A正确;
B.Cl的非金属性强于Br,氢氯键键能大于氢溴键,断开共价键吸热,则ΔH2(Cl)>ΔH2(Br),B正确;
C.根据题干可知,HCl(g)溶于大量水过程放热,ΔH1<0,根据盖斯定律,ΔH1=,C错误;
D.氢原子失电子吸热,氯原子得电子放热,ΔH3>0,ΔH4<0,则ΔH3-ΔH4>0,D正确;
故答案选C。
9.B
解析:A.反应物的总能量高于生成物,该反应为放热反应,A错误;
B.反应物的总能量高于生成物,该反应为放热反应,B正确;
C.图示反应的逆反应为吸热反应,反应条件不一定要加热,常温下也可以进行,C错误;
D.反应物总能量在上,生成物总能量在下,反应物的总能量高于生成物,D错误;
故选B。
10.A
【分析】根据图中信息得到,。
解析:A.根据两个方程式相减得到,故A正确;
B.根据两个方程式相减再乘以2得到,故B错误;
C.减去的2倍,得到,故C错误;
D.根据C分析得到,故D错误。
综上所述,答案为A。
二、填空题
11.(1);
(2) 放热; 大于; 吸收; 放出;
(3) 。
解析:(1)结合题干材料,偏二甲肼作燃料,四氧化二氮作氧化剂,生成氮气、水和二氧化碳气体即可写出相应化学方程式。
(2)该反应通过燃料燃烧可提供飞船飞行所需能量,故该反应为放热反应,则反应物总能量大于生成物总能量;在化学反应中,断开化学键需要吸收能量,形成化学键需要放出能量。
(3)① ,② ,根据盖斯定律①-②得 。
12.(1)
(2)
解析:(1)由于反应Ⅱ是二氧化硫的催化歧化反应,且由题意可知其氧化产物和还原产物分别为和,根据得失电子守恒和元素守恒可写出反应Ⅱ的化学方程式:。根据盖斯定律,反应Ⅱ与反应Ⅲ的热化学方程式相加得,所以反应Ⅱ的热化学方程式为;
(2)根据图示写出反应②,由①+②可写出总反应的热化学方程式为。
13.(1)吸热
(2)
(3)不变
(4)
解析:(1)反应物键能之和-生成物键能之和,根据题给数据可知,+-=>0,为吸热反应;
(2)根据(1)可知,,根据盖斯定律,;
(3)催化剂只改变化学反应速率,不改变反应的反应热,所以 ,使用“催化转化器”后,a不变;
(4)① ;② ,根据盖斯定律,由②-①×3可得 。
14.P4(白磷,s)=4 P(红磷,s)ΔH=-29.2 kJ/mol 红磷 强
解析:根据盖斯定律可知,①-②×4即得到P4(白磷,s)=4P(红磷,s),所以该反应的反应热ΔH=-2983.2kJ/mol+738.5kJ/mol×4=-29.2 kJ/mol;这说明白磷的总能量高于红磷的总能量,所以红磷稳定性强于白磷的;即相同状况下,能量较低的是红磷;红磷的稳定性比白磷强;故答案为P4(白磷,s)=4P(红磷,s)ΔH=-29.2 kJ/mol;红磷;强。
15. CH3OH(l)+ O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol 变小 不变 -93 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=(2b-a) kJ/mol
【分析】(1)燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量,据此分析书写;
(2)①催化剂降低反应的活化能,但不改变焓变;②根据△H=反应物总键能-生成物总键能计算;
(3)根据盖斯定律分析解答。
解析:(1)16gCH3OH在氧气中燃烧生成CO2和液态水,放出363.25kJ热量,则32gCH3OH即1molCH3OH在氧气中燃烧生成CO2和液态水,放出726.5kJ热量,则△H=-726.5kJ/mol,则甲醇燃烧热的热化学方程式为:CH3OH(l)+O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ/mol,故答案为:CH3OH(l)+ O2(g)=CO2(g)+2H2O(l)△H=-726.5kJ/mol;
(2)①催化剂能够降低反应的活化能,加快反应速率,但不改变焓变,则加催化剂会使图中E变小,图中△H不变,故答案为:变小;不变;
②N2(g)+3H2(g) 2NH3(g)△H=反应物总键能-生成物总键能=945kJ mol-1+436kJ mol-1×3-391kJ mol-1×6=-93kJ mol-1=akJ mol-1,解得a=-93,故答案为:-93;
(3) ①N2(g)+2O2(g)=2NO2(g) △H1=a kJ·mol-1,②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=b kJ·mol-1,根据盖斯定律,将②×2-①得:2N2H4(g)-N2(g)=2N2(g)+4H2O(g)-2NO2(g) △H=2△H2-△H1,整理得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=(2b-a) kJ/mol,故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=(2b-a) kJ/mol。
16.(1) 188.7kJ
(2) 速率问题
解析:(1)题中已知①
已知甲烷的燃烧热为,可写出热化学方程式
②
由方程式(②×3-①) × 可得CO燃烧的热化学方程式
;
根据=反应物总键能-生成物总键能,键能+×-2×=,求得键能为,则使1molCO转化为相应的原子时需要的能量是;
1mol按上述方式燃烧时放出热量为kJ≈701.3 kJ,损失的热能是890kJ -701.3kJ=188.7kJ;
(2)根据盖斯定律,方程式①×2+③×2-②,可得 ==;催化剂能加快反应速率,但不影响平衡状态,实际生产中该气化反应需要加入催化剂,其主要原因是速率问题。
17. 离子键和共价键 H2O NCl3+4H2O=NH3·H2O +3HClO S=C=S H2(g)+O2(g)= H2O(g)△H=-241.8kJ/mol H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ/mol
【分析】A、B、C、D、E是四种短周期元素,A是原子半径最小的元素故为H元素;B原子M层上的电子数是原子核外电子层数的2倍故为S元素;C原子最外层电子数是次外层电子数的2倍,故为C元素;D的氢化物水溶液呈碱性,故为N元素;E元素的最高价氧化物的水化物是酸性最强的含氧酸,则为Cl元素,据此解题。
解析:(1)元素B为S,其离子结构示意图为;
(2)B的最高价氧化物的水化物为硫酸, D的气态氢化物为NH3,两者形成的盐为硫酸铵,其中含有的化学键:离子键和共价键;
(3) A2B为硫化氢,电子式表示形成过程:;硫化氢与H2O沸点更高的是水,因为水分子间有氢键;
(4)DE3常温下呈液态,可与水反应生成一种酸和一种碱,写出对应的化学方程式为NCl3+4H2O=NH3·H2O +3HClO;
(5)CB2为CS2,结构式:S=C=S;
(6)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:H2(g)+O2(g)= H2O(g)△H=-241.8kJ/mol。
(7)工业上用H2和Cl2反应制HCl,各共价键键能数据为H-H:436kJ/mol,Cl-Cl:243kJ/mol,H-Cl:431kJ/mol,该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g) △H=(-436+234-2×431)=-183 kJ/mol。
18.试管中镁片逐渐溶解,并有气体产生,烧杯中石灰水变浑浊 镁与稀盐酸反应是放热反应,该反应放出的热量使石灰水温度升高,Ca(OH)2的溶解度随温度的升高而减小,故变浑浊 Mg+2H+===Mg2++H2↑ 小于 烧杯中液体放出气泡的速率逐渐加快 气体的溶解度随着温度的升高而减小
解析:(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊,故此处填:试管中镁片逐渐溶解,并有气体产生,烧杯中石灰水变浑浊;
(2)镁与盐酸剧烈反应,产生氢气并放出大量的热,由于氢氧化钙的溶解度随温度升高而减小,所以饱和石灰水升温后析出的氢氧化钙使溶液呈浑浊状,故此处填:镁与盐酸反应是放热反应,该反应放出的热量使石灰水温度升高,Ca(OH)2的溶解度随温度升高而减小,故变浑浊;
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的化学方程式为Mg+2HCl=MgCl2+H2↑,离子方程式为:Mg+2H+=Mg2++H2↑;
(4)当反应物的能量高于生成物的能量时,反应是放热反应,故MgCl2溶液和H2的总能量小于镁片和盐酸的总能量;
(5)气体的溶解度随着温度的升高而减小,换成“20℃碳酸饮料”,实验(1)中观察到的另一现象是:烧杯中液体放出气泡的速率逐渐加快;其原因是:气体的溶解度随着温度的升高而减小
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
