1.4金属的腐蚀与防护 同步练习题(含解析)2023-2024学年高二上学期鲁科版(2019)化学选择性必修1
文档属性
| 名称 | 1.4金属的腐蚀与防护 同步练习题(含解析)2023-2024学年高二上学期鲁科版(2019)化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 802.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 11:35:03 | ||
图片预览



文档简介
1.4金属的腐蚀与防护 同步练习题
一、选择题
1.化学与生活、生产密切相关。下列说法错误的是
A.利用铝与氢氧化钠遇水反应放出大量的热及气体,疏通下水管道
B.地沟油含有害物质,不可食用,但可用来制肥皂、生物柴油
C.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
D.大力发展新能源汽车,如电动汽车,可减少氮氧化物的排放
2.下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.铅蓄电池放电时的负极和充电时的阳极均发生氧化反应
C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
D.氢氧燃料电池正极消耗气体时,电路中通过的电子数为个
3.某浓差电池的装置如图所示,该电池使用前先将K与M连接一段时间,K再与N连接,当正负电极室中溶液的浓度相等时,电池将停止放电。下列说法错误的是
A.K与M连接时,当电路中转移0.1mol电子时,乙室溶液质量减少17g
B.K与N连接时,甲室的电极反应式为
C.若换成阳离子交换膜,电池将不能正常使用
D.K分别与M、N连接时,在电解质溶液中的移动方向相反
4.化学与生产、生活密切相关,下列叙述错误的是
A.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
B.煤经过气化和液化两个化学变化,可变为清洁能源
C.工业生产玻璃、水泥和陶瓷,均需用石灰石作原料
D.聚合硫酸铁是新型絮凝剂,可用来处理水中的悬浮物
5.古老的铁桥,经常每隔一段时间就要刷一遍油漆,但仍看到有锈迹。下列说法中合理的是
A.油漆只起美观作用,而与腐蚀无关
B.铁桥生锈主要是铁和空气中的氧气发生了化学腐蚀
C.铁桥生锈主要是铁与空气中的O2、H2O等发生电化学腐蚀
D.铁桥腐蚀与外界环境无关,只由金属内部结构决定
6.锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)。下列说法正确的是
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+2OH– 2e–=Zn(OH)2
D.放电时,电路中通过4mol电子,消耗氧气22.4L(标准状况)
7.海水是一种腐蚀性很强的天然电解质溶液沿垂直方向,海洋环境可分为海洋大气区、浪花飞溅区、海水潮差区、海水全浸区和海泥区。其中海水全浸区根据海水位置分为深海区和浅海区。根据钢铁桥梁在海洋区域建设的位置,下列说法错误的是
A.热带地区桥梁比寒带海域桥梁腐蚀更严重
B.海泥区含氧量非常低,腐蚀速率一般高于海水全浸区
C.浅海区溶氧量较高,存在着大量的微生物,钢铁在浅海区主要发生电化学腐蚀
D.在浪花飞溅区,海水的冲击不断破坏桥梁表面的腐蚀产物和保护涂层,所以浪花飞溅区桥梁腐蚀最严重
8.利用催化剂和电化学装置还原氮气的一种原理如图所示。下列相关说法错误的是
A.B电极反应式为
B.经过质子交换膜移向A电极
C.在催化剂表面转化为的反应为氧化反应
D.生成理论上可还原(标准状况)
9.下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
10.“夏禹铸九鼎,天下分九州”。青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。其表面铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是
A.青铜器中锡、铅对铜有保护作用
B.Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类
C.可用NH4Cl溶液浸泡青铜器来清洗铜锈
D.博物馆中贵重青铜器常放在银质托盘上进行展示
二、填空题
11.图中甲池的总反应式为N2H4+O2=N2+2H2O。
(1)甲池是 (填“原电池”或“电解池”),其发生氧化反应的电极上的电极反应式为 。
(2)乙池中石墨电极是 (填“正极”或“负极”或“阴极”或“阳极”),其电极反应式为 。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的 。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若加入9.8g的Cu(OH)2乙池能恢复到电解前的状态,则理论上甲池消耗标况下氧气的体积是 L。
(5)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为 g。
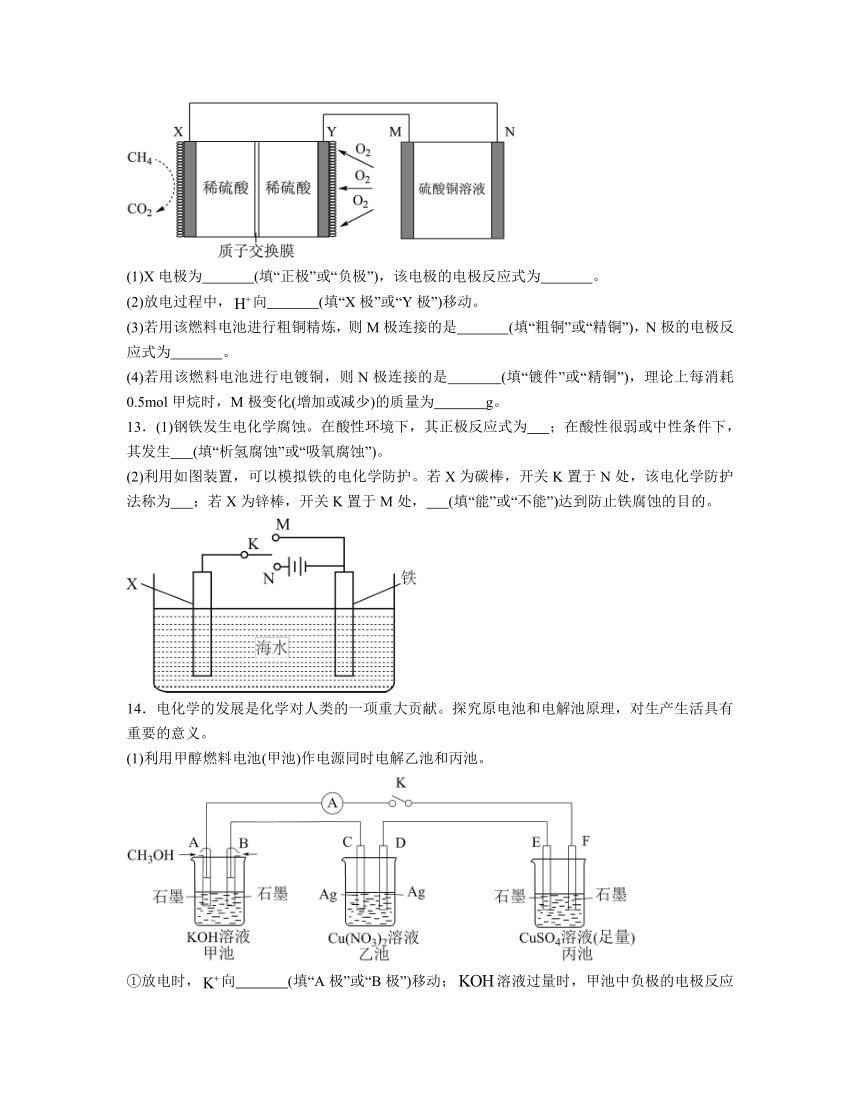
12.一种甲烷燃料电池的工作原理如图所示。
(1)X电极为 (填“正极”或“负极”),该电极的电极反应式为 。
(2)放电过程中,向 (填“X极”或“Y极”)移动。
(3)若用该燃料电池进行粗铜精炼,则M极连接的是 (填“粗铜”或“精铜”),N极的电极反应式为 。
(4)若用该燃料电池进行电镀铜,则N极连接的是 (填“镀件”或“精铜”),理论上每消耗0.5mol甲烷时,M极变化(增加或减少)的质量为 g。
13.(1)钢铁发生电化学腐蚀。在酸性环境下,其正极反应式为 ;在酸性很弱或中性条件下,其发生 (填“析氢腐蚀”或“吸氧腐蚀”)。
(2)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,开关K置于N处,该电化学防护法称为 ;若X为锌棒,开关K置于M处, (填“能”或“不能”)达到防止铁腐蚀的目的。
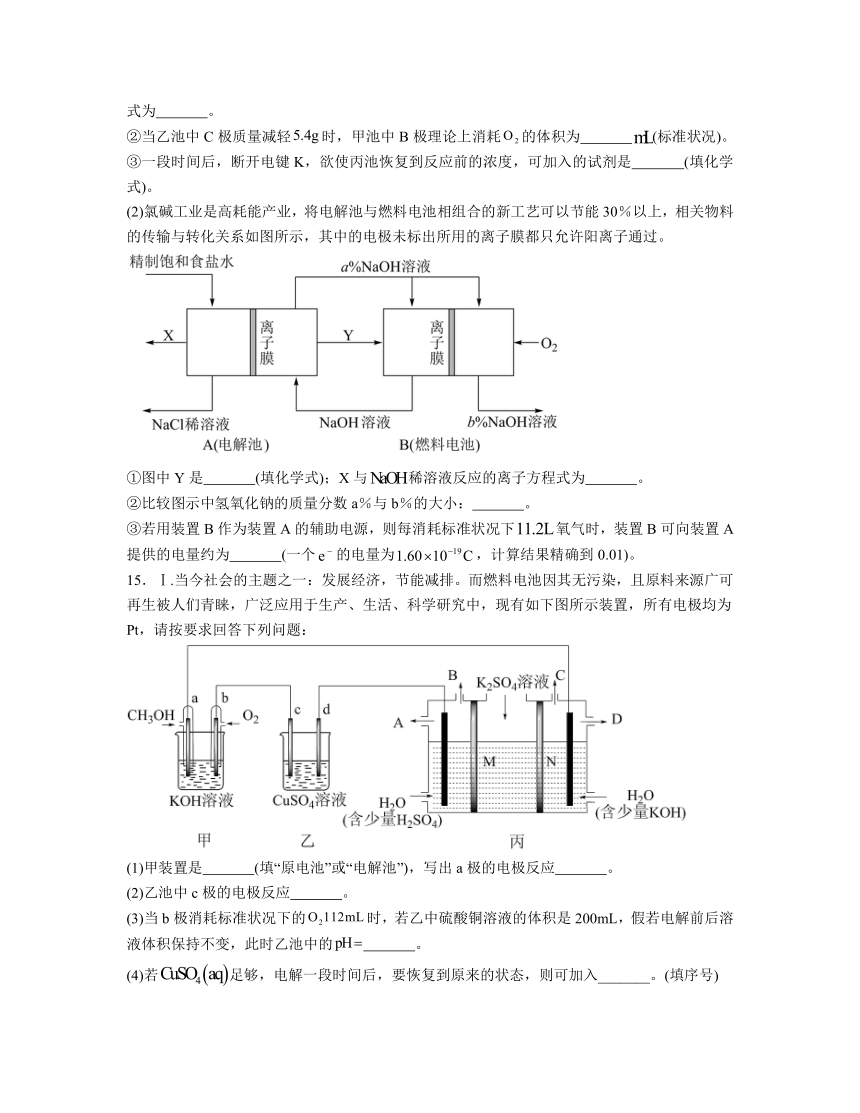
14.电化学的发展是化学对人类的一项重大贡献。探究原电池和电解池原理,对生产生活具有重要的意义。
(1)利用甲醇燃料电池(甲池)作电源同时电解乙池和丙池。
①放电时,向 (填“A极”或“B极”)移动;溶液过量时,甲池中负极的电极反应式为 。
②当乙池中C极质量减轻时,甲池中B极理论上消耗的体积为 (标准状况)。
③一段时间后,断开电键K,欲使丙池恢复到反应前的浓度,可加入的试剂是 (填化学式)。
(2)氯碱工业是高耗能产业,将电解池与燃料电池相组合的新工艺可以节能30%以上,相关物料的传输与转化关系如图所示,其中的电极未标出所用的离子膜都只允许阳离子通过。
①图中Y是 (填化学式);X与稀溶液反应的离子方程式为 。
②比较图示中氢氧化钠的质量分数a%与b%的大小: 。
③若用装置B作为装置A的辅助电源,则每消耗标准状况下氧气时,装置B可向装置A提供的电量约为 (一个的电量为,计算结果精确到0.01)。
15.Ⅰ.当今社会的主题之一:发展经济,节能减排。而燃料电池因其无污染,且原料来源广可再生被人们青睐,广泛应用于生产、生活、科学研究中,现有如下图所示装置,所有电极均为Pt,请按要求回答下列问题:
(1)甲装置是 (填“原电池”或“电解池”),写出a极的电极反应 。
(2)乙池中c极的电极反应 。
(3)当b极消耗标准状况下的时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的 。
(4)若足够,电解一段时间后,要恢复到原来的状态,则可加入_______。(填序号)
A. B. C. D.
(5)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为 (写化学式),M为 离子交换膜(填“阴”或“阳”)。
Ⅱ.下图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。
(6)环境中的扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈,其离子方程式为 。
(7)若生成,则理论上耗氧体积为 L(标准状况)。
16.某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 分别进行的操作 现象
Ⅰ. 连好装置一段时间后,向烧杯中滴加酚酞 _______
Ⅱ. 连好装置一段时间后,向烧杯中滴加 K3[Fe(CN)]6溶液 铁片表面产生蓝色沉淀
(1)小组同学认为以上两种检验方法,均能证明铁发生了 。 (哪种电化学腐蚀)
①实验Ⅰ中的现象是 。
②用电极反应解释实验Ⅰ中的现象: 。
③用离子方程式解释铁片产生蓝色沉淀原因: 。
(2)查阅资料:K3[Fe(CN)]6具有氧化性。
①据此有同学认为仅通过Ⅱ中现象不能证明铁发生了电化学腐蚀,理由是 。
②进行下列实验,在实验几分钟后的记录如下:
实验 试管中的溶液 现象
滴入K3[Fe(CN)6] Ⅲ. 蒸馏水 无明显变化
Ⅳ. 1mol/L NaCl 铁片表面产生大量蓝色沉淀
Ⅴ.0.5mol/L Na2SO4 无明显变化
a.以上实验表明:在 条件下, K3[Fe(CN)]6溶液可以与铁片发生反应。
b.为探究阴离子的存在对此反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明氯离子的作用是 。
【参考答案】
一、选择题
1.C
解析:A.2Al+2NaOH+2H2O=2NaAlO2+3H2,利用铝与氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通,A正确;
B.地沟油其主要成分是油脂,但不能食用,处理后可以用于制肥皂、生物柴油,B正确;
C.铁比锡活泼,当镀锡铁制品的镀层破损时,会形成铁作负极、锡作正极的原电池,从而加快对铁制品腐蚀,则镀层不能对铁制品起保护作用,C错误;
D.大力发展新能源汽车,如电动汽车,可减少氮氧化物的排放,符合可持续发展宗旨,D正确;
故选C。
2.B
解析:A.若在海轮外壳上附着一些铜块,铁、铜、海水构成原电池,铁的活泼性大于铜,铁是负极,铁被腐蚀,加快海轮外壳的腐蚀,故A错误;
B.铅蓄电池放电时的负极和充电时的阳极均发生氧化反应,故B正确;
C.电解法精炼铜时,以粗铜作阳极、纯铜作阴极,硫酸铜溶液作电解质溶液,故C错误;
D.氢氧燃料电池,正极氧气得电子,没有明确是否为标准状况,5.6L氧气的物质的量不一定是0.25mol,电路中通过的电子数不一定为个,故D错误;
选B。
3.B
【分析】浓度差电池是利用两极电势差实现两个氧化还原半反应,总反应类似扩散原理,最终两池电解质浓度将相等。该电池使用前先将K与M连接一段时间,开关与M相连时,为电解池,左侧甲室内Ag电极为阳极,右侧乙室内Ag电极为阴极,阳极上Ag失去电子转化为Ag+,阴极上Ag+得到电子转化为Ag,硝酸根透过阴离子交换膜向阳极移动进入左侧,一段时间后,两池中浓度不同;然后将K与N相连,装置为原电池,左侧甲室内硝酸银溶液浓度大,银离子氧化性强,则银离子得电子发生还原反应,左侧甲室内Ag电极为正极,则右侧乙室Ag电极为负极,硝酸根向负极移动进入乙室,据此回答;
解析:A. 据分析,K与M连接时,右侧乙室内、硝酸根迁出,当转移1mol电子时,乙室溶液质量减少(108+62)g=170g,则当电路中转移0.1mol电子时,乙室溶液质量减少17g,A正确;
B.K与N连接时为原电池,甲室为正极区,电极反应式为,B不正确;
C.若换成阳离子交换膜,若有1mol电子转移,阳极1mol Ag溶解、阴极析出1mol Ag,1mol Ag+透过阳离子交换膜进入乙室,则两池中Ag+浓度将相同,开关与N相连时,不会产生电流、将不能正常使用,因此应该选择阴离子交换膜电池,C正确;
D.据分析,K分别与M、N连接时,在电解质溶液中的移动方向相反,D正确;
答案选B。
4.C
解析:A.热水器内胆成分为不锈钢,连接镁棒形成原电池,Mg比Fe活泼作负极被腐蚀,而铁被保护,即牺牲阳极的阴极保护法,故A正确;
B.煤的气化是将煤转化为可燃性气体的过程;煤的液化是将煤转化为甲醇等液体燃料的过程,所以煤经过气化和液化两个化学变化,可变为清洁能源,故B正确;
C.陶瓷的生产原料为黏土,未用到石灰石,故C错误;
D.聚合硫酸铁溶于水可形成Fe(OH)3胶体,吸附水中悬浮的杂质,故D正确;
答案选:C。
5.C
解析:A.铁器表面的油漆可以阻止氧气和铁器接触,起到防护作用,A错误;
B.铁桥生锈主要是因为钢铁在潮湿空气中形成了Fe、C为电极,CO2溶于水形成的电解质溶液的原电池,发生了吸氧腐蚀,故生锈主要是发生了电化学腐蚀,B错误;
C.铁与空气中的O2、H2O等发生了吸氧腐蚀,属于电化学腐蚀,C正确;
D.铁桥生锈主要是因为钢铁在潮湿空气中形成原电池,发生了吸氧腐蚀,与外界环境有关,D错误;
答案选C。
6.D
解析:A.充电时,电解池“异性相吸”,则电解质溶液中K+向阴极移动,故A错误;
B.充电时,2Zn(OH) =2Zn+O2+4OH–+2H2O,则电解质溶液中c(OH–)逐渐增大,故B错误;
C.放电时,负极反应为:Zn+4OH– 2e–= Zn(OH),故C错误;
D.放电时,正极反应式为:O2+4e–+2H2O=4OH–,电路中通过4mol电子,消耗氧气1mol即体积为22.4L(标准状况),故D正确。
综上所述,答案为D。
7.B
解析:A.热带地区桥梁比寒带海域的温度高,反应速率更快,桥梁腐蚀更严重,故A正确;
B.铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快,海泥区含氧量非常低,腐蚀速率一般低于海水全浸区,故B错误;
C.浅海区溶氧量较高,钢铁在浅海区主要发生吸氧腐蚀,故C正确;
D.在浪花飞溅区,海水的冲击不断破坏桥梁表面的腐蚀产物和保护涂层,使铁不断与氧气和水接触反应,所以浪花飞溅区桥梁腐蚀最严重,故D正确;
故选:B。
8.D
【分析】根据图示分析可知H2O在B电极失电子发生氧化反应生成氧气,B为电解池阳极,连接电源的正极,A电极为电解池阴极,连接电源负极,以此解答。
解析:A.B为电解池阳极,H2O在B电极失电子发生氧化反应生成氧气,电极方程式为:,故A正确;
B.由分析可知A电极为电解池阴极,B为电解池阳极,根据离子迁移规律氢离子由阳极移向阴极,即由B电极经过质子交换膜移向A电极,B正确;
C.A电极为电解池阴极,电解液中POM1得电子转化为POM2的过程为还原反应,则在催化剂表面转化为的反应为氧化反应,C正确;
D.B电极反应式为,生成转移4mol电子,N2转化为NH的过程中N元素由0价下降到-3价,当转移4mol电子时可还原,标准状况下的体积为=14.9L,D错误;
故选D。
9.D
解析:A.氯碱工业上,用惰性电极电解饱和氯化钠溶液,阴极附近得到氢氧化钠,由图示知,Y极连接电源负极作电解池的阴极,故Y附近能得到氢氧化钠,A错误;
B.铜的精炼中,粗铜作阳极X,纯铜作阴极Y,硫酸铜溶液作电解质溶液,B错误;
C.电镀工业上,阴极Y是待镀金属,阳极X是镀层金属,C错误;
D.被保护金属对应的电极上应该发生还原反应,若为外加电流的阴极保护法,被保护金属应该作阴极,即Y极,D正确;
故答案选D。
10.D
解析:A.锡、铅的金属性比铜强,在形成原电池时,作原电池的负极,能阻止铜失电子,从而保护青铜器中的铜,A正确;
B.Cu2(OH)3Cl和Cu2(OH)2CO3中都含有Cu2+和Cl-或CO,二者都属于盐类,B正确;
C.NH4Cl在溶液中能发生水解而使溶液显酸性,浸泡青铜器能清洗青铜器的铜锈,C正确;
D. 青铜器常放在银质托盘上,可以形成原电池,青铜器作原电池的负极,从而会加快青铜器的腐蚀,D错误;
故选:D。
二、填空题
11.(1) 原电池 N2H4-4e-+4OH-=N2+4H2O
(2)阳极 2H2O-4e-=4H++O2↑
(3)AC
(4)2.24
(5)12.8
【分析】甲池是燃料电池,通N2H4一极为负极,通O2一极为正极,乙池是电解池,石墨为阳极,Fe为阴极。
解析:(1)甲池是燃料电池,通N2H4一极为负极,发生氧化反应,电极反应式N2H4-4e-+4OH-=N2+4H2O,故为:原电池;N2H4-4e-+4OH-=N2+4H2O;
(2)乙池是电解池,石墨为阳极,Fe为阴极,在阳极是水电离出的OH-放电,其电极反应式2H2O-4e-=4H++O2↑;故为:阳极;2H2O-4e-=4H++O2↑;
(3)乙池中的电解方程式2CuSO4+2H2O2Cu+ O2↑+2H2SO4,所以使乙池恢复到电解前的状态,CuO+H2SO4= CuSO4+H2O或CuCO3+H2SO4= CuSO4+H2O+CO2↑,应向溶液中加入适量的CuO或CuCO3,故为:AC;
(4)若加入9.8g的Cu(OH)2乙池能恢复到电解前的状态,9.8g的Cu(OH)2为0.1mol,根据电极反应及原子守恒,可知乙池电解时,阴极析出Cu0.1mol、0.1molH2,阳极析出0.1molO2,电解时转移电子0.4mol,根据得失电子守恒,则理论上甲池正极消耗O2为0.1mol,标况下氧气的体积是2.24L,故为:2.24L;
(5)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,则Cu做阳极,Fe做阴极,当甲中消耗1.6gN2H4时,即0.05mol N2H4失去电子0.2mol,则电镀池中阳极消耗Cu0.1mol,质量减轻为6.4g,阴极质量增加6.4g,所以乙池中两个电极质量差为12.8g。故为:12.8g。
12.(1) 负极
(2)Y极
(3)粗铜
(4)镀件 128
【分析】如图,左侧装置为甲烷燃料电池,有氧气参与的一极为正极,即Y极为正极,酸性电解质,电极反应式为,则X极为负极,电极反应式为,右边装置为电解池,电极M与原电池正极相连做阳极;N极为阴极;
解析:(1)综上所述,X极为负极,电极反应式为;
故答案为:负极;;
(2)在原电池中,阴阳离子移动方向为:阳离子向正极移动,阴离子向负极移动;所以放电过程中,向Y极移动;
故答案为:Y极;
(3)粗铜精炼时,粗铜连接电源正极,做阳极,精铜作阴极,若用该燃料电池进行粗铜精炼,M极与电池正极相连,做阳极,则M极连接的是粗铜,N极为阴极,电极反应式为;
故答案为:粗铜;;
(4)电镀时,镀件作阴极,镀层金属作阳极,如图所示的装置中,N极为阴极,连接镀件,M极为阳极,连接精铜,失电子,质量减少,电极反应式为,根据电极反应式、,可的关系式,理论上每消耗0.5mol甲烷时,M极减少的质量为128g;
故答案为:镀件;128。
13.2H++2e-=H2↑ 吸氧腐蚀 外加电流的阴极保护法 能
解析:(1)钢铁在酸性环境中发生析氢腐蚀,其正极反应式为:2H++2e =H2↑,钢铁在空气酸度不大的环境中,形成原电池发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应,负极上电极反应式为:2Fe 4e ═2Fe2+,正极上电极反应式为:O2+2H2O+4e ═4OH ;
(2)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处,该电化学防护法称为外加电流的阴极保护法,若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法。
14.(1)B极 280 CuO或
(2) b%>a%
【分析】甲醇燃料电池(甲池),A为负极,B为正极,C、E为阳极,D、F为阴极。
A为电解池,电解饱和食盐水生成氢气、氯气和氢氧化钠溶液,B为氢氧燃料电池。
解析:(1)①甲醇燃料电池(甲池),放电时,根据“同性相吸”,则向正极即B极移动;溶液过量时,甲池中负极是甲醇变为碳酸根,其电极反应式为;故答案为:B极;。
②当乙池中C极质量减轻时,物质的量为0.05mol,转移0.05mol电子,则甲池中B极理论上消耗物质的量为0.0125mol,其标准状况的体积为0.0125mol ×22.4L mol 1 ×1000mL L 1=280mL;故答案为:280。
③一段时间后,断开电键K,丙池阳极得到氧气,阴极得到铜单质,溶液不断变为硫酸,欲使丙池恢复到反应前的浓度,可加入的试剂是CuO或;故答案为:CuO或。
(2)①电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,B为燃料电池,则Y为氢气,B形成氢氧燃料电池,因此图中Y是;X(氯气)与稀溶液反应的离子方程式为;故答案为:;。
②B为氢氧燃料电池,电解质溶液为氢氧化钠溶液,负极是氢气失去电子和氢氧根结合生成水,正极是氧气得到电子和水反应生成氢氧根,因此图示中氢氧化钠的质量分数a%与b%的大小:b%>a%;故答案为:b%>a%。
③若用装置B作为装置A的辅助电源,则每消耗标准状况下氧气(物质的量为0.5mol)时,转移2mol电子,则装置B可向装置A提供的电量约为2mol ×NAmol 1 ×=;故答案为:。
15.(1) 原电池 CH3OH+ 8OH- -6e- = CO+ 6H2O
(2)2H2O- 4e-= O2↑+4H+
(3)1
(4)AC
(5)H2SO4 阴
(6)2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
(7)0.448
【分析】Ⅰ.由图中可知,甲装置为原电池,甲醇在负极发生失电子的氧化反应,所以a是原电池负极,氧气在正极发生得电子的还原反应,则b是原电池正极,根据连接方式可知,乙丙装置为电解池,c为阳极,d为阴极,B为阳极,C为阴极,据此结合原电池、电解池原理分析解答。
解析:(1)甲装置是原电池,a是原电池负极,其电极反应为CH3OH+ 8OH- -6e- = CO+ 6H2O;
(2)乙池为电解池,c极是阳极,其电极反应为2 H2O- 4e-= O2↑+4H+;
(3)由图分析可知O2~4e- ~4H+则 c(H+)= = 0.1mol/L,则溶液的pH=1;
(4)乙池只发生反应2CuSO4+2H2O 2Cu+O2↑+2H2SO4,损失的是铜与氧元素,所以要恢复到原来的状态只需要加入铜与氧元素即可,则上述物质中,AC符合题意;
(5)丙装置的左室消耗的是水电离的OH-,左室与电源的正极相连为电解池的阳极,SO42-向左室定向移动,所以A出口的产品是H2SO4,M是阴离子交换膜;
(6)Cl 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,则该离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(7)n[Cu2(OH)3Cl]=,根据转移电子得n(O2)=,V(O2)=0.02mol×22.4L/mol=0.448L。
16.(1)吸氧腐蚀 碳电极附近变红 O2+4e- +2H2O =4OH- 3Fe2+ +2 [Fe(CN)6]3-= Fe3[Fe(CN)6]2↓
(2) K3[Fe(CN)6]可能氧化Fe生成Fe2+ 会干扰电化学腐蚀生成Fe2+的检验 Cl-的存在 破坏铁片表面的氧化膜
解析:实验中连好装置,铁片为负极,电极反应为Fe-2e-=Fe2+,碳棒为正极,由于电解质溶液呈中性,则碳棒上的电极反应为O2+4e-+2H2O=4OH-,一段时间后,向烧杯中滴加酚酞,碳棒附近溶液变红,证明铁发生了吸氧腐蚀;据此回答。
(1)以上装置构成了原电池,由电化学原理引起的腐蚀为电化学腐蚀,由于电解质溶液是食盐水,正极是溶解氧得电子被还原的反应,则铁发生了吸氧腐蚀。
①正极反应为溶解氧得电子被还原的反应,生成的氢氧根离子使酚酞变红,则实验Ⅰ中的现象是:碳电极附近变红。
②实验Ⅰ中正极反应为:。
③负极为铁失去电子被氧化:Fe-2e-=Fe2+, Fe2+ 与[Fe(CN)6]3-反应生成蓝色沉淀Fe3[Fe(CN)6]2,离子方程式为:3Fe2+ +2 [Fe(CN)6]3-= Fe3[Fe(CN)6]2↓。
(2)①根据资料“K3[Fe(CN)6]具有氧化性”,故实验Ⅱ中铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,产生的Fe2+再与K3[Fe(CN)6]反应生成蓝色沉淀,干扰对电化学腐蚀生成的Fe2+的检验。
②a.根据实验Ⅲ知,只有水时K3[Fe(CN)6]溶液和铁片不反应;再对比实验Ⅳ和Ⅴ,阳离子相同、阴离子不同,结合实验现象知,在Cl-存在条件下,K3[Fe(CN)6]溶液可以和铁片发生反应。
b.为探究阴离子的存在对此反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验Ⅲ,发现铁片表面产生蓝色沉淀。稀硫酸“酸洗”的目的是除去铁表面的氧化膜,由此补充实验、结合实验Ⅳ说明,Cl-的作用是:破坏了铁表面的氧化膜
一、选择题
1.化学与生活、生产密切相关。下列说法错误的是
A.利用铝与氢氧化钠遇水反应放出大量的热及气体,疏通下水管道
B.地沟油含有害物质,不可食用,但可用来制肥皂、生物柴油
C.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
D.大力发展新能源汽车,如电动汽车,可减少氮氧化物的排放
2.下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.铅蓄电池放电时的负极和充电时的阳极均发生氧化反应
C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
D.氢氧燃料电池正极消耗气体时,电路中通过的电子数为个
3.某浓差电池的装置如图所示,该电池使用前先将K与M连接一段时间,K再与N连接,当正负电极室中溶液的浓度相等时,电池将停止放电。下列说法错误的是
A.K与M连接时,当电路中转移0.1mol电子时,乙室溶液质量减少17g
B.K与N连接时,甲室的电极反应式为
C.若换成阳离子交换膜,电池将不能正常使用
D.K分别与M、N连接时,在电解质溶液中的移动方向相反
4.化学与生产、生活密切相关,下列叙述错误的是
A.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
B.煤经过气化和液化两个化学变化,可变为清洁能源
C.工业生产玻璃、水泥和陶瓷,均需用石灰石作原料
D.聚合硫酸铁是新型絮凝剂,可用来处理水中的悬浮物
5.古老的铁桥,经常每隔一段时间就要刷一遍油漆,但仍看到有锈迹。下列说法中合理的是
A.油漆只起美观作用,而与腐蚀无关
B.铁桥生锈主要是铁和空气中的氧气发生了化学腐蚀
C.铁桥生锈主要是铁与空气中的O2、H2O等发生电化学腐蚀
D.铁桥腐蚀与外界环境无关,只由金属内部结构决定
6.锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)。下列说法正确的是
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+2OH– 2e–=Zn(OH)2
D.放电时,电路中通过4mol电子,消耗氧气22.4L(标准状况)
7.海水是一种腐蚀性很强的天然电解质溶液沿垂直方向,海洋环境可分为海洋大气区、浪花飞溅区、海水潮差区、海水全浸区和海泥区。其中海水全浸区根据海水位置分为深海区和浅海区。根据钢铁桥梁在海洋区域建设的位置,下列说法错误的是
A.热带地区桥梁比寒带海域桥梁腐蚀更严重
B.海泥区含氧量非常低,腐蚀速率一般高于海水全浸区
C.浅海区溶氧量较高,存在着大量的微生物,钢铁在浅海区主要发生电化学腐蚀
D.在浪花飞溅区,海水的冲击不断破坏桥梁表面的腐蚀产物和保护涂层,所以浪花飞溅区桥梁腐蚀最严重
8.利用催化剂和电化学装置还原氮气的一种原理如图所示。下列相关说法错误的是
A.B电极反应式为
B.经过质子交换膜移向A电极
C.在催化剂表面转化为的反应为氧化反应
D.生成理论上可还原(标准状况)
9.下列说法中正确的是
A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.电镀工业中,X是待镀金属,Y是镀层金属
D.外加电流的阴极保护法中,Y是待保护金属
10.“夏禹铸九鼎,天下分九州”。青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。其表面铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是
A.青铜器中锡、铅对铜有保护作用
B.Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类
C.可用NH4Cl溶液浸泡青铜器来清洗铜锈
D.博物馆中贵重青铜器常放在银质托盘上进行展示
二、填空题
11.图中甲池的总反应式为N2H4+O2=N2+2H2O。
(1)甲池是 (填“原电池”或“电解池”),其发生氧化反应的电极上的电极反应式为 。
(2)乙池中石墨电极是 (填“正极”或“负极”或“阴极”或“阳极”),其电极反应式为 。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的 。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若加入9.8g的Cu(OH)2乙池能恢复到电解前的状态,则理论上甲池消耗标况下氧气的体积是 L。
(5)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为 g。
12.一种甲烷燃料电池的工作原理如图所示。
(1)X电极为 (填“正极”或“负极”),该电极的电极反应式为 。
(2)放电过程中,向 (填“X极”或“Y极”)移动。
(3)若用该燃料电池进行粗铜精炼,则M极连接的是 (填“粗铜”或“精铜”),N极的电极反应式为 。
(4)若用该燃料电池进行电镀铜,则N极连接的是 (填“镀件”或“精铜”),理论上每消耗0.5mol甲烷时,M极变化(增加或减少)的质量为 g。
13.(1)钢铁发生电化学腐蚀。在酸性环境下,其正极反应式为 ;在酸性很弱或中性条件下,其发生 (填“析氢腐蚀”或“吸氧腐蚀”)。
(2)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,开关K置于N处,该电化学防护法称为 ;若X为锌棒,开关K置于M处, (填“能”或“不能”)达到防止铁腐蚀的目的。
14.电化学的发展是化学对人类的一项重大贡献。探究原电池和电解池原理,对生产生活具有重要的意义。
(1)利用甲醇燃料电池(甲池)作电源同时电解乙池和丙池。
①放电时,向 (填“A极”或“B极”)移动;溶液过量时,甲池中负极的电极反应式为 。
②当乙池中C极质量减轻时,甲池中B极理论上消耗的体积为 (标准状况)。
③一段时间后,断开电键K,欲使丙池恢复到反应前的浓度,可加入的试剂是 (填化学式)。
(2)氯碱工业是高耗能产业,将电解池与燃料电池相组合的新工艺可以节能30%以上,相关物料的传输与转化关系如图所示,其中的电极未标出所用的离子膜都只允许阳离子通过。
①图中Y是 (填化学式);X与稀溶液反应的离子方程式为 。
②比较图示中氢氧化钠的质量分数a%与b%的大小: 。
③若用装置B作为装置A的辅助电源,则每消耗标准状况下氧气时,装置B可向装置A提供的电量约为 (一个的电量为,计算结果精确到0.01)。
15.Ⅰ.当今社会的主题之一:发展经济,节能减排。而燃料电池因其无污染,且原料来源广可再生被人们青睐,广泛应用于生产、生活、科学研究中,现有如下图所示装置,所有电极均为Pt,请按要求回答下列问题:
(1)甲装置是 (填“原电池”或“电解池”),写出a极的电极反应 。
(2)乙池中c极的电极反应 。
(3)当b极消耗标准状况下的时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的 。
(4)若足够,电解一段时间后,要恢复到原来的状态,则可加入_______。(填序号)
A. B. C. D.
(5)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为 (写化学式),M为 离子交换膜(填“阴”或“阳”)。
Ⅱ.下图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。
(6)环境中的扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈,其离子方程式为 。
(7)若生成,则理论上耗氧体积为 L(标准状况)。
16.某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 分别进行的操作 现象
Ⅰ. 连好装置一段时间后,向烧杯中滴加酚酞 _______
Ⅱ. 连好装置一段时间后,向烧杯中滴加 K3[Fe(CN)]6溶液 铁片表面产生蓝色沉淀
(1)小组同学认为以上两种检验方法,均能证明铁发生了 。 (哪种电化学腐蚀)
①实验Ⅰ中的现象是 。
②用电极反应解释实验Ⅰ中的现象: 。
③用离子方程式解释铁片产生蓝色沉淀原因: 。
(2)查阅资料:K3[Fe(CN)]6具有氧化性。
①据此有同学认为仅通过Ⅱ中现象不能证明铁发生了电化学腐蚀,理由是 。
②进行下列实验,在实验几分钟后的记录如下:
实验 试管中的溶液 现象
滴入K3[Fe(CN)6] Ⅲ. 蒸馏水 无明显变化
Ⅳ. 1mol/L NaCl 铁片表面产生大量蓝色沉淀
Ⅴ.0.5mol/L Na2SO4 无明显变化
a.以上实验表明:在 条件下, K3[Fe(CN)]6溶液可以与铁片发生反应。
b.为探究阴离子的存在对此反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明氯离子的作用是 。
【参考答案】
一、选择题
1.C
解析:A.2Al+2NaOH+2H2O=2NaAlO2+3H2,利用铝与氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通,A正确;
B.地沟油其主要成分是油脂,但不能食用,处理后可以用于制肥皂、生物柴油,B正确;
C.铁比锡活泼,当镀锡铁制品的镀层破损时,会形成铁作负极、锡作正极的原电池,从而加快对铁制品腐蚀,则镀层不能对铁制品起保护作用,C错误;
D.大力发展新能源汽车,如电动汽车,可减少氮氧化物的排放,符合可持续发展宗旨,D正确;
故选C。
2.B
解析:A.若在海轮外壳上附着一些铜块,铁、铜、海水构成原电池,铁的活泼性大于铜,铁是负极,铁被腐蚀,加快海轮外壳的腐蚀,故A错误;
B.铅蓄电池放电时的负极和充电时的阳极均发生氧化反应,故B正确;
C.电解法精炼铜时,以粗铜作阳极、纯铜作阴极,硫酸铜溶液作电解质溶液,故C错误;
D.氢氧燃料电池,正极氧气得电子,没有明确是否为标准状况,5.6L氧气的物质的量不一定是0.25mol,电路中通过的电子数不一定为个,故D错误;
选B。
3.B
【分析】浓度差电池是利用两极电势差实现两个氧化还原半反应,总反应类似扩散原理,最终两池电解质浓度将相等。该电池使用前先将K与M连接一段时间,开关与M相连时,为电解池,左侧甲室内Ag电极为阳极,右侧乙室内Ag电极为阴极,阳极上Ag失去电子转化为Ag+,阴极上Ag+得到电子转化为Ag,硝酸根透过阴离子交换膜向阳极移动进入左侧,一段时间后,两池中浓度不同;然后将K与N相连,装置为原电池,左侧甲室内硝酸银溶液浓度大,银离子氧化性强,则银离子得电子发生还原反应,左侧甲室内Ag电极为正极,则右侧乙室Ag电极为负极,硝酸根向负极移动进入乙室,据此回答;
解析:A. 据分析,K与M连接时,右侧乙室内、硝酸根迁出,当转移1mol电子时,乙室溶液质量减少(108+62)g=170g,则当电路中转移0.1mol电子时,乙室溶液质量减少17g,A正确;
B.K与N连接时为原电池,甲室为正极区,电极反应式为,B不正确;
C.若换成阳离子交换膜,若有1mol电子转移,阳极1mol Ag溶解、阴极析出1mol Ag,1mol Ag+透过阳离子交换膜进入乙室,则两池中Ag+浓度将相同,开关与N相连时,不会产生电流、将不能正常使用,因此应该选择阴离子交换膜电池,C正确;
D.据分析,K分别与M、N连接时,在电解质溶液中的移动方向相反,D正确;
答案选B。
4.C
解析:A.热水器内胆成分为不锈钢,连接镁棒形成原电池,Mg比Fe活泼作负极被腐蚀,而铁被保护,即牺牲阳极的阴极保护法,故A正确;
B.煤的气化是将煤转化为可燃性气体的过程;煤的液化是将煤转化为甲醇等液体燃料的过程,所以煤经过气化和液化两个化学变化,可变为清洁能源,故B正确;
C.陶瓷的生产原料为黏土,未用到石灰石,故C错误;
D.聚合硫酸铁溶于水可形成Fe(OH)3胶体,吸附水中悬浮的杂质,故D正确;
答案选:C。
5.C
解析:A.铁器表面的油漆可以阻止氧气和铁器接触,起到防护作用,A错误;
B.铁桥生锈主要是因为钢铁在潮湿空气中形成了Fe、C为电极,CO2溶于水形成的电解质溶液的原电池,发生了吸氧腐蚀,故生锈主要是发生了电化学腐蚀,B错误;
C.铁与空气中的O2、H2O等发生了吸氧腐蚀,属于电化学腐蚀,C正确;
D.铁桥生锈主要是因为钢铁在潮湿空气中形成原电池,发生了吸氧腐蚀,与外界环境有关,D错误;
答案选C。
6.D
解析:A.充电时,电解池“异性相吸”,则电解质溶液中K+向阴极移动,故A错误;
B.充电时,2Zn(OH) =2Zn+O2+4OH–+2H2O,则电解质溶液中c(OH–)逐渐增大,故B错误;
C.放电时,负极反应为:Zn+4OH– 2e–= Zn(OH),故C错误;
D.放电时,正极反应式为:O2+4e–+2H2O=4OH–,电路中通过4mol电子,消耗氧气1mol即体积为22.4L(标准状况),故D正确。
综上所述,答案为D。
7.B
解析:A.热带地区桥梁比寒带海域的温度高,反应速率更快,桥梁腐蚀更严重,故A正确;
B.铁的吸氧腐蚀中,氧气的浓度越大,其腐蚀速率越快,海泥区含氧量非常低,腐蚀速率一般低于海水全浸区,故B错误;
C.浅海区溶氧量较高,钢铁在浅海区主要发生吸氧腐蚀,故C正确;
D.在浪花飞溅区,海水的冲击不断破坏桥梁表面的腐蚀产物和保护涂层,使铁不断与氧气和水接触反应,所以浪花飞溅区桥梁腐蚀最严重,故D正确;
故选:B。
8.D
【分析】根据图示分析可知H2O在B电极失电子发生氧化反应生成氧气,B为电解池阳极,连接电源的正极,A电极为电解池阴极,连接电源负极,以此解答。
解析:A.B为电解池阳极,H2O在B电极失电子发生氧化反应生成氧气,电极方程式为:,故A正确;
B.由分析可知A电极为电解池阴极,B为电解池阳极,根据离子迁移规律氢离子由阳极移向阴极,即由B电极经过质子交换膜移向A电极,B正确;
C.A电极为电解池阴极,电解液中POM1得电子转化为POM2的过程为还原反应,则在催化剂表面转化为的反应为氧化反应,C正确;
D.B电极反应式为,生成转移4mol电子,N2转化为NH的过程中N元素由0价下降到-3价,当转移4mol电子时可还原,标准状况下的体积为=14.9L,D错误;
故选D。
9.D
解析:A.氯碱工业上,用惰性电极电解饱和氯化钠溶液,阴极附近得到氢氧化钠,由图示知,Y极连接电源负极作电解池的阴极,故Y附近能得到氢氧化钠,A错误;
B.铜的精炼中,粗铜作阳极X,纯铜作阴极Y,硫酸铜溶液作电解质溶液,B错误;
C.电镀工业上,阴极Y是待镀金属,阳极X是镀层金属,C错误;
D.被保护金属对应的电极上应该发生还原反应,若为外加电流的阴极保护法,被保护金属应该作阴极,即Y极,D正确;
故答案选D。
10.D
解析:A.锡、铅的金属性比铜强,在形成原电池时,作原电池的负极,能阻止铜失电子,从而保护青铜器中的铜,A正确;
B.Cu2(OH)3Cl和Cu2(OH)2CO3中都含有Cu2+和Cl-或CO,二者都属于盐类,B正确;
C.NH4Cl在溶液中能发生水解而使溶液显酸性,浸泡青铜器能清洗青铜器的铜锈,C正确;
D. 青铜器常放在银质托盘上,可以形成原电池,青铜器作原电池的负极,从而会加快青铜器的腐蚀,D错误;
故选:D。
二、填空题
11.(1) 原电池 N2H4-4e-+4OH-=N2+4H2O
(2)阳极 2H2O-4e-=4H++O2↑
(3)AC
(4)2.24
(5)12.8
【分析】甲池是燃料电池,通N2H4一极为负极,通O2一极为正极,乙池是电解池,石墨为阳极,Fe为阴极。
解析:(1)甲池是燃料电池,通N2H4一极为负极,发生氧化反应,电极反应式N2H4-4e-+4OH-=N2+4H2O,故为:原电池;N2H4-4e-+4OH-=N2+4H2O;
(2)乙池是电解池,石墨为阳极,Fe为阴极,在阳极是水电离出的OH-放电,其电极反应式2H2O-4e-=4H++O2↑;故为:阳极;2H2O-4e-=4H++O2↑;
(3)乙池中的电解方程式2CuSO4+2H2O2Cu+ O2↑+2H2SO4,所以使乙池恢复到电解前的状态,CuO+H2SO4= CuSO4+H2O或CuCO3+H2SO4= CuSO4+H2O+CO2↑,应向溶液中加入适量的CuO或CuCO3,故为:AC;
(4)若加入9.8g的Cu(OH)2乙池能恢复到电解前的状态,9.8g的Cu(OH)2为0.1mol,根据电极反应及原子守恒,可知乙池电解时,阴极析出Cu0.1mol、0.1molH2,阳极析出0.1molO2,电解时转移电子0.4mol,根据得失电子守恒,则理论上甲池正极消耗O2为0.1mol,标况下氧气的体积是2.24L,故为:2.24L;
(5)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,则Cu做阳极,Fe做阴极,当甲中消耗1.6gN2H4时,即0.05mol N2H4失去电子0.2mol,则电镀池中阳极消耗Cu0.1mol,质量减轻为6.4g,阴极质量增加6.4g,所以乙池中两个电极质量差为12.8g。故为:12.8g。
12.(1) 负极
(2)Y极
(3)粗铜
(4)镀件 128
【分析】如图,左侧装置为甲烷燃料电池,有氧气参与的一极为正极,即Y极为正极,酸性电解质,电极反应式为,则X极为负极,电极反应式为,右边装置为电解池,电极M与原电池正极相连做阳极;N极为阴极;
解析:(1)综上所述,X极为负极,电极反应式为;
故答案为:负极;;
(2)在原电池中,阴阳离子移动方向为:阳离子向正极移动,阴离子向负极移动;所以放电过程中,向Y极移动;
故答案为:Y极;
(3)粗铜精炼时,粗铜连接电源正极,做阳极,精铜作阴极,若用该燃料电池进行粗铜精炼,M极与电池正极相连,做阳极,则M极连接的是粗铜,N极为阴极,电极反应式为;
故答案为:粗铜;;
(4)电镀时,镀件作阴极,镀层金属作阳极,如图所示的装置中,N极为阴极,连接镀件,M极为阳极,连接精铜,失电子,质量减少,电极反应式为,根据电极反应式、,可的关系式,理论上每消耗0.5mol甲烷时,M极减少的质量为128g;
故答案为:镀件;128。
13.2H++2e-=H2↑ 吸氧腐蚀 外加电流的阴极保护法 能
解析:(1)钢铁在酸性环境中发生析氢腐蚀,其正极反应式为:2H++2e =H2↑,钢铁在空气酸度不大的环境中,形成原电池发生吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,碳作正极,正极上氧气得电子发生还原反应,负极上电极反应式为:2Fe 4e ═2Fe2+,正极上电极反应式为:O2+2H2O+4e ═4OH ;
(2)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处,该电化学防护法称为外加电流的阴极保护法,若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法。
14.(1)B极 280 CuO或
(2) b%>a%
【分析】甲醇燃料电池(甲池),A为负极,B为正极,C、E为阳极,D、F为阴极。
A为电解池,电解饱和食盐水生成氢气、氯气和氢氧化钠溶液,B为氢氧燃料电池。
解析:(1)①甲醇燃料电池(甲池),放电时,根据“同性相吸”,则向正极即B极移动;溶液过量时,甲池中负极是甲醇变为碳酸根,其电极反应式为;故答案为:B极;。
②当乙池中C极质量减轻时,物质的量为0.05mol,转移0.05mol电子,则甲池中B极理论上消耗物质的量为0.0125mol,其标准状况的体积为0.0125mol ×22.4L mol 1 ×1000mL L 1=280mL;故答案为:280。
③一段时间后,断开电键K,丙池阳极得到氧气,阴极得到铜单质,溶液不断变为硫酸,欲使丙池恢复到反应前的浓度,可加入的试剂是CuO或;故答案为:CuO或。
(2)①电解饱和食盐水得到氯气、氢气和氢氧化钠溶液,B为燃料电池,则Y为氢气,B形成氢氧燃料电池,因此图中Y是;X(氯气)与稀溶液反应的离子方程式为;故答案为:;。
②B为氢氧燃料电池,电解质溶液为氢氧化钠溶液,负极是氢气失去电子和氢氧根结合生成水,正极是氧气得到电子和水反应生成氢氧根,因此图示中氢氧化钠的质量分数a%与b%的大小:b%>a%;故答案为:b%>a%。
③若用装置B作为装置A的辅助电源,则每消耗标准状况下氧气(物质的量为0.5mol)时,转移2mol电子,则装置B可向装置A提供的电量约为2mol ×NAmol 1 ×=;故答案为:。
15.(1) 原电池 CH3OH+ 8OH- -6e- = CO+ 6H2O
(2)2H2O- 4e-= O2↑+4H+
(3)1
(4)AC
(5)H2SO4 阴
(6)2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
(7)0.448
【分析】Ⅰ.由图中可知,甲装置为原电池,甲醇在负极发生失电子的氧化反应,所以a是原电池负极,氧气在正极发生得电子的还原反应,则b是原电池正极,根据连接方式可知,乙丙装置为电解池,c为阳极,d为阴极,B为阳极,C为阴极,据此结合原电池、电解池原理分析解答。
解析:(1)甲装置是原电池,a是原电池负极,其电极反应为CH3OH+ 8OH- -6e- = CO+ 6H2O;
(2)乙池为电解池,c极是阳极,其电极反应为2 H2O- 4e-= O2↑+4H+;
(3)由图分析可知O2~4e- ~4H+则 c(H+)= = 0.1mol/L,则溶液的pH=1;
(4)乙池只发生反应2CuSO4+2H2O 2Cu+O2↑+2H2SO4,损失的是铜与氧元素,所以要恢复到原来的状态只需要加入铜与氧元素即可,则上述物质中,AC符合题意;
(5)丙装置的左室消耗的是水电离的OH-,左室与电源的正极相连为电解池的阳极,SO42-向左室定向移动,所以A出口的产品是H2SO4,M是阴离子交换膜;
(6)Cl 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,则该离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;
(7)n[Cu2(OH)3Cl]=,根据转移电子得n(O2)=,V(O2)=0.02mol×22.4L/mol=0.448L。
16.(1)吸氧腐蚀 碳电极附近变红 O2+4e- +2H2O =4OH- 3Fe2+ +2 [Fe(CN)6]3-= Fe3[Fe(CN)6]2↓
(2) K3[Fe(CN)6]可能氧化Fe生成Fe2+ 会干扰电化学腐蚀生成Fe2+的检验 Cl-的存在 破坏铁片表面的氧化膜
解析:实验中连好装置,铁片为负极,电极反应为Fe-2e-=Fe2+,碳棒为正极,由于电解质溶液呈中性,则碳棒上的电极反应为O2+4e-+2H2O=4OH-,一段时间后,向烧杯中滴加酚酞,碳棒附近溶液变红,证明铁发生了吸氧腐蚀;据此回答。
(1)以上装置构成了原电池,由电化学原理引起的腐蚀为电化学腐蚀,由于电解质溶液是食盐水,正极是溶解氧得电子被还原的反应,则铁发生了吸氧腐蚀。
①正极反应为溶解氧得电子被还原的反应,生成的氢氧根离子使酚酞变红,则实验Ⅰ中的现象是:碳电极附近变红。
②实验Ⅰ中正极反应为:。
③负极为铁失去电子被氧化:Fe-2e-=Fe2+, Fe2+ 与[Fe(CN)6]3-反应生成蓝色沉淀Fe3[Fe(CN)6]2,离子方程式为:3Fe2+ +2 [Fe(CN)6]3-= Fe3[Fe(CN)6]2↓。
(2)①根据资料“K3[Fe(CN)6]具有氧化性”,故实验Ⅱ中铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,产生的Fe2+再与K3[Fe(CN)6]反应生成蓝色沉淀,干扰对电化学腐蚀生成的Fe2+的检验。
②a.根据实验Ⅲ知,只有水时K3[Fe(CN)6]溶液和铁片不反应;再对比实验Ⅳ和Ⅴ,阳离子相同、阴离子不同,结合实验现象知,在Cl-存在条件下,K3[Fe(CN)6]溶液可以和铁片发生反应。
b.为探究阴离子的存在对此反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验Ⅲ,发现铁片表面产生蓝色沉淀。稀硫酸“酸洗”的目的是除去铁表面的氧化膜,由此补充实验、结合实验Ⅳ说明,Cl-的作用是:破坏了铁表面的氧化膜
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
