1.3 金属的腐蚀与防护 同步练习(含解析)2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.3 金属的腐蚀与防护 同步练习(含解析)2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 345.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 12:19:06 | ||
图片预览


文档简介
1.3 金属的腐蚀与防护 同步练习
一、单选题
1.我市文旅产业初具规模。下列说法正确的是( )
A.东坡书画所用宣纸的主要成分是蛋白质
B.黄麻起义所用短枪生锈,主要原因是铁发生了化学腐蚀
C.蕲艾对多种霉菌、球菌、杆菌有抑制作用,说明蕲艾具有强氧化性
D.黄梅戏主奏乐器——高胡,所用钢丝弦属于合金
2.下列事实不能用电化学理论解释的是( )
A.纯铁制品比钢铁制品更耐腐蚀
B.同种金属作为原电池的正极比作为电解池的阳极腐蚀得更慢
C.钢管镀锌时,锌棒做阳极,钢管做阴极,锌盐溶液做电解质溶液
D.铝片不用特殊方法保存
3.化学与生活密切相关。下列说法错误的是
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
4.金属腐蚀现象普遍存在。下列事实与电化学腐蚀有关的是( )
A.金属钠置于空气中变暗
B.铝片浸入浓硝酸中产生致密的氧化膜
C.黄铜(铜锌合金)制作的铜锣不易生成铜绿
D.铁在 和 的混合溶液中发蓝、发黑
5.下列事实中,与电化学腐蚀无关的是( )
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.为保护海轮的船壳,常在船壳上镶入锌块
C.在空气中,金属银的表面生成一层黑色物质
D.镀银铁制品,镀层部分受损后,露出的铁表面易被腐蚀
6.用如下装置进行铁的电化学腐蚀实验。下列说法正确的是
一段时间后,左侧试管发热,导管口有气泡产生。
A.铁发生的电极反应:
B.铁腐蚀过程中,化学能转化为热能
C.炭粉的存在对铁腐蚀的速率无影响
D.导管口产生气泡证明铁发生了析氢腐蚀
7.化学与生产、生活密切相关。下列叙述错误的是( )
A.天然气的主要成分是甲烷
B.钢铁船身嵌入锌应用了外加电流的阴极保护法
C.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料
D.医用消毒酒精中乙醇的体积分数为75%
8.如图所示是探究铁发生腐蚀的装置图.发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升.下列说法不正确的是( )
A.两种腐蚀负极的电极反应式均为Fe﹣2e﹣═Fe2+
B.开始时发生的是析氢腐蚀
C.一段时间后发生的是吸氧腐蚀
D.析氢腐蚀的总反应式为2Fe+O2+2H2O═2Fe(OH)2
9.为防止海轮船体被腐蚀,应在船体的水线以下位置嵌上一定数量的锌块。下列说法不正确的是( )
A.这是利用锌比铁活泼采取的牺牲阳极的阴极保护法
B.这是利用电解原理采用的外加电流的阴极保护法
C.因为锌比铁活泼,所以在锌 铁 海水原电池中,锌是负极,失电子;而铁作正极,被保护
D.要定期更换锌块才能起到保护作用
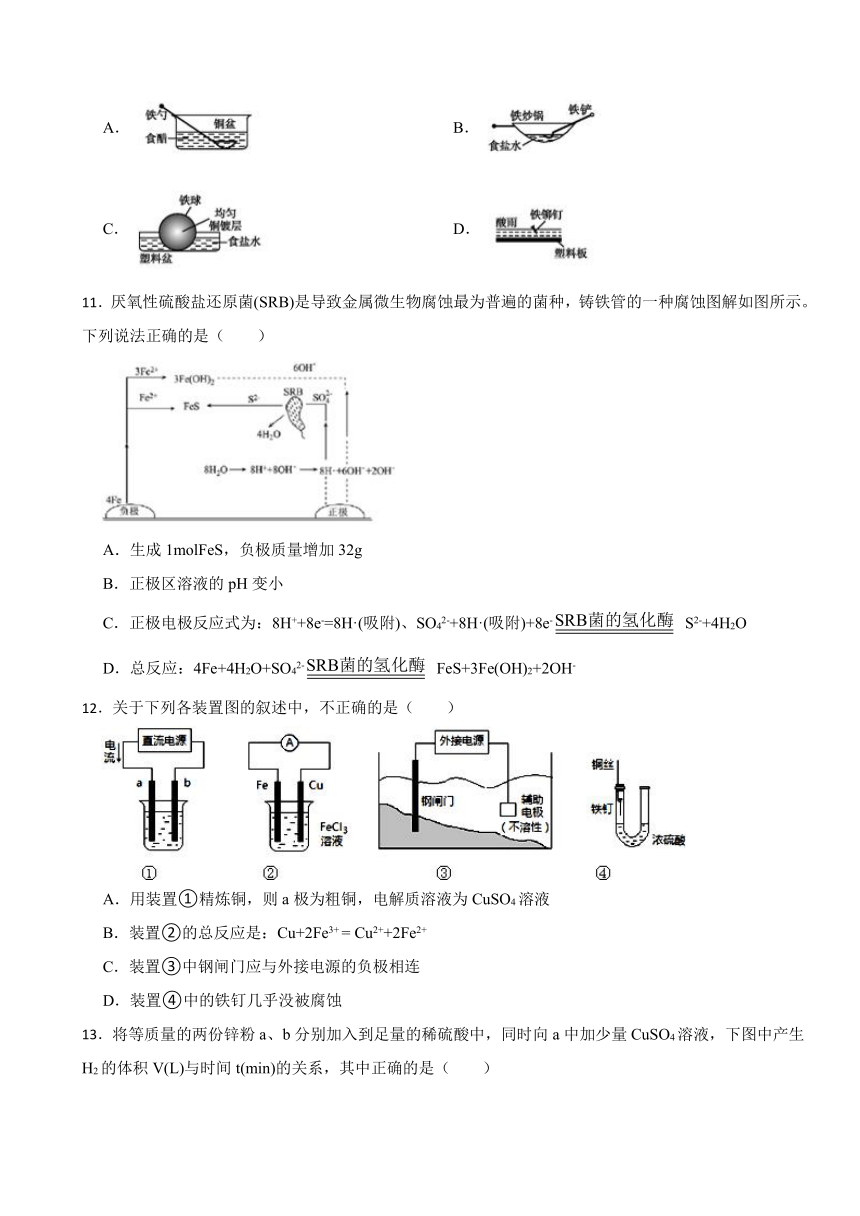
10.下列情形中,相同材质的铁最不易被腐蚀的是( )
A. B.
C. D.
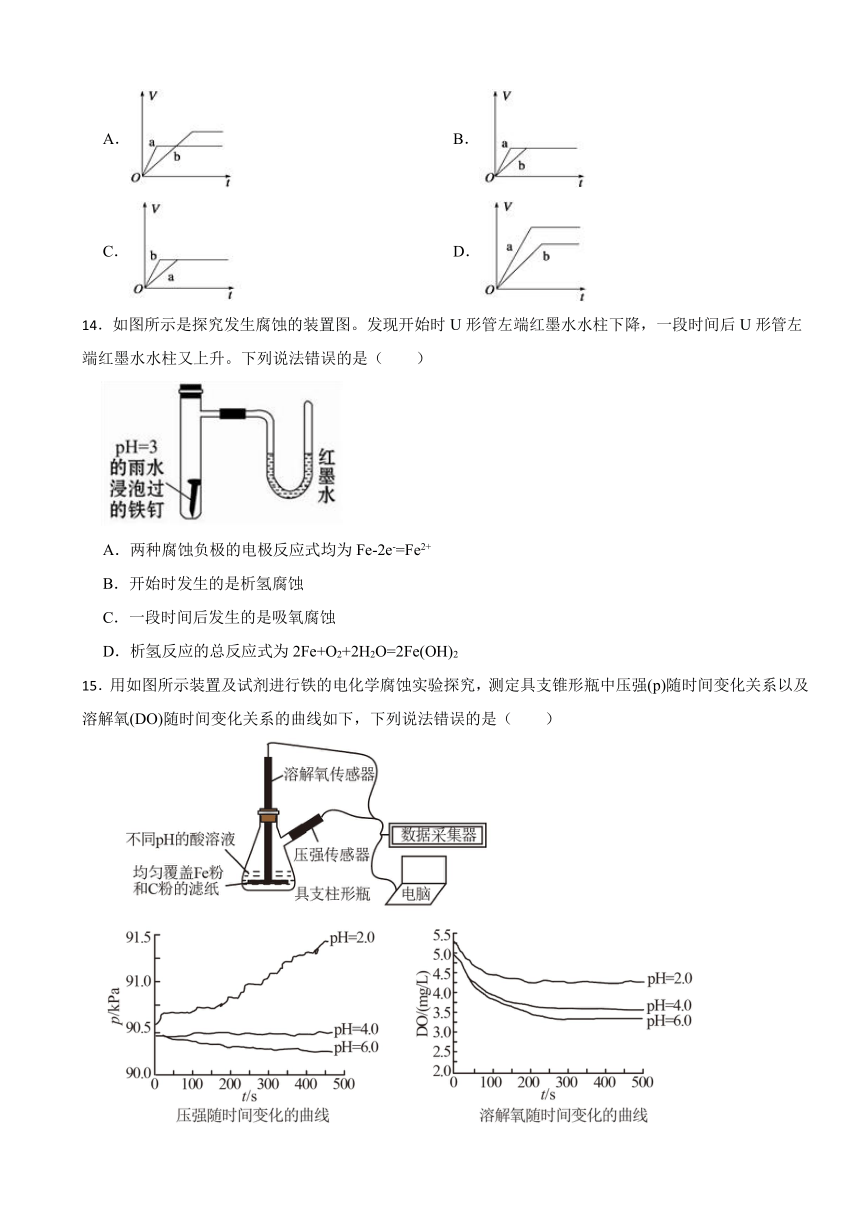
11.厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,铸铁管的一种腐蚀图解如图所示。下列说法正确的是( )
A.生成1molFeS,负极质量增加32g
B.正极区溶液的pH变小
C.正极电极反应式为:8H++8e-=8H·(吸附)、SO42-+8H·(吸附)+8e- S2-+4H2O
D.总反应:4Fe+4H2O+SO42- FeS+3Fe(OH)2+2OH-
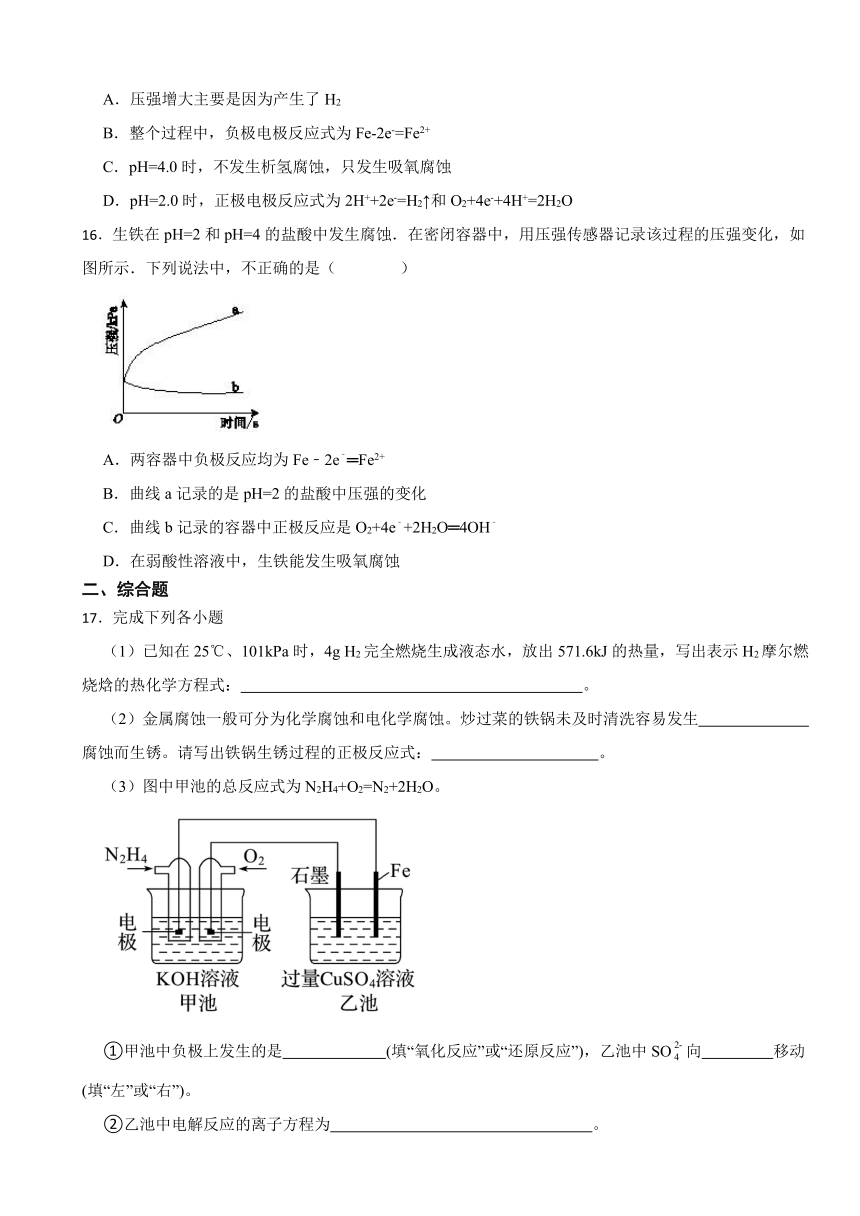
12.关于下列各装置图的叙述中,不正确的是( )
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+ = Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
13.将等质量的两份锌粉a、b分别加入到足量的稀硫酸中,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A. B.
C. D.
14.如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法错误的是( )
A.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B.开始时发生的是析氢腐蚀
C.一段时间后发生的是吸氧腐蚀
D.析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
15.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强(p)随时间变化关系以及溶解氧(DO)随时间变化关系的曲线如下,下列说法错误的是( )
A.压强增大主要是因为产生了H2
B.整个过程中,负极电极反应式为Fe-2e-=Fe2+
C.pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D.pH=2.0时,正极电极反应式为2H++2e-=H2↑和O2+4e-+4H+=2H2O
16.生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
A.两容器中负极反应均为Fe﹣2e﹣═Fe2+
B.曲线a记录的是pH=2的盐酸中压强的变化
C.曲线b记录的容器中正极反应是O2+4e﹣+2H2O═4OH﹣
D.在弱酸性溶液中,生铁能发生吸氧腐蚀
二、综合题
17.完成下列各小题
(1)已知在25℃、101kPa时,4g H2完全燃烧生成液态水,放出571.6kJ的热量,写出表示H2摩尔燃烧焓的热化学方程式: 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生 腐蚀而生锈。请写出铁锅生锈过程的正极反应式: 。
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。
①甲池中负极上发生的是 (填“氧化反应”或“还原反应”),乙池中SO向 移动(填“左”或“右”)。
②乙池中电解反应的离子方程为 。
③要使乙池恢复到电解前的状态,应向溶液中加入 (填化学式)。
18.银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如右图),一段时间后黑色褪去。回答下列问题:
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于 腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为 极,银器的电极反应式为 。
(3)处理过程中总反应的化学方程式为 。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为 。
19.电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛。
(1)下图是常见电化学装置图
①负极材料为Zn,其在此装置中的作用是 。
②若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应 。
(2)下图是氯碱工业电解饱和NaCl溶液的示意图
①电解饱和NaCl溶液的离子方程式是 。
②NaOH溶液从 (填b或c)口导出。结合化学用语解释NaOH在此区域生成的原因 。
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 。
(3)下图探究金属Fe是否腐蚀的示意图
在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为 端(填“左”或“右”),结合化学用语解释变红的原因 。
20.铁及其化合物是生活中常见的物质。
(1)铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作 (填 “阳”或“阴”)极,铜离子向 极移动,阴极的电极反应式为 。
(2)下图中,为了减缓海水对铁闸门A的腐蚀,材料B可以选择 (填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因: 。
(3)将FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为 。
21.
(1)Ⅰ.燃料电池一般指采用 、 等可燃物质与 一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为 。
负极上的电极反应为 。
(2)消耗5.6L(标准状况下) 时,有 mol电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度 (填“增大”、“减小”或“不变”)。
(4)Ⅱ.钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。利用如图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于 处。(填M或N)
②若X为锌,开关K置于M处,该电化学防护法称为 。
答案解析部分
1.【答案】D
【解析】【解答】A.东坡书画所用宣纸的主要成分是纤维素,故A不符合题意;
B.金属腐蚀主要是电化学腐蚀,故黄麻起义所用短枪生锈,主要原因是铁发生了电化学腐蚀,故B不符合题意;
C.蕲艾挥发油含有乙酸乙醋,挥发油对多种霉菌、球菌、杆菌有抑制作用,还有平喘、镇咳作用,故C不符合题意;
D.合金强度比纯金属高,高胡所用钢丝弦属于合金,故D符合题意;
故答案为:D
【分析】A.纸的主要成分为纤维素;
B.金属腐蚀主要是电化学腐蚀;
C.具有强氧化性的物质能使蛋白质变性。
2.【答案】D
【解析】【解答】A.纯铁制品不易形成电化学腐蚀,而钢铁制品中含C等易形成电化学腐蚀,加快腐蚀速率,不符合题意;
B.原电池正极一般只起到导电作用,电解池阳极易发生氧化反应加快腐蚀,不符合题意;
C.钢管镀锌时,阳极发生氧化反应,锌变为锌离子,阴极发生还原反应,锌离子变为锌镀在钢管表面,不符合题意;
D.铝在空气中易与氧气形成致密氧化膜,阻止了反应进一步进行。综上,D不能用电化学理论解释,符合题意。
故答案为:D
【分析】D中是因为铝本身能形成致密的氧化铝薄膜,与电化学无关。
3.【答案】A
【解析】【解答】泡沫灭火器喷出的物质中含水,易造成短路。
故答案为:A
【分析】本题主要考查化学与生活的相关内容,包括蛋白质的变性,有机溶剂的毒性以及金属的电化学防护法。
4.【答案】C
【解析】【解答】A.金属钠置于空气中变暗是因为钠与空气中的氧气反应生成氧化钠,与电化学腐蚀无关,选项A不符合;
B.铝片浸入浓硝酸中产生致密的氧化膜,是铝被钝化,发生氧化还原反应,与电化学腐蚀无关,选项B不符合;
C.黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜矿,制作的铜锣不易生成铜绿,与电化学腐蚀有关,选项C符合;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁,与电化学腐蚀无关,选项D不符合;
故答案为:C。
【分析】A.金属钠在空气中生成氧化钠,与电化学腐蚀无关;
B.铝在浓硝酸中钝化与电化学腐蚀无关;
C.铜锌构成原电池,锌比铜活泼,锌被腐蚀,铜被保护;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁。
5.【答案】C
【解析】【解答】A.铁管在潮湿的环境下容易形成原电池,加快铁的腐蚀,与电化学腐蚀有关,故A不选;
B.在船壳上镶嵌锌块,在海水中构成原电池,船体做正极被保护从而能减缓腐蚀,和电化学腐蚀有关,故B不选;
C.银在空气中被氧气氧化发生化学腐蚀,与电化学腐蚀无关,故C可选;
D.镀银的铁制品铁破损后发生电化腐蚀,因Fe比Ag活泼,因而是铁被腐蚀,发生原电池反应而可用电化学知识解释,故D不选;
故答案为:C。
【分析】A、潮湿空气有电解质形成原电池;
B、锌比铁更活泼,锌为负极;
C、银表面变黑是化学腐蚀;
D、铁比银活泼,铁为负极。
6.【答案】B
【解析】【解答】A.铁、碳粉、氯化钠溶液形成原电池,Fe作负极失电子,铁发生的电极反应:,A不符合题意;
B.该过程化学能转化为电能,同时有热量产生,部分化学能转化为热能,B符合题意;
C.碳作正极,Fe、C和氯化钠溶液形成原电池,加速铁的腐蚀速度,C不符合题意;
D.氯化钠溶液为电解质,此过程发生吸氧腐蚀,D不符合题意;
故答案为:B。
【分析】A.原电池中一般活泼金属作负极,不活泼金属或碳棒用正极;负极失电子发生氧化反应;正极得电子,发生还原反应;
B.原电池将化学能转化为电能,同时有热量产生;
C.原电池反应比化学反应快;
D.中性或弱酸性条件下,金属发生吸氧腐蚀,酸性环境下,金属发生析氢腐蚀。
7.【答案】B
【解析】【解答】A.天然气是烷烃和硫化氢、二氧化碳等气体的混合物,其中甲烷占绝大多数,所以天然气的主要成分是甲烷,故A不符合题意;
B.锌、铁和海水形成的原电池中,锌作负极、铁作正极,铁得到保护,该保护方法为牺牲阳极的阴极保护法,故B符合题意;
C.丙烯加聚反应生成的聚丙烯是高聚物,属于合成纤维,聚丙烯纤维属于有机合成高分子材料,故C不符合题意;
D.酒精浓度过低,杀菌效果不明显,浓度过高、效果太强,导致细菌细胞最外面的蛋白质变性而形成一个保护圈,达不到杀菌的目的,所以医用消毒酒精中乙醇的体积分数为75%最好,故D不符合题意;
答案为B。
【分析】B.可理解为牺牲负极的正极保护法,但该保护方法的名称为牺牲阳极的阴极保护法;
C.高聚物都属于高分子物质且为混合物。
D.注意为体积分数不是质量分数。
8.【答案】D
【解析】【解答】解:A.无论是析氢腐蚀还是吸氧腐蚀,铁都作负极,负极上发生的电极反应式都为Fe﹣2e﹣═Fe2+,故A正确;
B.pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,所以开始时,发生的是析氢腐蚀,故B正确;
C.一段时间后,亚硫酸根离子能被氧气氧化生成硫酸根离子,发生的是吸氧腐蚀,故C正确;
D.析氢腐蚀的总反应为:Fe+2H+=Fe 2++H2↑,故D错误;
故选D.
【分析】pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,导致试管内气体压强增大;亚硫酸根离子能被氧气氧化生成硫酸根离子,导致试管内气体压强减小.
9.【答案】B
【解析】【解答】船体是钢铁制成的,为防止浸在海水中的钢铁被腐蚀而在船体嵌入锌块,是利用原电池原理,使活泼的锌在锌 铁 海水原电池中作负极,失电子,而使铁作正极,达到保护船体的目的。这种方法就是牺牲负极锌而保护正极铁,习惯上叫牺牲阳极的阴极保护法。因为锌在反应中失去电子被消耗,所以要定期更换。
故答案为:B
【分析】A.组成原电池,利用锌的腐蚀来保护船体,称 牺牲阳极的阴极保护法 ;
B.无外界电源,不是利用电解原理;
C.较活泼金属(锌)作负极,被腐蚀;较不活泼金属(铁)作正极,被保护;
D.因锌被腐蚀,所以需定期更换。
10.【答案】C
【解析】【解答】A.图中的铁勺和铜盆以及食醋一同构成原电池,铁勺做原电池的负极,发生氧化反应,腐蚀较快,A项不符合题意;
B.铁做负极、合金中的碳等材料做正极,食盐水为电解质溶液,形成原电池,铁发生电化学腐蚀,B项不符合题意;
C.图中的塑料盆不导电,铁球表面镀了层铜,可以起到防腐蚀的作用,因此腐蚀速很慢,C项符合题意;
D.酸雨为电解质溶液,可以和金属铁之间反应,金属铁发生化学腐蚀,D项不符合题意;
故答案为:C。
【分析】(1)掌握阴极保护法的原理;
(2)在隔绝空气或者隔绝水的条件下,金属单质最不容易被腐蚀。
11.【答案】D
【解析】【解答】A.根据腐蚀原理示意图可知,SO42-+8H· S2-+4H2O,Fe2++S2-=FeS,3Fe2++6OH-=3Fe(OH)2↓,根据电子得失守恒可知,生成1molFeS同时生成3molFe(OH)2。则负极增加的质量为 ,A项不符合题意;
B.正极区消耗氢离子,溶液的pH增大,B项不符合题意;
C.由腐蚀原理示意图可知,正极H+得电子发生还原反应,电极反应方程式为:8H++8e-=8H·(吸附)。SO42-与H·发生反应,是一个完整的氧化还原反应,而不是半反应,不属于正极的电极反应方程式,且题中SO42-+8H·(吸附)+8e- S2-+4H2O,电子不守恒,反应式不符合题意,C项不符合题意;
D.由腐蚀原理示意图可知,正极H+先变成H·,SO42-再与8个H·在SRB菌的氢化酶的作用下生成S2-和水,负极Fe失去电子生成Fe2+,Fe2+与S2-、OH-结合生成FeS、Fe(OH)2,由此可知该腐蚀过程的总反应为:4Fe+4H2O+SO42- FeS+3Fe(OH)2+2OH-。D项符合题意;
故答案为:D。
【分析】根据腐蚀原理示意图可知,该腐蚀过程中发生的是原电池反应,为电化学腐蚀,其中铁为负极,铁中的杂质碳为正极,据此分析。
12.【答案】B
【解析】【解答】A.由电流方向可得,直流电源左端为正极,则与之相连的a电极为阳极,b电极为阴极,用该装置电解精炼铜时,a电极(即阳极)应为粗铜,电解质溶液为CuSO4溶液,选项正确,A不符合题意;
B.由于金属活动性Fe>Cu,因此电池总反应为Fe+2Fe3+=3Fe2+,选项错误,B符合题意;
C.图示装置为外接电源的阴极保护法,钢闸门为被保护金属,应作为阴极,与电源的负极相连,选项正确,C不符合题意;
D.常温下,浓硫酸能使铁钝化,因此该装置中铁钉几乎没被腐蚀,选项正确,D不符合题意;
故答案为:B
【分析】A.电解精炼铜时,粗铜作阳极,纯铜做阴极;
B.根据装置内所给物质发生的反应确定电池总反应;
C.图示装置为外接电源的阴极保护法,据此确定电极;
D.常温下,浓硫酸能使铁钝化;
13.【答案】A
【解析】【解答】解:将等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加少量组成原电池的条件CuSO4溶液,a中部分锌与硫酸铜反应生成铜,所以生成氢气总量减少,但构成铜锌原电池反应速率加快,故A正确。
故答案为:A
【分析】组成原电池,生成氢气的反应速率加快,所以a快反应时间短,又消耗少量锌置换铜,造成氢气总量减少
14.【答案】D
【解析】【解答】A.无论是析氢腐蚀还是吸氧腐蚀,铁都作负极,负极上发生的电极反应式都为Fe-2e-═Fe2+,故A不符合题意;
B.pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,所以开始时,发生的是析氢腐蚀,故B不符合题意;
C.一段时间后,亚硫酸根离子能被氧气氧化生成硫酸根离子,发生的是吸氧腐蚀,故C不符合题意;
D.析氢腐蚀的总反应为:Fe+2H+=Fe 2++H2↑,2Fe+O2+2H2O=2Fe(OH)2发生的是吸氧腐蚀,故D符合题意;
故答案为:D。
【分析】明确钢铁发生析氢腐蚀和吸氧腐蚀所需溶液的酸碱性是解本题的关键。pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,导致试管内气体压强增大,随着腐蚀的进行,溶液的酸性逐渐减小,亚硫酸根离子被氧气氧化生成硫酸根离子,导致试管内气体压强减小。
15.【答案】C
【解析】【解答】A.pH=2.0的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,故A不符合题意;
B.锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作为原电池的负极,发生的电极反应式为:Fe-2e-═Fe2+,故B不符合题意;
C.若pH=4.0时只发生吸氧腐蚀,那么锥形瓶内的压强会有下降;而图中pH=4.0时,锥形瓶内的压强几乎不变,说明除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,故C符合题意;
D.由图可知,pH=2.0时,锥形瓶内的溶解氧减少,说明有消耗氧气的吸氧腐蚀发生,同时锥形瓶内的气压增大,说明有产生氢气的析氢腐蚀发生;因此,正极反应式有:2H++2e-═H2↑和O2+4e-+4H+═2H2O,故D不符合题意;
故答案为:C。
【分析】Fe在酸性环境下会发生析氢腐蚀,产生氢气,会导致锥形瓶内压强增大;若介质的酸性很弱或呈中性,并且有氧气参与,此时Fe就会发生吸氧腐蚀,吸收氧气,会导致锥形瓶内压强减小。
16.【答案】C
【解析】【解答】解:A.两个溶液中都发生电化学腐蚀,铁均作负极,电极反应式为Fe﹣2e﹣=Fe2+,故A正确;
B.曲线a的压强随着反应的进行而逐渐增大,说明发生析氢腐蚀,发生析氢腐蚀的条件是酸性较强,则该容器中的盐酸pH=2,故B正确;
C.曲线b的压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,对应的应是酸性较弱的pH=4的盐酸溶液,电解质溶液呈酸性,正极反应为O2+4e﹣+4H+═2H2O,故C错误;
D.曲线b的压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,对应的应是酸性较弱的pH=4的盐酸溶液,所以在酸性溶液中生铁可能发生吸氧腐蚀,故D正确;
故选C.
【分析】据压强与时间关系图知,曲线a的压强随着反应的进行而逐渐增大,说明发生析氢腐蚀,对应的是酸性较强的pH=2的盐酸溶液;曲线b的压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,对应的应是酸性较弱的pH=4的盐酸溶液,根据原电池原理来分析解答.
17.【答案】(1)△H=
(2)吸氧(或电化学);
(3)氧化反应;左;;CuO
【解析】【解答】(1)已知在25℃、101kPa时,4g H2的物质的量为2mol,完全燃烧生成液态水,放出571.6kJ的热量,则表示H2摩尔燃烧焓的热化学方程式为:△H=,故答案为:△H=;
(2)炒过菜的铁锅未及时清洗含有盐,在空气中容易发生吸氧腐蚀(或电化学)而生锈,正极为氧气得电子,生成氢氧根,正极反应式为:,故答案为:吸氧(或电化学);;
(3)①甲池的总反应式为N2H4+O2=N2+2H2O,可知左边的电极(通入N2H4)为负极,右边的电极(通入O2)为正极,所以甲池中负极失电子,发生的是氧化反应;乙池中铁为阴极,石墨为阳极,SO向阳极移动,即向左移动,故答案为:氧化反应;左;
②乙池中电解硫酸铜溶液,生成铜和氧气,电解的离子方程为:,故答案为:;
③乙池中电解硫酸铜溶液,生成铜和氧气,要使乙池恢复到电解前的状态,应向溶液中加入CuO,故答案为:CuO。
【分析】(1)燃烧热是101kP时,1mol可燃物完全燃烧生成稳定产物时的反应热;
(2)在中性或弱碱性环境铁易发生吸氧腐蚀;
(3)①负极失电子发生氧化反应;电解时阴离子向阳极移动;
②利用放电顺序,电解硫酸铜溶液,生成铜和氧气;
③利用“出啥加啥”。
18.【答案】(1)化学
(2)负;Ag2S+2e-=2Ag +S2-
(3)3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
(4)2H++NO +e-=NO2↑+H2O
【解析】【解答】(1)银质器皿日久表面逐渐变黑腐蚀的过程中,没有电流产生,属于化学腐蚀;
(2)由于金属活动性Al>Ag,因此铝质容器作为负极,银器作为正极,由银器上的Ag2S发生得电子的还原反应生成Ag和S2-,其电极反应式为:Ag2S+2e-=2Ag+S2-;
(3)处理过程中,Ag2S、Al和H2O反应生成Ag、H2S气体和AlOOH3沉淀,该反应的化学方程式为:3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓;
(4)若将食盐水用浓硝酸代替,由于常温下浓硝酸能使铝钝化,因此铝质容器做正极,由溶液中的NO3-发生得电子的还原反应,生成NO2,该电极反应式为:2H++NO3-+e-=NO2↑+H2O;
【分析】(1)根据腐蚀过程是否有电流产生分析属于何种腐蚀;
(2)根据金属活动性判断正负极和电极反应式;
(3)根据题干信息确定反应物和生成物,结合原子守恒书写反应的化学方程式;
(4)常温下,浓硝酸能使铝发生钝化,此时铝做正极,溶液中的NO3-发生得电子的还原反应;
19.【答案】(1)做还原剂(或失电子),失电子的场所,电子导体;Cu 2e =Cu2+
(2)2Cl +2H2O2OH +Cl2↑+H2↑;c;c口为阴极区,阴极发生反应:2H2O+2e-=O2↑+2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出;Cl2+H2O HCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集
(3)左;铜、铁和溶液构成原电池,铜为正极,发生吸氧腐蚀,反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH )>c(H+),溶液呈碱性
【解析】【解答】(1)①负极材料为Zn,即Zn做还原剂(或失电子),失电子的场所,同时Zn也是导电,可以作为电子导体;
②若用一根铜丝代替盐桥插入两烧杯中,则左侧烧杯中发生锌的吸氧腐蚀,为原电池,右侧烧杯为电解池,a电极与原电池的正极相连,为阳极,电极反应为Cu 2e =Cu2+;
(2)①电解饱和NaCl溶液时,阳极氯离子被氧化为氯气,阴极水电离出的氢离子被还原生成氢气,同时产生氢氧根,离子方程式为2Cl +2H2O2OH +Cl2↑+H2↑;
②c口为阴极区,阴极发生反应:2H2O+2e-=O2↑+2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出;
③阳极产生的氯气会和水发生反应:Cl2+H2O HCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集;
(3)铜、铁和溶液构成原电池,铜为正极,整个体系中发生Fe的吸氧腐蚀,正极反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH )>c(H+),溶液呈碱性,所以左端变红。
【分析】(1)①依据材料的性质和电极反应分析;
②依据串联电路中,能自发进行的装置作原电池,其余的装置均不电解池分析;
(2)①电解饱和NaCl溶液时,阳极氯离子被氧化为氯气,阴极水电离出的氢离子被还原生成氢气;
②利用阳离子通过阳离子交换膜进入阴极分析;
③根据影响化学平衡移动的因素分析;
(3)依据构成原电池,发生吸氧腐蚀判断。
20.【答案】(1)阳;阴;Cu2+ + 2e = Cu
(2)b;Zn -2e = Zn2+,牺牲阳极的阴极保护法,锌板被腐蚀溶解
(3)2Fe3+ +3Mg (OH)2= 2Fe (OH)3+3Mg2+
【解析】【解答】(1)电镀时,镀件作阴极、镀层金属作阳极,铁表面镀铜,以CuSO4溶液为电解液,铜作阳极,铜离子向阴极极移动,阴极的电极反应式为Cu2+ + 2e = Cu;
(2)利用“牺牲阳极的阴极保护法”,为了减缓海水对铁闸门A的腐蚀,材料B作负极,材料B的活泼性大于铁,可以选择锌板;锌作负极Zn -2e = Zn2+,锌板被腐蚀溶解,所以材料B需定期拆换;
(3)将FeCl3溶液滴加到Mg(OH)2悬浊液中,发生沉淀转化,有红褐色氢氧化铁沉淀产生,该变化的离子方程式为2Fe3+ +3Mg (OH)2= 2Fe (OH)3+3Mg2+。
【分析】(1)电镀时,镀层金属做阳极,镀件做阴极,铜离子在溶液中的移动方向与电流方向一致,阴极铜离子得到电子生成铜;
(2)形成原电池时,负极失电子被腐蚀,正极被保护;
(3)氢氧化铁更难溶实现了沉淀的转化。
21.【答案】(1)
(2)1
(3)增大
(4)N;牺牲阳极保护法或牺牲阳极的阴极保护
【解析】【解答】(1)甲烷电池以KOH溶液为电解质,其总反应的化学方程式为 。甲烷在负极反应,氧气在正极反应,负极电极反应为: 。
(2)消耗5.6L(标准状况下) 时,即0.25mol氧气,每个氧气分子转移4个电子,故有1mol电子转移。
(3)开始放电时,正极是氧气反应生成氢氧根离子,附近溶液的氢氧根离子浓度增大;
(4)钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。利用如图装置,可以模拟铁的电化学防护。
(4)①若X为碳棒,为减缓铁件的腐蚀,铁应为电解池的阴极,即开关K应置于N处。
②若X为锌,开关K置于M处,该装置为原电池,电化学防护法称为牺牲阳极保护法或牺牲阳极的阴极保护。
【分析】
(1)原电池中失电子的电极是负极,负极失电子发生氧化反应,正极上氧化剂得电子发生还原反应,以此分析;
(2)计算出氧气的物质的量即可求出转移电子数;
(3)根据放电时的正极反应来确定正极附近溶液的氢氧根离子浓度的变化;
(4)①若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极,作电解池的阴极被保护;
②若X为锌,开关K置于M处,构成原电池,Zn为负极被腐蚀,Fe为正极被保护.
一、单选题
1.我市文旅产业初具规模。下列说法正确的是( )
A.东坡书画所用宣纸的主要成分是蛋白质
B.黄麻起义所用短枪生锈,主要原因是铁发生了化学腐蚀
C.蕲艾对多种霉菌、球菌、杆菌有抑制作用,说明蕲艾具有强氧化性
D.黄梅戏主奏乐器——高胡,所用钢丝弦属于合金
2.下列事实不能用电化学理论解释的是( )
A.纯铁制品比钢铁制品更耐腐蚀
B.同种金属作为原电池的正极比作为电解池的阳极腐蚀得更慢
C.钢管镀锌时,锌棒做阳极,钢管做阴极,锌盐溶液做电解质溶液
D.铝片不用特殊方法保存
3.化学与生活密切相关。下列说法错误的是
A.泡沫灭火器可用于一般的起火,也适用于电器起火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
4.金属腐蚀现象普遍存在。下列事实与电化学腐蚀有关的是( )
A.金属钠置于空气中变暗
B.铝片浸入浓硝酸中产生致密的氧化膜
C.黄铜(铜锌合金)制作的铜锣不易生成铜绿
D.铁在 和 的混合溶液中发蓝、发黑
5.下列事实中,与电化学腐蚀无关的是( )
A.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
B.为保护海轮的船壳,常在船壳上镶入锌块
C.在空气中,金属银的表面生成一层黑色物质
D.镀银铁制品,镀层部分受损后,露出的铁表面易被腐蚀
6.用如下装置进行铁的电化学腐蚀实验。下列说法正确的是
一段时间后,左侧试管发热,导管口有气泡产生。
A.铁发生的电极反应:
B.铁腐蚀过程中,化学能转化为热能
C.炭粉的存在对铁腐蚀的速率无影响
D.导管口产生气泡证明铁发生了析氢腐蚀
7.化学与生产、生活密切相关。下列叙述错误的是( )
A.天然气的主要成分是甲烷
B.钢铁船身嵌入锌应用了外加电流的阴极保护法
C.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料
D.医用消毒酒精中乙醇的体积分数为75%
8.如图所示是探究铁发生腐蚀的装置图.发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升.下列说法不正确的是( )
A.两种腐蚀负极的电极反应式均为Fe﹣2e﹣═Fe2+
B.开始时发生的是析氢腐蚀
C.一段时间后发生的是吸氧腐蚀
D.析氢腐蚀的总反应式为2Fe+O2+2H2O═2Fe(OH)2
9.为防止海轮船体被腐蚀,应在船体的水线以下位置嵌上一定数量的锌块。下列说法不正确的是( )
A.这是利用锌比铁活泼采取的牺牲阳极的阴极保护法
B.这是利用电解原理采用的外加电流的阴极保护法
C.因为锌比铁活泼,所以在锌 铁 海水原电池中,锌是负极,失电子;而铁作正极,被保护
D.要定期更换锌块才能起到保护作用
10.下列情形中,相同材质的铁最不易被腐蚀的是( )
A. B.
C. D.
11.厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,铸铁管的一种腐蚀图解如图所示。下列说法正确的是( )
A.生成1molFeS,负极质量增加32g
B.正极区溶液的pH变小
C.正极电极反应式为:8H++8e-=8H·(吸附)、SO42-+8H·(吸附)+8e- S2-+4H2O
D.总反应:4Fe+4H2O+SO42- FeS+3Fe(OH)2+2OH-
12.关于下列各装置图的叙述中,不正确的是( )
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+ = Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
13.将等质量的两份锌粉a、b分别加入到足量的稀硫酸中,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
A. B.
C. D.
14.如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法错误的是( )
A.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B.开始时发生的是析氢腐蚀
C.一段时间后发生的是吸氧腐蚀
D.析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
15.用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强(p)随时间变化关系以及溶解氧(DO)随时间变化关系的曲线如下,下列说法错误的是( )
A.压强增大主要是因为产生了H2
B.整个过程中,负极电极反应式为Fe-2e-=Fe2+
C.pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D.pH=2.0时,正极电极反应式为2H++2e-=H2↑和O2+4e-+4H+=2H2O
16.生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
A.两容器中负极反应均为Fe﹣2e﹣═Fe2+
B.曲线a记录的是pH=2的盐酸中压强的变化
C.曲线b记录的容器中正极反应是O2+4e﹣+2H2O═4OH﹣
D.在弱酸性溶液中,生铁能发生吸氧腐蚀
二、综合题
17.完成下列各小题
(1)已知在25℃、101kPa时,4g H2完全燃烧生成液态水,放出571.6kJ的热量,写出表示H2摩尔燃烧焓的热化学方程式: 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀。炒过菜的铁锅未及时清洗容易发生 腐蚀而生锈。请写出铁锅生锈过程的正极反应式: 。
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。
①甲池中负极上发生的是 (填“氧化反应”或“还原反应”),乙池中SO向 移动(填“左”或“右”)。
②乙池中电解反应的离子方程为 。
③要使乙池恢复到电解前的状态,应向溶液中加入 (填化学式)。
18.银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如右图),一段时间后黑色褪去。回答下列问题:
(1)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,该现象属于 腐蚀(填“化学”或“电化学”)。
(2)铝质容器作为 极,银器的电极反应式为 。
(3)处理过程中总反应的化学方程式为 。
(4)若将铝质容器中的食盐水用浓硝酸代替,则铝质容器极的电极反应式为 。
19.电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛。
(1)下图是常见电化学装置图
①负极材料为Zn,其在此装置中的作用是 。
②若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应 。
(2)下图是氯碱工业电解饱和NaCl溶液的示意图
①电解饱和NaCl溶液的离子方程式是 。
②NaOH溶液从 (填b或c)口导出。结合化学用语解释NaOH在此区域生成的原因 。
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 。
(3)下图探究金属Fe是否腐蚀的示意图
在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为 端(填“左”或“右”),结合化学用语解释变红的原因 。
20.铁及其化合物是生活中常见的物质。
(1)铁件表面镀铜可有效防止铁被腐蚀,电镀时,以CuSO4溶液为电解液,铜作 (填 “阳”或“阴”)极,铜离子向 极移动,阴极的电极反应式为 。
(2)下图中,为了减缓海水对铁闸门A的腐蚀,材料B可以选择 (填字母序号)。
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因: 。
(3)将FeCl3溶液滴加到Mg(OH)2悬浊液中,有红褐色沉淀产生。该变化的离子方程式为 。
21.
(1)Ⅰ.燃料电池一般指采用 、 等可燃物质与 一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为 。
负极上的电极反应为 。
(2)消耗5.6L(标准状况下) 时,有 mol电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度 (填“增大”、“减小”或“不变”)。
(4)Ⅱ.钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。利用如图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于 处。(填M或N)
②若X为锌,开关K置于M处,该电化学防护法称为 。
答案解析部分
1.【答案】D
【解析】【解答】A.东坡书画所用宣纸的主要成分是纤维素,故A不符合题意;
B.金属腐蚀主要是电化学腐蚀,故黄麻起义所用短枪生锈,主要原因是铁发生了电化学腐蚀,故B不符合题意;
C.蕲艾挥发油含有乙酸乙醋,挥发油对多种霉菌、球菌、杆菌有抑制作用,还有平喘、镇咳作用,故C不符合题意;
D.合金强度比纯金属高,高胡所用钢丝弦属于合金,故D符合题意;
故答案为:D
【分析】A.纸的主要成分为纤维素;
B.金属腐蚀主要是电化学腐蚀;
C.具有强氧化性的物质能使蛋白质变性。
2.【答案】D
【解析】【解答】A.纯铁制品不易形成电化学腐蚀,而钢铁制品中含C等易形成电化学腐蚀,加快腐蚀速率,不符合题意;
B.原电池正极一般只起到导电作用,电解池阳极易发生氧化反应加快腐蚀,不符合题意;
C.钢管镀锌时,阳极发生氧化反应,锌变为锌离子,阴极发生还原反应,锌离子变为锌镀在钢管表面,不符合题意;
D.铝在空气中易与氧气形成致密氧化膜,阻止了反应进一步进行。综上,D不能用电化学理论解释,符合题意。
故答案为:D
【分析】D中是因为铝本身能形成致密的氧化铝薄膜,与电化学无关。
3.【答案】A
【解析】【解答】泡沫灭火器喷出的物质中含水,易造成短路。
故答案为:A
【分析】本题主要考查化学与生活的相关内容,包括蛋白质的变性,有机溶剂的毒性以及金属的电化学防护法。
4.【答案】C
【解析】【解答】A.金属钠置于空气中变暗是因为钠与空气中的氧气反应生成氧化钠,与电化学腐蚀无关,选项A不符合;
B.铝片浸入浓硝酸中产生致密的氧化膜,是铝被钝化,发生氧化还原反应,与电化学腐蚀无关,选项B不符合;
C.黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜矿,制作的铜锣不易生成铜绿,与电化学腐蚀有关,选项C符合;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁,与电化学腐蚀无关,选项D不符合;
故答案为:C。
【分析】A.金属钠在空气中生成氧化钠,与电化学腐蚀无关;
B.铝在浓硝酸中钝化与电化学腐蚀无关;
C.铜锌构成原电池,锌比铜活泼,锌被腐蚀,铜被保护;
D.铁在 和 的混合溶液中发蓝、发黑是因为被氧化生成四氧化三铁。
5.【答案】C
【解析】【解答】A.铁管在潮湿的环境下容易形成原电池,加快铁的腐蚀,与电化学腐蚀有关,故A不选;
B.在船壳上镶嵌锌块,在海水中构成原电池,船体做正极被保护从而能减缓腐蚀,和电化学腐蚀有关,故B不选;
C.银在空气中被氧气氧化发生化学腐蚀,与电化学腐蚀无关,故C可选;
D.镀银的铁制品铁破损后发生电化腐蚀,因Fe比Ag活泼,因而是铁被腐蚀,发生原电池反应而可用电化学知识解释,故D不选;
故答案为:C。
【分析】A、潮湿空气有电解质形成原电池;
B、锌比铁更活泼,锌为负极;
C、银表面变黑是化学腐蚀;
D、铁比银活泼,铁为负极。
6.【答案】B
【解析】【解答】A.铁、碳粉、氯化钠溶液形成原电池,Fe作负极失电子,铁发生的电极反应:,A不符合题意;
B.该过程化学能转化为电能,同时有热量产生,部分化学能转化为热能,B符合题意;
C.碳作正极,Fe、C和氯化钠溶液形成原电池,加速铁的腐蚀速度,C不符合题意;
D.氯化钠溶液为电解质,此过程发生吸氧腐蚀,D不符合题意;
故答案为:B。
【分析】A.原电池中一般活泼金属作负极,不活泼金属或碳棒用正极;负极失电子发生氧化反应;正极得电子,发生还原反应;
B.原电池将化学能转化为电能,同时有热量产生;
C.原电池反应比化学反应快;
D.中性或弱酸性条件下,金属发生吸氧腐蚀,酸性环境下,金属发生析氢腐蚀。
7.【答案】B
【解析】【解答】A.天然气是烷烃和硫化氢、二氧化碳等气体的混合物,其中甲烷占绝大多数,所以天然气的主要成分是甲烷,故A不符合题意;
B.锌、铁和海水形成的原电池中,锌作负极、铁作正极,铁得到保护,该保护方法为牺牲阳极的阴极保护法,故B符合题意;
C.丙烯加聚反应生成的聚丙烯是高聚物,属于合成纤维,聚丙烯纤维属于有机合成高分子材料,故C不符合题意;
D.酒精浓度过低,杀菌效果不明显,浓度过高、效果太强,导致细菌细胞最外面的蛋白质变性而形成一个保护圈,达不到杀菌的目的,所以医用消毒酒精中乙醇的体积分数为75%最好,故D不符合题意;
答案为B。
【分析】B.可理解为牺牲负极的正极保护法,但该保护方法的名称为牺牲阳极的阴极保护法;
C.高聚物都属于高分子物质且为混合物。
D.注意为体积分数不是质量分数。
8.【答案】D
【解析】【解答】解:A.无论是析氢腐蚀还是吸氧腐蚀,铁都作负极,负极上发生的电极反应式都为Fe﹣2e﹣═Fe2+,故A正确;
B.pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,所以开始时,发生的是析氢腐蚀,故B正确;
C.一段时间后,亚硫酸根离子能被氧气氧化生成硫酸根离子,发生的是吸氧腐蚀,故C正确;
D.析氢腐蚀的总反应为:Fe+2H+=Fe 2++H2↑,故D错误;
故选D.
【分析】pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,导致试管内气体压强增大;亚硫酸根离子能被氧气氧化生成硫酸根离子,导致试管内气体压强减小.
9.【答案】B
【解析】【解答】船体是钢铁制成的,为防止浸在海水中的钢铁被腐蚀而在船体嵌入锌块,是利用原电池原理,使活泼的锌在锌 铁 海水原电池中作负极,失电子,而使铁作正极,达到保护船体的目的。这种方法就是牺牲负极锌而保护正极铁,习惯上叫牺牲阳极的阴极保护法。因为锌在反应中失去电子被消耗,所以要定期更换。
故答案为:B
【分析】A.组成原电池,利用锌的腐蚀来保护船体,称 牺牲阳极的阴极保护法 ;
B.无外界电源,不是利用电解原理;
C.较活泼金属(锌)作负极,被腐蚀;较不活泼金属(铁)作正极,被保护;
D.因锌被腐蚀,所以需定期更换。
10.【答案】C
【解析】【解答】A.图中的铁勺和铜盆以及食醋一同构成原电池,铁勺做原电池的负极,发生氧化反应,腐蚀较快,A项不符合题意;
B.铁做负极、合金中的碳等材料做正极,食盐水为电解质溶液,形成原电池,铁发生电化学腐蚀,B项不符合题意;
C.图中的塑料盆不导电,铁球表面镀了层铜,可以起到防腐蚀的作用,因此腐蚀速很慢,C项符合题意;
D.酸雨为电解质溶液,可以和金属铁之间反应,金属铁发生化学腐蚀,D项不符合题意;
故答案为:C。
【分析】(1)掌握阴极保护法的原理;
(2)在隔绝空气或者隔绝水的条件下,金属单质最不容易被腐蚀。
11.【答案】D
【解析】【解答】A.根据腐蚀原理示意图可知,SO42-+8H· S2-+4H2O,Fe2++S2-=FeS,3Fe2++6OH-=3Fe(OH)2↓,根据电子得失守恒可知,生成1molFeS同时生成3molFe(OH)2。则负极增加的质量为 ,A项不符合题意;
B.正极区消耗氢离子,溶液的pH增大,B项不符合题意;
C.由腐蚀原理示意图可知,正极H+得电子发生还原反应,电极反应方程式为:8H++8e-=8H·(吸附)。SO42-与H·发生反应,是一个完整的氧化还原反应,而不是半反应,不属于正极的电极反应方程式,且题中SO42-+8H·(吸附)+8e- S2-+4H2O,电子不守恒,反应式不符合题意,C项不符合题意;
D.由腐蚀原理示意图可知,正极H+先变成H·,SO42-再与8个H·在SRB菌的氢化酶的作用下生成S2-和水,负极Fe失去电子生成Fe2+,Fe2+与S2-、OH-结合生成FeS、Fe(OH)2,由此可知该腐蚀过程的总反应为:4Fe+4H2O+SO42- FeS+3Fe(OH)2+2OH-。D项符合题意;
故答案为:D。
【分析】根据腐蚀原理示意图可知,该腐蚀过程中发生的是原电池反应,为电化学腐蚀,其中铁为负极,铁中的杂质碳为正极,据此分析。
12.【答案】B
【解析】【解答】A.由电流方向可得,直流电源左端为正极,则与之相连的a电极为阳极,b电极为阴极,用该装置电解精炼铜时,a电极(即阳极)应为粗铜,电解质溶液为CuSO4溶液,选项正确,A不符合题意;
B.由于金属活动性Fe>Cu,因此电池总反应为Fe+2Fe3+=3Fe2+,选项错误,B符合题意;
C.图示装置为外接电源的阴极保护法,钢闸门为被保护金属,应作为阴极,与电源的负极相连,选项正确,C不符合题意;
D.常温下,浓硫酸能使铁钝化,因此该装置中铁钉几乎没被腐蚀,选项正确,D不符合题意;
故答案为:B
【分析】A.电解精炼铜时,粗铜作阳极,纯铜做阴极;
B.根据装置内所给物质发生的反应确定电池总反应;
C.图示装置为外接电源的阴极保护法,据此确定电极;
D.常温下,浓硫酸能使铁钝化;
13.【答案】A
【解析】【解答】解:将等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加少量组成原电池的条件CuSO4溶液,a中部分锌与硫酸铜反应生成铜,所以生成氢气总量减少,但构成铜锌原电池反应速率加快,故A正确。
故答案为:A
【分析】组成原电池,生成氢气的反应速率加快,所以a快反应时间短,又消耗少量锌置换铜,造成氢气总量减少
14.【答案】D
【解析】【解答】A.无论是析氢腐蚀还是吸氧腐蚀,铁都作负极,负极上发生的电极反应式都为Fe-2e-═Fe2+,故A不符合题意;
B.pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,所以开始时,发生的是析氢腐蚀,故B不符合题意;
C.一段时间后,亚硫酸根离子能被氧气氧化生成硫酸根离子,发生的是吸氧腐蚀,故C不符合题意;
D.析氢腐蚀的总反应为:Fe+2H+=Fe 2++H2↑,2Fe+O2+2H2O=2Fe(OH)2发生的是吸氧腐蚀,故D符合题意;
故答案为:D。
【分析】明确钢铁发生析氢腐蚀和吸氧腐蚀所需溶液的酸碱性是解本题的关键。pH=3的雨水说明该雨水是酸雨,溶液中溶有二氧化硫,酸性条件下,钢铁能发生析氢腐蚀,导致试管内气体压强增大,随着腐蚀的进行,溶液的酸性逐渐减小,亚硫酸根离子被氧气氧化生成硫酸根离子,导致试管内气体压强减小。
15.【答案】C
【解析】【解答】A.pH=2.0的溶液,酸性较强,因此锥形瓶中的Fe粉能发生析氢腐蚀,析氢腐蚀产生氢气,因此会导致锥形瓶内压强增大,故A不符合题意;
B.锥形瓶中的Fe粉和C粉构成了原电池,Fe粉作为原电池的负极,发生的电极反应式为:Fe-2e-═Fe2+,故B不符合题意;
C.若pH=4.0时只发生吸氧腐蚀,那么锥形瓶内的压强会有下降;而图中pH=4.0时,锥形瓶内的压强几乎不变,说明除了吸氧腐蚀,Fe粉还发生了析氢腐蚀,消耗氧气的同时也产生了氢气,因此锥形瓶内压强几乎不变,故C符合题意;
D.由图可知,pH=2.0时,锥形瓶内的溶解氧减少,说明有消耗氧气的吸氧腐蚀发生,同时锥形瓶内的气压增大,说明有产生氢气的析氢腐蚀发生;因此,正极反应式有:2H++2e-═H2↑和O2+4e-+4H+═2H2O,故D不符合题意;
故答案为:C。
【分析】Fe在酸性环境下会发生析氢腐蚀,产生氢气,会导致锥形瓶内压强增大;若介质的酸性很弱或呈中性,并且有氧气参与,此时Fe就会发生吸氧腐蚀,吸收氧气,会导致锥形瓶内压强减小。
16.【答案】C
【解析】【解答】解:A.两个溶液中都发生电化学腐蚀,铁均作负极,电极反应式为Fe﹣2e﹣=Fe2+,故A正确;
B.曲线a的压强随着反应的进行而逐渐增大,说明发生析氢腐蚀,发生析氢腐蚀的条件是酸性较强,则该容器中的盐酸pH=2,故B正确;
C.曲线b的压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,对应的应是酸性较弱的pH=4的盐酸溶液,电解质溶液呈酸性,正极反应为O2+4e﹣+4H+═2H2O,故C错误;
D.曲线b的压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,对应的应是酸性较弱的pH=4的盐酸溶液,所以在酸性溶液中生铁可能发生吸氧腐蚀,故D正确;
故选C.
【分析】据压强与时间关系图知,曲线a的压强随着反应的进行而逐渐增大,说明发生析氢腐蚀,对应的是酸性较强的pH=2的盐酸溶液;曲线b的压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,对应的应是酸性较弱的pH=4的盐酸溶液,根据原电池原理来分析解答.
17.【答案】(1)△H=
(2)吸氧(或电化学);
(3)氧化反应;左;;CuO
【解析】【解答】(1)已知在25℃、101kPa时,4g H2的物质的量为2mol,完全燃烧生成液态水,放出571.6kJ的热量,则表示H2摩尔燃烧焓的热化学方程式为:△H=,故答案为:△H=;
(2)炒过菜的铁锅未及时清洗含有盐,在空气中容易发生吸氧腐蚀(或电化学)而生锈,正极为氧气得电子,生成氢氧根,正极反应式为:,故答案为:吸氧(或电化学);;
(3)①甲池的总反应式为N2H4+O2=N2+2H2O,可知左边的电极(通入N2H4)为负极,右边的电极(通入O2)为正极,所以甲池中负极失电子,发生的是氧化反应;乙池中铁为阴极,石墨为阳极,SO向阳极移动,即向左移动,故答案为:氧化反应;左;
②乙池中电解硫酸铜溶液,生成铜和氧气,电解的离子方程为:,故答案为:;
③乙池中电解硫酸铜溶液,生成铜和氧气,要使乙池恢复到电解前的状态,应向溶液中加入CuO,故答案为:CuO。
【分析】(1)燃烧热是101kP时,1mol可燃物完全燃烧生成稳定产物时的反应热;
(2)在中性或弱碱性环境铁易发生吸氧腐蚀;
(3)①负极失电子发生氧化反应;电解时阴离子向阳极移动;
②利用放电顺序,电解硫酸铜溶液,生成铜和氧气;
③利用“出啥加啥”。
18.【答案】(1)化学
(2)负;Ag2S+2e-=2Ag +S2-
(3)3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓
(4)2H++NO +e-=NO2↑+H2O
【解析】【解答】(1)银质器皿日久表面逐渐变黑腐蚀的过程中,没有电流产生,属于化学腐蚀;
(2)由于金属活动性Al>Ag,因此铝质容器作为负极,银器作为正极,由银器上的Ag2S发生得电子的还原反应生成Ag和S2-,其电极反应式为:Ag2S+2e-=2Ag+S2-;
(3)处理过程中,Ag2S、Al和H2O反应生成Ag、H2S气体和AlOOH3沉淀,该反应的化学方程式为:3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓;
(4)若将食盐水用浓硝酸代替,由于常温下浓硝酸能使铝钝化,因此铝质容器做正极,由溶液中的NO3-发生得电子的还原反应,生成NO2,该电极反应式为:2H++NO3-+e-=NO2↑+H2O;
【分析】(1)根据腐蚀过程是否有电流产生分析属于何种腐蚀;
(2)根据金属活动性判断正负极和电极反应式;
(3)根据题干信息确定反应物和生成物,结合原子守恒书写反应的化学方程式;
(4)常温下,浓硝酸能使铝发生钝化,此时铝做正极,溶液中的NO3-发生得电子的还原反应;
19.【答案】(1)做还原剂(或失电子),失电子的场所,电子导体;Cu 2e =Cu2+
(2)2Cl +2H2O2OH +Cl2↑+H2↑;c;c口为阴极区,阴极发生反应:2H2O+2e-=O2↑+2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出;Cl2+H2O HCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集
(3)左;铜、铁和溶液构成原电池,铜为正极,发生吸氧腐蚀,反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH )>c(H+),溶液呈碱性
【解析】【解答】(1)①负极材料为Zn,即Zn做还原剂(或失电子),失电子的场所,同时Zn也是导电,可以作为电子导体;
②若用一根铜丝代替盐桥插入两烧杯中,则左侧烧杯中发生锌的吸氧腐蚀,为原电池,右侧烧杯为电解池,a电极与原电池的正极相连,为阳极,电极反应为Cu 2e =Cu2+;
(2)①电解饱和NaCl溶液时,阳极氯离子被氧化为氯气,阴极水电离出的氢离子被还原生成氢气,同时产生氢氧根,离子方程式为2Cl +2H2O2OH +Cl2↑+H2↑;
②c口为阴极区,阴极发生反应:2H2O+2e-=O2↑+2OH ,OH 在阴极生成,阳极的Na+通过阳离子交换膜进入阴极,因此NaOH在c口导出;
③阳极产生的氯气会和水发生反应:Cl2+H2O HCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集;
(3)铜、铁和溶液构成原电池,铜为正极,整个体系中发生Fe的吸氧腐蚀,正极反应为O2+4e +2H2O=4OH ,使左端附近溶液c(OH )>c(H+),溶液呈碱性,所以左端变红。
【分析】(1)①依据材料的性质和电极反应分析;
②依据串联电路中,能自发进行的装置作原电池,其余的装置均不电解池分析;
(2)①电解饱和NaCl溶液时,阳极氯离子被氧化为氯气,阴极水电离出的氢离子被还原生成氢气;
②利用阳离子通过阳离子交换膜进入阴极分析;
③根据影响化学平衡移动的因素分析;
(3)依据构成原电池,发生吸氧腐蚀判断。
20.【答案】(1)阳;阴;Cu2+ + 2e = Cu
(2)b;Zn -2e = Zn2+,牺牲阳极的阴极保护法,锌板被腐蚀溶解
(3)2Fe3+ +3Mg (OH)2= 2Fe (OH)3+3Mg2+
【解析】【解答】(1)电镀时,镀件作阴极、镀层金属作阳极,铁表面镀铜,以CuSO4溶液为电解液,铜作阳极,铜离子向阴极极移动,阴极的电极反应式为Cu2+ + 2e = Cu;
(2)利用“牺牲阳极的阴极保护法”,为了减缓海水对铁闸门A的腐蚀,材料B作负极,材料B的活泼性大于铁,可以选择锌板;锌作负极Zn -2e = Zn2+,锌板被腐蚀溶解,所以材料B需定期拆换;
(3)将FeCl3溶液滴加到Mg(OH)2悬浊液中,发生沉淀转化,有红褐色氢氧化铁沉淀产生,该变化的离子方程式为2Fe3+ +3Mg (OH)2= 2Fe (OH)3+3Mg2+。
【分析】(1)电镀时,镀层金属做阳极,镀件做阴极,铜离子在溶液中的移动方向与电流方向一致,阴极铜离子得到电子生成铜;
(2)形成原电池时,负极失电子被腐蚀,正极被保护;
(3)氢氧化铁更难溶实现了沉淀的转化。
21.【答案】(1)
(2)1
(3)增大
(4)N;牺牲阳极保护法或牺牲阳极的阴极保护
【解析】【解答】(1)甲烷电池以KOH溶液为电解质,其总反应的化学方程式为 。甲烷在负极反应,氧气在正极反应,负极电极反应为: 。
(2)消耗5.6L(标准状况下) 时,即0.25mol氧气,每个氧气分子转移4个电子,故有1mol电子转移。
(3)开始放电时,正极是氧气反应生成氢氧根离子,附近溶液的氢氧根离子浓度增大;
(4)钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。利用如图装置,可以模拟铁的电化学防护。
(4)①若X为碳棒,为减缓铁件的腐蚀,铁应为电解池的阴极,即开关K应置于N处。
②若X为锌,开关K置于M处,该装置为原电池,电化学防护法称为牺牲阳极保护法或牺牲阳极的阴极保护。
【分析】
(1)原电池中失电子的电极是负极,负极失电子发生氧化反应,正极上氧化剂得电子发生还原反应,以此分析;
(2)计算出氧气的物质的量即可求出转移电子数;
(3)根据放电时的正极反应来确定正极附近溶液的氢氧根离子浓度的变化;
(4)①若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极,作电解池的阴极被保护;
②若X为锌,开关K置于M处,构成原电池,Zn为负极被腐蚀,Fe为正极被保护.
