2.3化学反应进行的方向课件(共42张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.3化学反应进行的方向课件(共42张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 13:17:18 | ||
图片预览











文档简介
(共42张PPT)
第二章 第三节
化学反应进行的方向
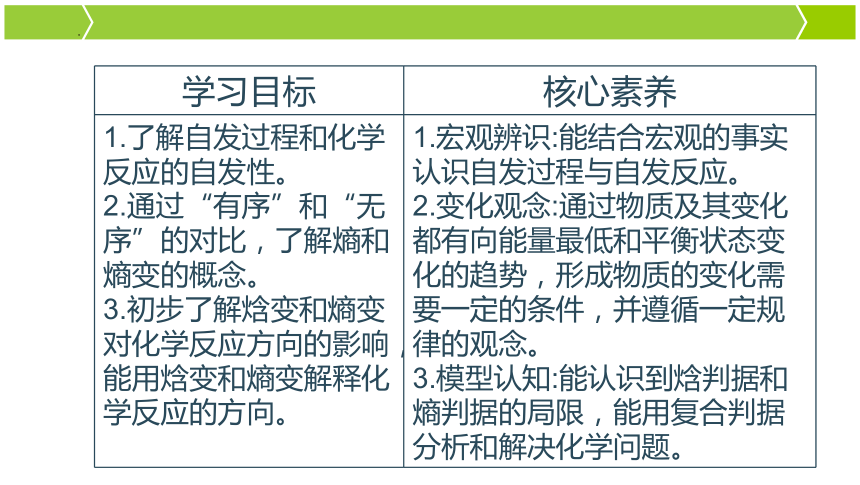
学习目标 核心素养
1.了解自发过程和化学反应的自发性。 2.通过“有序”和“无序”的对比,了解熵和熵变的概念。 3.初步了解焓变和熵变对化学反应方向的影响,能用焓变和熵变解释化学反应的方向。 1.宏观辨识:能结合宏观的事实认识自发过程与自发反应。
2.变化观念:通过物质及其变化都有向能量最低和平衡状态变化的趋势,形成物质的变化需要一定的条件,并遵循一定规律的观念。
3.模型认知:能认识到焓判据和熵判据的局限,能用复合判据分析和解决化学问题。
由热到冷
由密到稀
事物是否都是如此变化的呢
室温下冰融化
四时风光
思考:请同学们根据生活常识试列举生活中由哪些自发现象并试着给自发反应下一个定义?
与自然界中的许多变化一样,化学反应也具有方向性。
如: 化学反应中酸碱中和、铁器暴露在潮湿空气中生锈、甲烷和氧气的混合气体遇明火就燃烧、锌与CuSO4溶液反应生成Cu和ZnSO4等。
这些过程都是自发的,其逆过程就是非自发的.
【学习任务一】自发反应
非也~注意定义里的“给定条件”。如氢气和氧气反应需要点燃,但也是自发反应。
【学习任务一】自发反应
自发反应:在一定条件(温度、压强)下不需外界(光、电能)帮助,就能自动进行的反应。
注意定义里的“给定条件”。如氢气和氧气反应需要点燃,高温但也是自发反应。
自发反应不需要任何条件就能自发进行吗?
【学习任务二】反应自发性的判断依据
由热到冷
高能状态
低能状态
1. 焓判据(能量判据)
思考与讨论1:下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的原因吗?
① C3H8(g) +5 O2(g) = 3CO2(g) + 4H2O(l) △H=-2217.5kJ/mol
② 2Na(s)+Cl2(g)=2NaCl(s) △H=-882kJ/mol
③ C(s)+ O2(g)=CO2 (g) △H =-393.5kJ/mol
④ H2 (g) +F2(g) = 2HF(g) △H =-546.6kJ/mol
共同特点
总结:放热反应使体系能量降低,能量越低越稳定,△H < O 有利于反应自发进行
△H<0,放热反应。
即体系趋向于从高能状态转变为低能状态(稳定)
思考与讨论2:在19世纪,一些化学家认为,决定反应能否自发进行的因素是反应热,放热反应可以自发进行,而吸热反应不能自发进行。你同意这种观点吗?
回顾我们所学过的反应,试列举实例实际设计实验验证你的猜想
2NH4Cl(s) +Ba(OH)2.8H2O (s)= BaCl2(s)+2NH3(g)+10H2O(l) △H>0
该反应是吸热反应,但在常温下能自发进行
结论: 反应的焓变是制约化学反应能否自发进行的因素之一,但不是唯一的因素。
人们经过大量反应焓变的研究表明,大多数能自发进行的反应是放热反应。但是,有些吸热反应也能自发。因此,不能仅仅依靠焓变来判断反应是否自发。
由密到稀
体积膨胀
混乱程度增大
【学习任务二】反应自发性的判断依据
思考与讨论3:下列现象哪个混乱度大?哪个更有序?在化学上如果描述混乱度的?
熵:用来衡量体系混乱(无序)程度的物理量,用S表示。体系越混乱(无序),熵值越大,单位是J.mol-1.K-1。
【学习任务二】反应自发性的判断依据
2. 熵判据(混乱度判据)
熵变(△S):
△S=S(产物)-S(反应物)
△S>0,熵增反应
△S<0,熵减反应
【学习任务二】反应自发性的判断依据
①同一物质在不同状态下熵值不同,一般规律是:S(g)>S(l)>S(s)
S(高温)> S(低温); S(低压)> S(高压)
②在化学反应中,气态物质的系数增大,则熵增大。反之,则熵减小
2.关于下列过程熵变的判断不正确的是( )
A.溶解少量食盐于水中,△S>0 B.纯碳和氧气反应生成CO(g),△S>0
C.H2O(g)变成液态水,△S>0 D.CaCO3(s)加热分解为CaO(s)和CO2(g),△S>0
1.下列过程中△S<0的是( )
A.H2O(I)=H2O(g) B.C(s)+H2O(g)=CO(g)+H2(g)
C.N2(g)+3H2(g)=2NH3(g) D.2H2O(g)=2H2(g)+O2(g)
C
C
随
堂
练
习
课堂小游戏:巧拼魔方
墨水扩散
有序
无序
自发过程
有序
无序
自发过程
思考与讨论4:对比上述过程,是熵增过程容易自发,还是熵减过程容易自发?
越是有序的状态,越是难以维持
【学习任务二】反应自发性的判断依据
2. 熵判据(混乱度判据)
结论:密闭条件下,体系有从有序自发的转变为无序的倾向。
即△S>0有利于反应自发进行,也叫熵增原理,这就是熵判据
2N2O5(g)=4NO2(g) + O2(g) △H= +56.7kJ/mol
(NH4 ) 2CO3(s) =NH4HCO3(s)+NH3(g) △H= +74.9kJ/mol
请说说下列吸热反应能够自发进行的原因。
熵增反应(△S>0 )具有自发进行的倾向
△S>0
△S>0
【学习任务二】反应自发性的判断依据
2. 熵判据(混乱度判据)
【学习任务二】反应自发性的判断依据
结论;熵增加(ΔS>0)有利于化学反应的自发进行,但不全面。
思考与讨论9:所有自发进行的化学反应都是熵增的?
2H2(g)+O2(g)= 2H2O(l)
△S<0
NH3(g)+HCl(g)= NH4Cl(s) △S<0
都可自发进行
回顾我们所学过的反应,试列举实例
情况 焓变 熵变 反应能否自发进行
① ΔH<0 ΔS>0
② ΔH>0 ΔS<0
③ ΔH<0 ΔS<0
④ ΔH>0 ΔS>0
能
不能
无法判断
无法判断
【学习任务二】反应自发性的判断依据
室温 冰融化
-10 ℃ 水结冰
H2O(l) = H2O (s) △H <0 △S<0
H2O(s) = H2O (l) △H >0 △S>0
寻找全面的判据
复合判据:自由能ΔG=ΔH-TΔS ,化学反应总是向着自由能减小的方向进行,直到达到平衡。
当ΔG<0, 反应能自发进行;
当ΔG=0,反应处于平衡状态;
当ΔG>0, 反应不能自发进行。
【学习任务二】反应自发性的判断依据
3. 复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
反应在该状况下能否自发进行
<0 >0
>0 <0
>0 >0
<0 <0
H
S
G
<0
>0
低温时>0,高温时<0
低温时<0,高温时>0
自发进行
不自发进行
低温不自发,高温自发
低温自发,高温不自发
△S
△H
H<0
S>0
所有温度下
反应自发进行
H>0
S>0
高温下
反应自发进行
H<0
S<0
低温下
反应自发进行
H<0 , S<0
所有温度下
反应不能自发进行
3. 复合判据(ΔG=ΔH-TΔS )
知识点都掌握了吗?来做几道题检测下~
随
堂
练
习
【例1】(2021·莆田第七中学高二期末)下列过程是非自发的是
A.水由高处向低处流
B.氯气和溴化钾溶液的反应
C.铁在潮湿空气中生锈
D.室温下水结成冰
D
题型一:自发过程与自发反应
【例2】(2021·浙江高考真题)相同温度和压强下,关于物质熵的大小比较,合理的是
B
题型二:熵的大小比较
D
题型三:自由能判断反应进行的方向
【例4】(2021·云南省云天化中学高二期中)某化学反应 A(s)=D(g)+E(g)
ΔH-TΔS=(-4500+11T)kJ·mol-1(其中ΔH为焓变,ΔS为熵变,T为热力学温度,单位为K),要防止反应发生,温度必须
A.高于409 K B.低于136 K
C.高于136 K而低于409 K D.低于409 K
A
题型三:自由能判断反应进行的方向
【变5-1】焦炭常用于冶炼工业。已知反应①:2C(s)+O2(g)=2CO(g);反应②:2CO(g)+O2(g)=2CO2(g),反应①、②的反应趋势与温度关系如图所示。下列说法错误的是
A.反应②2CO(g)+O2(g)=2CO2(g)的ΔS<0,ΔH<0
B.983K是两个反应主次趋势变化的转折点
C.L1对应反应①
D.当温度低于983K时,过量焦炭的氧化产物以反应②生成CO2为主
C
题型三:自由能判断反应进行的方向
课堂小结
谢谢观看!
第二章 第三节
化学反应进行的方向
学习目标 核心素养
1.了解自发过程和化学反应的自发性。 2.通过“有序”和“无序”的对比,了解熵和熵变的概念。 3.初步了解焓变和熵变对化学反应方向的影响,能用焓变和熵变解释化学反应的方向。 1.宏观辨识:能结合宏观的事实认识自发过程与自发反应。
2.变化观念:通过物质及其变化都有向能量最低和平衡状态变化的趋势,形成物质的变化需要一定的条件,并遵循一定规律的观念。
3.模型认知:能认识到焓判据和熵判据的局限,能用复合判据分析和解决化学问题。
由热到冷
由密到稀
事物是否都是如此变化的呢
室温下冰融化
四时风光
思考:请同学们根据生活常识试列举生活中由哪些自发现象并试着给自发反应下一个定义?
与自然界中的许多变化一样,化学反应也具有方向性。
如: 化学反应中酸碱中和、铁器暴露在潮湿空气中生锈、甲烷和氧气的混合气体遇明火就燃烧、锌与CuSO4溶液反应生成Cu和ZnSO4等。
这些过程都是自发的,其逆过程就是非自发的.
【学习任务一】自发反应
非也~注意定义里的“给定条件”。如氢气和氧气反应需要点燃,但也是自发反应。
【学习任务一】自发反应
自发反应:在一定条件(温度、压强)下不需外界(光、电能)帮助,就能自动进行的反应。
注意定义里的“给定条件”。如氢气和氧气反应需要点燃,高温但也是自发反应。
自发反应不需要任何条件就能自发进行吗?
【学习任务二】反应自发性的判断依据
由热到冷
高能状态
低能状态
1. 焓判据(能量判据)
思考与讨论1:下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的原因吗?
① C3H8(g) +5 O2(g) = 3CO2(g) + 4H2O(l) △H=-2217.5kJ/mol
② 2Na(s)+Cl2(g)=2NaCl(s) △H=-882kJ/mol
③ C(s)+ O2(g)=CO2 (g) △H =-393.5kJ/mol
④ H2 (g) +F2(g) = 2HF(g) △H =-546.6kJ/mol
共同特点
总结:放热反应使体系能量降低,能量越低越稳定,△H < O 有利于反应自发进行
△H<0,放热反应。
即体系趋向于从高能状态转变为低能状态(稳定)
思考与讨论2:在19世纪,一些化学家认为,决定反应能否自发进行的因素是反应热,放热反应可以自发进行,而吸热反应不能自发进行。你同意这种观点吗?
回顾我们所学过的反应,试列举实例实际设计实验验证你的猜想
2NH4Cl(s) +Ba(OH)2.8H2O (s)= BaCl2(s)+2NH3(g)+10H2O(l) △H>0
该反应是吸热反应,但在常温下能自发进行
结论: 反应的焓变是制约化学反应能否自发进行的因素之一,但不是唯一的因素。
人们经过大量反应焓变的研究表明,大多数能自发进行的反应是放热反应。但是,有些吸热反应也能自发。因此,不能仅仅依靠焓变来判断反应是否自发。
由密到稀
体积膨胀
混乱程度增大
【学习任务二】反应自发性的判断依据
思考与讨论3:下列现象哪个混乱度大?哪个更有序?在化学上如果描述混乱度的?
熵:用来衡量体系混乱(无序)程度的物理量,用S表示。体系越混乱(无序),熵值越大,单位是J.mol-1.K-1。
【学习任务二】反应自发性的判断依据
2. 熵判据(混乱度判据)
熵变(△S):
△S=S(产物)-S(反应物)
△S>0,熵增反应
△S<0,熵减反应
【学习任务二】反应自发性的判断依据
①同一物质在不同状态下熵值不同,一般规律是:S(g)>S(l)>S(s)
S(高温)> S(低温); S(低压)> S(高压)
②在化学反应中,气态物质的系数增大,则熵增大。反之,则熵减小
2.关于下列过程熵变的判断不正确的是( )
A.溶解少量食盐于水中,△S>0 B.纯碳和氧气反应生成CO(g),△S>0
C.H2O(g)变成液态水,△S>0 D.CaCO3(s)加热分解为CaO(s)和CO2(g),△S>0
1.下列过程中△S<0的是( )
A.H2O(I)=H2O(g) B.C(s)+H2O(g)=CO(g)+H2(g)
C.N2(g)+3H2(g)=2NH3(g) D.2H2O(g)=2H2(g)+O2(g)
C
C
随
堂
练
习
课堂小游戏:巧拼魔方
墨水扩散
有序
无序
自发过程
有序
无序
自发过程
思考与讨论4:对比上述过程,是熵增过程容易自发,还是熵减过程容易自发?
越是有序的状态,越是难以维持
【学习任务二】反应自发性的判断依据
2. 熵判据(混乱度判据)
结论:密闭条件下,体系有从有序自发的转变为无序的倾向。
即△S>0有利于反应自发进行,也叫熵增原理,这就是熵判据
2N2O5(g)=4NO2(g) + O2(g) △H= +56.7kJ/mol
(NH4 ) 2CO3(s) =NH4HCO3(s)+NH3(g) △H= +74.9kJ/mol
请说说下列吸热反应能够自发进行的原因。
熵增反应(△S>0 )具有自发进行的倾向
△S>0
△S>0
【学习任务二】反应自发性的判断依据
2. 熵判据(混乱度判据)
【学习任务二】反应自发性的判断依据
结论;熵增加(ΔS>0)有利于化学反应的自发进行,但不全面。
思考与讨论9:所有自发进行的化学反应都是熵增的?
2H2(g)+O2(g)= 2H2O(l)
△S<0
NH3(g)+HCl(g)= NH4Cl(s) △S<0
都可自发进行
回顾我们所学过的反应,试列举实例
情况 焓变 熵变 反应能否自发进行
① ΔH<0 ΔS>0
② ΔH>0 ΔS<0
③ ΔH<0 ΔS<0
④ ΔH>0 ΔS>0
能
不能
无法判断
无法判断
【学习任务二】反应自发性的判断依据
室温 冰融化
-10 ℃ 水结冰
H2O(l) = H2O (s) △H <0 △S<0
H2O(s) = H2O (l) △H >0 △S>0
寻找全面的判据
复合判据:自由能ΔG=ΔH-TΔS ,化学反应总是向着自由能减小的方向进行,直到达到平衡。
当ΔG<0, 反应能自发进行;
当ΔG=0,反应处于平衡状态;
当ΔG>0, 反应不能自发进行。
【学习任务二】反应自发性的判断依据
3. 复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
反应在该状况下能否自发进行
<0 >0
>0 <0
>0 >0
<0 <0
H
S
G
<0
>0
低温时>0,高温时<0
低温时<0,高温时>0
自发进行
不自发进行
低温不自发,高温自发
低温自发,高温不自发
△S
△H
H<0
S>0
所有温度下
反应自发进行
H>0
S>0
高温下
反应自发进行
H<0
S<0
低温下
反应自发进行
H<0 , S<0
所有温度下
反应不能自发进行
3. 复合判据(ΔG=ΔH-TΔS )
知识点都掌握了吗?来做几道题检测下~
随
堂
练
习
【例1】(2021·莆田第七中学高二期末)下列过程是非自发的是
A.水由高处向低处流
B.氯气和溴化钾溶液的反应
C.铁在潮湿空气中生锈
D.室温下水结成冰
D
题型一:自发过程与自发反应
【例2】(2021·浙江高考真题)相同温度和压强下,关于物质熵的大小比较,合理的是
B
题型二:熵的大小比较
D
题型三:自由能判断反应进行的方向
【例4】(2021·云南省云天化中学高二期中)某化学反应 A(s)=D(g)+E(g)
ΔH-TΔS=(-4500+11T)kJ·mol-1(其中ΔH为焓变,ΔS为熵变,T为热力学温度,单位为K),要防止反应发生,温度必须
A.高于409 K B.低于136 K
C.高于136 K而低于409 K D.低于409 K
A
题型三:自由能判断反应进行的方向
【变5-1】焦炭常用于冶炼工业。已知反应①:2C(s)+O2(g)=2CO(g);反应②:2CO(g)+O2(g)=2CO2(g),反应①、②的反应趋势与温度关系如图所示。下列说法错误的是
A.反应②2CO(g)+O2(g)=2CO2(g)的ΔS<0,ΔH<0
B.983K是两个反应主次趋势变化的转折点
C.L1对应反应①
D.当温度低于983K时,过量焦炭的氧化产物以反应②生成CO2为主
C
题型三:自由能判断反应进行的方向
课堂小结
谢谢观看!
