第四章 化学反应与电能 单元训练卷(含解析)-2023--2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能 单元训练卷(含解析)-2023--2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 566.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:02:58 | ||
图片预览



文档简介
第四章 化学反应与电能 单元训练卷
一、单选题
1.下列关于铜电极的叙述中错误的是( )
A.锌铜原电池铜是正极
B.在镀件上镀铜时可用金属铜做阳极
C.用电解法精炼粗铜时粗铜做阴极
D.用电解法精炼粗铜时,Cu2+移向纯铜电极
2.如图所示的装置中,有关说法不正确的是( )
A.该原电池中极发生氧化反应 B.该原电池电流从极流向极
C.该原电池电解质溶液质量不变 D.该原电池将化学能转化为电能
3.下列电池不属于化学电池的是( )
A.锂电池 B.太阳能电池 C.燃料电池 D.碱性干电池
4.已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。下列说法正确的是( )
A.Ⅰ和Ⅱ的电池反应不相同
B.能量转化形式不同
C.Ⅰ的电流效率低于Ⅱ的电流效率
D.放电一段时间后,Ⅰ、Ⅱ中都只含1种溶质
5.向烧杯中加入下列物质,闭合K,电流计指针无明显偏转的是( )
A.NaOH B.NaCl C.蔗糖 D.H2SO4
6.我国科学家利用Na2CO3和碳纳米管组装“无Na预填装”的Na-CO2二次电池(如下图所示)。b电极中的碳纳米管可作导体、反应物和CO2通道等。电池的总反应 ,下列关于该电池的说法错误的是( )
A.不能用水配制电解液
B.电池组装后,在使用前必须先充电
C.放电时,电解液中的Na+向a电极移动
D.充电时,b极反应为2Na2CO3+C-4e-=4Na++3CO2↑
7.有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为燃料的用途之一就是用于制作燃料电池。有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。以下判断错误的是( )
A.电池正极发生的反应:O2+4e-=2O2-
B.电池负极发生的反应:CH4+4O2--8e-=CO2+2H2O
C.固体电解质里的O2-的移动方向:由正极流向负极
D.向外电路释放电子的电极:正极(即电子由正极流向负极)
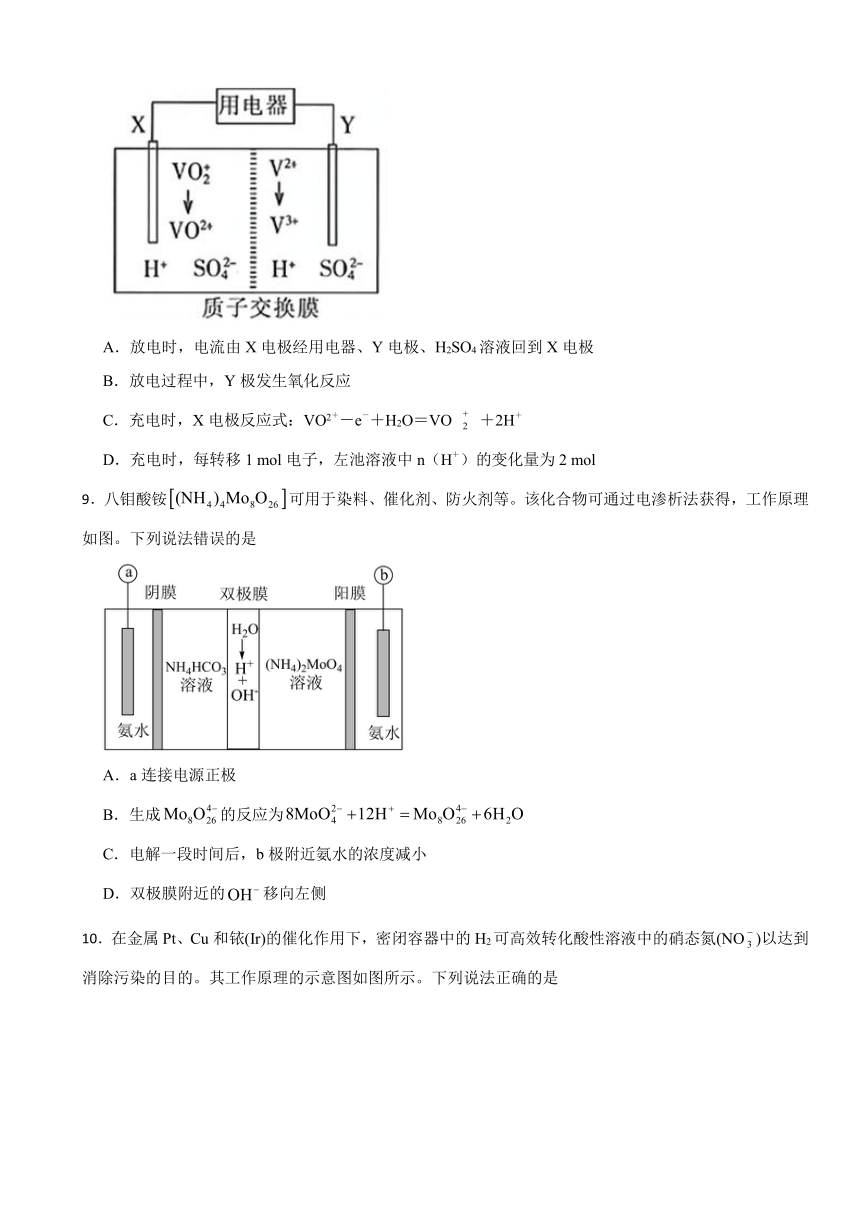
8.全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述错误的是( )
A.放电时,电流由X电极经用电器、Y电极、H2SO4溶液回到X电极
B.放电过程中,Y极发生氧化反应
C.充电时,X电极反应式:VO2+-e-+H2O=VO +2H+
D.充电时,每转移1 mol电子,左池溶液中n(H+)的变化量为2 mol
9.八钼酸铵可用于染料、催化剂、防火剂等。该化合物可通过电渗析法获得,工作原理如图。下列说法错误的是
A.a连接电源正极
B.生成的反应为
C.电解一段时间后,b极附近氨水的浓度减小
D.双极膜附近的移向左侧
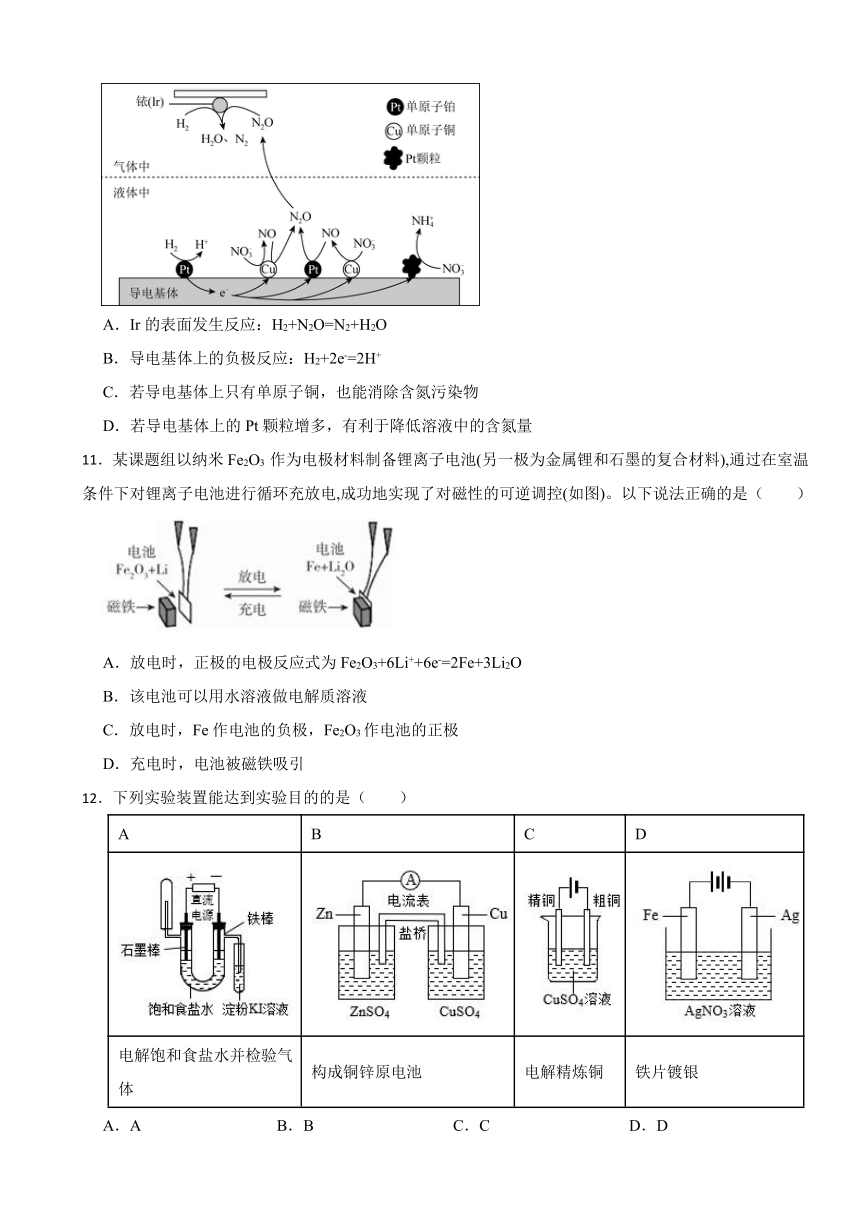
10.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO)以达到消除污染的目的。其工作原理的示意图如图所示。下列说法正确的是
A.Ir的表面发生反应:H2+N2O=N2+H2O
B.导电基体上的负极反应:H2+2e-=2H+
C.若导电基体上只有单原子铜,也能消除含氮污染物
D.若导电基体上的Pt颗粒增多,有利于降低溶液中的含氮量
11.某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是( )
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液做电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电时,电池被磁铁吸引
12.下列实验装置能达到实验目的的是( )
A B C D
电解饱和食盐水并检验气体 构成铜锌原电池 电解精炼铜 铁片镀银
A.A B.B C.C D.D
13.现有a、b、c、d四个金属电极,用导线两两相连组成原电池。①a、b相连插入硫酸铜溶液中后,b极变粗;②a、d相连插入稀硫酸中后,外电路电流从a流向d;③b、c相连插入稀硫酸中后,c极上有气泡产生;④c、d相连插入稀硫酸中后,d极溶解。则下列说法正确的是( )
A.由①和④可推出金属活动性:Cu>c
B.由②和③可推出金属活动性:d>c
C.由①②③可推出金属活动性:d>a>b>c
D.由①②④可推出金属活动性:a>b>d>c
14.硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是( )
A.电极a的电势比VB2极的高
B.VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C.放电时,OH-由VB2极向a电极移动
D.若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
15.实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )。
A.该原电池的正极反应:Zn-2e-=Zn2+
B.左边烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡生成
D.该电池总反应:3Zn+2Fe3+=2Fe+3Zn2+
16.CO2催化加氢制备甲醇的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49 kJ·mol-1,CO2电化学还原法制备甲醇的电解原理如图所示。下列说法错误的是( )
A.CO2催化加氢法在低温自发时△H的影响为主
B.a膜为阴离子交换膜,石墨电极上的电极反应式为4OH--4e-=2H2O+O2↑
C.电解过程中,右室溶液中物质的量减小
D.产生相同量CH3OH时,催化加氢法消耗的H2与电化学还原法产生的O2物质的量之比为2:1
二、综合题
17.甲烷在工业上有很多用途。回答下列问题:
Ⅰ.利用甲烷催化还原消除氮氧化物的污染:
ⅰ.;
ⅱ.;
ⅲ.。
其中:。
(1) (用含a、b的代数式表示)。
(2)在4L某恒容密闭容器中充入和,只发生反应ⅲ,的平衡转化率随温度的变化关系如图所示。
①曲线上m、n两点的正反应速率: (填“>”、“<”或“=”)。
②T1时,若反应进行到时达到平衡,此时测得混合气体的总压强为,则内, ,反应平衡常数 (用分压表示,分压=物质的量分数×总压)。
③下列说法正确的是 (填标号)。
A.当混合气体的密度不再随时间改变时,该反应达到平衡
B.该反应的反应物的键能总和小于生成物的键能总和
C.降低温度,有利于提高的转化率,反应平衡常数也增大
D.加入合适的催化剂,的值增大
(3)甲烷-氧气燃料电池的工作原理如图所示(L、K均为惰性电极,气体已换算成标准状况)。
①电池工作时,K电极上发生 (填“还原反应”或“氧化反应”)。
②L电极上的电极反应式为 。
③每消耗,电路中转移电子的物质的量为 mol。
18.钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为 。
(2)已知:2Mo(s)+3O2(g)=2MoO3(s) △H1;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H2;
MoS2(s)+2 O2(g)=Mo(s)+2SO2(g) △H3
则△H3= (用含△H1、△H2的代数式表示)
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-
①辉钼矿应放入电解槽的 (填“阴极区”或“阳极区”)。
②阴极的电极反应式为 。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
①由图1可知,该反应△H (填“>”或“<”)0,p1、p2、p3由大到小的顺序为 。
②由图2可知,A点时H2的平衡转化率为 。
③B点对应的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2。
19.完成下列各小题。
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,炒过菜的铁锅未及时清洗容易发生 腐蚀而生锈。请写出铁锅生锈过程的负极反应式: 。
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。
①甲池中N2H4发生的是 (填“氧化反应”或“还原反应”),乙池中SO向 移动(填“左”或“右”)。
②乙池中总反应的离子方程式为 。
③要使乙池恢复到反应前的状态,应向溶液中加入 (填化学式)。
20.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状况下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 。
21.与研究物质变化一样,研究化学反应中的能量变化,同样具有重要意义。请回答:
(1)已知二甲醚(CH3OCH3,常温下呈气态),H2的燃烧热分别为1455kJ/mol、286kJ/mol。请写出表示二甲醚燃烧热的热化学方程式 。利用二甲醚制取H2,总反应为CH3OCH3(g)+3H2O(g)6H2(g)+2CO2(g)。已知H2O(g)=H2O(l) △H=-44kJ/mol,则总反应的△H= 。总反应能自发进行的条件是 (选填“高温”“低温”或“任意温度”)。
(2)二甲醚制H2的总反应分两步完成:
二甲醚水解:CH3OCH3(g)+H2O(g)2CH3OH(g) 活化能Ea1
甲醇与水蒸气重整:CH3OH(g)+H2O(g)CO2(g)+3H2(g) 活化能Ea2
已知Ea1远小于Ea2。在恒温恒容容器内,一甲醚与水按1∶3投料进行制氢,请在图中画出甲醇(CH3OH)浓度随时间变化的曲线图 。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。某二甲醚熔融碳酸钾燃料电池的结构如图所示,Y为氧化物。负极的电极方程式为 。
答案解析部分
1.【答案】C
【解析】【解答】A.锌比铜活泼,在锌铜原电池中,铜是正极,选项A不符合题意;
B.在镀件上镀铜时,用金属铜作阳极,镀件为阴极,电解质为铜盐溶液,阴极上析出铜,选项B不符合题意;
C.用电解法精炼粗铜时,粗铜作阳极,精炼为阴极,粗铜中的锌、铁等活动性比铜强的金属发生氧化反应,变为金属阳离子进入溶液,活动性比Cu弱的银、金等金属则以单质的形式沉淀在容器底部,俗称阳极泥,从而可与铜分离,选项C符合题意;
D.用电解法精炼粗铜时,纯铜作阴极,Cu2+在阴极上获得电子,变为单质铜,从而起到提纯铜的目的,选项D不符合题意;
故答案为:C。
【分析】要注意原电池中活泼金属做负极,精炼铜是粗铜做阳极,电镀时,镀层做阳极。
2.【答案】C
【解析】【解答】A.该装置为原电池,锌比铜活泼,锌做负极,失电子发生氧化反应,故A不符合题意;
B.原电池中电子由负极流出经过外电路进入正极,该装置中,锌为负极、铜为正极,电子由锌极流向铜极,因此电流从极流向极,故B不符合题意;
C.该装置为原电池,锌做负极,发生氧化反应生成锌离子,铜为正极,铜离子得到电子发生还原反应在铜电极上析出铜,因此该反应的总反应为:Zn+Cu2+=Zn2++Cu;电解质溶液中每消耗1mol铜离子生成1mol锌离子,电解质溶液的质量增加,故C符合题意;
D.原电池为将化学能转化为电能的装置,故D不符合题意;
故答案为:C。
【分析】易错点;负极消耗Zn,正极析出铜,二者质量不相等,电解质溶液会发生变化
3.【答案】B
【解析】【解答】锂电池、燃料电池、碱性干电池都是化学能变为电能的装置,属于化学电池,太阳能电池是将太阳能转化为电能的装置,不属于化学电池,故B符合题意。
故答案为:B。
【分析】化学电池指通过化学反应,将化学能转化为电能的装置,太阳能电池是李用哪个太阳能发电,将太阳能转化为电能。
4.【答案】C
【解析】【解答】A.在两个装置中,负极都是Cu-2e-=Cu2+,正极都是Fe3++e-=Fe2+,因此两个装置的电池反应相同,都是2Fe3++Cu=Cu2++2Fe2+,A不符合题意;
B.两个装置都是原电池装置,其能量转化形式都是化学能转化为电能,B不符合题意;
C.装置Ⅰ中FeCl3溶液与Cu直接接触,导致二者直接发生反应,使得部分电子没有通过电路,而装置Ⅱ中采用阴离子交换膜可以使得Fe3+和Cu不接触,二者不会直接接触而反应,因此Ⅱ的电流效率更高,C符合题意;
D.放电一段时间后,Ⅰ中溶液的溶质为FeCl2和CuCl2,Ⅱ中左侧溶液的溶质为CuCl2,右侧溶液的溶质为FeCl2,两装置中溶质都有两种,D不符合题意;
故答案为:C
【分析】装置Ⅰ和装置Ⅱ都是原电池装置,且电极反应式都相同,结合电极反应和离子的移动分析选项即可。
5.【答案】C
【解析】【解答】电解质溶于水可以导电,酸碱盐都是电解质,蔗糖是非电解质,溶于水不导电,所以电流计指针无明显偏转,
故答案为:C。
【分析】形成原电池的条件:电极材料、电解质溶液、氧化还原反应、闭合回路。
6.【答案】C
【解析】【解答】A.由于该电池工作时有钠单质参与,钠会与水反应降低效率,所以不能用水配制电解液,A不符合题意;
B.根据题意可知该电池组装好时Al符合电极上没有钠单质,所以要先充电,生成钠单质,然后才能放电,B不符合题意;
C.放电时a极为负极,而原电池中阳离子向正极移动,即Na+向b电极移动,C符合题意;
D.充电时b为阳极,Na2CO3(s)/碳纳米管电极上C被氧化为二氧化碳,电极反应为2Na2CO3+C-4e-=4Na++3CO2↑,D不符合题意;
故答案为:C。
【分析】根据总反应可知充电时Na2CO3(s)/碳纳米管电极上C被氧化为二氧化碳,所以b电极为阳极,a电极为阴极,钠离子在Al复合电极上被还原为Na单质,则放电时a为负极,钠被氧化为Na+,b电极为正极,二氧化碳部分被还原为C单质,部分生成碳酸钠。
7.【答案】D
【解析】【解答】A.该燃料电池中,正极上氧气得电子生成氧离子,电极反应式为O2+4e-=2O2-,故A不符合题意;
B.负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4-8e-+4O2-=CO2+2H2O,故B不符合题意;
C.放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,故C不符合题意;
D.向外电路释放电子的电极:是负极,电子从负极流向正极,故D符合题意;
故答案为:D。
【分析】A.燃料电池的正极发生还原反应;
B.燃料电池的负极发生甲烷的氧化反应;
C.氧负离子向负极方向移动;
D.电子由负极流向正极。
8.【答案】D
【解析】【解答】A.放电时,电流与电子的流向相反,由X电极经用电器、Y电极、H2SO4溶液回到X电极,A叙述不符合题意;
B.放电过程中,Y极作电池的负极,失电子,发生氧化反应,B叙述不符合题意;
C.充电时,X电极作阳极,失电子,电极反应式为VO2+-e-+H2O=VO +2H+,C叙述不符合题意;
D.充电时,每转移1 mol电子,X电极产生2mol氢离子,左池中氢离子向右池转移1mol氢离子,则左池溶液中n(H+)的变化量为1mol,D叙述符合题意;
故答案为:D。
【分析】A.放电时是原电池、充电时是电解池
D.每转移1 mol电子,X电极产生2mol氢离子,左池中氢离子向右池转移1mol氢离子
9.【答案】C
【解析】【解答】A.由分析可知,a为阳极,连接电源正极,A不符合题意;
B.双极膜释放出氢离子向阴极移动和反应生成,生成的反应为,B不符合题意;
C.电解一段时间后,b极附近生成的氢氧根离子和左侧迁移过来的铵根离子生成一水合氨,氨水的浓度变大,C符合题意;
D.阴离子向阳极迁移,双极膜附近的移向左侧,D不符合题意;
故答案为:C。
【分析】电解时,阳极与直流电源的正极相连的电极,发生氧化反应;阴极与直流电源的负极相连的电极,发生还原反应;阴离子通过阴离子交换膜移向阳极,阳离子通过阳离子交换膜移向阴极。
10.【答案】A
【解析】【解答】A.根据图示可知,氢气与一氧化二氮在铱(Ir)的催化作用下发生氧化还原反应生成氮气:H2+N2O=N2+H2O,A符合题意;
B.根据图示可知导电基体上的负极是氢气失电子,发生氧化反应,导电基体上的负极反应:H2-2e-=2H+,B不符合题意;
C.若导电基体上只有单原子铜,则不能形成原电池,故不能消除含氮污染物,C不符合题意;
D.根据图示可知,若导电基体上的Pt颗粒增多,硝酸根离子得电子变为铵根离子,不利于降低溶液中的含氮量,D不符合题意;
故答案为:A。
【分析】A.Ir表面,氢气与一氧化二氮发生氧化还原反应生成氮气和水;
B.导电基体上,氢气失去电子生成氢离子;
C.只有单原子铜不能形成原电池;
D.导电基体上的Pt颗粒增多,硝酸根会更多的转化成铵根。
11.【答案】A
【解析】【解答】A.正极发生还原反应,Fe2O3得电子被还原,所以放电时电池正极的电极反应式为Fe2O3+6Li++6e-═3Li2O+2Fe,A符合题意;
B.锂和水能发生反应,所以不可以用水溶液为电解质溶液,B不符合题意;
C.放电时,Li作电池的负极,Fe2O3作电池的正极,C不符合题意;
D.充电时,Fe作为阳极生成Fe2O3,磁铁不可吸引Fe2O3,D不符合题意;
故答案为:A。
【分析】由图可知该电池放电时负极反应式为Li-e-═xLi+,正极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe;充电时,阳极、阴极电极反应式与放电时负极、正极电极反应式正好相反,以此解答该题。
12.【答案】B
【解析】【解答】A.铁棒作阴极,阴极上放电的是氢离子,而不是氯离子,所以阴极上得不到氯气,淀粉碘化钾溶液不会变蓝,故A不符合题意;
B.锌作负极,铜作正极,发生的自发氧化还原反应为:Zn + Cu2+ = Zn2+ + Cu,符合构成原电池的条件,故B符合题意;
C.电解精炼铜时,粗铜作阳极,纯铜作阴极,故C不符合题意;
D.铁作阳极,铁自身放电,消耗铁电极,无法镀银,故D不符合题意;
故答案为:B。
【分析】
A.阴极上发生还原反应,氢离子放电,无法得到氯气;
B.活泼金属电离,构成可自发反应的氧化还原反应;
C.根据电解精炼铜,阳极应是粗铜;
D.阳极氧化反应,活泼金属铁放电,消耗铁电极。
13.【答案】C
【解析】【解答】A.根据以上分析可知由①和④无法推出金属活动性:Cu>c,A不符合题意;
B.由②和③可推出金属活动性:d>a、b>c,无法判断d与c的金属性强弱,B不符合题意;
C.由①②③可推出金属活动性:d>a>b>c,C符合题意;
D.由①②④可推出金属活动性:d>a>b、d>c,b和c的金属性无法判断,D不符合题意;
故答案为:C。
【分析】原电池的角度进行分析,活泼金属作为负极,负极质量减少,正极质量增加或者生产气体,电子由负极经过导线流向正极,电流由正极经过导线流向负极。
14.【答案】C
【解析】【解答】A. 电极a是正极,VB2极是负极 ,所以电极a的电势比VB2极的高,故A不符合题意;
B.负极上是VB2失电子发生氧化反应,则VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O,故B不符合题意;
C. 硼化钒(VB2)-空气电池,氧气在正极上得电子,所以a为正极,放电时,OH-由正极向负极移动,由a极向VB2电极移动,故C符合题意;
D. 若采用稀盐酸作电解质溶液,V2O5要和盐酸反应,故该电池发生的总反应改变,故D不符合题意。
故答案为:C。
【分析】在原电池中,负极失去电子,化合价升高,发生氧化反应,正极得到电子,化合价降低,发生还原反应,负极失去的电子等于正极得到的电子。
15.【答案】B
【解析】【解答】A.Zn失去电子发生氧化反应,为负极反应,A不符合题意;
B.Fe3+在正极得电子被还原为Fe2+,溶液红色褪去,B符合题意;
C.铂电极上Fe3+被还原为Fe2+,没有气体生成,C不符合题意;
D.在负极Zn失去电子,变为Zn2+,Fe3+得到电子变为Fe2+,电池总反应为:Zn+2Fe3+=2Fe2++Zn2+,并没有单质生成,D不符合题意;
故答案为:B。
【分析】Zn失去电子发生氧化反应,为负极反应,Fe3+在正极得电子被还原为Fe2+,以此解答。
16.【答案】C
【解析】【解答】A.CO2催化加氢反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49 kJ·mol-1的正反应是气体体积减小的放热反应,△H<0,△S<0,要使反应自发进行,则△G=△H-T△S<0,则反应自发进行的外界条件在低温时△H的影响为主,A不符合题意;
B.在石墨电极上OH-失去电子变为O2逸出,电极反应式为4OH--4e-=2H2O+O2↑,OH-放电导致左侧阳离子浓度增大,为维持电荷守恒,溶液中的阴离子要通过离子交换膜a进入左侧,故a膜为阴离子交换膜,B不符合题意;
C.电解过程中,右室溶液中CO2得到电子被还原为CH3OH,右侧的电极反应式为CO2+6e-+6H+=CH3OH+H2O,可见在电解过程中不消耗,也不产生,故物质的量不变,C符合题意;
D.根据化学方程式CO2(g)+3H2(g)CH3OH(g)+H2O(g)可知:每反应产生1 mol CH3OH,反应消耗3 mol H2,根据电解方法可知:阳极的电极反应式为电极反应式为4OH--4e-=2H2O+O2↑,阴极的电极反应式为CO2+6e-+6H+=CH3OH+H2O,由于同一闭合回路中电子转移数目相等,可知总反应方程式为:2CO2+4H2O=2CH3OH+3O2,则产生等量CH3OH时,催化加氢法消耗的H2与电化学还原法产生的O2物质的量之比为6 mol:3 mol=2:1,D不符合题意;
故答案为:C。
【分析】A.反应自发进行的条件是△G=△H-T△S<0。
B.石墨电极上OH-失电子生成O2,OH-放电导致左侧阳离子浓度增大,为维持电荷守恒,溶液中的阴离子要通过离子交换膜a进入左侧。
C.右室溶液中CO2得电子生成CH3OH。
D.根据CO2(g)+3H2(g)CH3OH(g)+H2O(g)和2CO2+4H2O=2CH3OH+3O2进行分析。
17.【答案】(1)
(2)<;0.02;0.16;BC
(3)还原反应;;2
【解析】【解答】(1)观察三道热化学方程式,可知反应iii和反应i、反应ii的关系,根据反应iii,可知NO在反应中没有出现,需要将其抵消,则反应i和反应ii两式相加即可,相加后其化学方程式为,可发现和反应iii有倍数关系,即,因为b>a>0,则a-b<0,需要用“+”或者“-”表示放热和吸热,则,故答案为: ;
(2) ① 温度越高,速率越快,v(m)②CH4起始物质的量1mol,平衡时转化率为40%,即变化的物质的量为0.4mol,结合三段式
可知;
总物质的量为,则反应平衡常数,故答案为:0.02;0.16;
(3)A、恒容体积为定制,质量守恒,则密度为定值,A错误;
B、该反应为放热反应,则反应物的总键能小于生成物的总键能,B正确;
C、该反应为放热反应,降低温度,平衡朝逆向移动,NO2转化率减小,放热反应的平衡常数和温度为反比,C正确;
D、催化剂只能减小活化能,不影响反应热,D错误;
故答案为:BC;
(3)①氢离子由L移向K,则K为正极,正极发生还原反应,故答案为:还原反应;
② L电极为负极,通入的气体为CH4,失去电子形成二氧化碳和氢离子,故答案为: ;
③正极反应式为,,,则转移的电子数为2mol。
【分析】(1)盖斯定律的应用要注意,判断列出的热化学方程式的对应关系,左右两边相同的物质互相抵消则相加,在同一边相同的物质互相抵消则相减;
(2) ① 温度升高,正、逆反应速率都增大;
② 分压平衡常数的计算要结合总压强、总物质的量判断;
③ A、化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
B、反应物的总键能大于生成物的总键能,反应放热,反之反应吸热;
C、平衡移动的判断;
增大反应物浓度,平衡朝正向移动,被增加的反应物转化率减小,另一种反应物浓度增大,减小反应物的浓度则反之;
增大生产物浓度,平衡朝逆向移动,反应物的转化率减小,减少生成物的浓度则反之;
增大压强,减小体积,平衡朝气体体积缩小的方向移动,减小压强,增大体积则反之;
升高温度,平衡朝吸热方向移动,降低温度则反之;
D、催化剂不影响平衡移动和改变反应热;
(3) ① 负极发生氧化反应,正极发生还原反应;
②燃料电池中,负极为燃料失去电子,根据其元素组成,C生成二氧化碳或碳酸根,H生成水;
③ 结合化学计量数之比等于物质的量之比判断。
18.【答案】(1)6:1
(2) (△H2-△H1)
(3)阳极区;2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-)
(4)>;p3>p2>p1;50%;0.01
【解析】【解答】(1)在反应中N的化合价从+5→+4降低1价,Mo从0→+6升高6价,根据氧化还原反应中化合价升降总数相等,必有6个硝酸中N降低6×1=6价,同时有1个Mo升高1×6=6价,即6个硝酸和1个Mo同时反应,即氧化剂有6摩尔硝酸反应时,就有1摩尔还原剂钼反应,因此氧化剂与还原剂的物质的量之比为6:1,故答案为6:1;(2)根据盖斯定律2Mo(s)+3O2(g)=2MoO3(s)①;2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)②;MoS2(s)+2 O2(g)=Mo(s)+2SO2(g)③,(②式-①式)÷2=③式,所以△H3= (△H2-△H1),故答案为 (△H2-△H1);(3)将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-,所以辉钼矿应放入电解槽的阳极,故答案为阳极区;阴极区放电的阳离子为钠离子和氢离子,放电顺序氢离子在钠离子之前,阴极氢离子放电的电极反应为2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-),故答案为2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);(4)①由图1相同压强下,温度升高,氢气转化率增大,则平衡正向移动,又因为温度升高平衡向吸热反应方向移动,所以该反应正向吸热,△H>0,故答案为>;根据反应方程式MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)可知该反应正向为气体体积增大的方向,在相同温度下,压强越大氢气的转化率越小,由图1可知:在相同温度下p1下氢气的转化率最大,所以p1压强最小,p3下氢气的转化率最小,所以p3压强最大,所以p3>p2>p1,故答案为p3>p2>p1②由MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),设A混合气体的总物质的量为1mol,则A点时H2的物质的量为0.4mol,H2O的物质的量为0.4mol,则变化的H2的物质的量为0.4mol,A点时H2的为平衡转化率为α(H2)= =50%,故答案为50%
③B点时H2、CO的体积分数均为25%,混合气体为H2、CO、H2O,则H2O的体积分数为1-25%-25%=50%,B点对应的平衡常数K= =0.01,故答案为0.01
【分析】在分析图1那种有三个变量的图像时,一般做法是定一议二法,即先找相同压强下氢气平衡转化率与温度的关系,再定相同温度下氢气平衡转化率与压强的关系。
19.【答案】(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol
(2)电化学;Fe-2e-=Fe2+
(3)氧化反应;左;2Cu2++2H2O2Cu+O2↑+4H+;CuO
【解析】【解答】(1)N2H4和H2O2反应的化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),0.4mol液态肼完全反应放热256kJ,则1mol液态肼完全反应放热256kJ×
=640kJ/mol,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol;
(2)炒过菜的铁锅未及时清洗,为潮湿环境,且炒菜的铁锅为合金,所以会发生电化学腐蚀,负极为Fe被氧化为Fe2+,电极反应为Fe-2e-=Fe2+;
(3)①甲池中N2H4转化为N2,N元素化合价升高,所以发生氧化反应;N2H4被氧化,所以甲池中左侧电极为负极,右侧电极为正极,乙池为电解池,石墨电极与电源正极相连,为阳极,Fe电极为阴极,电解池中阴离子流向阳极,所以乙池中SO
向左移动;
②乙池中石墨为阳极,溶液中水电离出的氢氧根被氧化生成氧气,Fe电极为阴极,铜离子被还原为铜单质,总反应为2Cu2++2H2O
2Cu+O2↑+4H+;
③根据乙池总反应可知电解过程中从溶液中出来的为Cu和O2,所以应向溶液中加入CuO使之恢复反应前的状态。
【分析】(1)根据题给条件书写热化学方程式的原则写出;
(2)生铁的吸氧腐蚀中,负极上铁失电子发生氧化反应;
(3)①甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-;
②乙池为电解池,阴极Ag反应为Cu2++2e-=Cu、阳极石墨反应为4OH--4e-=2H2O+O2↑;
③根据析出什么加入什么原则使溶液恢复原状。
20.【答案】(1)正;4OH--4e-=2H2O+O2↑;2.8L;16g;甲中相当于电解水,故NaOH的浓度增大,碱性增强;乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,酸性增强;丙中为电解水,对于K2SO4而言,其pH几乎不变
(2)能;铜全部析出,可以继续电解H2SO4,有电解液即可电解
【解析】【解答】(1)①乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。
②甲中为氢氧化钠溶液,惰性电极相当于是电解水,b为阳极,氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑;
③丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2=2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。转移0.5mol电子,则生成O2为0.5mol/4=0.125mol,标况下的体积为0.125mol×22.4=2.8L。
④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5mol/2×64g/mol=16g。
⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
【分析】接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加,这说明c电极是阴极,溶液中的金属阳离子放电,因此M是负极,N是正极,结合电解原理分析解答。
21.【答案】(1)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol;129kJ/mol;高温
(2)
(3)CH3OCH3+6-12e-=8CO2+3H2O
【解析】【解答】(1)燃烧热是指1mol物质完全燃烧生成稳定物质所放出的热量,二甲醚的燃烧热为1455kJ/mol,则其燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol。氢气的燃烧热化学方程式为:H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol。设①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H1=-1455kJ/mol,②H2(g)+1/2O2(g)=H2O(l) △H2=-286kJ/mol,③H2O(g)=H2O(l) △H3=-44kJ/mol,④CH3OCH3(g)+3H2O(g)
6H2(g)+2CO2(g) △H,依据盖斯定律:④=①-②6+③3,△H=△H1-△H26+△H33,代入数值,求得△H=129kJ/mol。总反应反应后气体分子数增多,△S>0,而△H>0,因此总反应能自发进行的条件是高温。
(2)反应I的活化能比反应Ⅱ低,所以第一步转化为甲醇的反应进行较快,而第二步甲醇转化为氢气的反应进行较慢,这样会在短时间内造成甲醇的积累,随着时间推移,上述反应各自达到平衡,甲醇的浓度最终还会下降,因此图像中甲醇的浓度先上升,后下降,最后几乎不变,图像为:
(3)燃料电池中,氧气在正极发生还原反应,二甲醚在负极发生氧化反应。负极上二甲醚失电子,电极反应式为:CH3OCH3+6
-12e-=8CO2+3H2O。
【分析】 (1) 根据燃烧热的含义和盖斯定律书写热化学方程式、计算总反应的△H,根据△H-T△S分析反应自发的温度;
(2)根据Ea1远小于Ea2,甲醇先快速增加,然后又逐渐减小,达到平衡时不再改变;
(3)氧气为正极,二甲醚为负极,失电子后转化为二氧化碳,根据化合价确定失电子数,根据电荷守恒确定碳酸根离子的位置和系数。
一、单选题
1.下列关于铜电极的叙述中错误的是( )
A.锌铜原电池铜是正极
B.在镀件上镀铜时可用金属铜做阳极
C.用电解法精炼粗铜时粗铜做阴极
D.用电解法精炼粗铜时,Cu2+移向纯铜电极
2.如图所示的装置中,有关说法不正确的是( )
A.该原电池中极发生氧化反应 B.该原电池电流从极流向极
C.该原电池电解质溶液质量不变 D.该原电池将化学能转化为电能
3.下列电池不属于化学电池的是( )
A.锂电池 B.太阳能电池 C.燃料电池 D.碱性干电池
4.已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。下列说法正确的是( )
A.Ⅰ和Ⅱ的电池反应不相同
B.能量转化形式不同
C.Ⅰ的电流效率低于Ⅱ的电流效率
D.放电一段时间后,Ⅰ、Ⅱ中都只含1种溶质
5.向烧杯中加入下列物质,闭合K,电流计指针无明显偏转的是( )
A.NaOH B.NaCl C.蔗糖 D.H2SO4
6.我国科学家利用Na2CO3和碳纳米管组装“无Na预填装”的Na-CO2二次电池(如下图所示)。b电极中的碳纳米管可作导体、反应物和CO2通道等。电池的总反应 ,下列关于该电池的说法错误的是( )
A.不能用水配制电解液
B.电池组装后,在使用前必须先充电
C.放电时,电解液中的Na+向a电极移动
D.充电时,b极反应为2Na2CO3+C-4e-=4Na++3CO2↑
7.有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为燃料的用途之一就是用于制作燃料电池。有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。以下判断错误的是( )
A.电池正极发生的反应:O2+4e-=2O2-
B.电池负极发生的反应:CH4+4O2--8e-=CO2+2H2O
C.固体电解质里的O2-的移动方向:由正极流向负极
D.向外电路释放电子的电极:正极(即电子由正极流向负极)
8.全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述错误的是( )
A.放电时,电流由X电极经用电器、Y电极、H2SO4溶液回到X电极
B.放电过程中,Y极发生氧化反应
C.充电时,X电极反应式:VO2+-e-+H2O=VO +2H+
D.充电时,每转移1 mol电子,左池溶液中n(H+)的变化量为2 mol
9.八钼酸铵可用于染料、催化剂、防火剂等。该化合物可通过电渗析法获得,工作原理如图。下列说法错误的是
A.a连接电源正极
B.生成的反应为
C.电解一段时间后,b极附近氨水的浓度减小
D.双极膜附近的移向左侧
10.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO)以达到消除污染的目的。其工作原理的示意图如图所示。下列说法正确的是
A.Ir的表面发生反应:H2+N2O=N2+H2O
B.导电基体上的负极反应:H2+2e-=2H+
C.若导电基体上只有单原子铜,也能消除含氮污染物
D.若导电基体上的Pt颗粒增多,有利于降低溶液中的含氮量
11.某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是( )
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液做电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电时,电池被磁铁吸引
12.下列实验装置能达到实验目的的是( )
A B C D
电解饱和食盐水并检验气体 构成铜锌原电池 电解精炼铜 铁片镀银
A.A B.B C.C D.D
13.现有a、b、c、d四个金属电极,用导线两两相连组成原电池。①a、b相连插入硫酸铜溶液中后,b极变粗;②a、d相连插入稀硫酸中后,外电路电流从a流向d;③b、c相连插入稀硫酸中后,c极上有气泡产生;④c、d相连插入稀硫酸中后,d极溶解。则下列说法正确的是( )
A.由①和④可推出金属活动性:Cu>c
B.由②和③可推出金属活动性:d>c
C.由①②③可推出金属活动性:d>a>b>c
D.由①②④可推出金属活动性:a>b>d>c
14.硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是( )
A.电极a的电势比VB2极的高
B.VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C.放电时,OH-由VB2极向a电极移动
D.若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
15.实验发现,298 K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如图所示的原电池装置。下列有关说法中正确的是( )。
A.该原电池的正极反应:Zn-2e-=Zn2+
B.左边烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡生成
D.该电池总反应:3Zn+2Fe3+=2Fe+3Zn2+
16.CO2催化加氢制备甲醇的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49 kJ·mol-1,CO2电化学还原法制备甲醇的电解原理如图所示。下列说法错误的是( )
A.CO2催化加氢法在低温自发时△H的影响为主
B.a膜为阴离子交换膜,石墨电极上的电极反应式为4OH--4e-=2H2O+O2↑
C.电解过程中,右室溶液中物质的量减小
D.产生相同量CH3OH时,催化加氢法消耗的H2与电化学还原法产生的O2物质的量之比为2:1
二、综合题
17.甲烷在工业上有很多用途。回答下列问题:
Ⅰ.利用甲烷催化还原消除氮氧化物的污染:
ⅰ.;
ⅱ.;
ⅲ.。
其中:。
(1) (用含a、b的代数式表示)。
(2)在4L某恒容密闭容器中充入和,只发生反应ⅲ,的平衡转化率随温度的变化关系如图所示。
①曲线上m、n两点的正反应速率: (填“>”、“<”或“=”)。
②T1时,若反应进行到时达到平衡,此时测得混合气体的总压强为,则内, ,反应平衡常数 (用分压表示,分压=物质的量分数×总压)。
③下列说法正确的是 (填标号)。
A.当混合气体的密度不再随时间改变时,该反应达到平衡
B.该反应的反应物的键能总和小于生成物的键能总和
C.降低温度,有利于提高的转化率,反应平衡常数也增大
D.加入合适的催化剂,的值增大
(3)甲烷-氧气燃料电池的工作原理如图所示(L、K均为惰性电极,气体已换算成标准状况)。
①电池工作时,K电极上发生 (填“还原反应”或“氧化反应”)。
②L电极上的电极反应式为 。
③每消耗,电路中转移电子的物质的量为 mol。
18.钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为 。
(2)已知:2Mo(s)+3O2(g)=2MoO3(s) △H1;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H2;
MoS2(s)+2 O2(g)=Mo(s)+2SO2(g) △H3
则△H3= (用含△H1、△H2的代数式表示)
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-
①辉钼矿应放入电解槽的 (填“阴极区”或“阳极区”)。
②阴极的电极反应式为 。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
①由图1可知,该反应△H (填“>”或“<”)0,p1、p2、p3由大到小的顺序为 。
②由图2可知,A点时H2的平衡转化率为 。
③B点对应的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2。
19.完成下列各小题。
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,炒过菜的铁锅未及时清洗容易发生 腐蚀而生锈。请写出铁锅生锈过程的负极反应式: 。
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。
①甲池中N2H4发生的是 (填“氧化反应”或“还原反应”),乙池中SO向 移动(填“左”或“右”)。
②乙池中总反应的离子方程式为 。
③要使乙池恢复到反应前的状态,应向溶液中加入 (填化学式)。
20.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状况下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? 。
21.与研究物质变化一样,研究化学反应中的能量变化,同样具有重要意义。请回答:
(1)已知二甲醚(CH3OCH3,常温下呈气态),H2的燃烧热分别为1455kJ/mol、286kJ/mol。请写出表示二甲醚燃烧热的热化学方程式 。利用二甲醚制取H2,总反应为CH3OCH3(g)+3H2O(g)6H2(g)+2CO2(g)。已知H2O(g)=H2O(l) △H=-44kJ/mol,则总反应的△H= 。总反应能自发进行的条件是 (选填“高温”“低温”或“任意温度”)。
(2)二甲醚制H2的总反应分两步完成:
二甲醚水解:CH3OCH3(g)+H2O(g)2CH3OH(g) 活化能Ea1
甲醇与水蒸气重整:CH3OH(g)+H2O(g)CO2(g)+3H2(g) 活化能Ea2
已知Ea1远小于Ea2。在恒温恒容容器内,一甲醚与水按1∶3投料进行制氢,请在图中画出甲醇(CH3OH)浓度随时间变化的曲线图 。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。某二甲醚熔融碳酸钾燃料电池的结构如图所示,Y为氧化物。负极的电极方程式为 。
答案解析部分
1.【答案】C
【解析】【解答】A.锌比铜活泼,在锌铜原电池中,铜是正极,选项A不符合题意;
B.在镀件上镀铜时,用金属铜作阳极,镀件为阴极,电解质为铜盐溶液,阴极上析出铜,选项B不符合题意;
C.用电解法精炼粗铜时,粗铜作阳极,精炼为阴极,粗铜中的锌、铁等活动性比铜强的金属发生氧化反应,变为金属阳离子进入溶液,活动性比Cu弱的银、金等金属则以单质的形式沉淀在容器底部,俗称阳极泥,从而可与铜分离,选项C符合题意;
D.用电解法精炼粗铜时,纯铜作阴极,Cu2+在阴极上获得电子,变为单质铜,从而起到提纯铜的目的,选项D不符合题意;
故答案为:C。
【分析】要注意原电池中活泼金属做负极,精炼铜是粗铜做阳极,电镀时,镀层做阳极。
2.【答案】C
【解析】【解答】A.该装置为原电池,锌比铜活泼,锌做负极,失电子发生氧化反应,故A不符合题意;
B.原电池中电子由负极流出经过外电路进入正极,该装置中,锌为负极、铜为正极,电子由锌极流向铜极,因此电流从极流向极,故B不符合题意;
C.该装置为原电池,锌做负极,发生氧化反应生成锌离子,铜为正极,铜离子得到电子发生还原反应在铜电极上析出铜,因此该反应的总反应为:Zn+Cu2+=Zn2++Cu;电解质溶液中每消耗1mol铜离子生成1mol锌离子,电解质溶液的质量增加,故C符合题意;
D.原电池为将化学能转化为电能的装置,故D不符合题意;
故答案为:C。
【分析】易错点;负极消耗Zn,正极析出铜,二者质量不相等,电解质溶液会发生变化
3.【答案】B
【解析】【解答】锂电池、燃料电池、碱性干电池都是化学能变为电能的装置,属于化学电池,太阳能电池是将太阳能转化为电能的装置,不属于化学电池,故B符合题意。
故答案为:B。
【分析】化学电池指通过化学反应,将化学能转化为电能的装置,太阳能电池是李用哪个太阳能发电,将太阳能转化为电能。
4.【答案】C
【解析】【解答】A.在两个装置中,负极都是Cu-2e-=Cu2+,正极都是Fe3++e-=Fe2+,因此两个装置的电池反应相同,都是2Fe3++Cu=Cu2++2Fe2+,A不符合题意;
B.两个装置都是原电池装置,其能量转化形式都是化学能转化为电能,B不符合题意;
C.装置Ⅰ中FeCl3溶液与Cu直接接触,导致二者直接发生反应,使得部分电子没有通过电路,而装置Ⅱ中采用阴离子交换膜可以使得Fe3+和Cu不接触,二者不会直接接触而反应,因此Ⅱ的电流效率更高,C符合题意;
D.放电一段时间后,Ⅰ中溶液的溶质为FeCl2和CuCl2,Ⅱ中左侧溶液的溶质为CuCl2,右侧溶液的溶质为FeCl2,两装置中溶质都有两种,D不符合题意;
故答案为:C
【分析】装置Ⅰ和装置Ⅱ都是原电池装置,且电极反应式都相同,结合电极反应和离子的移动分析选项即可。
5.【答案】C
【解析】【解答】电解质溶于水可以导电,酸碱盐都是电解质,蔗糖是非电解质,溶于水不导电,所以电流计指针无明显偏转,
故答案为:C。
【分析】形成原电池的条件:电极材料、电解质溶液、氧化还原反应、闭合回路。
6.【答案】C
【解析】【解答】A.由于该电池工作时有钠单质参与,钠会与水反应降低效率,所以不能用水配制电解液,A不符合题意;
B.根据题意可知该电池组装好时Al符合电极上没有钠单质,所以要先充电,生成钠单质,然后才能放电,B不符合题意;
C.放电时a极为负极,而原电池中阳离子向正极移动,即Na+向b电极移动,C符合题意;
D.充电时b为阳极,Na2CO3(s)/碳纳米管电极上C被氧化为二氧化碳,电极反应为2Na2CO3+C-4e-=4Na++3CO2↑,D不符合题意;
故答案为:C。
【分析】根据总反应可知充电时Na2CO3(s)/碳纳米管电极上C被氧化为二氧化碳,所以b电极为阳极,a电极为阴极,钠离子在Al复合电极上被还原为Na单质,则放电时a为负极,钠被氧化为Na+,b电极为正极,二氧化碳部分被还原为C单质,部分生成碳酸钠。
7.【答案】D
【解析】【解答】A.该燃料电池中,正极上氧气得电子生成氧离子,电极反应式为O2+4e-=2O2-,故A不符合题意;
B.负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4-8e-+4O2-=CO2+2H2O,故B不符合题意;
C.放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,故C不符合题意;
D.向外电路释放电子的电极:是负极,电子从负极流向正极,故D符合题意;
故答案为:D。
【分析】A.燃料电池的正极发生还原反应;
B.燃料电池的负极发生甲烷的氧化反应;
C.氧负离子向负极方向移动;
D.电子由负极流向正极。
8.【答案】D
【解析】【解答】A.放电时,电流与电子的流向相反,由X电极经用电器、Y电极、H2SO4溶液回到X电极,A叙述不符合题意;
B.放电过程中,Y极作电池的负极,失电子,发生氧化反应,B叙述不符合题意;
C.充电时,X电极作阳极,失电子,电极反应式为VO2+-e-+H2O=VO +2H+,C叙述不符合题意;
D.充电时,每转移1 mol电子,X电极产生2mol氢离子,左池中氢离子向右池转移1mol氢离子,则左池溶液中n(H+)的变化量为1mol,D叙述符合题意;
故答案为:D。
【分析】A.放电时是原电池、充电时是电解池
D.每转移1 mol电子,X电极产生2mol氢离子,左池中氢离子向右池转移1mol氢离子
9.【答案】C
【解析】【解答】A.由分析可知,a为阳极,连接电源正极,A不符合题意;
B.双极膜释放出氢离子向阴极移动和反应生成,生成的反应为,B不符合题意;
C.电解一段时间后,b极附近生成的氢氧根离子和左侧迁移过来的铵根离子生成一水合氨,氨水的浓度变大,C符合题意;
D.阴离子向阳极迁移,双极膜附近的移向左侧,D不符合题意;
故答案为:C。
【分析】电解时,阳极与直流电源的正极相连的电极,发生氧化反应;阴极与直流电源的负极相连的电极,发生还原反应;阴离子通过阴离子交换膜移向阳极,阳离子通过阳离子交换膜移向阴极。
10.【答案】A
【解析】【解答】A.根据图示可知,氢气与一氧化二氮在铱(Ir)的催化作用下发生氧化还原反应生成氮气:H2+N2O=N2+H2O,A符合题意;
B.根据图示可知导电基体上的负极是氢气失电子,发生氧化反应,导电基体上的负极反应:H2-2e-=2H+,B不符合题意;
C.若导电基体上只有单原子铜,则不能形成原电池,故不能消除含氮污染物,C不符合题意;
D.根据图示可知,若导电基体上的Pt颗粒增多,硝酸根离子得电子变为铵根离子,不利于降低溶液中的含氮量,D不符合题意;
故答案为:A。
【分析】A.Ir表面,氢气与一氧化二氮发生氧化还原反应生成氮气和水;
B.导电基体上,氢气失去电子生成氢离子;
C.只有单原子铜不能形成原电池;
D.导电基体上的Pt颗粒增多,硝酸根会更多的转化成铵根。
11.【答案】A
【解析】【解答】A.正极发生还原反应,Fe2O3得电子被还原,所以放电时电池正极的电极反应式为Fe2O3+6Li++6e-═3Li2O+2Fe,A符合题意;
B.锂和水能发生反应,所以不可以用水溶液为电解质溶液,B不符合题意;
C.放电时,Li作电池的负极,Fe2O3作电池的正极,C不符合题意;
D.充电时,Fe作为阳极生成Fe2O3,磁铁不可吸引Fe2O3,D不符合题意;
故答案为:A。
【分析】由图可知该电池放电时负极反应式为Li-e-═xLi+,正极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe;充电时,阳极、阴极电极反应式与放电时负极、正极电极反应式正好相反,以此解答该题。
12.【答案】B
【解析】【解答】A.铁棒作阴极,阴极上放电的是氢离子,而不是氯离子,所以阴极上得不到氯气,淀粉碘化钾溶液不会变蓝,故A不符合题意;
B.锌作负极,铜作正极,发生的自发氧化还原反应为:Zn + Cu2+ = Zn2+ + Cu,符合构成原电池的条件,故B符合题意;
C.电解精炼铜时,粗铜作阳极,纯铜作阴极,故C不符合题意;
D.铁作阳极,铁自身放电,消耗铁电极,无法镀银,故D不符合题意;
故答案为:B。
【分析】
A.阴极上发生还原反应,氢离子放电,无法得到氯气;
B.活泼金属电离,构成可自发反应的氧化还原反应;
C.根据电解精炼铜,阳极应是粗铜;
D.阳极氧化反应,活泼金属铁放电,消耗铁电极。
13.【答案】C
【解析】【解答】A.根据以上分析可知由①和④无法推出金属活动性:Cu>c,A不符合题意;
B.由②和③可推出金属活动性:d>a、b>c,无法判断d与c的金属性强弱,B不符合题意;
C.由①②③可推出金属活动性:d>a>b>c,C符合题意;
D.由①②④可推出金属活动性:d>a>b、d>c,b和c的金属性无法判断,D不符合题意;
故答案为:C。
【分析】原电池的角度进行分析,活泼金属作为负极,负极质量减少,正极质量增加或者生产气体,电子由负极经过导线流向正极,电流由正极经过导线流向负极。
14.【答案】C
【解析】【解答】A. 电极a是正极,VB2极是负极 ,所以电极a的电势比VB2极的高,故A不符合题意;
B.负极上是VB2失电子发生氧化反应,则VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O,故B不符合题意;
C. 硼化钒(VB2)-空气电池,氧气在正极上得电子,所以a为正极,放电时,OH-由正极向负极移动,由a极向VB2电极移动,故C符合题意;
D. 若采用稀盐酸作电解质溶液,V2O5要和盐酸反应,故该电池发生的总反应改变,故D不符合题意。
故答案为:C。
【分析】在原电池中,负极失去电子,化合价升高,发生氧化反应,正极得到电子,化合价降低,发生还原反应,负极失去的电子等于正极得到的电子。
15.【答案】B
【解析】【解答】A.Zn失去电子发生氧化反应,为负极反应,A不符合题意;
B.Fe3+在正极得电子被还原为Fe2+,溶液红色褪去,B符合题意;
C.铂电极上Fe3+被还原为Fe2+,没有气体生成,C不符合题意;
D.在负极Zn失去电子,变为Zn2+,Fe3+得到电子变为Fe2+,电池总反应为:Zn+2Fe3+=2Fe2++Zn2+,并没有单质生成,D不符合题意;
故答案为:B。
【分析】Zn失去电子发生氧化反应,为负极反应,Fe3+在正极得电子被还原为Fe2+,以此解答。
16.【答案】C
【解析】【解答】A.CO2催化加氢反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=-49 kJ·mol-1的正反应是气体体积减小的放热反应,△H<0,△S<0,要使反应自发进行,则△G=△H-T△S<0,则反应自发进行的外界条件在低温时△H的影响为主,A不符合题意;
B.在石墨电极上OH-失去电子变为O2逸出,电极反应式为4OH--4e-=2H2O+O2↑,OH-放电导致左侧阳离子浓度增大,为维持电荷守恒,溶液中的阴离子要通过离子交换膜a进入左侧,故a膜为阴离子交换膜,B不符合题意;
C.电解过程中,右室溶液中CO2得到电子被还原为CH3OH,右侧的电极反应式为CO2+6e-+6H+=CH3OH+H2O,可见在电解过程中不消耗,也不产生,故物质的量不变,C符合题意;
D.根据化学方程式CO2(g)+3H2(g)CH3OH(g)+H2O(g)可知:每反应产生1 mol CH3OH,反应消耗3 mol H2,根据电解方法可知:阳极的电极反应式为电极反应式为4OH--4e-=2H2O+O2↑,阴极的电极反应式为CO2+6e-+6H+=CH3OH+H2O,由于同一闭合回路中电子转移数目相等,可知总反应方程式为:2CO2+4H2O=2CH3OH+3O2,则产生等量CH3OH时,催化加氢法消耗的H2与电化学还原法产生的O2物质的量之比为6 mol:3 mol=2:1,D不符合题意;
故答案为:C。
【分析】A.反应自发进行的条件是△G=△H-T△S<0。
B.石墨电极上OH-失电子生成O2,OH-放电导致左侧阳离子浓度增大,为维持电荷守恒,溶液中的阴离子要通过离子交换膜a进入左侧。
C.右室溶液中CO2得电子生成CH3OH。
D.根据CO2(g)+3H2(g)CH3OH(g)+H2O(g)和2CO2+4H2O=2CH3OH+3O2进行分析。
17.【答案】(1)
(2)<;0.02;0.16;BC
(3)还原反应;;2
【解析】【解答】(1)观察三道热化学方程式,可知反应iii和反应i、反应ii的关系,根据反应iii,可知NO在反应中没有出现,需要将其抵消,则反应i和反应ii两式相加即可,相加后其化学方程式为,可发现和反应iii有倍数关系,即,因为b>a>0,则a-b<0,需要用“+”或者“-”表示放热和吸热,则,故答案为: ;
(2) ① 温度越高,速率越快,v(m)
可知;
总物质的量为,则反应平衡常数,故答案为:0.02;0.16;
(3)A、恒容体积为定制,质量守恒,则密度为定值,A错误;
B、该反应为放热反应,则反应物的总键能小于生成物的总键能,B正确;
C、该反应为放热反应,降低温度,平衡朝逆向移动,NO2转化率减小,放热反应的平衡常数和温度为反比,C正确;
D、催化剂只能减小活化能,不影响反应热,D错误;
故答案为:BC;
(3)①氢离子由L移向K,则K为正极,正极发生还原反应,故答案为:还原反应;
② L电极为负极,通入的气体为CH4,失去电子形成二氧化碳和氢离子,故答案为: ;
③正极反应式为,,,则转移的电子数为2mol。
【分析】(1)盖斯定律的应用要注意,判断列出的热化学方程式的对应关系,左右两边相同的物质互相抵消则相加,在同一边相同的物质互相抵消则相减;
(2) ① 温度升高,正、逆反应速率都增大;
② 分压平衡常数的计算要结合总压强、总物质的量判断;
③ A、化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
B、反应物的总键能大于生成物的总键能,反应放热,反之反应吸热;
C、平衡移动的判断;
增大反应物浓度,平衡朝正向移动,被增加的反应物转化率减小,另一种反应物浓度增大,减小反应物的浓度则反之;
增大生产物浓度,平衡朝逆向移动,反应物的转化率减小,减少生成物的浓度则反之;
增大压强,减小体积,平衡朝气体体积缩小的方向移动,减小压强,增大体积则反之;
升高温度,平衡朝吸热方向移动,降低温度则反之;
D、催化剂不影响平衡移动和改变反应热;
(3) ① 负极发生氧化反应,正极发生还原反应;
②燃料电池中,负极为燃料失去电子,根据其元素组成,C生成二氧化碳或碳酸根,H生成水;
③ 结合化学计量数之比等于物质的量之比判断。
18.【答案】(1)6:1
(2) (△H2-△H1)
(3)阳极区;2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-)
(4)>;p3>p2>p1;50%;0.01
【解析】【解答】(1)在反应中N的化合价从+5→+4降低1价,Mo从0→+6升高6价,根据氧化还原反应中化合价升降总数相等,必有6个硝酸中N降低6×1=6价,同时有1个Mo升高1×6=6价,即6个硝酸和1个Mo同时反应,即氧化剂有6摩尔硝酸反应时,就有1摩尔还原剂钼反应,因此氧化剂与还原剂的物质的量之比为6:1,故答案为6:1;(2)根据盖斯定律2Mo(s)+3O2(g)=2MoO3(s)①;2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g)②;MoS2(s)+2 O2(g)=Mo(s)+2SO2(g)③,(②式-①式)÷2=③式,所以△H3= (△H2-△H1),故答案为 (△H2-△H1);(3)将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-,所以辉钼矿应放入电解槽的阳极,故答案为阳极区;阴极区放电的阳离子为钠离子和氢离子,放电顺序氢离子在钠离子之前,阴极氢离子放电的电极反应为2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-),故答案为2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-);(4)①由图1相同压强下,温度升高,氢气转化率增大,则平衡正向移动,又因为温度升高平衡向吸热反应方向移动,所以该反应正向吸热,△H>0,故答案为>;根据反应方程式MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s)可知该反应正向为气体体积增大的方向,在相同温度下,压强越大氢气的转化率越小,由图1可知:在相同温度下p1下氢气的转化率最大,所以p1压强最小,p3下氢气的转化率最小,所以p3压强最大,所以p3>p2>p1,故答案为p3>p2>p1②由MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),设A混合气体的总物质的量为1mol,则A点时H2的物质的量为0.4mol,H2O的物质的量为0.4mol,则变化的H2的物质的量为0.4mol,A点时H2的为平衡转化率为α(H2)= =50%,故答案为50%
③B点时H2、CO的体积分数均为25%,混合气体为H2、CO、H2O,则H2O的体积分数为1-25%-25%=50%,B点对应的平衡常数K= =0.01,故答案为0.01
【分析】在分析图1那种有三个变量的图像时,一般做法是定一议二法,即先找相同压强下氢气平衡转化率与温度的关系,再定相同温度下氢气平衡转化率与压强的关系。
19.【答案】(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol
(2)电化学;Fe-2e-=Fe2+
(3)氧化反应;左;2Cu2++2H2O2Cu+O2↑+4H+;CuO
【解析】【解答】(1)N2H4和H2O2反应的化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),0.4mol液态肼完全反应放热256kJ,则1mol液态肼完全反应放热256kJ×
=640kJ/mol,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol;
(2)炒过菜的铁锅未及时清洗,为潮湿环境,且炒菜的铁锅为合金,所以会发生电化学腐蚀,负极为Fe被氧化为Fe2+,电极反应为Fe-2e-=Fe2+;
(3)①甲池中N2H4转化为N2,N元素化合价升高,所以发生氧化反应;N2H4被氧化,所以甲池中左侧电极为负极,右侧电极为正极,乙池为电解池,石墨电极与电源正极相连,为阳极,Fe电极为阴极,电解池中阴离子流向阳极,所以乙池中SO
向左移动;
②乙池中石墨为阳极,溶液中水电离出的氢氧根被氧化生成氧气,Fe电极为阴极,铜离子被还原为铜单质,总反应为2Cu2++2H2O
2Cu+O2↑+4H+;
③根据乙池总反应可知电解过程中从溶液中出来的为Cu和O2,所以应向溶液中加入CuO使之恢复反应前的状态。
【分析】(1)根据题给条件书写热化学方程式的原则写出;
(2)生铁的吸氧腐蚀中,负极上铁失电子发生氧化反应;
(3)①甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-;
②乙池为电解池,阴极Ag反应为Cu2++2e-=Cu、阳极石墨反应为4OH--4e-=2H2O+O2↑;
③根据析出什么加入什么原则使溶液恢复原状。
20.【答案】(1)正;4OH--4e-=2H2O+O2↑;2.8L;16g;甲中相当于电解水,故NaOH的浓度增大,碱性增强;乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,酸性增强;丙中为电解水,对于K2SO4而言,其pH几乎不变
(2)能;铜全部析出,可以继续电解H2SO4,有电解液即可电解
【解析】【解答】(1)①乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。
②甲中为氢氧化钠溶液,惰性电极相当于是电解水,b为阳极,氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑;
③丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2=2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。转移0.5mol电子,则生成O2为0.5mol/4=0.125mol,标况下的体积为0.125mol×22.4=2.8L。
④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5mol/2×64g/mol=16g。
⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
【分析】接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加,这说明c电极是阴极,溶液中的金属阳离子放电,因此M是负极,N是正极,结合电解原理分析解答。
21.【答案】(1)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol;129kJ/mol;高温
(2)
(3)CH3OCH3+6-12e-=8CO2+3H2O
【解析】【解答】(1)燃烧热是指1mol物质完全燃烧生成稳定物质所放出的热量,二甲醚的燃烧热为1455kJ/mol,则其燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol。氢气的燃烧热化学方程式为:H2(g)+1/2O2(g)=H2O(l) △H=-286kJ/mol。设①CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H1=-1455kJ/mol,②H2(g)+1/2O2(g)=H2O(l) △H2=-286kJ/mol,③H2O(g)=H2O(l) △H3=-44kJ/mol,④CH3OCH3(g)+3H2O(g)
6H2(g)+2CO2(g) △H,依据盖斯定律:④=①-②6+③3,△H=△H1-△H26+△H33,代入数值,求得△H=129kJ/mol。总反应反应后气体分子数增多,△S>0,而△H>0,因此总反应能自发进行的条件是高温。
(2)反应I的活化能比反应Ⅱ低,所以第一步转化为甲醇的反应进行较快,而第二步甲醇转化为氢气的反应进行较慢,这样会在短时间内造成甲醇的积累,随着时间推移,上述反应各自达到平衡,甲醇的浓度最终还会下降,因此图像中甲醇的浓度先上升,后下降,最后几乎不变,图像为:
(3)燃料电池中,氧气在正极发生还原反应,二甲醚在负极发生氧化反应。负极上二甲醚失电子,电极反应式为:CH3OCH3+6
-12e-=8CO2+3H2O。
【分析】 (1) 根据燃烧热的含义和盖斯定律书写热化学方程式、计算总反应的△H,根据△H-T△S分析反应自发的温度;
(2)根据Ea1远小于Ea2,甲醇先快速增加,然后又逐渐减小,达到平衡时不再改变;
(3)氧气为正极,二甲醚为负极,失电子后转化为二氧化碳,根据化合价确定失电子数,根据电荷守恒确定碳酸根离子的位置和系数。
