2.1 课时2 影响化学反应速率的因素 活化能 课件(共20张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1 课时2 影响化学反应速率的因素 活化能 课件(共20张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:23:19 | ||
图片预览







文档简介
(共20张PPT)
第一节 化学反应速率 课时2
第二章 化学反应速率与化学平衡
1.了解化学反应速率的影响因素。
2.能用简单碰撞理论解释速率影响因素对反应速率的影响。
夏天,食物很快就会腐
烂变质,为此人们发明了冰箱。为什么将食品放在冰箱里就可以保存比较长的时间?
【思考】在必修的学习中,我们知道了钠和水、镁和水的反应速率是不一样的,这说明了什么问题?
在相同条件下,不同的化学反应会有不同的速率,这表明反应速率首先是由反应物的组成、结构和性质等因素决定的。
一、化学反应速率的影响因素
【思考】除了物质本身的结构性质外,我们发现外界因素也会对化学反应速率造成影响。请举出一些生活中的例子,并说明相关的影响因素是什么?
浓度、压强、温度、催化剂、表面积、光、放射线辐射、电弧、强磁场、高速研磨、超声波、原电池与电解池、等等。向反应体系输入能量,都有可能改变化学反应速率。
浓度、温度、催化剂等因素如何影响化学反应速率
1.浓度对化学反应速率的影响
5mL 0.1mol/L H2SO4
+ 5mL 0.1mol/L Na2S2O3
出现淡黄色浑浊慢
出现淡黄色浑浊快
【结论】其它条件相同时,增大反应物浓度,反应速率增大;减小反应物浓度,反应速率减小。
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
5mL 0.5mol/L H2SO4
+ 5mL 0.1mol/L Na2S2O3
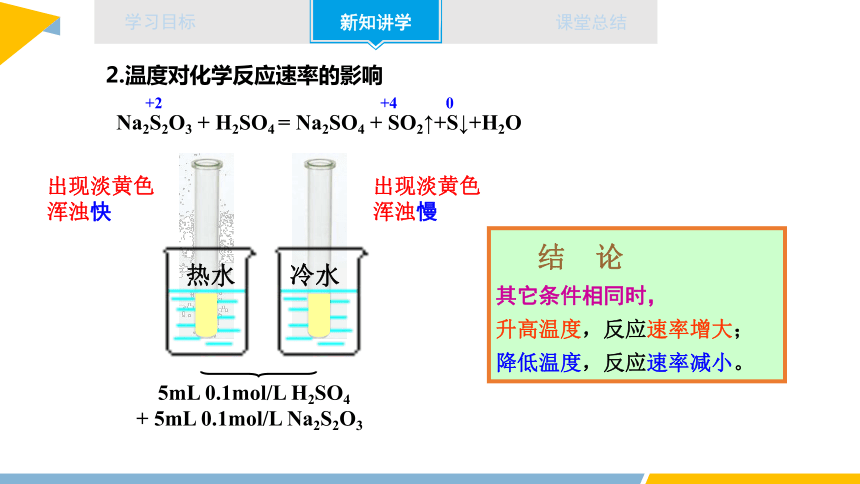
2.温度对化学反应速率的影响
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
5mL 0.1mol/L H2SO4
+ 5mL 0.1mol/L Na2S2O3
热水
冷水
出现淡黄色
浑浊快
出现淡黄色
浑浊慢
结 论
其它条件相同时,
升高温度,反应速率增大;
降低温度,反应速率减小。
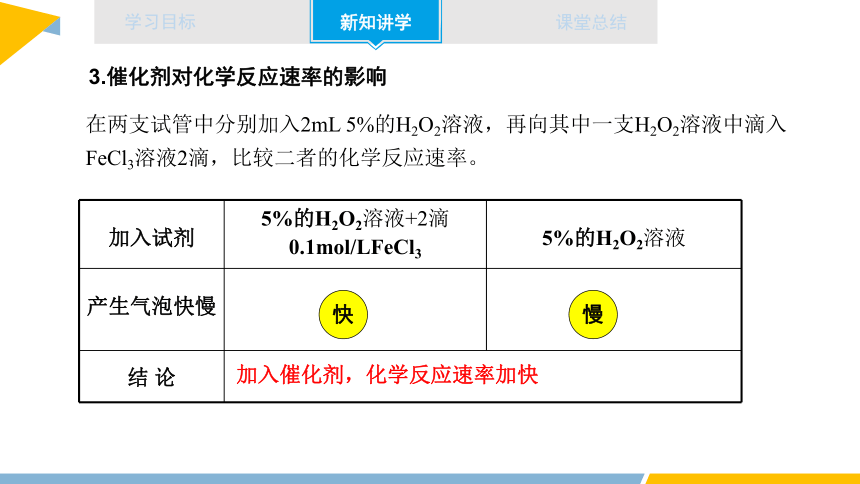
在两支试管中分别加入2mL 5%的H2O2溶液,再向其中一支H2O2溶液中滴入FeCl3溶液2滴,比较二者的化学反应速率。
加入试剂 5%的H2O2溶液+2滴0.1mol/LFeCl3 5%的H2O2溶液
产生气泡快慢
结 论
快
慢
加入催化剂,化学反应速率加快
3.催化剂对化学反应速率的影响
【实验小结】
当其他条件相同时,
增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小。
升高温度,化学反应速率增大;降低温度,化学反应速率减小。大量实验证明,温度每升高100C,化学反应速率通常增大为原来的2~4倍。这表明温度对反应速率的影响非常显著。
催化剂可以改变化学反应速率。
对于有气体参加的化学反应,改变压强同样可以改变化学反应速率。
二、活化分子与活化能
如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢
1918年,路易斯提出了化学反应速率的简单碰撞理论。该理论认为,反应物分子间的碰撞是化学反应的先决条件。反应物分子间有效碰撞的频率越高,化学反应速率越大。
简单碰撞理论
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI= H2+ I2 的反应历程。反应历程又称反应机理。
1.反应机理
2HI=H2+I2
第一步: 2HI → H2 +2I
第二步: 2I → I2
实际过程
自由基
气体分子的碰撞频率:任何气体中分子间的碰撞次数都是非常巨大的。气体的浓度为1mol/L时,在每立方厘米、每秒内反应物分子的碰撞可达1028次 ,如果反应物分子间的任何一次碰撞都能发生反应,反应只需10-5 s就可以完成。任何气体的反应均可瞬间完成。但实际并非如此。
2.有效碰撞
基元反应的发生:有效碰撞
有效碰撞:能够发生化学反应的碰撞。
碰撞时取向不合适
碰撞时能量不足
有效碰撞
有效碰撞的条件:
①足够的能力
②合适的取向
活化分子:能够发生有效碰撞的分子。
活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
反应物分子
平均能量
反应的
活化能
活化分子
3.简单碰撞理论解释温度对化学反应速率的影响
其他条件相同时,升高温度→单位体积内活化分子数目增多→单位体积内活化分子百分数增多→单位时间内有效碰撞次数增多→化学反应速率增大。
升高温度
4.简单碰撞理论解释浓度对化学反应速率的影响
其他条件相同时,增大反应物浓度→单位体积内活化分子数目增多→单位时间内有效碰撞次数增多→化学反应速率增大
增大浓度
5.简单碰撞理论解释压强对化学反应速率的影响
气体P↑,V体↓,气体浓度↑
即单位体积内反应物分子总数↑
单位体积内活化分子数↑
有效碰撞次数↑
v ↑
增大压强
6.简单碰撞理论解释催化剂对化学反应速率的影响
当其他条件相同时,使用催化剂,改变反应历程→活化能降低→活化分子百分数增多→单位体积、单位时间内有效碰撞次数增多→化学反应速率增大
1.采用N2O5为硝化剂是一种新型的绿色硝化技术,在材料、医药等工业中得到广泛应用。对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5 NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_________。
A. v(第一步的逆反应)>v(第二步反应)
B. 反应的中间产物只有NO3
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应活化能较高
AC
练一练
2.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法不正确的是( )
A.每活化一个氧分子吸收0.29eV能量
B.水可使氧分子活化反应的活化能降低0.18eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
A
练一练
化学反应速率的影响因素:①内因——反应物的性质
②外因——浓度、温度、压强、催化剂等
单位时间内、
单位体积内
有效碰撞次数增多
增大化学反应速率
单位体积内
活化分子
百分数增大
单位体积内
活化分子数增大
增大浓度
升高温度
使用催化剂
增大压强
简单碰撞理论:①有效碰撞
②活化分子
③活化能
简单碰撞理论解释反应条件对化学反应速率的影响
第一节 化学反应速率 课时2
第二章 化学反应速率与化学平衡
1.了解化学反应速率的影响因素。
2.能用简单碰撞理论解释速率影响因素对反应速率的影响。
夏天,食物很快就会腐
烂变质,为此人们发明了冰箱。为什么将食品放在冰箱里就可以保存比较长的时间?
【思考】在必修的学习中,我们知道了钠和水、镁和水的反应速率是不一样的,这说明了什么问题?
在相同条件下,不同的化学反应会有不同的速率,这表明反应速率首先是由反应物的组成、结构和性质等因素决定的。
一、化学反应速率的影响因素
【思考】除了物质本身的结构性质外,我们发现外界因素也会对化学反应速率造成影响。请举出一些生活中的例子,并说明相关的影响因素是什么?
浓度、压强、温度、催化剂、表面积、光、放射线辐射、电弧、强磁场、高速研磨、超声波、原电池与电解池、等等。向反应体系输入能量,都有可能改变化学反应速率。
浓度、温度、催化剂等因素如何影响化学反应速率
1.浓度对化学反应速率的影响
5mL 0.1mol/L H2SO4
+ 5mL 0.1mol/L Na2S2O3
出现淡黄色浑浊慢
出现淡黄色浑浊快
【结论】其它条件相同时,增大反应物浓度,反应速率增大;减小反应物浓度,反应速率减小。
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
5mL 0.5mol/L H2SO4
+ 5mL 0.1mol/L Na2S2O3
2.温度对化学反应速率的影响
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑+S↓+H2O
+2 +4 0
5mL 0.1mol/L H2SO4
+ 5mL 0.1mol/L Na2S2O3
热水
冷水
出现淡黄色
浑浊快
出现淡黄色
浑浊慢
结 论
其它条件相同时,
升高温度,反应速率增大;
降低温度,反应速率减小。
在两支试管中分别加入2mL 5%的H2O2溶液,再向其中一支H2O2溶液中滴入FeCl3溶液2滴,比较二者的化学反应速率。
加入试剂 5%的H2O2溶液+2滴0.1mol/LFeCl3 5%的H2O2溶液
产生气泡快慢
结 论
快
慢
加入催化剂,化学反应速率加快
3.催化剂对化学反应速率的影响
【实验小结】
当其他条件相同时,
增大反应物浓度,化学反应速率增大;降低反应物浓度,化学反应速率减小。
升高温度,化学反应速率增大;降低温度,化学反应速率减小。大量实验证明,温度每升高100C,化学反应速率通常增大为原来的2~4倍。这表明温度对反应速率的影响非常显著。
催化剂可以改变化学反应速率。
对于有气体参加的化学反应,改变压强同样可以改变化学反应速率。
二、活化分子与活化能
如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢
1918年,路易斯提出了化学反应速率的简单碰撞理论。该理论认为,反应物分子间的碰撞是化学反应的先决条件。反应物分子间有效碰撞的频率越高,化学反应速率越大。
简单碰撞理论
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI= H2+ I2 的反应历程。反应历程又称反应机理。
1.反应机理
2HI=H2+I2
第一步: 2HI → H2 +2I
第二步: 2I → I2
实际过程
自由基
气体分子的碰撞频率:任何气体中分子间的碰撞次数都是非常巨大的。气体的浓度为1mol/L时,在每立方厘米、每秒内反应物分子的碰撞可达1028次 ,如果反应物分子间的任何一次碰撞都能发生反应,反应只需10-5 s就可以完成。任何气体的反应均可瞬间完成。但实际并非如此。
2.有效碰撞
基元反应的发生:有效碰撞
有效碰撞:能够发生化学反应的碰撞。
碰撞时取向不合适
碰撞时能量不足
有效碰撞
有效碰撞的条件:
①足够的能力
②合适的取向
活化分子:能够发生有效碰撞的分子。
活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差。
反应物分子
平均能量
反应的
活化能
活化分子
3.简单碰撞理论解释温度对化学反应速率的影响
其他条件相同时,升高温度→单位体积内活化分子数目增多→单位体积内活化分子百分数增多→单位时间内有效碰撞次数增多→化学反应速率增大。
升高温度
4.简单碰撞理论解释浓度对化学反应速率的影响
其他条件相同时,增大反应物浓度→单位体积内活化分子数目增多→单位时间内有效碰撞次数增多→化学反应速率增大
增大浓度
5.简单碰撞理论解释压强对化学反应速率的影响
气体P↑,V体↓,气体浓度↑
即单位体积内反应物分子总数↑
单位体积内活化分子数↑
有效碰撞次数↑
v ↑
增大压强
6.简单碰撞理论解释催化剂对化学反应速率的影响
当其他条件相同时,使用催化剂,改变反应历程→活化能降低→活化分子百分数增多→单位体积、单位时间内有效碰撞次数增多→化学反应速率增大
1.采用N2O5为硝化剂是一种新型的绿色硝化技术,在材料、医药等工业中得到广泛应用。对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5 NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_________。
A. v(第一步的逆反应)>v(第二步反应)
B. 反应的中间产物只有NO3
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应活化能较高
AC
练一练
2.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法不正确的是( )
A.每活化一个氧分子吸收0.29eV能量
B.水可使氧分子活化反应的活化能降低0.18eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
A
练一练
化学反应速率的影响因素:①内因——反应物的性质
②外因——浓度、温度、压强、催化剂等
单位时间内、
单位体积内
有效碰撞次数增多
增大化学反应速率
单位体积内
活化分子
百分数增大
单位体积内
活化分子数增大
增大浓度
升高温度
使用催化剂
增大压强
简单碰撞理论:①有效碰撞
②活化分子
③活化能
简单碰撞理论解释反应条件对化学反应速率的影响
