2.2 课时2 化学平衡常数 课件(共20张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2 课时2 化学平衡常数 课件(共20张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 854.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:23:47 | ||
图片预览





文档简介
(共20张PPT)
第二节 化学平衡 课时2
第二章 化学反应速率与化学平衡
1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
2.能够利用化学平衡常数进行简单的计算。
3.知道反应物的转化率计算方法。
在工业生产和实验室中,人们会遇到各种各样的可逆反应,如合成氨反应:
N2(g)+3H2(g)??? 2NH3(g)
该反应在一定条件下不可能进行完全,即存在一定的限度。而反应限度的大小对于生产和生活实际有着直接影响。因此还需关注化学反应的限度。那么怎样才能定量地描述化学反应的限度呢!化学反应中,反应物的转化程度会受到哪些因素的影响呢!
化化学平衡的改变,有规律可循吗?不同的化学平衡状态,反应物和生成物的浓度之间有什么关系呢?
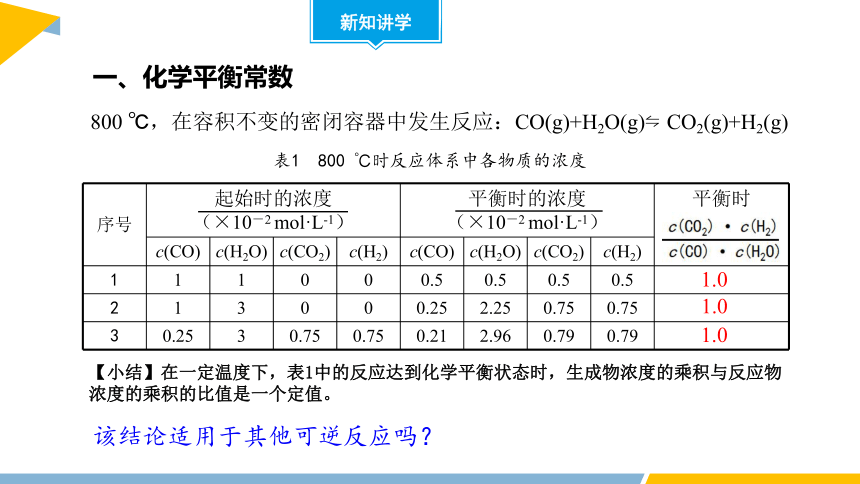
800 ℃,在容积不变的密闭容器中发生反应:CO(g)+H2O(g) CO2(g)+H2(g)
序号 起始时的浓度 (×10-2 mol·L-1) 平衡时的浓度 (×10-2 mol·L-1) 平衡时
c(CO) c(H2O) c(CO2) c(H2) c(CO) c(H2O) c(CO2) c(H2)
1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1.0
1.0
1.0
表1 800 ℃时反应体系中各物质的浓度
一、化学平衡常数
【小结】在一定温度下,表1中的反应达到化学平衡状态时,生成物浓度的乘积与反应物浓度的乘积的比值是一个定值。
该结论适用于其他可逆反应吗?
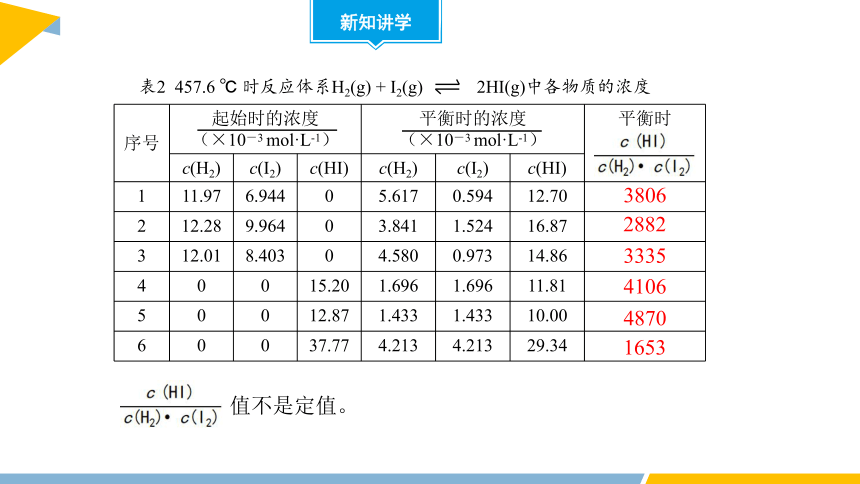
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
3806
2882
3335
4106
4870
1653
表2 457.6 ℃ 时反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度
值不是定值。
c(CO2) c(H2)
c(CO) c(H2O)
是定值
不是定值
c (HI)
c(H2) c(I2)
比较两个反应,结果的不同可能跟什么因素有关?
H2(g) + I2(g) HI(g) + HI(g)
H2(g) + I2(g) 2HI(g)
CO(g) + H2O(g) CO2(g) + H2(g)
化学计量数?
是定值?
c (HI) c(HI)
c(H2) c(I2)
是定值?
c2 (HI)
c(H2) c(I2)
即
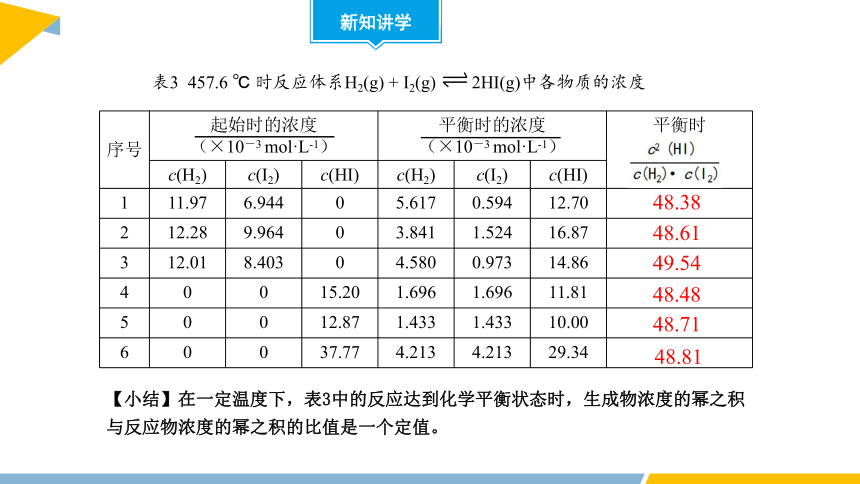
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
表3 457.6 ℃ 时反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度
48.38
48.61
49.54
48.48
48.71
48.81
【小结】在一定温度下,表3中的反应达到化学平衡状态时,生成物浓度的幂之积与反应物浓度的幂之积的比值是一个定值。
2.表达式
对于一般的可逆反应mA(g)+nB(g) pC(g)+qD(g),平衡常数的表达式为:
3.意义及影响因素
(1)K越大,说明正反应进行的程度越大,平衡时反应物的转化率越大。
(2)K只受温度影响,与反应物或生成物的浓度变化无关。
(3)常数K与正向建立平衡还是逆向建立平衡无关,即:K与平衡建立的过程无关。
1.定义
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,通常用符号K表示。
化学平衡常数
提示:一般来说,当K>105时,该反应就进行得基本完全了。
提示:计量系数次幂。
工业合成氨的反应N2+3H22NH3,某温度下,在同一密闭容积中发生该过程,可以表示出以下三个反应方程式:
①N2(g)+3H2(g)2NH3(g) △H1,平衡常数为K1;
②N2(g)+H2(g)NH3(g) △H2,平衡常数为K2;
③NH3(g)N2(g)+H2(g) △H3,平衡常数为K3。
三个平衡常数是否相等 请找出它们之间的关系。
c (NH3)
c1/2(N2) c3/2(H2)
K2=
c 2(NH3)
c(N2) c3(H2)
K1=
c (NH3)
c1/2(N2) c3/2(H2)
K3=
K1=, K2·K3=1,K1·=1。
不相等,
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
c4(H2)
c4(H2O)
K =
写一写
注:化学平衡常数是生成物浓度幂之积与反应物浓度幂之积的比值。
①表达式中的各物质的浓度必须为平衡浓度。
②平衡常数表达式与化学方程式的书写一一对应。
③固体、液体纯物质的浓度视为常数,在表达式中不出现。
写出下列可逆反应的平衡常数表达式。
浓度商
对于一般的可逆反应mA(g)+nB(g) pC(g)+qD(g),在任意时刻下,生成物浓度幂之积与反应物浓度幂之积的比值,称为浓度商,用Q表示。
c p(C)·cq(D)
cm(A) cn(B)
Q =
Q与K的关系:
QQ=K时,反应处于平衡状态;
Q>K时,反应向逆反应方向进行。
二、化学平衡常数相关计算
在某温度下,将H2和I2各0.1 mol的气态混合物充入10 L的密闭容器中,发生反应H2(g)+I2(g) 2HI(g),连续测定c(I2)的变化,5 s 时测定c(H2)=0.008 0 mol/L并保持不变。则此温度下,平衡常数值为多少?
【解】依题意可知,平衡时c(H2)=0.008 0 mol/L,消耗c(H2)=0.002 0 mol/L,生成c(HI)=0.004 0 mol/L。
H2(g) + I2(g) 2HI(g)
起始浓度(mol/L) 0.010 0.010 0
变化浓度(mol/L) 0.002 0 0.002 0 0.004 0
平衡浓度(mol/L) 0.008 0 0.008 0 0.004 0
K = = = 0.25
c 2(HI)
c(H2) c(I2)
0.004 2
0.0082
本书暂不考虑K的单位。
平衡转化率
注:n转化表示已转化的物质的量。
n始表示该物质起始时的物质的量。
c转化表示已转化的该物质的浓度。
c始表示起始时该物质的浓度。
平衡转化率是指某一可逆化学反应达到化学平衡状态时,转化为目的产物的某种原料的量占该种原料起始量的百分数
某指定反应物的转化率 α =
1.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如表所示:
练一练
T/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。该温度下加入2 mol CO2(g)和10mol H2(g)充分反应,达到平衡时,求CO2的转化率?
【解】依题意可知,该反应平衡常数表达式为:
c(CO2)·c(H2)
c(CO)·c(H2O)
K=
已知:c(CO2)·c(H2)=c(CO)·c(H2O),
∴K=1
查表可知对应温度为830 ℃
830
该温度下加入2 mol CO2(g)和10mol H2(g)充分反应,达到平衡时,求CO2的转化率?
CO2(g) + H2(g) CO(g) + H2O(g)
起始量(mol) 2 10 0 0
变化量(mol) x x x x
平衡量(mol) 2-x 10-x x x
设容器体积为V L,达到平衡时CO2的变化量为x mol
c(CO2)·c(H2)
c(CO)·c(H2O)
K=
= = 1
·
解得:x=
CO2的转化率为:α= ×100%=83%
mol
2mol
答:CO2的转化率为83%。
2.已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的初始浓度分别为c0(M)=1 mol·L-1,c0(N)=2.4 mol·L-1;达到平衡后,M的平衡转化率为60%,此时N的平衡转化率为 ;
(2)若反应温度不变,反应物的初始浓度分别为c0(M)=4 mol·L-1,c0(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= 。
解:(1)根据题意:
M(g) + N(g) P(g) + Q(g)
初始浓度/(mol·L-1) 1 2.4 0 0
转化浓度/(mol·L-1) 0.6 0.6 0.6 0.6
平衡浓度/(mol·L-1) 0.4 1.8 0.6 0.6
25%
6
3 .合成氨反应N2(g)+3H2(g)2NH3(g)在某温度下达到平衡时,各物质的浓度是c(N2)=3 mol·L-1,c(H2)=9 mol·L-1,c(NH3)=4 mol·L-1,则:
(1)该温度时的平衡常数为 ;起始浓度c(N2)= 。
(2)H2的转化率为 。
7.3×10-3
5 mol·L-1
40%
[解析] (1)K==≈7.3×10-3。
设起始时N2、H2的浓度分别为x、y。
N2 + 3H2 2NH3
起始 x y 0
平衡 3 mol·L-1 9 mol·L-1 4 mol·L-1
Δc x-3 mol·L-1 y-9 mol·L-1 4 mol·L-1
=,则x=5 mol·L-1;= ,则y=15 mol·L-1。
(2)H2的转化率=×100%=40%。
第二节 化学平衡 课时2
第二章 化学反应速率与化学平衡
1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。
2.能够利用化学平衡常数进行简单的计算。
3.知道反应物的转化率计算方法。
在工业生产和实验室中,人们会遇到各种各样的可逆反应,如合成氨反应:
N2(g)+3H2(g)??? 2NH3(g)
该反应在一定条件下不可能进行完全,即存在一定的限度。而反应限度的大小对于生产和生活实际有着直接影响。因此还需关注化学反应的限度。那么怎样才能定量地描述化学反应的限度呢!化学反应中,反应物的转化程度会受到哪些因素的影响呢!
化化学平衡的改变,有规律可循吗?不同的化学平衡状态,反应物和生成物的浓度之间有什么关系呢?
800 ℃,在容积不变的密闭容器中发生反应:CO(g)+H2O(g) CO2(g)+H2(g)
序号 起始时的浓度 (×10-2 mol·L-1) 平衡时的浓度 (×10-2 mol·L-1) 平衡时
c(CO) c(H2O) c(CO2) c(H2) c(CO) c(H2O) c(CO2) c(H2)
1 1 1 0 0 0.5 0.5 0.5 0.5
2 1 3 0 0 0.25 2.25 0.75 0.75
3 0.25 3 0.75 0.75 0.21 2.96 0.79 0.79
1.0
1.0
1.0
表1 800 ℃时反应体系中各物质的浓度
一、化学平衡常数
【小结】在一定温度下,表1中的反应达到化学平衡状态时,生成物浓度的乘积与反应物浓度的乘积的比值是一个定值。
该结论适用于其他可逆反应吗?
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
3806
2882
3335
4106
4870
1653
表2 457.6 ℃ 时反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度
值不是定值。
c(CO2) c(H2)
c(CO) c(H2O)
是定值
不是定值
c (HI)
c(H2) c(I2)
比较两个反应,结果的不同可能跟什么因素有关?
H2(g) + I2(g) HI(g) + HI(g)
H2(g) + I2(g) 2HI(g)
CO(g) + H2O(g) CO2(g) + H2(g)
化学计量数?
是定值?
c (HI) c(HI)
c(H2) c(I2)
是定值?
c2 (HI)
c(H2) c(I2)
即
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI)
1 11.97 6.944 0 5.617 0.594 12.70
2 12.28 9.964 0 3.841 1.524 16.87
3 12.01 8.403 0 4.580 0.973 14.86
4 0 0 15.20 1.696 1.696 11.81
5 0 0 12.87 1.433 1.433 10.00
6 0 0 37.77 4.213 4.213 29.34
表3 457.6 ℃ 时反应体系H2(g) + I2(g) 2HI(g)中各物质的浓度
48.38
48.61
49.54
48.48
48.71
48.81
【小结】在一定温度下,表3中的反应达到化学平衡状态时,生成物浓度的幂之积与反应物浓度的幂之积的比值是一个定值。
2.表达式
对于一般的可逆反应mA(g)+nB(g) pC(g)+qD(g),平衡常数的表达式为:
3.意义及影响因素
(1)K越大,说明正反应进行的程度越大,平衡时反应物的转化率越大。
(2)K只受温度影响,与反应物或生成物的浓度变化无关。
(3)常数K与正向建立平衡还是逆向建立平衡无关,即:K与平衡建立的过程无关。
1.定义
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,通常用符号K表示。
化学平衡常数
提示:一般来说,当K>105时,该反应就进行得基本完全了。
提示:计量系数次幂。
工业合成氨的反应N2+3H22NH3,某温度下,在同一密闭容积中发生该过程,可以表示出以下三个反应方程式:
①N2(g)+3H2(g)2NH3(g) △H1,平衡常数为K1;
②N2(g)+H2(g)NH3(g) △H2,平衡常数为K2;
③NH3(g)N2(g)+H2(g) △H3,平衡常数为K3。
三个平衡常数是否相等 请找出它们之间的关系。
c (NH3)
c1/2(N2) c3/2(H2)
K2=
c 2(NH3)
c(N2) c3(H2)
K1=
c (NH3)
c1/2(N2) c3/2(H2)
K3=
K1=, K2·K3=1,K1·=1。
不相等,
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g)
高温
c4(H2)
c4(H2O)
K =
写一写
注:化学平衡常数是生成物浓度幂之积与反应物浓度幂之积的比值。
①表达式中的各物质的浓度必须为平衡浓度。
②平衡常数表达式与化学方程式的书写一一对应。
③固体、液体纯物质的浓度视为常数,在表达式中不出现。
写出下列可逆反应的平衡常数表达式。
浓度商
对于一般的可逆反应mA(g)+nB(g) pC(g)+qD(g),在任意时刻下,生成物浓度幂之积与反应物浓度幂之积的比值,称为浓度商,用Q表示。
c p(C)·cq(D)
cm(A) cn(B)
Q =
Q与K的关系:
Q
Q>K时,反应向逆反应方向进行。
二、化学平衡常数相关计算
在某温度下,将H2和I2各0.1 mol的气态混合物充入10 L的密闭容器中,发生反应H2(g)+I2(g) 2HI(g),连续测定c(I2)的变化,5 s 时测定c(H2)=0.008 0 mol/L并保持不变。则此温度下,平衡常数值为多少?
【解】依题意可知,平衡时c(H2)=0.008 0 mol/L,消耗c(H2)=0.002 0 mol/L,生成c(HI)=0.004 0 mol/L。
H2(g) + I2(g) 2HI(g)
起始浓度(mol/L) 0.010 0.010 0
变化浓度(mol/L) 0.002 0 0.002 0 0.004 0
平衡浓度(mol/L) 0.008 0 0.008 0 0.004 0
K = = = 0.25
c 2(HI)
c(H2) c(I2)
0.004 2
0.0082
本书暂不考虑K的单位。
平衡转化率
注:n转化表示已转化的物质的量。
n始表示该物质起始时的物质的量。
c转化表示已转化的该物质的浓度。
c始表示起始时该物质的浓度。
平衡转化率是指某一可逆化学反应达到化学平衡状态时,转化为目的产物的某种原料的量占该种原料起始量的百分数
某指定反应物的转化率 α =
1.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如表所示:
练一练
T/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。该温度下加入2 mol CO2(g)和10mol H2(g)充分反应,达到平衡时,求CO2的转化率?
【解】依题意可知,该反应平衡常数表达式为:
c(CO2)·c(H2)
c(CO)·c(H2O)
K=
已知:c(CO2)·c(H2)=c(CO)·c(H2O),
∴K=1
查表可知对应温度为830 ℃
830
该温度下加入2 mol CO2(g)和10mol H2(g)充分反应,达到平衡时,求CO2的转化率?
CO2(g) + H2(g) CO(g) + H2O(g)
起始量(mol) 2 10 0 0
变化量(mol) x x x x
平衡量(mol) 2-x 10-x x x
设容器体积为V L,达到平衡时CO2的变化量为x mol
c(CO2)·c(H2)
c(CO)·c(H2O)
K=
= = 1
·
解得:x=
CO2的转化率为:α= ×100%=83%
mol
2mol
答:CO2的转化率为83%。
2.已知可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0,请回答下列问题:
(1)在某温度下,反应物的初始浓度分别为c0(M)=1 mol·L-1,c0(N)=2.4 mol·L-1;达到平衡后,M的平衡转化率为60%,此时N的平衡转化率为 ;
(2)若反应温度不变,反应物的初始浓度分别为c0(M)=4 mol·L-1,c0(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a= 。
解:(1)根据题意:
M(g) + N(g) P(g) + Q(g)
初始浓度/(mol·L-1) 1 2.4 0 0
转化浓度/(mol·L-1) 0.6 0.6 0.6 0.6
平衡浓度/(mol·L-1) 0.4 1.8 0.6 0.6
25%
6
3 .合成氨反应N2(g)+3H2(g)2NH3(g)在某温度下达到平衡时,各物质的浓度是c(N2)=3 mol·L-1,c(H2)=9 mol·L-1,c(NH3)=4 mol·L-1,则:
(1)该温度时的平衡常数为 ;起始浓度c(N2)= 。
(2)H2的转化率为 。
7.3×10-3
5 mol·L-1
40%
[解析] (1)K==≈7.3×10-3。
设起始时N2、H2的浓度分别为x、y。
N2 + 3H2 2NH3
起始 x y 0
平衡 3 mol·L-1 9 mol·L-1 4 mol·L-1
Δc x-3 mol·L-1 y-9 mol·L-1 4 mol·L-1
=,则x=5 mol·L-1;= ,则y=15 mol·L-1。
(2)H2的转化率=×100%=40%。
