3.1 课时2 电离平衡常数 课件(共23张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1 课时2 电离平衡常数 课件(共23张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
第三章 水溶液中的离子反应与平衡
第一节 电离平衡 课时2
1.能构建电离平衡常数模型,并能应用模型解释弱电解质在水溶液中发生的变化;
2.能解决与电离平衡常数有关的计算。
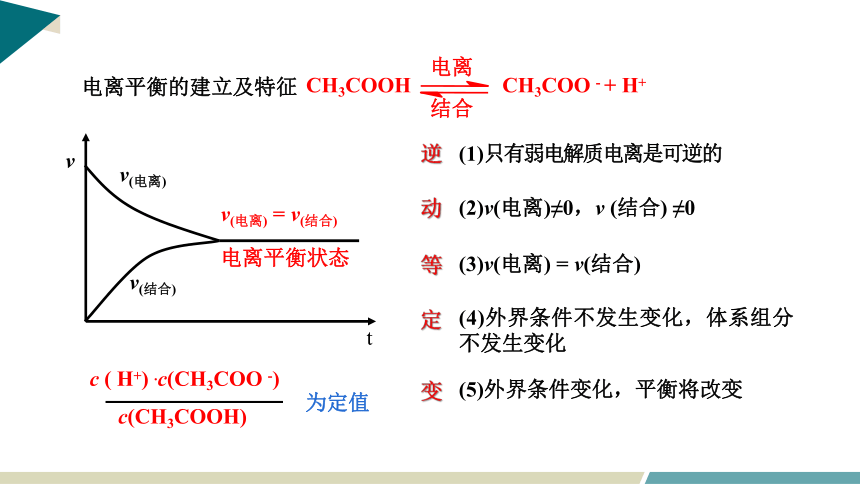
CH3COOH CH3COO - + H+
电离
结合
v(电离)
v(结合)
v(电离) = v(结合)
电离平衡状态
t
v
电离平衡的建立及特征
逆
动
等
定
变
(5)外界条件变化,平衡将改变
(1)只有弱电解质电离是可逆的
(2)v(电离)≠0,v (结合) ≠0
(3)v(电离) = v(结合)
(4)外界条件不发生变化,体系组分不发生变化
c ( H+) .c(CH3COO -)
c(CH3COOH)
为定值
一、电离平衡常数
1.概念:一定条件下达到电离平衡时,弱电解质电离形成的各种离子的
乘积与溶液中未电离的分子的 之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。
①一元弱酸和弱碱的电离常数分别用Ka和Kb表示。
浓度
浓度
醋酸的电离常数表达式
一水合氨的电离常数表达式
Kb=
c( )·c(OH )
c(NH3·H2O)
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
CH3COOH H+ + CH3COO
NH3·H2O + OH
如:
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
1.7×10 3
c(NH3·H2O)=(0.2 1.7×10 3) mol·L 1 ≈ 0.2 mol·L 1
1.7×10 3
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
=
(1.7×10 3)·(1.7×10 3)
0.2
c(NH3·H2O)
Kb=
c( )·c(OH )
【例】在某温度时,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数(Kb)
NH3·H2O + OH
≈
1.4×10 5
该温度下电离程度小
②多元弱酸、多元弱碱的电离常数
多元弱酸的电离是分步进行的,每一步各有电离常数,通常用Ka1、Ka2 、Ka3或Kb1、Kb2 、Kb3等来分别表示。
如:
H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
Ka1
Ka2
Ka3
=6.9×10-3
=6.2×10-8
=4.8×10-13
通过比较多元弱酸各步电离常数大小发现:K1>>K2>>K3,因此多元弱酸的酸性主要由第一步电离决定的。
(记住:分步进行,一步定性)
Ka1
Ka2
Ka3
=6.9×10-3
=6.2×10-8
=4.8×10-13
2.电离常数的意义
电离常数常用于比较弱电解质的相对强弱,即对于弱电解质,其电离常数越大,一般此弱电解质的电离程度越大,对于弱酸来讲,其酸性一般越强。
【实验3-2】
2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O
CH3COOH H2CO3
>
Ka (CH3COOH) Ka1(H2CO3)
>
[实验结论]
酸性:
【练一练】
已知某温度下有如下三个反应:
NaCN+HNO2==HCN+NaNO2
NaCN+HF==HCN+NaF
NaNO2+HF==HNO2+NaF
该温度下有如下三个反应:HF、HCN和HNO2三种弱酸的电离常数由大到小的顺序是 。
Ka(HF)
Ka(HCN)
Ka(HNO2)
>
>
3.影响弱电解质电离常数的因素:
内因:弱电解质的本性 [电解质越弱,Ka(或Kb)越小,越难电离,
酸 (碱)的酸(碱)性越弱。]
外因:只与温度有关。
T越高, Ka(Kb)越大。
CH3COOH 25℃ 0℃
电离平衡常数 Ka=1.75×10-5 Ka=1.65×10-5
25℃ CH3COOH HCN
电离平衡常数 Ka=1.75×10-5 Ka=4.9×10-10
注意:升高温度对电离常数影响不大,因此在室温范围内可以忽略电离常数变化。
二、电离平衡常数的应用
1.相同温度下,直接比较弱电解质的相对强弱
CH3COOH的电离常数(25 ℃)
=1.75×10 5
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
=6.2×10 10
Ka=
c(CN )·c(H+)
c(HCN)
CH3COOH > HCN
酸性:
HCN的电离常数(25 ℃)
教科书附录II:
某些弱电解质的电离常数(25 ℃)
HClO
HF
HNO2
4.0×10 8
6.3×10 4
5.6×10 4
酸性:HF>HNO2>HClO
【练一练】
部分弱酸的电离平衡常数如下表:
弱酸
电离平衡常数(25°C)
HCOOH
Ka= 1.77×10-4
HCN
Ka= 4.9×10-10
H2CO3
Ka1= 4.3×10-7
Ka2= 5.6×10-11
下列选项错误的是( )
A.2CN-+H2O+CO2=2HCN+
B.2HCOOH+=2HCOO-+H2O+CO2
C.酸性:HCOOH>H2CO3>HCN>
D.浓度相同的HCOOH和HCN溶液,前者的导电能力强
A
CH3COOH CH3COO + H+
Q =
c(H+)
2
·
c(CH3COO )
2
c(CH3COOH)
2
=
Ka
2
< Ka
加水稀释,电离平衡向电离的方向移动
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
2.判断电离平衡移动的方向
【例】若将0.1 mol/L 醋酸加水稀释,使其溶质的浓度变为原来的一半,你能判断醋酸电离平衡移动的方向吗?
查阅教科书附录II
Ka=1.75×10 5(25 ℃)
CH3COOH电离常数
3.计算粒子的浓度
【例】取1 mL 2 mol/L 醋酸,加水稀释到10 mL,稀释后的溶液,酸的浓度和氢离子浓度分别为多少?
稀释前
2 mol/L
稀释后
0.2 mol/L
?
CH3COOH部分电离,酸的浓度与氢离子浓度不相等
=
x·x
0.2
≈
1.75×10 5
变化浓度/(mol·L 1)
x
x
x
平衡浓度/(mol·L 1)
x
0.2 x
x
c(CH3COOH)=(0.2 x) mol·L 1 ≈ 0.2 mol·L 1
c(H+)= x = 0.001 87 mol/L
Ka=1.75×10 5(25 ℃)
CH3COOH电离常数
0
起始浓度/(mol·L 1)
0.2
0
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
进一步分析:
稀释过程中,醋酸电离平衡正向移动
平衡移动只能削弱反应条件的影响
0.001 87 mol/L
0.00 591 mol/L
稀释10倍后,c(CH3COOH)降为之前浓度的
1
10
稀释10倍后,c(H+)降为之前浓度的
3.2
10
稀释前
2 mol/L
稀释后
0.2 mol/L
类比上述计算方法
25 ℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。将SO2通入以上氨水中,当c(OH-)降至1.0×10-7 mol·L-1时,溶液中的c()/c( ) = 。
[已知:常温下中性溶液中c(H+)=c(OH-)=1.0×10-7 mol·L-1]
0.62
Ka2=
c( )
·c(H+)
c( )
c( )·1.0×10-7
=
c( )
=6.2×10-8
=0.62
c( )
c( )
【练一练】
4.计算电离度
已知弱电解质在水中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数的百分率,称为电离度(用α表示)。
x
x
x
起始
c
0
0
平衡
c-x
x
x
c
x
电离度α=
【练一练】
1.已知弱电解质在水中达到电离平衡状态时,已电离的电解质分子数占原有
电解质分子总数的百分率,称为电离度。在相同温度100mL0.01mol.L-1醋酸
溶液与10mL0.1mol.L-1醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.电离度
C.H+的物质的量浓度
D.CH3COOH的物质的量
B
D
2.在0.1mol L-1CH3COOH溶液中存在如下电离平衡:
,对于该平衡,下列叙述正确的是( )
A.加入少量CH3COONa固体,平衡正向移动,溶液的pH减小
B.加入少量NaOH固体,并恢复到室温,电离平衡常数增大
C.加入少量0.1mol L-1HCl溶液,溶液中c(H+)减小
D.加热时,CH3COOH的电离平衡常数增大
CH3COOH CH3COO + H+
A.加入少量CH3COONa固体,溶液中CH3COO-离子浓度增大,则平衡逆向移动,则H+离子浓度减小,pH值增大,故A错误;
B.电离平衡常数只与温度有关,温度不变电离平衡常数不变,即加入少量NaOH固体,并恢复到室温,电离程度增大,但电离平衡常数不变,故B错误;
C.加入少量0.1mol L-1HCl溶液,虽然平衡逆向移动,但溶液中c(H+)增大,C错误;
D.CH3COOH的电离为吸热过程,所以加热时,CH3COOH的电离程度增大,电离平衡平衡常数增大,故D正确
3.有下列物质的溶液
①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为 (用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺为 。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为 ,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka= ,温度升高,Ka将___________(填“变大”“不变”或“变小”,下同),加入少量CH3COONa后c(H+)________,Ka________。
③>②=④>①
①>④=②>③
0.1 mol·L-1
1.96×10-5
变大
变小
不变
电离平衡常数
表达式
影响因素
作用意义
内因
外因
由物质本性决定
只受温度影响
比较弱电解质的相对强弱
借助 Q 与 K 的关系,判断电离平衡移动方向
计算相关粒子的浓度
计算电离度
第三章 水溶液中的离子反应与平衡
第一节 电离平衡 课时2
1.能构建电离平衡常数模型,并能应用模型解释弱电解质在水溶液中发生的变化;
2.能解决与电离平衡常数有关的计算。
CH3COOH CH3COO - + H+
电离
结合
v(电离)
v(结合)
v(电离) = v(结合)
电离平衡状态
t
v
电离平衡的建立及特征
逆
动
等
定
变
(5)外界条件变化,平衡将改变
(1)只有弱电解质电离是可逆的
(2)v(电离)≠0,v (结合) ≠0
(3)v(电离) = v(结合)
(4)外界条件不发生变化,体系组分不发生变化
c ( H+) .c(CH3COO -)
c(CH3COOH)
为定值
一、电离平衡常数
1.概念:一定条件下达到电离平衡时,弱电解质电离形成的各种离子的
乘积与溶液中未电离的分子的 之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。
①一元弱酸和弱碱的电离常数分别用Ka和Kb表示。
浓度
浓度
醋酸的电离常数表达式
一水合氨的电离常数表达式
Kb=
c( )·c(OH )
c(NH3·H2O)
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
CH3COOH H+ + CH3COO
NH3·H2O + OH
如:
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
1.7×10 3
c(NH3·H2O)=(0.2 1.7×10 3) mol·L 1 ≈ 0.2 mol·L 1
1.7×10 3
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
=
(1.7×10 3)·(1.7×10 3)
0.2
c(NH3·H2O)
Kb=
c( )·c(OH )
【例】在某温度时,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数(Kb)
NH3·H2O + OH
≈
1.4×10 5
该温度下电离程度小
②多元弱酸、多元弱碱的电离常数
多元弱酸的电离是分步进行的,每一步各有电离常数,通常用Ka1、Ka2 、Ka3或Kb1、Kb2 、Kb3等来分别表示。
如:
H3PO4 H+ + H2PO4-
H2PO4- H+ + HPO42-
HPO42- H+ + PO43-
Ka1
Ka2
Ka3
=6.9×10-3
=6.2×10-8
=4.8×10-13
通过比较多元弱酸各步电离常数大小发现:K1>>K2>>K3,因此多元弱酸的酸性主要由第一步电离决定的。
(记住:分步进行,一步定性)
Ka1
Ka2
Ka3
=6.9×10-3
=6.2×10-8
=4.8×10-13
2.电离常数的意义
电离常数常用于比较弱电解质的相对强弱,即对于弱电解质,其电离常数越大,一般此弱电解质的电离程度越大,对于弱酸来讲,其酸性一般越强。
【实验3-2】
2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O
CH3COOH H2CO3
>
Ka (CH3COOH) Ka1(H2CO3)
>
[实验结论]
酸性:
【练一练】
已知某温度下有如下三个反应:
NaCN+HNO2==HCN+NaNO2
NaCN+HF==HCN+NaF
NaNO2+HF==HNO2+NaF
该温度下有如下三个反应:HF、HCN和HNO2三种弱酸的电离常数由大到小的顺序是 。
Ka(HF)
Ka(HCN)
Ka(HNO2)
>
>
3.影响弱电解质电离常数的因素:
内因:弱电解质的本性 [电解质越弱,Ka(或Kb)越小,越难电离,
酸 (碱)的酸(碱)性越弱。]
外因:只与温度有关。
T越高, Ka(Kb)越大。
CH3COOH 25℃ 0℃
电离平衡常数 Ka=1.75×10-5 Ka=1.65×10-5
25℃ CH3COOH HCN
电离平衡常数 Ka=1.75×10-5 Ka=4.9×10-10
注意:升高温度对电离常数影响不大,因此在室温范围内可以忽略电离常数变化。
二、电离平衡常数的应用
1.相同温度下,直接比较弱电解质的相对强弱
CH3COOH的电离常数(25 ℃)
=1.75×10 5
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
=6.2×10 10
Ka=
c(CN )·c(H+)
c(HCN)
CH3COOH > HCN
酸性:
HCN的电离常数(25 ℃)
教科书附录II:
某些弱电解质的电离常数(25 ℃)
HClO
HF
HNO2
4.0×10 8
6.3×10 4
5.6×10 4
酸性:HF>HNO2>HClO
【练一练】
部分弱酸的电离平衡常数如下表:
弱酸
电离平衡常数(25°C)
HCOOH
Ka= 1.77×10-4
HCN
Ka= 4.9×10-10
H2CO3
Ka1= 4.3×10-7
Ka2= 5.6×10-11
下列选项错误的是( )
A.2CN-+H2O+CO2=2HCN+
B.2HCOOH+=2HCOO-+H2O+CO2
C.酸性:HCOOH>H2CO3>HCN>
D.浓度相同的HCOOH和HCN溶液,前者的导电能力强
A
CH3COOH CH3COO + H+
Q =
c(H+)
2
·
c(CH3COO )
2
c(CH3COOH)
2
=
Ka
2
< Ka
加水稀释,电离平衡向电离的方向移动
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
2.判断电离平衡移动的方向
【例】若将0.1 mol/L 醋酸加水稀释,使其溶质的浓度变为原来的一半,你能判断醋酸电离平衡移动的方向吗?
查阅教科书附录II
Ka=1.75×10 5(25 ℃)
CH3COOH电离常数
3.计算粒子的浓度
【例】取1 mL 2 mol/L 醋酸,加水稀释到10 mL,稀释后的溶液,酸的浓度和氢离子浓度分别为多少?
稀释前
2 mol/L
稀释后
0.2 mol/L
?
CH3COOH部分电离,酸的浓度与氢离子浓度不相等
=
x·x
0.2
≈
1.75×10 5
变化浓度/(mol·L 1)
x
x
x
平衡浓度/(mol·L 1)
x
0.2 x
x
c(CH3COOH)=(0.2 x) mol·L 1 ≈ 0.2 mol·L 1
c(H+)= x = 0.001 87 mol/L
Ka=1.75×10 5(25 ℃)
CH3COOH电离常数
0
起始浓度/(mol·L 1)
0.2
0
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
进一步分析:
稀释过程中,醋酸电离平衡正向移动
平衡移动只能削弱反应条件的影响
0.001 87 mol/L
0.00 591 mol/L
稀释10倍后,c(CH3COOH)降为之前浓度的
1
10
稀释10倍后,c(H+)降为之前浓度的
3.2
10
稀释前
2 mol/L
稀释后
0.2 mol/L
类比上述计算方法
25 ℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。将SO2通入以上氨水中,当c(OH-)降至1.0×10-7 mol·L-1时,溶液中的c()/c( ) = 。
[已知:常温下中性溶液中c(H+)=c(OH-)=1.0×10-7 mol·L-1]
0.62
Ka2=
c( )
·c(H+)
c( )
c( )·1.0×10-7
=
c( )
=6.2×10-8
=0.62
c( )
c( )
【练一练】
4.计算电离度
已知弱电解质在水中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数的百分率,称为电离度(用α表示)。
x
x
x
起始
c
0
0
平衡
c-x
x
x
c
x
电离度α=
【练一练】
1.已知弱电解质在水中达到电离平衡状态时,已电离的电解质分子数占原有
电解质分子总数的百分率,称为电离度。在相同温度100mL0.01mol.L-1醋酸
溶液与10mL0.1mol.L-1醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.电离度
C.H+的物质的量浓度
D.CH3COOH的物质的量
B
D
2.在0.1mol L-1CH3COOH溶液中存在如下电离平衡:
,对于该平衡,下列叙述正确的是( )
A.加入少量CH3COONa固体,平衡正向移动,溶液的pH减小
B.加入少量NaOH固体,并恢复到室温,电离平衡常数增大
C.加入少量0.1mol L-1HCl溶液,溶液中c(H+)减小
D.加热时,CH3COOH的电离平衡常数增大
CH3COOH CH3COO + H+
A.加入少量CH3COONa固体,溶液中CH3COO-离子浓度增大,则平衡逆向移动,则H+离子浓度减小,pH值增大,故A错误;
B.电离平衡常数只与温度有关,温度不变电离平衡常数不变,即加入少量NaOH固体,并恢复到室温,电离程度增大,但电离平衡常数不变,故B错误;
C.加入少量0.1mol L-1HCl溶液,虽然平衡逆向移动,但溶液中c(H+)增大,C错误;
D.CH3COOH的电离为吸热过程,所以加热时,CH3COOH的电离程度增大,电离平衡平衡常数增大,故D正确
3.有下列物质的溶液
①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为 (用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺为 。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为 ,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka= ,温度升高,Ka将___________(填“变大”“不变”或“变小”,下同),加入少量CH3COONa后c(H+)________,Ka________。
③>②=④>①
①>④=②>③
0.1 mol·L-1
1.96×10-5
变大
变小
不变
电离平衡常数
表达式
影响因素
作用意义
内因
外因
由物质本性决定
只受温度影响
比较弱电解质的相对强弱
借助 Q 与 K 的关系,判断电离平衡移动方向
计算相关粒子的浓度
计算电离度
