4.2 课时2 电解规律及电极反应式 课件(共19张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2 课时2 电解规律及电极反应式 课件(共19张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:31:59 | ||
图片预览






文档简介
(共19张PPT)
第四章 化学反应与电能
第二节 电解池 课时2
1.掌握离子的放电顺序与其氧化性、还原性的关系,能解释
或推测电解反应的产物;
2.能写出电极反应式和电解池总反应方程式。
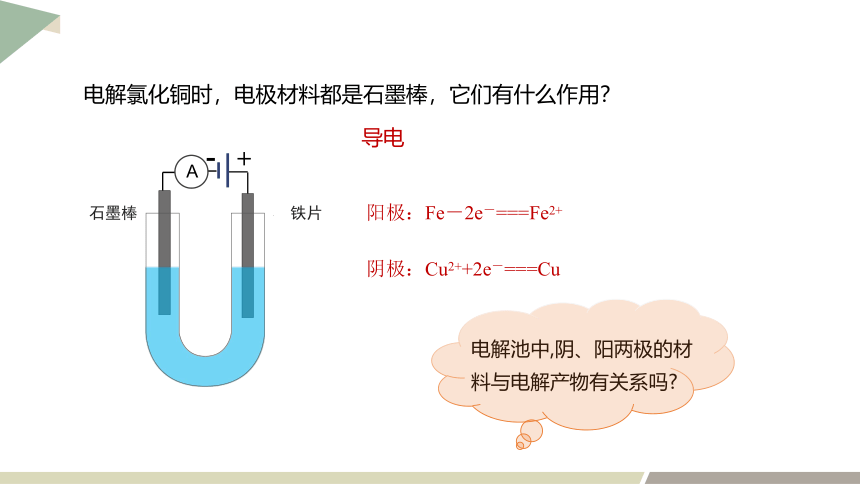
电解氯化铜时,电极材料都是石墨棒,它们有什么作用?
+
-
A
石墨棒
石墨棒
导电
电解池中,阴、阳两极的材料与电解产物有关系吗
铁片
阳极:Fe-2e-===Fe2+
阴极:Cu2++2e-===Cu
(2)活性电极:既导电又能反应。电极自身失去电子发生氧化反应。
如:Fe、Cu、Ag
(1)惰性电极:只导电。电极自身不反应,电解质中的阴离子 失去
电子发生氧化反应。
如:Pt、C
一、电解规律
1.电极材料
阳极材料与阳极产物有关,阴极无关,阴极材料只要导电就可以 。
2.离子放电顺序
离子在电极表面得到或失去电子的过程也叫作“放电”。当电解质溶液中存在多种阳离子或阴离子时,离子在电极上放电的顺序是存在某种规律的。
(1)阴极放电顺序(氧化性)
Ag+>Hg2+> Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+ >H+(水)>Al3+>Mg2+>Na+ >Ca2+>K+
①Al3+~ K+水溶液中不放电,熔融状态放电。
【注意】
②离子在两极上放电顺序复杂,与离子性质、溶液浓度、电极材料等有关,以上仅是一般规律。
Ag+>Hg2+> Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+ >Al3+>Mg2+>Na+ >Ca2+>K+
Ag+>Hg2+> Fe3+> Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+ >Al3+>Mg2+>Na+ >Ca2+>K+
浓度大
浓度小
(2)阳极放电顺序
活性金属电极
>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
(还原性)
[例1]如图所示,烧杯内盛有100 mL的溶液,按要求回答下列问题:
(1)若所盛溶液为CuSO4溶液,则B极为______极,
A极的电极反应式为________________________。
若所盛溶液为KCl溶液,则B极的电极反应式为________________。
阴
4OH--4e-=O2↑+2H2O
2Cl--2e-===Cl2↑
X
A
B
三、电解类型
(用惰性电极电解某电解质的水溶液)
【思考】请写出电解CuCl2、NaOH、NaCl、CuSO4溶液的电极反应式
和电解池总反应方程式
总反应:CuCl2===Cu + Cl2↑
电解
阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
CuCl2
阴极:2H++2e-===H2↑
阳极:4OH--4e-=== O2↑+2H2O
总反应:2H2O===2H2↑+ O2↑
电解
NaOH
NaCl
阳极:2Cl--2e-===Cl2↑
阴极:2H2O+2e-===H2↑+2OH-
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
CuSO4
阳极:H2O-2e-=== O2↑+2H+
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
阴极:
Cu2++2e-===Cu
总反应:CuCl2===Cu + Cl2↑
电解
阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
CuCl2
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
1.电解电解质型:
电解质电离出的阴、阳离子分别在两极放电。
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2.电解水型:
水电离出的H+、OH-分别在两极放电。
阴极:2H++2e-===H2↑
阳极:4OH--4e-=== O2↑+2H2O
总反应:2H2O===2H2↑+ O2↑
电解
NaOH
NaCl
阴极:2H2O+2e-===H2↑+2OH-
阳极:2Cl--2e-===Cl2↑
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
①放氢生碱型:电解质电离的阴离子在阳极放电,水电离的阳离子在阴极放电。
2.电解电解质+水型:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
②放氧生酸型:
电解质电离的阳离子在阴极放电,水电离的阴离子在阳极放电。
CuSO4
阳极:H2O-2e-=== O2↑+2H+
阴极:
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
Cu2++2e-===Cu
Ⅱ.通电片刻后,若使电解液恢复至原来的体积和浓度,应往其中
添加适量的什么物质?
根据总反应式,加入CuO。 H2SO4+CuO=CuSO4+H2O
Ⅰ.给CuSO4溶液通电,电解液的pH如何变化?
思考与交流
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
生成新电解质——酸
pH逐渐减小
1.如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出有刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
D
【练一练】
2.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A.NaCl[盐酸] B.NaOH[H2O]
C.CuCl2[HCl] D.CuSO4[Cu(OH)2]
B
二.电极反应式
①首先判断阴、阳极,分析电极材料,判断是电极材料放电还是溶液中的离子放电。
②再分析溶液中的离子种类,根据离子放电顺序,分析电极反应,并判断电极产物,写出电极反应式。
③电解水溶液时,注意放电顺序中H+、OH-之后的离子一般不参与放电反应。
1.电极反应式的书写
看电极→找离子→分阴阳→排顺序→写反应
2.电解化学方程式的书写
反应条件必须标明“电解”。
仅是电解质被电解,电解化学方程式中只写电解质及电解产物。
如电解CuCl2溶液:
仅有水被电离,只写水及电解产物即可。
如电解NaOH溶液:
电解质、水同时被电解,则都要写进方程式。
如电解NaCl溶液:
CuCl2===Cu + Cl2↑
电解
2H2O===2H2↑+ O2↑
电解
2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
(1)当X为Pt,Y为Fe,Z为AgNO3时,
阳极反应式为 ,
阴极反应式为 ,
电解反应式为 。
(2)X为Cu,Y为Fe,Z为CuSO4时,
阳极反应式为 ,
阴极反应式为 。
4OH--4e-= 2H2O+O2↑
4Ag++4e-=4Ag
Cu-2e-=Cu2+
Cu2++2e-=Cu
2H2O+4AgNO3===4Ag+O2↑+4HNO3
电解
【练一练】
电 解
电解规律
电极反应式和电解总方程式
电极材料
离子放电顺序
电解类型
电解水型
分解电解质型
放氢生碱型
放氧生酸型
活性材料
惰性材料
只导电不溶解
既导电又能反应
阴极放电顺序(阳离子得电子能力)
阳极放电顺序(阴离子失电子能力)
看电极→找离子→分阴阳→排顺序→写反应
第四章 化学反应与电能
第二节 电解池 课时2
1.掌握离子的放电顺序与其氧化性、还原性的关系,能解释
或推测电解反应的产物;
2.能写出电极反应式和电解池总反应方程式。
电解氯化铜时,电极材料都是石墨棒,它们有什么作用?
+
-
A
石墨棒
石墨棒
导电
电解池中,阴、阳两极的材料与电解产物有关系吗
铁片
阳极:Fe-2e-===Fe2+
阴极:Cu2++2e-===Cu
(2)活性电极:既导电又能反应。电极自身失去电子发生氧化反应。
如:Fe、Cu、Ag
(1)惰性电极:只导电。电极自身不反应,电解质中的阴离子 失去
电子发生氧化反应。
如:Pt、C
一、电解规律
1.电极材料
阳极材料与阳极产物有关,阴极无关,阴极材料只要导电就可以 。
2.离子放电顺序
离子在电极表面得到或失去电子的过程也叫作“放电”。当电解质溶液中存在多种阳离子或阴离子时,离子在电极上放电的顺序是存在某种规律的。
(1)阴极放电顺序(氧化性)
Ag+>Hg2+> Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+ >H+(水)>Al3+>Mg2+>Na+ >Ca2+>K+
①Al3+~ K+水溶液中不放电,熔融状态放电。
【注意】
②离子在两极上放电顺序复杂,与离子性质、溶液浓度、电极材料等有关,以上仅是一般规律。
Ag+>Hg2+> Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+ >Al3+>Mg2+>Na+ >Ca2+>K+
Ag+>Hg2+> Fe3+> Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+ >Al3+>Mg2+>Na+ >Ca2+>K+
浓度大
浓度小
(2)阳极放电顺序
活性金属电极
>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
(还原性)
[例1]如图所示,烧杯内盛有100 mL的溶液,按要求回答下列问题:
(1)若所盛溶液为CuSO4溶液,则B极为______极,
A极的电极反应式为________________________。
若所盛溶液为KCl溶液,则B极的电极反应式为________________。
阴
4OH--4e-=O2↑+2H2O
2Cl--2e-===Cl2↑
X
A
B
三、电解类型
(用惰性电极电解某电解质的水溶液)
【思考】请写出电解CuCl2、NaOH、NaCl、CuSO4溶液的电极反应式
和电解池总反应方程式
总反应:CuCl2===Cu + Cl2↑
电解
阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
CuCl2
阴极:2H++2e-===H2↑
阳极:4OH--4e-=== O2↑+2H2O
总反应:2H2O===2H2↑+ O2↑
电解
NaOH
NaCl
阳极:2Cl--2e-===Cl2↑
阴极:2H2O+2e-===H2↑+2OH-
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
CuSO4
阳极:H2O-2e-=== O2↑+2H+
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
阴极:
Cu2++2e-===Cu
总反应:CuCl2===Cu + Cl2↑
电解
阳极:2Cl--2e-===Cl2↑
阴极:Cu2++2e-===Cu
CuCl2
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
1.电解电解质型:
电解质电离出的阴、阳离子分别在两极放电。
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
2.电解水型:
水电离出的H+、OH-分别在两极放电。
阴极:2H++2e-===H2↑
阳极:4OH--4e-=== O2↑+2H2O
总反应:2H2O===2H2↑+ O2↑
电解
NaOH
NaCl
阴极:2H2O+2e-===H2↑+2OH-
阳极:2Cl--2e-===Cl2↑
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
①放氢生碱型:电解质电离的阴离子在阳极放电,水电离的阳离子在阴极放电。
2.电解电解质+水型:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>其它
S2->I->Br->Cl-> OH- >非还原性含氧酸根
②放氧生酸型:
电解质电离的阳离子在阴极放电,水电离的阴离子在阳极放电。
CuSO4
阳极:H2O-2e-=== O2↑+2H+
阴极:
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
Cu2++2e-===Cu
Ⅱ.通电片刻后,若使电解液恢复至原来的体积和浓度,应往其中
添加适量的什么物质?
根据总反应式,加入CuO。 H2SO4+CuO=CuSO4+H2O
Ⅰ.给CuSO4溶液通电,电解液的pH如何变化?
思考与交流
总反应:2CuSO4 +2H2O===2Cu+2H2SO4+O2↑
电解
生成新电解质——酸
pH逐渐减小
1.如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出有刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
D
【练一练】
2.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A.NaCl[盐酸] B.NaOH[H2O]
C.CuCl2[HCl] D.CuSO4[Cu(OH)2]
B
二.电极反应式
①首先判断阴、阳极,分析电极材料,判断是电极材料放电还是溶液中的离子放电。
②再分析溶液中的离子种类,根据离子放电顺序,分析电极反应,并判断电极产物,写出电极反应式。
③电解水溶液时,注意放电顺序中H+、OH-之后的离子一般不参与放电反应。
1.电极反应式的书写
看电极→找离子→分阴阳→排顺序→写反应
2.电解化学方程式的书写
反应条件必须标明“电解”。
仅是电解质被电解,电解化学方程式中只写电解质及电解产物。
如电解CuCl2溶液:
仅有水被电离,只写水及电解产物即可。
如电解NaOH溶液:
电解质、水同时被电解,则都要写进方程式。
如电解NaCl溶液:
CuCl2===Cu + Cl2↑
电解
2H2O===2H2↑+ O2↑
电解
2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
(1)当X为Pt,Y为Fe,Z为AgNO3时,
阳极反应式为 ,
阴极反应式为 ,
电解反应式为 。
(2)X为Cu,Y为Fe,Z为CuSO4时,
阳极反应式为 ,
阴极反应式为 。
4OH--4e-= 2H2O+O2↑
4Ag++4e-=4Ag
Cu-2e-=Cu2+
Cu2++2e-=Cu
2H2O+4AgNO3===4Ag+O2↑+4HNO3
电解
【练一练】
电 解
电解规律
电极反应式和电解总方程式
电极材料
离子放电顺序
电解类型
电解水型
分解电解质型
放氢生碱型
放氧生酸型
活性材料
惰性材料
只导电不溶解
既导电又能反应
阴极放电顺序(阳离子得电子能力)
阳极放电顺序(阴离子失电子能力)
看电极→找离子→分阴阳→排顺序→写反应
