3.3 课时4 盐类水解的应用 课件 (共20张PPT)2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.3 课时4 盐类水解的应用 课件 (共20张PPT)2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 64.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:32:50 | ||
图片预览








文档简介
(共20张PPT)
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解 课时4
1.能列举盐类水解在实际生产、生活和科学研究中的应用实例;
2.能依据盐类水解原理对上述实例进行解释,体会化学原理的应用价值。
在生产、生活和科学研究中,人们常利用盐类水解的原理来解决实际问题。那么盐类水解有哪些实际应用呢?
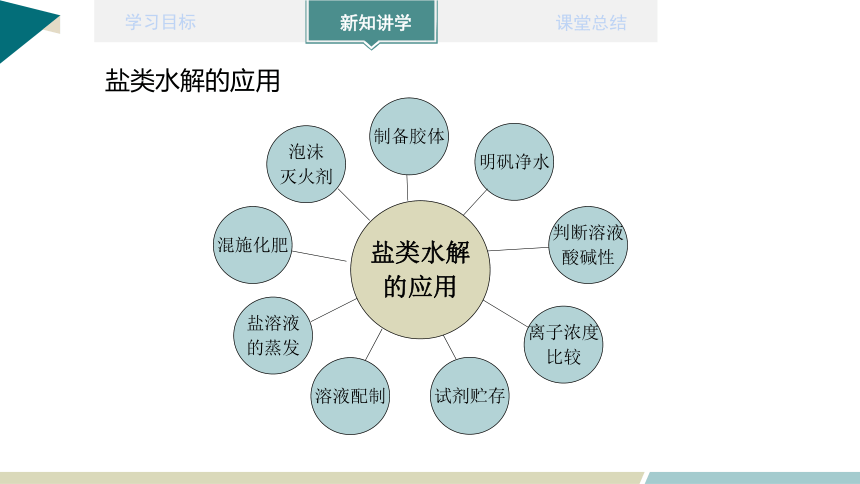
盐类水解的应用
混施化肥
泡沫
灭火剂
制备胶体
明矾净水
判断溶液
酸碱性
离子浓度
比较
试剂贮存
盐溶液
的蒸发
溶液配制
盐类水解
的应用
应用1:实验室如何配制一定浓度的FeCl3溶液?
分析:增大c(H+),可抑制Fe3+的水解。
操作:先将FeCl3晶体溶解在较浓盐酸中,再加水稀释到所需浓度。
Fe3+ + 3H2O Fe(OH)3 + 3H+
应用2 实验室如何制备Fe(OH)3胶体?
分析:加热可使上述平衡右移。
操作:向40 mL沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3 溶液,继续煮沸至液体呈红褐色,停止加热。
Fe3+ + 3H2O Fe(OH)3 + 3H+
应用3:为什么FeCl3可用作净水剂?
分析:Fe3+水解生成的Fe(OH)3胶体可以使水中细小的悬浮颗粒聚集成较大的颗粒而沉降,从而除去水中的悬浮物,起到净水的作用。
明矾[KAl(SO4)2·12H2O]作净水剂也是相同原理。
Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
应用4::纯碱溶液可以清理油污,加热后去污能力更强,为什么?
分析:去油污的是OH-。Na2CO3水解可以生成OH- ,所以Na2CO3溶液可以清理油污。水解反应是吸热的,升温促进Na2CO3水解,使溶液中的c(OH-)增大,去污效果更好。
+ H2O + OH- H >0
应用5:铵态氮肥与草木灰(主要成分为K2CO3)混合使用会大大降低氮肥的肥效,原因是什么?
草木灰的成分:K2CO3,水解呈碱性
+H2O +OH-
+H2O NH3·H2O+ H+,
铵态氮肥——铵盐,水解呈酸性
分析:混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,会导致NH3·H2O分解生成NH3逸出了,从而降低了肥效。
+H2O H2CO3+OH-
分析:在制备时加入大量的水,同时加热,可以促使水解趋于完全,所得TiO2 xH2O经焙烧得到TiO2(类似的方法也可用于制备SnO、SnO2 和Sn2O3等)。
应用6:请解析用TiCl4制备TiO2时加入大量的水,同时加热的原因。已知制备反应可表示如下:
TiCl4 +(x+2)H2O TiO2·xH2O + 4HCl
应用7:泡沫灭火器原理
泡沫灭火器
图示泡沫灭火器(标准型)。左方是外形,里面是装有硫酸铝溶液的塑料内筒。外筒装着发泡剂和碳酸氢钠的混合溶液。使用时,一手握住提柄,一手握住筒底边缘。筒底斜向上方,轻轻抖动几下(中图),内筒上的玻璃塞自动脱落,两种溶液很快混合,生成二氧化碳。标准型的喷射距离是8米左右,喷射时间约一分钟,一般用来扑灭不溶于水的易燃液体引起的火灾和扑灭竹、木等引起的火灾。前往火场途中,筒身保持平稳。
Al3++3H2O Al(OH)3+3H+
双水解
+H2O H2CO3+OH-
Al3++3 =Al(OH)3↓+3CO2 ↑
应用8:请判断下列盐溶液蒸干、灼烧后的产物
Fe2O3
Fe2O3
Fe2(SO4)3
Fe2(SO4)3
CaCO3
FeCl3 溶液
Fe(NO3)3 溶液
Fe2(SO4)3 溶液
FeSO4 溶液
Ca(HCO3)2 溶液
NH4HCO3溶液
无固体剩余
Na2SO3溶液
Na2SO4
1. 易挥发的酸形成的盐:
MgCl2~ CuCl2
Mg(NO3)2~ Cu(NO3)2
蒸干
碱
灼烧
金属氧化物
2.难挥发的酸形成的盐:
MgSO4~ CuSO4
蒸干仍为原来的盐
3. Ca(HCO3)2 和NaHCO3 在溶液中受热分解
4. 弱酸和挥发性酸的铵盐:
如:NH4HCO3 、 (NH4) 2CO3、CH3COONH4、NH4Cl等
蒸干后无剩余固体
5. K+、Na+的正盐溶液蒸干后一般仍为原来的盐。
如:Na2CO3、 K2CO3
6.还原性盐在蒸干时会被O2氧化。
如:Na2SO3→Na2SO4 FeSO4→Fe2(SO4)3
应用9:电解法制金属镁时,需无水氯化镁。在干燥的HCl气流中加热MgCl2 6H2O时,能得到无水MgCl2,其原因是?
干燥的HCl气流既可抑制Mg2+的水解,还能带走MgCl2·6H2O受热产生的水汽。
【练一练】
1.下列事实,其中与盐类的水解有关的是____________。
①NaHSO4溶液呈酸性;
②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;
③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;
④实验室盛放纯碱溶液的试剂瓶不能用磨口玻璃塞;
⑤氯化铵或氯化锌溶液可去除金属制品表面的锈斑;
⑥加热FeCl3·6H2O晶体,往往得不到FeCl3固体。
②③④⑤⑥
D
加热能使平衡向水解方向移动,c(H+)增大,pH减小;通入HCl能增大c(H+),抑制了水解,且pH减小;加入NaCl溶液,相当于加水稀释,能促进水解,但因加入NaCl溶液稀释引起c(H+)变小,故pH增大。
2.在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A.加热 B.通入HCl
C.加入少量Na2SO4(s) D.加入NaCl溶液
3.下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,
Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃
时Fe3+的水解程度比20 ℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
C
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解 课时4
1.能列举盐类水解在实际生产、生活和科学研究中的应用实例;
2.能依据盐类水解原理对上述实例进行解释,体会化学原理的应用价值。
在生产、生活和科学研究中,人们常利用盐类水解的原理来解决实际问题。那么盐类水解有哪些实际应用呢?
盐类水解的应用
混施化肥
泡沫
灭火剂
制备胶体
明矾净水
判断溶液
酸碱性
离子浓度
比较
试剂贮存
盐溶液
的蒸发
溶液配制
盐类水解
的应用
应用1:实验室如何配制一定浓度的FeCl3溶液?
分析:增大c(H+),可抑制Fe3+的水解。
操作:先将FeCl3晶体溶解在较浓盐酸中,再加水稀释到所需浓度。
Fe3+ + 3H2O Fe(OH)3 + 3H+
应用2 实验室如何制备Fe(OH)3胶体?
分析:加热可使上述平衡右移。
操作:向40 mL沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3 溶液,继续煮沸至液体呈红褐色,停止加热。
Fe3+ + 3H2O Fe(OH)3 + 3H+
应用3:为什么FeCl3可用作净水剂?
分析:Fe3+水解生成的Fe(OH)3胶体可以使水中细小的悬浮颗粒聚集成较大的颗粒而沉降,从而除去水中的悬浮物,起到净水的作用。
明矾[KAl(SO4)2·12H2O]作净水剂也是相同原理。
Fe3+ + 3H2O Fe(OH)3(胶体) + 3H+
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
应用4::纯碱溶液可以清理油污,加热后去污能力更强,为什么?
分析:去油污的是OH-。Na2CO3水解可以生成OH- ,所以Na2CO3溶液可以清理油污。水解反应是吸热的,升温促进Na2CO3水解,使溶液中的c(OH-)增大,去污效果更好。
+ H2O + OH- H >0
应用5:铵态氮肥与草木灰(主要成分为K2CO3)混合使用会大大降低氮肥的肥效,原因是什么?
草木灰的成分:K2CO3,水解呈碱性
+H2O +OH-
+H2O NH3·H2O+ H+,
铵态氮肥——铵盐,水解呈酸性
分析:混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,会导致NH3·H2O分解生成NH3逸出了,从而降低了肥效。
+H2O H2CO3+OH-
分析:在制备时加入大量的水,同时加热,可以促使水解趋于完全,所得TiO2 xH2O经焙烧得到TiO2(类似的方法也可用于制备SnO、SnO2 和Sn2O3等)。
应用6:请解析用TiCl4制备TiO2时加入大量的水,同时加热的原因。已知制备反应可表示如下:
TiCl4 +(x+2)H2O TiO2·xH2O + 4HCl
应用7:泡沫灭火器原理
泡沫灭火器
图示泡沫灭火器(标准型)。左方是外形,里面是装有硫酸铝溶液的塑料内筒。外筒装着发泡剂和碳酸氢钠的混合溶液。使用时,一手握住提柄,一手握住筒底边缘。筒底斜向上方,轻轻抖动几下(中图),内筒上的玻璃塞自动脱落,两种溶液很快混合,生成二氧化碳。标准型的喷射距离是8米左右,喷射时间约一分钟,一般用来扑灭不溶于水的易燃液体引起的火灾和扑灭竹、木等引起的火灾。前往火场途中,筒身保持平稳。
Al3++3H2O Al(OH)3+3H+
双水解
+H2O H2CO3+OH-
Al3++3 =Al(OH)3↓+3CO2 ↑
应用8:请判断下列盐溶液蒸干、灼烧后的产物
Fe2O3
Fe2O3
Fe2(SO4)3
Fe2(SO4)3
CaCO3
FeCl3 溶液
Fe(NO3)3 溶液
Fe2(SO4)3 溶液
FeSO4 溶液
Ca(HCO3)2 溶液
NH4HCO3溶液
无固体剩余
Na2SO3溶液
Na2SO4
1. 易挥发的酸形成的盐:
MgCl2~ CuCl2
Mg(NO3)2~ Cu(NO3)2
蒸干
碱
灼烧
金属氧化物
2.难挥发的酸形成的盐:
MgSO4~ CuSO4
蒸干仍为原来的盐
3. Ca(HCO3)2 和NaHCO3 在溶液中受热分解
4. 弱酸和挥发性酸的铵盐:
如:NH4HCO3 、 (NH4) 2CO3、CH3COONH4、NH4Cl等
蒸干后无剩余固体
5. K+、Na+的正盐溶液蒸干后一般仍为原来的盐。
如:Na2CO3、 K2CO3
6.还原性盐在蒸干时会被O2氧化。
如:Na2SO3→Na2SO4 FeSO4→Fe2(SO4)3
应用9:电解法制金属镁时,需无水氯化镁。在干燥的HCl气流中加热MgCl2 6H2O时,能得到无水MgCl2,其原因是?
干燥的HCl气流既可抑制Mg2+的水解,还能带走MgCl2·6H2O受热产生的水汽。
【练一练】
1.下列事实,其中与盐类的水解有关的是____________。
①NaHSO4溶液呈酸性;
②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;
③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;
④实验室盛放纯碱溶液的试剂瓶不能用磨口玻璃塞;
⑤氯化铵或氯化锌溶液可去除金属制品表面的锈斑;
⑥加热FeCl3·6H2O晶体,往往得不到FeCl3固体。
②③④⑤⑥
D
加热能使平衡向水解方向移动,c(H+)增大,pH减小;通入HCl能增大c(H+),抑制了水解,且pH减小;加入NaCl溶液,相当于加水稀释,能促进水解,但因加入NaCl溶液稀释引起c(H+)变小,故pH增大。
2.在Al3++3H2O Al(OH)3+3H+的平衡体系中,要使平衡向水解方向移动,且使溶液的pH增大,应采取的措施是 ( )
A.加热 B.通入HCl
C.加入少量Na2SO4(s) D.加入NaCl溶液
3.下列关于FeCl3水解的说法错误的是( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,
Fe3+的水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃
时Fe3+的水解程度比20 ℃时的小
D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
C
