第二章 章末复习 课件 (共30张PPT)2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第二章 章末复习 课件 (共30张PPT)2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:33:23 | ||
图片预览











文档简介
(共30张PPT)
章末复习
第二章 化学反应速率与化学平衡
1.回顾本单元的文本及教材,熟悉本单元的知识及逻辑结构;
2.知道化学反应速率的含义,理解化学反应速率的影响因素对速率的影响;
3.掌握化学平衡的特征,知道化学平衡的移动及相关计算;
4.明白化学反应具有方向性,知道化学反应的调控的重要作用。
化学反应速率
知识一:
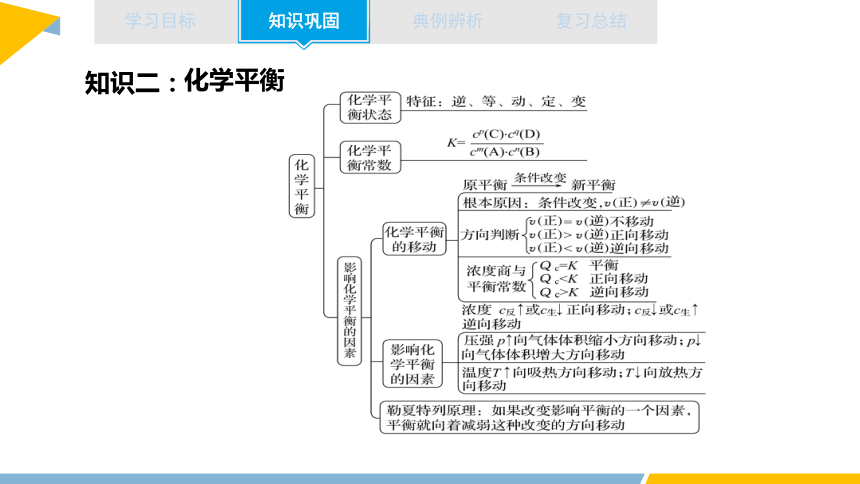
化学平衡
知识二:
化学反应的方向
知识三:
化学反应的调控
知识四:
【考点一】化学反应速率的计算
【例1】某温度时,在2 L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示。根据图中数据,试回答:
(1)反应在2 min内的v(X)=________________________,
v(Y)=________________________,
v(Z)=________________________。
(2)容器内的反应物是________。
(3)写出该反应的化学方程式:_______________________。
0.025 mol·L-1·min-1
0.075 mol·L-1·min-1
0.05 mol·L-1·min-1
X、Y
X+3Y 2Z
【例2】反应4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.用B表示的反应速率是0.3 mol·L-1·min-1
C.2 min末时的反应速率用B表示是0.3 mol·L-1·min-1
D.在这2 min内用B表示的反应速率的值是减小的,用C表示的反应速率的值逐渐增大
B
【考点二】化学反应速率的影响因素
【例1】NO和CO都是汽车尾气里的有毒气体,它们之间能缓慢反应生成N2和CO2,对于该反应的下列说法不正确的是( )
D
A.增大压强能增大反应速率
B.使用适当催化剂可增大反应速率
C.升高温度能增大反应速率
D.增大压强(体积减小)对该反应速率无影响
【例2】2018年是合成氨工业哈伯(F·Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为1/2 N2(g)+3/2 H2(g) NH3(g) ΔH(298 K)=-46.2 kJ·mol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H* NH*;NH*+H* NH2* ;
NH2* +H* NH3*
脱附:NH3* NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有____________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)实际生产中,常用Fe作催化剂,控制温度773 K,压强3.0×105 Pa,原料中N2和H2物质的量之比为1∶2.8。分析说明原料气中N2过量的两个理由:__________
。
(3)关于合成氨工艺的下列理解,正确的是________。
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气必须经过净化处理,以防止催化剂中毒和安全事故发生
AD
ACD
原料气中N2相
对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率
【考点三】化学平衡状态判断
【例1】一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(s)+3B(g)2C(g)达到平衡状态的是 ( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B ③气体密度不再变化
④混合气体的总压强不再变化 ⑤A、B、C的物质的量之比为1∶3∶2
⑥混合气体的总物质的量不再改变
A.②④⑤⑥ B.①③④⑥ C.①②④⑥ D.①③④⑤
B
【例2】恒温条件下,可逆反应:2NO(g)+O2(g) 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
A
[易错警示] 判断化学平衡时要规避“2”个易失分点
(1)化学平衡状态判断“三关注”
关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
【例1】某温度下反应H2(g)+I2(g) 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器(1 L)中充入0.2 mol H2(g)、0.5 mol I2(g)及0.3 mol HI(g),则下列说法中正确的是( )
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2 mol·L-1
D
【考点四】化学平衡常数的相关计算
【例2】某温度下,向容积为1 L的密闭反应器中充入0.10 mol SO3,当反应容器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为( )
A.8.0×102
B.1.6×103
C.3.2×103
D.4.0×102
B
【考点五】化学平衡移动方向的分析与判断
【例1】将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
C
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
【例2】在某温度下,反应ClF(g)+F2(g) ClF3(g) ΔH=+268 kJ·mol-1,在密闭容器中达到平衡,下列说法中正确的是( )
A.升高温度,平衡常数不变,平衡向正反应方向移动
B.升高温度,平衡常数减小
C.升高温度,平衡向正反应方向移动,F2的转化率增大
D.降低温度,ClF3的产率增大
C
【例3】反应NH4HS(s) NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况下,不会使平衡发生移动的是( )
A.温度、容积不变时,通入SO2气体
B.移走一部分NH4HS固体
C.容器体积不变,充入氨气
D.保持压强不变,充入氮气
B
【考点六】化学平衡的影响因素
【例1】合成氨所需的氢气可用煤和水做原料经多步反应制得,其中的一步反应为CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强
B.降低温度
C.增大CO的浓度
D.更换催化剂
B
【例2】在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
C
【例1】1 000 ℃时,FeO(s)+H2 Fe(s)+H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a的值最接近( )
A.1.0 B.2.0
C.3.0 D.4.0
C
【考点七】化学平衡相关计算
【例2】如图,关闭活塞K,向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,此时A的容积是a L,B的容积是2a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) 2Z(g)+W(g) ΔH<0。A保持恒压,B保持恒容。达平衡时,A的体积为1.4a L。下列说法错误的是( )
A.反应速率:v(B)>v(A) B.A容器中X的转化率为80%
C.若打开K,则A的体积变为2.6a L D.平衡时Y的体积分数:AC
A
B
【例3】可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在密闭容器中建立了平衡。当温度为749 K时,K=9/4,问:
(1)当CO和H2O的起始浓度为2 mol·L-1时,CO的转化率为________。
(2)当CO的起始浓度仍为2 mol·L-1,H2O的起始浓度为6 mol·L-1时,CO的转化率为________。
60%
85%
【例4】一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(s)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )
A.该条件下此反应的化学平衡常数约为0.91
B.A的平均反应速率为0.3 mol·L-1·s-1
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应不一定达到平衡状态
A
【考点八】化学反应的方向
【例1】下列说法正确的是( )
A.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
B.反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C.CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH<0
B
【例2】已知在等温等压条件下,化学反应方向的判据为
ΔH-TΔS<0 反应能自发进行
ΔH-TΔS=0 反应达到平衡状态
ΔH-TΔS>0 反应不能自发进行
设反应A=D+E ΔH-TΔS=(-4 500+11T) J·mol-1,要防止反应发生,温度必须( )
A.高于409 K B.低于136 K
C.高于136 K而低于409 K D.低于409 K
A
【考点九】化学反应的调控
【例1】某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率
C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
D
【例2】据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃下进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
B
章末复习
第二章 化学反应速率与化学平衡
1.回顾本单元的文本及教材,熟悉本单元的知识及逻辑结构;
2.知道化学反应速率的含义,理解化学反应速率的影响因素对速率的影响;
3.掌握化学平衡的特征,知道化学平衡的移动及相关计算;
4.明白化学反应具有方向性,知道化学反应的调控的重要作用。
化学反应速率
知识一:
化学平衡
知识二:
化学反应的方向
知识三:
化学反应的调控
知识四:
【考点一】化学反应速率的计算
【例1】某温度时,在2 L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示。根据图中数据,试回答:
(1)反应在2 min内的v(X)=________________________,
v(Y)=________________________,
v(Z)=________________________。
(2)容器内的反应物是________。
(3)写出该反应的化学方程式:_______________________。
0.025 mol·L-1·min-1
0.075 mol·L-1·min-1
0.05 mol·L-1·min-1
X、Y
X+3Y 2Z
【例2】反应4A(s)+3B(g) 2C(g)+D(g),经2 min,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.用B表示的反应速率是0.3 mol·L-1·min-1
C.2 min末时的反应速率用B表示是0.3 mol·L-1·min-1
D.在这2 min内用B表示的反应速率的值是减小的,用C表示的反应速率的值逐渐增大
B
【考点二】化学反应速率的影响因素
【例1】NO和CO都是汽车尾气里的有毒气体,它们之间能缓慢反应生成N2和CO2,对于该反应的下列说法不正确的是( )
D
A.增大压强能增大反应速率
B.使用适当催化剂可增大反应速率
C.升高温度能增大反应速率
D.增大压强(体积减小)对该反应速率无影响
【例2】2018年是合成氨工业哈伯(F·Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为1/2 N2(g)+3/2 H2(g) NH3(g) ΔH(298 K)=-46.2 kJ·mol-1,在Fe催化剂作用下的反应历程如下(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+H* NH*;NH*+H* NH2* ;
NH2* +H* NH3*
脱附:NH3* NH3(g)
其中,N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)利于提高合成氨平衡产率的条件有____________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)实际生产中,常用Fe作催化剂,控制温度773 K,压强3.0×105 Pa,原料中N2和H2物质的量之比为1∶2.8。分析说明原料气中N2过量的两个理由:__________
。
(3)关于合成氨工艺的下列理解,正确的是________。
A.合成氨反应在不同温度下的ΔH和ΔS都小于零
B.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气必须经过净化处理,以防止催化剂中毒和安全事故发生
AD
ACD
原料气中N2相
对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率
【考点三】化学平衡状态判断
【例1】一定温度下,在一固定体积的密闭容器中,能说明可逆反应A(s)+3B(g)2C(g)达到平衡状态的是 ( )
①C的生成速率与C的分解速率相等
②单位时间内生成a mol A,同时生成3a mol B ③气体密度不再变化
④混合气体的总压强不再变化 ⑤A、B、C的物质的量之比为1∶3∶2
⑥混合气体的总物质的量不再改变
A.②④⑤⑥ B.①③④⑥ C.①②④⑥ D.①③④⑤
B
【例2】恒温条件下,可逆反应:2NO(g)+O2(g) 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
A
[易错警示] 判断化学平衡时要规避“2”个易失分点
(1)化学平衡状态判断“三关注”
关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;关注反应特点,是等体积反应,还是非等体积反应;关注特殊情况,是否有固体参加或生成,或固体的分解反应。
【例1】某温度下反应H2(g)+I2(g) 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器(1 L)中充入0.2 mol H2(g)、0.5 mol I2(g)及0.3 mol HI(g),则下列说法中正确的是( )
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2 mol·L-1
D
【考点四】化学平衡常数的相关计算
【例2】某温度下,向容积为1 L的密闭反应器中充入0.10 mol SO3,当反应容器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为( )
A.8.0×102
B.1.6×103
C.3.2×103
D.4.0×102
B
【考点五】化学平衡移动方向的分析与判断
【例1】将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
C
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
【例2】在某温度下,反应ClF(g)+F2(g) ClF3(g) ΔH=+268 kJ·mol-1,在密闭容器中达到平衡,下列说法中正确的是( )
A.升高温度,平衡常数不变,平衡向正反应方向移动
B.升高温度,平衡常数减小
C.升高温度,平衡向正反应方向移动,F2的转化率增大
D.降低温度,ClF3的产率增大
C
【例3】反应NH4HS(s) NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况下,不会使平衡发生移动的是( )
A.温度、容积不变时,通入SO2气体
B.移走一部分NH4HS固体
C.容器体积不变,充入氨气
D.保持压强不变,充入氮气
B
【考点六】化学平衡的影响因素
【例1】合成氨所需的氢气可用煤和水做原料经多步反应制得,其中的一步反应为CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强
B.降低温度
C.增大CO的浓度
D.更换催化剂
B
【例2】在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
C
【例1】1 000 ℃时,FeO(s)+H2 Fe(s)+H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a的值最接近( )
A.1.0 B.2.0
C.3.0 D.4.0
C
【考点七】化学平衡相关计算
【例2】如图,关闭活塞K,向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,此时A的容积是a L,B的容积是2a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) 2Z(g)+W(g) ΔH<0。A保持恒压,B保持恒容。达平衡时,A的体积为1.4a L。下列说法错误的是( )
A.反应速率:v(B)>v(A) B.A容器中X的转化率为80%
C.若打开K,则A的体积变为2.6a L D.平衡时Y的体积分数:A
A
B
【例3】可逆反应CO(g)+H2O(g) CO2(g)+H2(g)在密闭容器中建立了平衡。当温度为749 K时,K=9/4,问:
(1)当CO和H2O的起始浓度为2 mol·L-1时,CO的转化率为________。
(2)当CO的起始浓度仍为2 mol·L-1,H2O的起始浓度为6 mol·L-1时,CO的转化率为________。
60%
85%
【例4】一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(s)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断正确的是( )
A.该条件下此反应的化学平衡常数约为0.91
B.A的平均反应速率为0.3 mol·L-1·s-1
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应不一定达到平衡状态
A
【考点八】化学反应的方向
【例1】下列说法正确的是( )
A.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
B.反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C.CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH<0
B
【例2】已知在等温等压条件下,化学反应方向的判据为
ΔH-TΔS<0 反应能自发进行
ΔH-TΔS=0 反应达到平衡状态
ΔH-TΔS>0 反应不能自发进行
设反应A=D+E ΔH-TΔS=(-4 500+11T) J·mol-1,要防止反应发生,温度必须( )
A.高于409 K B.低于136 K
C.高于136 K而低于409 K D.低于409 K
A
【考点九】化学反应的调控
【例1】某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )
A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成
B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率
C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高
D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
D
【例2】据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃下进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
B
