第三章 章末复习 课件(共46张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第三章 章末复习 课件(共46张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:33:48 | ||
图片预览











文档简介
(共46张PPT)
第三章 水溶液中的离子反应与平衡
章末复习
1.回顾本单元的文本及教材,熟悉本单元的知识及逻辑结构;
2.能从电离、离子反应、化学平衡的角度分析溶液的性质;
3.熟练运用平衡移动原理解决有关电解质溶液的问题。
知识点一:电解质的分类
1.弱电解质的电离平衡
在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率相等时,电离过程达到电离平衡状态。如图所示:
知识点二:弱电解质的电离平衡
特征:逆、等、动、定、变
2.影响电离平衡的条件
(1)内因:物质本身的性质
(2)外因:
①温度:由于电离过程是吸热的过程,所以升高温度,平衡向电离方向移动,电离程度增大
②浓度:I、加水稀释→平衡向电离的方向移动→电离程度增大→但离子浓度减小
II、增大弱电解质的浓度→平衡向电离方向移动→但电离程度减小
III、加入同浓度的弱电解质溶液→平衡不移动→各微粒浓度不变、电离程度不变
IV、加入其它试剂,减小或增大弱电解质电离出的某离子的浓度,可促进或抑制电离
知识点三:电离平衡常数
1.表达式:
以AB A++B-为例,则
2.影响因素:
(1)物质本身的性质决定
(2)只受温度影响,升高温度,电离平衡常数增大,电离程度越大
3.意义:相同条件下,K值越大,表示该弱电解质越易电离,所对应溶液的酸性或碱性越强
1.电离方程式:
H2O
H++OH- 或 H2O+H2O
H3O ++OH-
2.特点:
由水电离出的H+与OH-浓度相等,即c(H+)水=c(OH-)水
3.影响因素:
(1)促进:
①升温
②加活泼金属
④加弱碱阳离子或弱酸阴离子(即能水解的盐)
③电解
(2)抑制:
①降温
②加酸或碱
③加强酸酸式盐
知识点四:水的电离
知识点五:水的离子积
表达式:Kw=c(H+)·c(OH-)
①c(H+)和c(OH-)均表示整个溶液中的H+、OH-的总物质的量浓度
②Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液
酸溶液中:Kw= c(H+)酸·c(OH-)水
碱溶液中:Kw= c(H+)水·c(OH-)碱
盐溶液中:Kw= c(H+)水·c(OH-)水
③不同溶液中的c(H+)、c(OH-)可能不同,但任何溶液中的c(H+)水=c(OH-)水
④Kw只与温度有关,温度升高,Kw增大,水更易电离
25℃时,Kw=1.0×10-14
100℃时,Kw=1.0×10-12
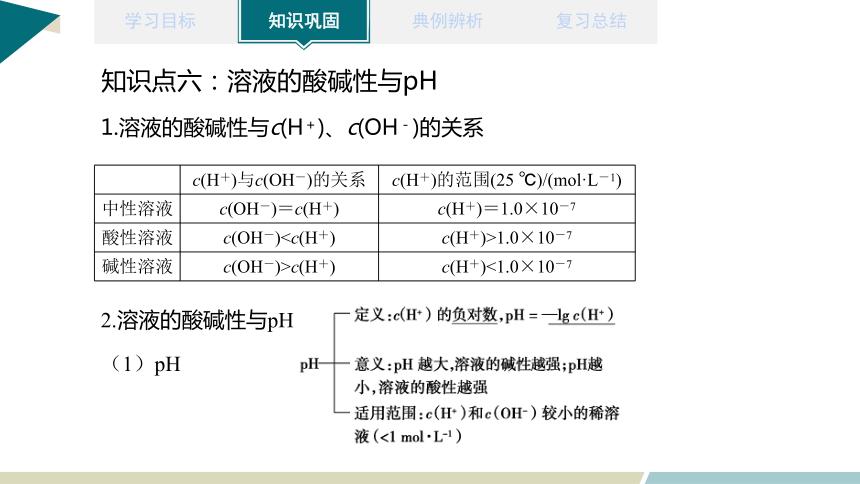
知识点六:溶液的酸碱性与pH
1.溶液的酸碱性与c(H+)、c(OH-)的关系
c(H+)与c(OH-)的关系 c(H+)的范围(25 ℃)/(mol·L-1)
中性溶液 c(OH-)=c(H+) c(H+)=1.0×10-7
酸性溶液 c(OH-)1.0×10-7
碱性溶液 c(OH-)>c(H+) c(H+)<1.0×10-7
2.溶液的酸碱性与pH
(1)pH
(2)溶液的酸碱性与pH的关系(常温下)
(3)溶液酸碱性的测定方法
①酸碱指示剂法
②利用pH试纸测定。
③利用pH计测定。
知识点七:酸碱中和滴定
酸碱中和滴定的原理:H++OH-=H2O 即利用中和反应时,c(H+)酸·V酸= c(OH-)碱·V碱
则c(H+)酸=
或 c(OH-)碱=
知识点八:盐类的水解
1.实质
盐电离―→ ―→破坏了水的电离平衡―→水的电离程度增大―→c(H+)≠c(OH-)―→溶液呈碱性、酸性或中性。
2.特点
1.极其微弱,为可逆反应,存在水解平衡
2.是中和反应的逆反应,水解反应是吸热反应
3.规律:
有弱就水解,无弱不水解;
越弱越水解,都弱都水解;
谁强显谁性,同强显中性
知识点九:影响盐类水解的主要因素
1.内因:
反应物的性质。
越弱越水解,越水解其酸(或碱)性越强。
2.外因:
(1)温度:
升高温度,促进水解
(2)浓度:
加水稀释 →向右移动→水解程度大→酸(或碱)性减弱
盐的浓度越高→向右移动→水解程度小→酸(或碱)性增强
(3)同离子效应:加酸或碱抑制或促进水解
小结:越弱越水解,越热越水解,越稀越水解,加酸或碱抑制或促进水解
知识点十:难溶电解质溶解平衡的特点
逆——沉淀溶解平衡是一个可逆过程
等——溶解速率和沉淀速率相等
动——动态平衡,溶解速率和沉淀速率不等于零
定——平衡状态时,溶液中的离子浓度保持不变
变——当改变外界条件时,溶解平衡发生移动
注:(1)生成沉淀的离子反应不能进行到底(即离子浓度≠0),
一般情况下,当溶液中剩余离子的浓度小于1×10-5mol/L时,化学上通常认为生成沉淀的反应就进行完全了
(2)易溶的饱和溶液中也存在溶解平衡。例:NaCl饱和溶液中存在溶解和结晶平衡
知识点十一:影响难溶电解质的因素
1.内因:难溶电解质本身的性质
2.外因:(1)浓度:加水,平衡向溶解方向移动,溶解度不变
(2)温度:升温,多数平衡向溶解方向移动(原因:溶解吸热);但少数向沉淀方向移动(例:Ca(OH)2)
(3)同离子效应:加入相同的离子,平衡向沉淀方向移动,溶解度减小
(4)加入与体系中某些离子反应的物质,产生气体或更难溶的物质,导致平衡向溶解的方向移动。
知识点十二:溶度积常数(简称溶度积) ——Ksp
1.表达式
对于溶解平衡:MmAn(s)
mMn+(aq)+nAm-(aq) 反应
Ksp=[c(Mn+)]m·[c(Am-)]n
例:Ag2S(s)
2Ag+(aq)+S2-(aq) Ksp=c2(Ag+)·c(S2-)
2.意义:
对于同类型(阴、阳离子个数相同)的难溶电解质,
在相同温度下,Ksp越大→S(溶解度)越大
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15
说明S(AgCl)> S(AgBr)
3.影响因素:
Ksp只与难溶电解质的性质和温度有关
4.应用:
判断有无沉淀——溶度积规则
Q(离子积)= [c(Mn+)]m·[c(Am-)]n
Q>Ksp时,溶液中有沉淀析出
Q=Ksp时,沉淀与溶解处于平衡状态
Q1.沉淀的生成
(1)调节pH法(2)加沉淀剂法。
知识点十二:沉淀溶解平衡的应用
2.沉淀的溶解
(1)原理:根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
(2)溶解沉淀的试剂类型。
①用强酸溶解
②用某些盐溶液溶解
3.沉淀的转化
【典例】泡沫灭火器内含有NaHCO3浓溶液(置于铁桶内)和浓Al2(SO4)3溶液(置于玻璃瓶内)。使用时把灭火器倒置即有泡沫喷出灭火。
(1)写出倒置灭火器时所发生反应的离子方程式: 。
(2)灭火器内NaHCO3溶液体积和Al2(SO4)3溶液体积之比约为5∶1,请估计两种溶液的物质的量浓度之比约为 ; 溶液稍过量更好些。
考点1:阴、阳离子水解相互促进的应用
相互促进水解的离子主要有如下几种情况
(1)两种离子水解相互促进。有下面两种情况:
①两种离子水解,强烈的相互促进,使反应趋于完全,其离子方程式中应用“=”连接,产物应标明“↑”“↓”。
②两种离子水解,相互促进但不强烈,其离子方程式仍用“ ”连接。
(2)发生复分解反应。当发生复分解反应生成的沉淀比水解反应生成的沉淀更难溶时,物质之间发生复分解反应。
(3)发生氧化还原反应。物质之间若既能发生氧化还原反应,又能发生水解反应,通常以氧化还原反应为主。
【变式1】下列离子组一定不能大量共存的是( )
C
【变式2】(1)明矾可用于净水,原因是 (用离子方程式表示)。
把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)纯碱可代替洗涤剂洗涤餐具,原因是
(用离子方程式表示)。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是
。
考点2:酸碱中和滴定曲线问题
【典例】 以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2-的分布系数: 下列叙述正确的是( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
C
抓反应的“起始点” 判断酸、碱的相对强弱
抓反应的“一半点” 判断是哪种溶质的等量混合
抓溶液的“中性点” 判断溶液中溶质的成分及哪种物质过量或不足
抓“恰好反应点” 判断生成的溶质成分及溶液的酸碱性
抓反应的“过量点” 判断溶液中的溶质,判断哪种物质过量
1.关键“五点”
2.示例点拨
常温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示:
【变式】 常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。已知在点③处恰好中和。下列说法错误的是( )
A.点①②③三处溶液中水的电离程度依次增大
B.该温度时CH3COOH的电离平衡常数约为1.8×10-5
C.点③处c(OH-)<c(CH3COOH)+ c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)> c(H+)>c(Na+)>c(OH-)
C
【典例1】 常温下,下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.pH=8 的CH3COONa溶液:c(CH3COOH)=9.9×10-7 mol·L-1
B.0.1 mol·L-1Na2SO3溶液:c(Na+)+c(H+)=c()+c()+c(OH-)
C.0.1 mol·L-1NaHCO3溶液:c(Na+)+c(OH-)=c()+c(H2CO3)+c(H+)
D.0.1 mol·L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)> c(CH3COOH)>c(Cl-)
A
考点3:电解质溶液中三大守恒关系的应用
AD
【典例2】(双选)室温下,将两种浓度均为0.1 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒的物质的量浓度关系正确的是( )
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)> c()> c()> c(OH-)
B.氨水-NH4Cl混合溶液(pH=9.25):c()+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)> c(CH3COOH)> c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c()+c(OH-)
(1)电荷守恒规律:电解质溶液中,不论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。
(2)元素质量守恒(物料守恒)规律:电解质溶液中,由于某些离子能水解或电离,离子的存在形式发生了变化,就该离子所含的某种元素来说,其质量在变化前后是守恒的。
(3)质子守恒规律:电解质溶液中,由于电离、水解等过程的发生,往往存在质子(H+)的转移,但转移过程中质子数量保持不变,称为质子守恒。
解决混合溶液中粒子浓度问题的整体思路
【变式1】常温下,将a L 0.1 mol·L-1的NaOH溶液与b L 0.1 mol·L-1的CH3COOH溶液混合。下列有关混合溶液的说法一定不正确的是( )
A.ac(Na+)>c(H+)>c(OH-)
B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.a=b时,c(CH3COOH)+c(H+)=c(OH-)
D.无论a、b有何关系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
解析:由电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),故D正确;若b>a,醋酸过量,混合后溶液为CH3COONa与CH3COOH的混合溶液,当溶液呈酸性时A正确;若a=b,反应后的溶液为CH3COONa溶液,由于CH3COO-水解而显碱性,根据质子守恒可知,C正确;若a>b,说明碱过量,溶液为CH3COONa与NaOH的混合溶液,存在c(Na+)>c(CH3COO-),B错误。
B
【变式2】在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
B
典例1下列物质的溶液在蒸发皿中加热蒸干、灼烧,可以得到该物质的固体的是( )
A.FeCl3 B.Na2SO3 C.KMnO4 D.MgSO4
解析:FeCl3的溶液在蒸发皿中加热蒸干、灼烧得到Fe2O3;Na2SO3的溶液在蒸发皿中加热蒸干、灼烧得到Na2SO4;KMnO4加热分解。
考点4:不同类型盐溶液蒸干后所得固体的判断
D
解决溶液蒸干是否得到原溶质的问题时,常常需要从以下几个方面进行分析
(1)加热挥发性酸的弱碱盐(铵盐除外)的水合晶体或溶液时,得到水解产物(也可能再分解)。
(2)加热挥发性酸的强碱盐溶液或不挥发性酸的弱碱盐溶液等,得到的固体一般为原溶质。
(3)某些盐溶液在加热过程中或蒸干后可能发生分解反应,最终得到分解产物。
(4)加热阴、阳离子均易水解且水解产物易挥发的盐的水溶液,蒸干时得不到任何固体物质,如(NH4)2S、(NH4)2CO3等。
(5)加热蒸干易被氧化的盐溶液,蒸干后得到其氧化产物。
例如,FeSO4溶液蒸干后得到Fe2(SO4)3。Na2SO3溶液蒸干后得到Na2SO4。
【变式1】在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该固体物质的是( )
A.MgCl2 B.Al2(SO4)3
C.Ca(HCO3)2 D.(NH4)2CO3
B
【变式2】在蒸发皿中加热蒸干并灼烧(低于400 ℃)下列溶液,可以得到原溶质的是( )
A.氯化镁溶液 B.硫酸亚铁溶液
C.碳酸氢钠溶液 D.硫酸铝溶液
解析:氯化镁溶液蒸干并灼烧得到氧化镁;硫酸亚铁溶液蒸干并灼烧最后得到硫酸铁;碳酸氢钠溶液蒸干并灼烧最后得到碳酸钠,硫酸铝溶液蒸干并灼烧最后得到硫酸铝。
D
考点5:四大平衡常数对比
【典例】已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是________(填标号)。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25 ℃时,H2SO3 +H+的电离常数Ka=1.4×10-2 mol/L,
则该温度下pH=3、c()=0.1 mol/L的NaHSO3溶液中
c(H2SO3)= 。
ad
0.007 mol/L
认知
思路
找准粒子
溶解、反应、电离、水解
找准平衡
写对平衡
电离平衡、水解平衡、
沉淀溶解平衡
用好常数
Ka Kb Kw Kh Ksp
分析动向
判断结果
定量、定性
【变式1】已知 25 ℃,NH3·H2O 的 Kb=1.8×10-5,H2SO3 的 Ka1=1.3×10-2,Ka2= 6.2×10-8。若氨水的浓度为 2.0 mol·L-1,溶液中的 c(OH-) = mol·L-1.将SO2通入该氨水中,当 c(OH-) 降至1.0×10-7 mol·L-1 时,溶液中的 c(SO32-) /c(HSO3- )= 。
6.0×10-3
0.62
Kb=
c ( NH4+).c( OH- )
c(NH3·H2O)
找平衡:NH3·H2O NH4+ +OH-
起
转
平:
列等式:
x= c(OH-) = 6.0×10-3 mol/L
≈2 mol/L
算结果:
2 mol/L 0 0
x x x
(2 –x) mol/L x x
=1.8×10-5
x2
2
=
25℃:c(OH-)= c(H+)=10-7 mol/L
c(SO32-)
c(HSO3-)
c(SO32-) c(H+)
c(HSO3-)
Ka2=
=0.62
c(H+)
Ka2
=
【变式2】相同温度下,根据三种酸的电离常数,下列判断正确的是( )
A.三种酸的强弱关系:HX>HY>HZ
B.反应HX+Y-===HY+X-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最小
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
酸 HX HY HZ
电离常数Ka 9×10-7 9×10-6 1×10-2
C
【解析】A.相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,根据电离平衡常数知,这三种酸的强弱顺序为HZ>HY>HX,故A错误;B.由A知,HY的酸性强于HX,根据强酸制取弱酸知,该反应HX+Y-===HY+X-不能发生,故B错误;C.根据电离平衡常数知,这三种酸的强弱顺序是HZ>HY>HX,根据盐越弱越水解,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最小,故C正确;D.电离平衡常数与浓度无关,只受温度影响,相同温度下同一物质的电离平衡常数不变,故D错误。
第三章 水溶液中的离子反应与平衡
章末复习
1.回顾本单元的文本及教材,熟悉本单元的知识及逻辑结构;
2.能从电离、离子反应、化学平衡的角度分析溶液的性质;
3.熟练运用平衡移动原理解决有关电解质溶液的问题。
知识点一:电解质的分类
1.弱电解质的电离平衡
在一定条件下(如温度和浓度),弱电解质电离成离子的速率和离子结合成分子的速率相等时,电离过程达到电离平衡状态。如图所示:
知识点二:弱电解质的电离平衡
特征:逆、等、动、定、变
2.影响电离平衡的条件
(1)内因:物质本身的性质
(2)外因:
①温度:由于电离过程是吸热的过程,所以升高温度,平衡向电离方向移动,电离程度增大
②浓度:I、加水稀释→平衡向电离的方向移动→电离程度增大→但离子浓度减小
II、增大弱电解质的浓度→平衡向电离方向移动→但电离程度减小
III、加入同浓度的弱电解质溶液→平衡不移动→各微粒浓度不变、电离程度不变
IV、加入其它试剂,减小或增大弱电解质电离出的某离子的浓度,可促进或抑制电离
知识点三:电离平衡常数
1.表达式:
以AB A++B-为例,则
2.影响因素:
(1)物质本身的性质决定
(2)只受温度影响,升高温度,电离平衡常数增大,电离程度越大
3.意义:相同条件下,K值越大,表示该弱电解质越易电离,所对应溶液的酸性或碱性越强
1.电离方程式:
H2O
H++OH- 或 H2O+H2O
H3O ++OH-
2.特点:
由水电离出的H+与OH-浓度相等,即c(H+)水=c(OH-)水
3.影响因素:
(1)促进:
①升温
②加活泼金属
④加弱碱阳离子或弱酸阴离子(即能水解的盐)
③电解
(2)抑制:
①降温
②加酸或碱
③加强酸酸式盐
知识点四:水的电离
知识点五:水的离子积
表达式:Kw=c(H+)·c(OH-)
①c(H+)和c(OH-)均表示整个溶液中的H+、OH-的总物质的量浓度
②Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液
酸溶液中:Kw= c(H+)酸·c(OH-)水
碱溶液中:Kw= c(H+)水·c(OH-)碱
盐溶液中:Kw= c(H+)水·c(OH-)水
③不同溶液中的c(H+)、c(OH-)可能不同,但任何溶液中的c(H+)水=c(OH-)水
④Kw只与温度有关,温度升高,Kw增大,水更易电离
25℃时,Kw=1.0×10-14
100℃时,Kw=1.0×10-12
知识点六:溶液的酸碱性与pH
1.溶液的酸碱性与c(H+)、c(OH-)的关系
c(H+)与c(OH-)的关系 c(H+)的范围(25 ℃)/(mol·L-1)
中性溶液 c(OH-)=c(H+) c(H+)=1.0×10-7
酸性溶液 c(OH-)
碱性溶液 c(OH-)>c(H+) c(H+)<1.0×10-7
2.溶液的酸碱性与pH
(1)pH
(2)溶液的酸碱性与pH的关系(常温下)
(3)溶液酸碱性的测定方法
①酸碱指示剂法
②利用pH试纸测定。
③利用pH计测定。
知识点七:酸碱中和滴定
酸碱中和滴定的原理:H++OH-=H2O 即利用中和反应时,c(H+)酸·V酸= c(OH-)碱·V碱
则c(H+)酸=
或 c(OH-)碱=
知识点八:盐类的水解
1.实质
盐电离―→ ―→破坏了水的电离平衡―→水的电离程度增大―→c(H+)≠c(OH-)―→溶液呈碱性、酸性或中性。
2.特点
1.极其微弱,为可逆反应,存在水解平衡
2.是中和反应的逆反应,水解反应是吸热反应
3.规律:
有弱就水解,无弱不水解;
越弱越水解,都弱都水解;
谁强显谁性,同强显中性
知识点九:影响盐类水解的主要因素
1.内因:
反应物的性质。
越弱越水解,越水解其酸(或碱)性越强。
2.外因:
(1)温度:
升高温度,促进水解
(2)浓度:
加水稀释 →向右移动→水解程度大→酸(或碱)性减弱
盐的浓度越高→向右移动→水解程度小→酸(或碱)性增强
(3)同离子效应:加酸或碱抑制或促进水解
小结:越弱越水解,越热越水解,越稀越水解,加酸或碱抑制或促进水解
知识点十:难溶电解质溶解平衡的特点
逆——沉淀溶解平衡是一个可逆过程
等——溶解速率和沉淀速率相等
动——动态平衡,溶解速率和沉淀速率不等于零
定——平衡状态时,溶液中的离子浓度保持不变
变——当改变外界条件时,溶解平衡发生移动
注:(1)生成沉淀的离子反应不能进行到底(即离子浓度≠0),
一般情况下,当溶液中剩余离子的浓度小于1×10-5mol/L时,化学上通常认为生成沉淀的反应就进行完全了
(2)易溶的饱和溶液中也存在溶解平衡。例:NaCl饱和溶液中存在溶解和结晶平衡
知识点十一:影响难溶电解质的因素
1.内因:难溶电解质本身的性质
2.外因:(1)浓度:加水,平衡向溶解方向移动,溶解度不变
(2)温度:升温,多数平衡向溶解方向移动(原因:溶解吸热);但少数向沉淀方向移动(例:Ca(OH)2)
(3)同离子效应:加入相同的离子,平衡向沉淀方向移动,溶解度减小
(4)加入与体系中某些离子反应的物质,产生气体或更难溶的物质,导致平衡向溶解的方向移动。
知识点十二:溶度积常数(简称溶度积) ——Ksp
1.表达式
对于溶解平衡:MmAn(s)
mMn+(aq)+nAm-(aq) 反应
Ksp=[c(Mn+)]m·[c(Am-)]n
例:Ag2S(s)
2Ag+(aq)+S2-(aq) Ksp=c2(Ag+)·c(S2-)
2.意义:
对于同类型(阴、阳离子个数相同)的难溶电解质,
在相同温度下,Ksp越大→S(溶解度)越大
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15
说明S(AgCl)> S(AgBr)
3.影响因素:
Ksp只与难溶电解质的性质和温度有关
4.应用:
判断有无沉淀——溶度积规则
Q(离子积)= [c(Mn+)]m·[c(Am-)]n
Q>Ksp时,溶液中有沉淀析出
Q=Ksp时,沉淀与溶解处于平衡状态
Q
(1)调节pH法(2)加沉淀剂法。
知识点十二:沉淀溶解平衡的应用
2.沉淀的溶解
(1)原理:根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。
(2)溶解沉淀的试剂类型。
①用强酸溶解
②用某些盐溶液溶解
3.沉淀的转化
【典例】泡沫灭火器内含有NaHCO3浓溶液(置于铁桶内)和浓Al2(SO4)3溶液(置于玻璃瓶内)。使用时把灭火器倒置即有泡沫喷出灭火。
(1)写出倒置灭火器时所发生反应的离子方程式: 。
(2)灭火器内NaHCO3溶液体积和Al2(SO4)3溶液体积之比约为5∶1,请估计两种溶液的物质的量浓度之比约为 ; 溶液稍过量更好些。
考点1:阴、阳离子水解相互促进的应用
相互促进水解的离子主要有如下几种情况
(1)两种离子水解相互促进。有下面两种情况:
①两种离子水解,强烈的相互促进,使反应趋于完全,其离子方程式中应用“=”连接,产物应标明“↑”“↓”。
②两种离子水解,相互促进但不强烈,其离子方程式仍用“ ”连接。
(2)发生复分解反应。当发生复分解反应生成的沉淀比水解反应生成的沉淀更难溶时,物质之间发生复分解反应。
(3)发生氧化还原反应。物质之间若既能发生氧化还原反应,又能发生水解反应,通常以氧化还原反应为主。
【变式1】下列离子组一定不能大量共存的是( )
C
【变式2】(1)明矾可用于净水,原因是 (用离子方程式表示)。
把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)纯碱可代替洗涤剂洗涤餐具,原因是
(用离子方程式表示)。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是
。
考点2:酸碱中和滴定曲线问题
【典例】 以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2-的分布系数: 下列叙述正确的是( )
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.200 0 mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)
C
抓反应的“起始点” 判断酸、碱的相对强弱
抓反应的“一半点” 判断是哪种溶质的等量混合
抓溶液的“中性点” 判断溶液中溶质的成分及哪种物质过量或不足
抓“恰好反应点” 判断生成的溶质成分及溶液的酸碱性
抓反应的“过量点” 判断溶液中的溶质,判断哪种物质过量
1.关键“五点”
2.示例点拨
常温下,向20 mL 0.1 mol·L-1 HA溶液中逐滴加入0.1 mol·L-1 NaOH溶液,溶液pH的变化如图所示:
【变式】 常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。已知在点③处恰好中和。下列说法错误的是( )
A.点①②③三处溶液中水的电离程度依次增大
B.该温度时CH3COOH的电离平衡常数约为1.8×10-5
C.点③处c(OH-)<c(CH3COOH)+ c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)> c(H+)>c(Na+)>c(OH-)
C
【典例1】 常温下,下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.pH=8 的CH3COONa溶液:c(CH3COOH)=9.9×10-7 mol·L-1
B.0.1 mol·L-1Na2SO3溶液:c(Na+)+c(H+)=c()+c()+c(OH-)
C.0.1 mol·L-1NaHCO3溶液:c(Na+)+c(OH-)=c()+c(H2CO3)+c(H+)
D.0.1 mol·L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)> c(CH3COOH)>c(Cl-)
A
考点3:电解质溶液中三大守恒关系的应用
AD
【典例2】(双选)室温下,将两种浓度均为0.1 mol·L-1的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒的物质的量浓度关系正确的是( )
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)> c()> c()> c(OH-)
B.氨水-NH4Cl混合溶液(pH=9.25):c()+c(H+)=c(NH3·H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)> c(CH3COOH)> c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c()+c(OH-)
(1)电荷守恒规律:电解质溶液中,不论存在多少种离子,溶液总是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。
(2)元素质量守恒(物料守恒)规律:电解质溶液中,由于某些离子能水解或电离,离子的存在形式发生了变化,就该离子所含的某种元素来说,其质量在变化前后是守恒的。
(3)质子守恒规律:电解质溶液中,由于电离、水解等过程的发生,往往存在质子(H+)的转移,但转移过程中质子数量保持不变,称为质子守恒。
解决混合溶液中粒子浓度问题的整体思路
【变式1】常温下,将a L 0.1 mol·L-1的NaOH溶液与b L 0.1 mol·L-1的CH3COOH溶液混合。下列有关混合溶液的说法一定不正确的是( )
A.a
B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.a=b时,c(CH3COOH)+c(H+)=c(OH-)
D.无论a、b有何关系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
解析:由电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),故D正确;若b>a,醋酸过量,混合后溶液为CH3COONa与CH3COOH的混合溶液,当溶液呈酸性时A正确;若a=b,反应后的溶液为CH3COONa溶液,由于CH3COO-水解而显碱性,根据质子守恒可知,C正确;若a>b,说明碱过量,溶液为CH3COONa与NaOH的混合溶液,存在c(Na+)>c(CH3COO-),B错误。
B
【变式2】在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
B
典例1下列物质的溶液在蒸发皿中加热蒸干、灼烧,可以得到该物质的固体的是( )
A.FeCl3 B.Na2SO3 C.KMnO4 D.MgSO4
解析:FeCl3的溶液在蒸发皿中加热蒸干、灼烧得到Fe2O3;Na2SO3的溶液在蒸发皿中加热蒸干、灼烧得到Na2SO4;KMnO4加热分解。
考点4:不同类型盐溶液蒸干后所得固体的判断
D
解决溶液蒸干是否得到原溶质的问题时,常常需要从以下几个方面进行分析
(1)加热挥发性酸的弱碱盐(铵盐除外)的水合晶体或溶液时,得到水解产物(也可能再分解)。
(2)加热挥发性酸的强碱盐溶液或不挥发性酸的弱碱盐溶液等,得到的固体一般为原溶质。
(3)某些盐溶液在加热过程中或蒸干后可能发生分解反应,最终得到分解产物。
(4)加热阴、阳离子均易水解且水解产物易挥发的盐的水溶液,蒸干时得不到任何固体物质,如(NH4)2S、(NH4)2CO3等。
(5)加热蒸干易被氧化的盐溶液,蒸干后得到其氧化产物。
例如,FeSO4溶液蒸干后得到Fe2(SO4)3。Na2SO3溶液蒸干后得到Na2SO4。
【变式1】在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该固体物质的是( )
A.MgCl2 B.Al2(SO4)3
C.Ca(HCO3)2 D.(NH4)2CO3
B
【变式2】在蒸发皿中加热蒸干并灼烧(低于400 ℃)下列溶液,可以得到原溶质的是( )
A.氯化镁溶液 B.硫酸亚铁溶液
C.碳酸氢钠溶液 D.硫酸铝溶液
解析:氯化镁溶液蒸干并灼烧得到氧化镁;硫酸亚铁溶液蒸干并灼烧最后得到硫酸铁;碳酸氢钠溶液蒸干并灼烧最后得到碳酸钠,硫酸铝溶液蒸干并灼烧最后得到硫酸铝。
D
考点5:四大平衡常数对比
【典例】已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是________(填标号)。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25 ℃时,H2SO3 +H+的电离常数Ka=1.4×10-2 mol/L,
则该温度下pH=3、c()=0.1 mol/L的NaHSO3溶液中
c(H2SO3)= 。
ad
0.007 mol/L
认知
思路
找准粒子
溶解、反应、电离、水解
找准平衡
写对平衡
电离平衡、水解平衡、
沉淀溶解平衡
用好常数
Ka Kb Kw Kh Ksp
分析动向
判断结果
定量、定性
【变式1】已知 25 ℃,NH3·H2O 的 Kb=1.8×10-5,H2SO3 的 Ka1=1.3×10-2,Ka2= 6.2×10-8。若氨水的浓度为 2.0 mol·L-1,溶液中的 c(OH-) = mol·L-1.将SO2通入该氨水中,当 c(OH-) 降至1.0×10-7 mol·L-1 时,溶液中的 c(SO32-) /c(HSO3- )= 。
6.0×10-3
0.62
Kb=
c ( NH4+).c( OH- )
c(NH3·H2O)
找平衡:NH3·H2O NH4+ +OH-
起
转
平:
列等式:
x= c(OH-) = 6.0×10-3 mol/L
≈2 mol/L
算结果:
2 mol/L 0 0
x x x
(2 –x) mol/L x x
=1.8×10-5
x2
2
=
25℃:c(OH-)= c(H+)=10-7 mol/L
c(SO32-)
c(HSO3-)
c(SO32-) c(H+)
c(HSO3-)
Ka2=
=0.62
c(H+)
Ka2
=
【变式2】相同温度下,根据三种酸的电离常数,下列判断正确的是( )
A.三种酸的强弱关系:HX>HY>HZ
B.反应HX+Y-===HY+X-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最小
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
酸 HX HY HZ
电离常数Ka 9×10-7 9×10-6 1×10-2
C
【解析】A.相同温度下,酸的电离常数越大,则酸的电离程度越大,酸的酸性越强,则酸根离子水解程度越小,根据电离平衡常数知,这三种酸的强弱顺序为HZ>HY>HX,故A错误;B.由A知,HY的酸性强于HX,根据强酸制取弱酸知,该反应HX+Y-===HY+X-不能发生,故B错误;C.根据电离平衡常数知,这三种酸的强弱顺序是HZ>HY>HX,根据盐越弱越水解,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最小,故C正确;D.电离平衡常数与浓度无关,只受温度影响,相同温度下同一物质的电离平衡常数不变,故D错误。
