第一章 章末复习 课件 (共31张PPT)2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第一章 章末复习 课件 (共31张PPT)2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 545.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:34:36 | ||
图片预览









文档简介
(共31张PPT)
第一章 化学反应的热效应
章末复习
1.了解反应热、焓变、燃烧热、中和热的概念
2.能对中和反应反应热的进行误差分析
3.能正确书写热化学方程式,并判断热化学方程式的正误
4.能从宏观和微观角度解释化学反应中能量变化的原因
5.能利用盖斯定律计算
6.能对反应热的大小进行比较
知识点一:反应热 焓变
1.反应热
2.焓变
符号:
单位:
规定:
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
生成物与反应物的焓值差,等压条件下的反应热也可称为“焓变”。
H
kJ/mol
当 H<0时,为放热反应;当 H>0时,为吸热反应
知识点二:中和热
在25℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
1.定义
H+(aq)+OH-(aq) == H2O(l) ΔH = -57.3 kJ mol-1
①若弱酸与弱碱稀溶液反应,因为电离吸热,ΔH > -57.3 kJ mol-1
②若强酸与强碱浓溶液反应,因为稀释放热,ΔH < -57.3 kJ mol-1
③若中和反应生成沉淀,因为形成沉淀放热,ΔH < -57.3 kJ mol-1
2.热化学方程式
3.注意
知识点三:中和热的测定
Q = c · m ·(t2-t1)
【实验步骤】
①反应物温度的测量。
②反应后体系温度的测量。
③重复上述步骤两次。
【数据处理】
【误差分析】
看实验中有哪些因素能造成(t2-t1)出现误差。
若(t2-t1)偏大,则|ΔH|偏大,若(t2-t1)偏小,则|ΔH|偏小
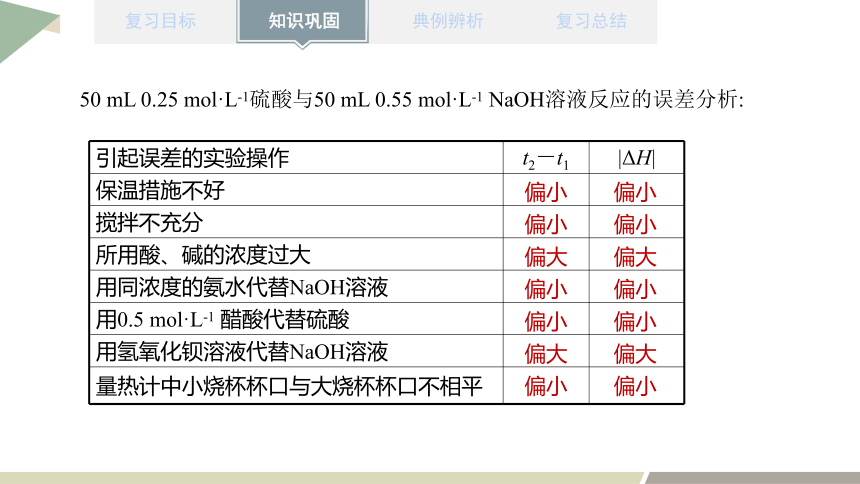
50 mL 0.25 mol·L-1硫酸与50 mL 0.55 mol·L-1 NaOH溶液反应的误差分析:
引起误差的实验操作 t2-t1 |ΔH|
保温措施不好
搅拌不充分
所用酸、碱的浓度过大
用同浓度的氨水代替NaOH溶液
用0.5 mol·L-1 醋酸代替硫酸
用氢氧化钡溶液代替NaOH溶液
量热计中小烧杯杯口与大烧杯杯口不相平
偏小
偏小
偏小
偏小
偏大
偏大
偏小
偏小
偏小
偏小
偏大
偏大
偏小
偏小
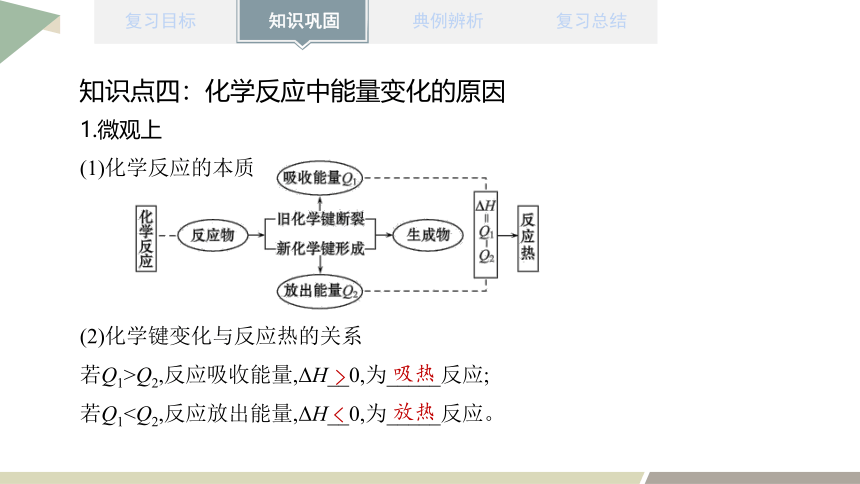
1.微观上
(1)化学反应的本质
(2)化学键变化与反应热的关系
若Q1>Q2,反应吸收能量,ΔH__0,为_____反应;
若Q1>
吸热
<
放热
知识点四:化学反应中能量变化的原因
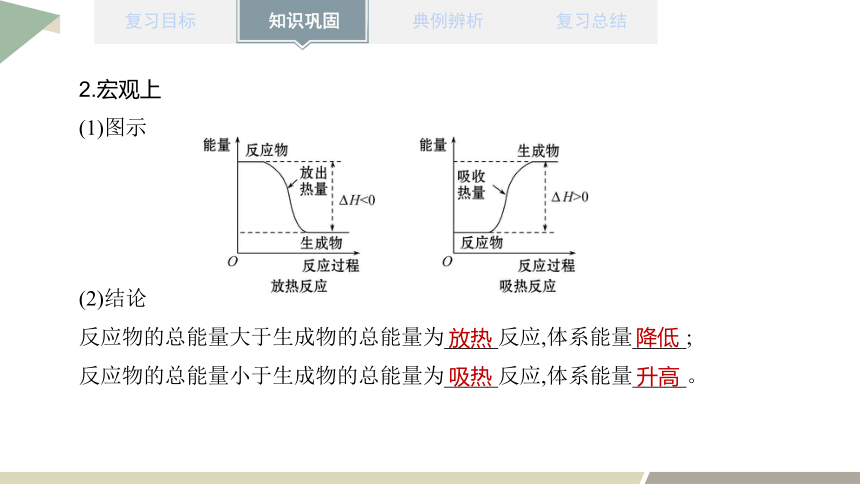
2.宏观上
(1)图示
(2)结论
反应物的总能量大于生成物的总能量为_____反应,体系能量_____;
反应物的总能量小于生成物的总能量为_____反应,体系能量_____。
放热
降低
吸热
升高
知识点五:热化学方程式的书写
1.定义:
表明反应所释放或吸收的热量的化学方程式。
表明了化学反应中的物质变化和能量变化。
2.含义:
3.书写热化学方程式步骤:
写出配平的化学方程式
用s、l、g、aq标明物质的聚集状态状态
根据吸热或者放热判断ΔH的正负
根据化学计量数计算写出ΔH的值
4.注意事项
热化学反应中的ΔH的“+”与“-”一定要注明,“+”代表吸热,“-”代表放热,不能省略。
热化学反应方程式逆向书写时(化学计量数不变),ΔH的数值的绝对值相等,符号相反。
② 注明反应时的温度和压强,25℃ 101kPa时进行的反应可不注明。
①必须在化学方程式的右边标明反应热ΔH的符号、数值和单位
③ 注明反应体系中反应物和生成物的聚集状态,不用写引发条件。
不再用“↑”“↓”来标记气体生成物和难溶生成物
热化学方程式中各物质的化学计量数可以写成分数或整数,其 H与系数对应成比例,系数加倍, H值也加倍。
101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量
知识六:燃烧热
1.定义:
C CO2(g)
S SO2(g)
H H2O (l)
N N2(g)
2.研究物质燃烧热的意义
了解化学反应完成时产生热量的多少,以便更好地控制反应条件,充分利用能源。
不管化学反应是一步完成或是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
知识点七:盖斯定律
1.内容:
2.盖斯定律在科学研究中的重要意义:
盖斯定律
反应进行得很慢
反应不容易直接发生
反应的产品不纯
间接计算
ΔH
知识点八:反应热的计算
1.根据反应物和生成物的能量计算
2.根据键能计算
3.根据热化学方程式计算
4.根据燃烧热计算
5.根据盖斯定律计算
6.根据图像信息计算
ΔH=生成物的总能量 反应物的总能量
ΔH=反应物键能和-生成物键能和
Q放=n(可燃物)×|ΔH|
【考点一】吸热反应与放热反应的判断
【例】下列图示变化为吸热反应的是( )
A
理论分析判断法
用常见吸热和放热的反应类型来判断
ΔH = 化学键断裂吸收的能量 - 化学键形成释放的能量
ΔH = 生成物具有的总能量 - 反应物具有的总能量
ΔH = 反应物的键能之和-生成物的键能之和
根据反应物和生成物的相对稳定性判断
【方法归纳】
[练一练]
已知:反应A+B=C+D的能量变化如图所示,下列叙述正确的是( )
A.该反应为放热反应
B.反应物的总能量高于生成物的总能量
C.旧化学键断裂吸收的总能量大于新化学键形成放出的总能量
D.该反应只有在加热条件下才能进行
C
【考点二】热化学方程式的正误判断
【例】燃烧1 g乙炔生成二氧化碳和液态水放出热量50 kJ,则下列热化学
方程式书写正确的是( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=+50 kJ·mol-1
B.C2H2(g)+ O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ
C.2C2H2+5O2===4CO2+2H2O ΔH=-2 600 kJ
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1
D
【方法归纳】
热化学方程式是否已配平,是否符合客观事实;
各物质的聚集状态是否标明;
反应热ΔH的数值与该热化学方程式的化学计量数是否对应;
反应热ΔH的符号、单位是否正确。
热化学方程式正误判断方法
[练一练]
下列热化学方程式书写正确的是( )
A.
B.
C.
D.
D
【考点三】盖斯定律的应用
【例】CH4—CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:
C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol-1
+247
该催化重整反应的ΔH= kJ·mol-1。
【方法归纳】
找出待求热化学方程式中各物质在已知热化学方程式中的位置
根据待求热化学方程式中各物质的化学计量数和位置对已知热化学方程式进行处理,得到变形后的新热化学方程式
将新得到的热化学方程式进行加减,反应热也需要相应加减
写出待求的热化学方程式
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1。
2.用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH= kJ·mol-1。
+114
-136.2
[练一练]
【考点四】燃烧热和中和热
【例】
A.CO(g)的燃烧热283.0kJ·mol-1,则反应2CO2(g)=2CO(g)+O2(g)的ΔH=+566.0kJ·mol-1
B.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
C.反应热有正负之分,燃烧热ΔH全部是正值
D.1mol甲烷燃烧生成二氧化碳所和气态水放出的热量是甲烷的燃烧热
下列关于反应热的描述中正确的是( )
A
【方法归纳】
反应热 中和热 燃烧热
含义 化学反应过程中放出或吸收的热量 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所释放的热量称为中和热 101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热
反应特点 任何反应 中和反应 在氧气中燃烧的燃烧反应
方程式配平标准 任意物质的量 以生成1 mol H2O为标准 以燃烧1 mol纯物质为标准
ΔH符号 放热为“-”,吸热为“+” “-” “-”
举例 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8kJ/mol
[练一练]
已知稀溶液中, 由此判断下列热化学方程式书写正确的是( )
A.
B.
C.
D.
D
H
H
H
H
【考点五】反应热的大小比较
比较下列各组热化学方程式中ΔH的大小(填“>”“<”或“=”)。
【例】
>
<
>
【方法归纳】
(1)比较“反应热”或ΔH的大小时,必须带“+”或“-”符号;
比较反应吸收或放出的热量的多少时,只需比较|ΔH|的大小。
(2)参加反应的物质的物质的量与反应热成正比
(3)同一反应中物质的聚集状态不同,反应热数值大小也不同。
同种物质:E(g)>E(l)>E(s)
g→l ΔH<0 ; l→s ΔH<0 ; g→s ΔH<0
1.根据反应规律和影响ΔH大小的因素直接进行比较
【方法归纳】
2.根据反应进行的程度比较
对于可逆反应,如3H2(g)+N2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,是指生成2 mol NH3(g)时放出92.4 kJ的热量,而不是指3 mol H2和1 mol N2在一定条件下混合反应就可放出92.4 kJ的热量,实际上3 mol H2和1 mol N2在一定条件下混合反应放出的热量小于92.4 kJ,因为该反应的反应物不能完全转化为生成物。
【方法归纳】
3.根据反应物的性质比较
等物质的量的不同物质与同一种物质反应时,物质性质不同其反
应热不同。如等物质的量的不同金属(或非金属)与同一种物质反
应,金属(或非金属)越活泼反应越容易进行,放出的热量越多,对应
的ΔH越小。
例如Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g) ΔH1,
Ca(s)+2HCl(aq)=CaCl2(aq)+H2(g) ΔH2, ΔH1>ΔH2。
[练一练]
比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2 ΔH1________ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH4 ΔH3________ΔH4
(3)4Al(s)+3O2(g)===2Al2O3(s) ΔH5
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH6 ΔH5________ΔH6
<
>
<
化学反应的热效应
热化学方程式
燃烧热
中和热
化学反应热的计算
反应热 焓变
恒压反应热=焓变
H=H生成物-H反应物
概念
意义
注意事项
书写
概念
测定
一个条件
化学反应中
能量变化
宏观
微观
一个标准
两个要求
两种表示
盖斯定律
计算方法
第一章 化学反应的热效应
章末复习
1.了解反应热、焓变、燃烧热、中和热的概念
2.能对中和反应反应热的进行误差分析
3.能正确书写热化学方程式,并判断热化学方程式的正误
4.能从宏观和微观角度解释化学反应中能量变化的原因
5.能利用盖斯定律计算
6.能对反应热的大小进行比较
知识点一:反应热 焓变
1.反应热
2.焓变
符号:
单位:
规定:
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
生成物与反应物的焓值差,等压条件下的反应热也可称为“焓变”。
H
kJ/mol
当 H<0时,为放热反应;当 H>0时,为吸热反应
知识点二:中和热
在25℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ的热量。
1.定义
H+(aq)+OH-(aq) == H2O(l) ΔH = -57.3 kJ mol-1
①若弱酸与弱碱稀溶液反应,因为电离吸热,ΔH > -57.3 kJ mol-1
②若强酸与强碱浓溶液反应,因为稀释放热,ΔH < -57.3 kJ mol-1
③若中和反应生成沉淀,因为形成沉淀放热,ΔH < -57.3 kJ mol-1
2.热化学方程式
3.注意
知识点三:中和热的测定
Q = c · m ·(t2-t1)
【实验步骤】
①反应物温度的测量。
②反应后体系温度的测量。
③重复上述步骤两次。
【数据处理】
【误差分析】
看实验中有哪些因素能造成(t2-t1)出现误差。
若(t2-t1)偏大,则|ΔH|偏大,若(t2-t1)偏小,则|ΔH|偏小
50 mL 0.25 mol·L-1硫酸与50 mL 0.55 mol·L-1 NaOH溶液反应的误差分析:
引起误差的实验操作 t2-t1 |ΔH|
保温措施不好
搅拌不充分
所用酸、碱的浓度过大
用同浓度的氨水代替NaOH溶液
用0.5 mol·L-1 醋酸代替硫酸
用氢氧化钡溶液代替NaOH溶液
量热计中小烧杯杯口与大烧杯杯口不相平
偏小
偏小
偏小
偏小
偏大
偏大
偏小
偏小
偏小
偏小
偏大
偏大
偏小
偏小
1.微观上
(1)化学反应的本质
(2)化学键变化与反应热的关系
若Q1>Q2,反应吸收能量,ΔH__0,为_____反应;
若Q1
吸热
<
放热
知识点四:化学反应中能量变化的原因
2.宏观上
(1)图示
(2)结论
反应物的总能量大于生成物的总能量为_____反应,体系能量_____;
反应物的总能量小于生成物的总能量为_____反应,体系能量_____。
放热
降低
吸热
升高
知识点五:热化学方程式的书写
1.定义:
表明反应所释放或吸收的热量的化学方程式。
表明了化学反应中的物质变化和能量变化。
2.含义:
3.书写热化学方程式步骤:
写出配平的化学方程式
用s、l、g、aq标明物质的聚集状态状态
根据吸热或者放热判断ΔH的正负
根据化学计量数计算写出ΔH的值
4.注意事项
热化学反应中的ΔH的“+”与“-”一定要注明,“+”代表吸热,“-”代表放热,不能省略。
热化学反应方程式逆向书写时(化学计量数不变),ΔH的数值的绝对值相等,符号相反。
② 注明反应时的温度和压强,25℃ 101kPa时进行的反应可不注明。
①必须在化学方程式的右边标明反应热ΔH的符号、数值和单位
③ 注明反应体系中反应物和生成物的聚集状态,不用写引发条件。
不再用“↑”“↓”来标记气体生成物和难溶生成物
热化学方程式中各物质的化学计量数可以写成分数或整数,其 H与系数对应成比例,系数加倍, H值也加倍。
101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量
知识六:燃烧热
1.定义:
C CO2(g)
S SO2(g)
H H2O (l)
N N2(g)
2.研究物质燃烧热的意义
了解化学反应完成时产生热量的多少,以便更好地控制反应条件,充分利用能源。
不管化学反应是一步完成或是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
知识点七:盖斯定律
1.内容:
2.盖斯定律在科学研究中的重要意义:
盖斯定律
反应进行得很慢
反应不容易直接发生
反应的产品不纯
间接计算
ΔH
知识点八:反应热的计算
1.根据反应物和生成物的能量计算
2.根据键能计算
3.根据热化学方程式计算
4.根据燃烧热计算
5.根据盖斯定律计算
6.根据图像信息计算
ΔH=生成物的总能量 反应物的总能量
ΔH=反应物键能和-生成物键能和
Q放=n(可燃物)×|ΔH|
【考点一】吸热反应与放热反应的判断
【例】下列图示变化为吸热反应的是( )
A
理论分析判断法
用常见吸热和放热的反应类型来判断
ΔH = 化学键断裂吸收的能量 - 化学键形成释放的能量
ΔH = 生成物具有的总能量 - 反应物具有的总能量
ΔH = 反应物的键能之和-生成物的键能之和
根据反应物和生成物的相对稳定性判断
【方法归纳】
[练一练]
已知:反应A+B=C+D的能量变化如图所示,下列叙述正确的是( )
A.该反应为放热反应
B.反应物的总能量高于生成物的总能量
C.旧化学键断裂吸收的总能量大于新化学键形成放出的总能量
D.该反应只有在加热条件下才能进行
C
【考点二】热化学方程式的正误判断
【例】燃烧1 g乙炔生成二氧化碳和液态水放出热量50 kJ,则下列热化学
方程式书写正确的是( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=+50 kJ·mol-1
B.C2H2(g)+ O2(g)===2CO2(g)+H2O(l) ΔH=-1 300 kJ
C.2C2H2+5O2===4CO2+2H2O ΔH=-2 600 kJ
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1
D
【方法归纳】
热化学方程式是否已配平,是否符合客观事实;
各物质的聚集状态是否标明;
反应热ΔH的数值与该热化学方程式的化学计量数是否对应;
反应热ΔH的符号、单位是否正确。
热化学方程式正误判断方法
[练一练]
下列热化学方程式书写正确的是( )
A.
B.
C.
D.
D
【考点三】盖斯定律的应用
【例】CH4—CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:
C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol-1
+247
该催化重整反应的ΔH= kJ·mol-1。
【方法归纳】
找出待求热化学方程式中各物质在已知热化学方程式中的位置
根据待求热化学方程式中各物质的化学计量数和位置对已知热化学方程式进行处理,得到变形后的新热化学方程式
将新得到的热化学方程式进行加减,反应热也需要相应加减
写出待求的热化学方程式
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1。
2.用水吸收NOx的相关热化学方程式如下:
2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=-116.1 kJ·mol-1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=+75.9 kJ·mol-1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH= kJ·mol-1。
+114
-136.2
[练一练]
【考点四】燃烧热和中和热
【例】
A.CO(g)的燃烧热283.0kJ·mol-1,则反应2CO2(g)=2CO(g)+O2(g)的ΔH=+566.0kJ·mol-1
B.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
C.反应热有正负之分,燃烧热ΔH全部是正值
D.1mol甲烷燃烧生成二氧化碳所和气态水放出的热量是甲烷的燃烧热
下列关于反应热的描述中正确的是( )
A
【方法归纳】
反应热 中和热 燃烧热
含义 化学反应过程中放出或吸收的热量 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时所释放的热量称为中和热 101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热
反应特点 任何反应 中和反应 在氧气中燃烧的燃烧反应
方程式配平标准 任意物质的量 以生成1 mol H2O为标准 以燃烧1 mol纯物质为标准
ΔH符号 放热为“-”,吸热为“+” “-” “-”
举例 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol H2(g)+1/2O2(g)=H2O(l)
ΔH=-285.8kJ/mol
[练一练]
已知稀溶液中, 由此判断下列热化学方程式书写正确的是( )
A.
B.
C.
D.
D
H
H
H
H
【考点五】反应热的大小比较
比较下列各组热化学方程式中ΔH的大小(填“>”“<”或“=”)。
【例】
>
<
>
【方法归纳】
(1)比较“反应热”或ΔH的大小时,必须带“+”或“-”符号;
比较反应吸收或放出的热量的多少时,只需比较|ΔH|的大小。
(2)参加反应的物质的物质的量与反应热成正比
(3)同一反应中物质的聚集状态不同,反应热数值大小也不同。
同种物质:E(g)>E(l)>E(s)
g→l ΔH<0 ; l→s ΔH<0 ; g→s ΔH<0
1.根据反应规律和影响ΔH大小的因素直接进行比较
【方法归纳】
2.根据反应进行的程度比较
对于可逆反应,如3H2(g)+N2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,是指生成2 mol NH3(g)时放出92.4 kJ的热量,而不是指3 mol H2和1 mol N2在一定条件下混合反应就可放出92.4 kJ的热量,实际上3 mol H2和1 mol N2在一定条件下混合反应放出的热量小于92.4 kJ,因为该反应的反应物不能完全转化为生成物。
【方法归纳】
3.根据反应物的性质比较
等物质的量的不同物质与同一种物质反应时,物质性质不同其反
应热不同。如等物质的量的不同金属(或非金属)与同一种物质反
应,金属(或非金属)越活泼反应越容易进行,放出的热量越多,对应
的ΔH越小。
例如Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g) ΔH1,
Ca(s)+2HCl(aq)=CaCl2(aq)+H2(g) ΔH2, ΔH1>ΔH2。
[练一练]
比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2 ΔH1________ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH3
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH4 ΔH3________ΔH4
(3)4Al(s)+3O2(g)===2Al2O3(s) ΔH5
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH6 ΔH5________ΔH6
<
>
<
化学反应的热效应
热化学方程式
燃烧热
中和热
化学反应热的计算
反应热 焓变
恒压反应热=焓变
H=H生成物-H反应物
概念
意义
注意事项
书写
概念
测定
一个条件
化学反应中
能量变化
宏观
微观
一个标准
两个要求
两种表示
盖斯定律
计算方法
