1.2 课时2 反应热的计算 课件(共18张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.2 课时2 反应热的计算 课件(共18张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:36:47 | ||
图片预览





文档简介
(共18张PPT)
第一章 化学反应的热效应
第二节 反应热的计算 课时2
1.掌握多种计算反应热的方法;
2.了解反应热计算的常见题型。
如何计算反应热呢?
ΔH=生成物的总能量 反应物的总能量
ΔH=反应物键能和-生成物键能和
还有哪些计算反应热的方法呢?
一、反应热的计算
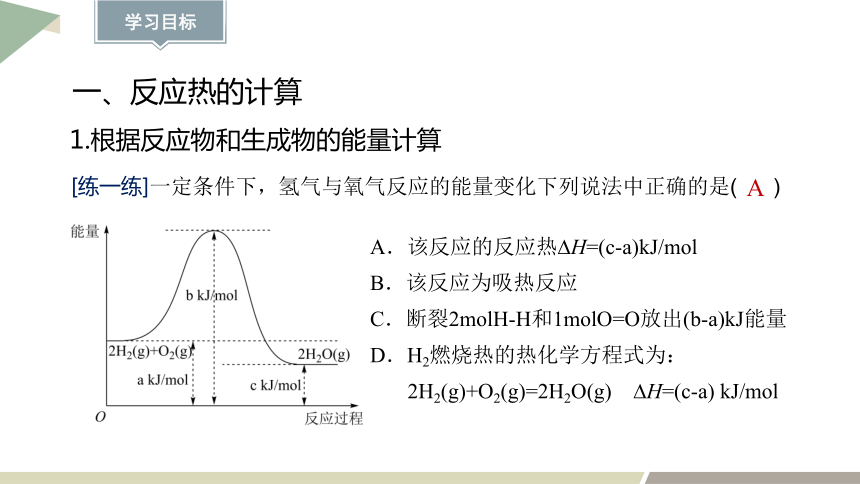
1.根据反应物和生成物的能量计算
A.该反应的反应热 H=(c-a)kJ/mol
B.该反应为吸热反应
C.断裂2molH-H和1molO=O放出(b-a)kJ能量
D.H2燃烧热的热化学方程式为:
2H2(g)+O2(g)=2H2O(g) H=(c-a) kJ/mol
[练一练]一定条件下,氢气与氧气反应的能量变化下列说法中正确的是( )
A
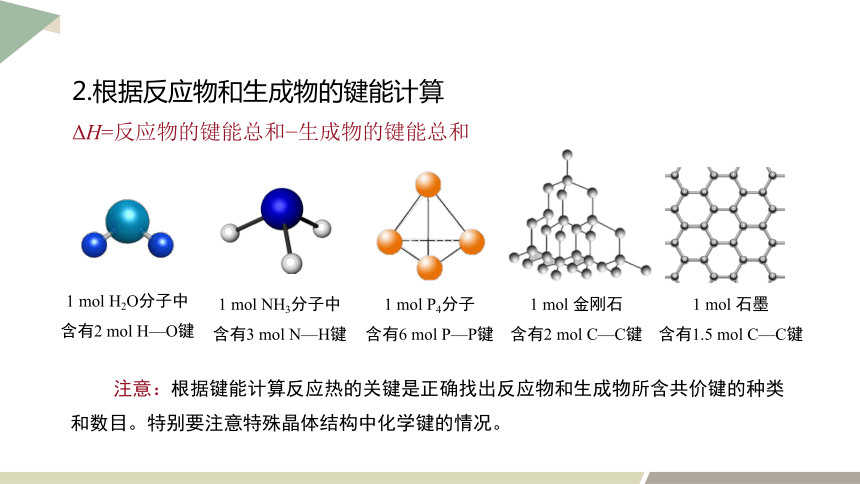
2.根据反应物和生成物的键能计算
ΔH=反应物的键能总和 生成物的键能总和
注意:根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的种类和数目。特别要注意特殊晶体结构中化学键的情况。
1 mol H2O分子中含有2 mol H—O键
1 mol NH3分子中含有3 mol N—H键
1 mol P4分子
含有6 mol P—P键
1 mol 金刚石
含有2 mol C—C键
1 mol 石墨
含有1.5 mol C—C键
[练一练]已知:CH3CH3(g)→CH2=CH2(g)+H2 (g) 有关化学键的键能如下:
化学键 C-H C=C C-C H-H
键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热。
吸热:414.4×6+347.4(kJ/mol)
放热:414.4×4+615.3+435.3(kJ/mol)
ΔH =(414.4×6+347.4)-(414.4×4+615.3+435.3)
= +125.6 kJ/mol
热化学方程式与数学上的方程式相似,可以移项地同时改变正、负号;
各项的系数包括ΔH的数值可以同时扩大或缩小相同的倍数。
[注意事项]
(1)反应热数值与各物质的化学计量数成正比,因此热化学方程式中各
物质的化学计量数改变时,其反应热数值需同时做相同倍数的改变。
(2)热化学方程式中的反应热是指反应按所给形式完全进行时的反应热。
(3)正、逆反应的反应热数值相等,符号相反。
3.根据热化学方程式计算
[练一练]已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1;
②2H2(g)+O2(g)===2H2O(g) ΔH2;
③2H2(g)+O2(g)===2H2O(l) ΔH3。
常温下取体积比4∶1的甲烷和氢气的混合气体11.2 L(标准状况),经完全燃烧后恢复至室温,则放出的热量为?
先算出甲烷和氢气各自的物质的量,再根据热化学方程式分别求算它们各自完全燃烧放出的热量,就可求出总热量。
n(气体)=0.5 mol,n(CH4)=0.4 mol,n(H2)=0.1 mol。
燃烧后恢复至室温,H2O为液态,所以放出热量:
Q=0.4 mol×(-ΔH1)+0.1 mol×(-ΔH3) =-(0.4 mol·ΔH1+0.05 mol·ΔH3)。
4.根据燃烧热计算反应热
注意关键条件——可燃物的物质的量为1 mol、生成物为指定产物。
Q放=n(可燃物)×|ΔH|
(1)请与出FeS2燃烧的热化学方程式。
[练一练]黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2
的途径之一,反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
在25℃和101kPa时,1mol FeS2 (s)完全燃烧生成Fe2O3 (s)和SO2(g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
[练一练]
(2)计算理论上1kg黄铁矿(FeS 的含量为90%)完全燃烧放出的热量。
FeS2+O2Fe2O3+2SO2(g) H=-853 kJ/mol
FeS2的摩尔质量为120g·mol-1
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
900gFeS的物质的量为: =7.5mol
理论上1kg黄铁矿完全燃烧放出的热量为:7.5mol×853kJ/mol=6398kJ
[练一练]已知3.0 g乙烷在常温下完全燃烧放出的热量为155.98 kJ,则表示乙烷燃烧热的热化学方程式是( )
A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3 119.6 kJ·mol-1
B.C2H6(g)+O2(g)=2CO(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
C.C2H6(g)+O2(g)=2CO2(g)+3H2O(g) ΔH=-1 559.8 kJ·mol-1
D.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
D
5.根据盖斯定律计算反应热
(1)找出待求热化学方程式中反应物与生成物在已知热化学方程式中的位置。
(2)调整已知热化学方程式方向、计量数和ΔH。
(3)加和已调整的热化学方程式中的ΔH,确定待求反应的ΔH。
[注意事项]
①热化学方程式同乘以某一个数时,反应热的数值也必须乘上该数。
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
③将一个热化学方程式左右颠倒时,ΔH的“+”“-”号必须随之改变。
[练一练]已知下列反应的反应热为
①CH3COOH (l) + 2O2(g) == 2CO2(g) + 2H2O(l) H1= -870.3 kJ/mol
②C(s) + O2 (g) == CO2(g) H2= -393.5 kJ/mol
③ H2(g) + O2(g) == H2O(l) H3= -285.8 kJ/mol
试计算2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l) 的反应热:
分析各方程式的关系,可知将方程式按2[② + ③] - ①组合得上述反应方程式
即:△H = 2[△H 2 + △H3] - △H1
△H =2[(-393.5kJ/mol) + (-285.8kJ/mol)]-(-870.3kJ/mol)
= - 488.3kJ/mol
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=-ckJ/mol
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=+ckJ/mol
6.根据图像计算反应热
[练一练]已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
B
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
[练一练]化学反应H2+Cl2=2HCl的能量变化如图所示。关于该过程能量变化的叙述不正确的是( )
A.氢气与氯气反应的热化学方程式:
H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
B.该反应在光照和点燃条件下的反应热效应相同
C.2 mol HCl分子中的化学键形成时要释放862 kJ能量
D.2 mol气态氢原子的能量低于1 mol氢气的能量
D
[练一练]饮用水中的主要来自于。已知在微生物的作用下,经过两步反应被氧化成。两步反应的能量变化示意图如下:
1mol全部被氧化成的热化学方程式为?
反应热的计算
根据△H=生成物的总能量-反应物的总能量
根据键能计算
根据热化学方程式计算
根据燃烧热计算
根据盖斯定律计算
根据图像信息计算
第一章 化学反应的热效应
第二节 反应热的计算 课时2
1.掌握多种计算反应热的方法;
2.了解反应热计算的常见题型。
如何计算反应热呢?
ΔH=生成物的总能量 反应物的总能量
ΔH=反应物键能和-生成物键能和
还有哪些计算反应热的方法呢?
一、反应热的计算
1.根据反应物和生成物的能量计算
A.该反应的反应热 H=(c-a)kJ/mol
B.该反应为吸热反应
C.断裂2molH-H和1molO=O放出(b-a)kJ能量
D.H2燃烧热的热化学方程式为:
2H2(g)+O2(g)=2H2O(g) H=(c-a) kJ/mol
[练一练]一定条件下,氢气与氧气反应的能量变化下列说法中正确的是( )
A
2.根据反应物和生成物的键能计算
ΔH=反应物的键能总和 生成物的键能总和
注意:根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的种类和数目。特别要注意特殊晶体结构中化学键的情况。
1 mol H2O分子中含有2 mol H—O键
1 mol NH3分子中含有3 mol N—H键
1 mol P4分子
含有6 mol P—P键
1 mol 金刚石
含有2 mol C—C键
1 mol 石墨
含有1.5 mol C—C键
[练一练]已知:CH3CH3(g)→CH2=CH2(g)+H2 (g) 有关化学键的键能如下:
化学键 C-H C=C C-C H-H
键能(kJ/mol) 414.4 615.3 347.4 435.3
试计算该反应的反应热。
吸热:414.4×6+347.4(kJ/mol)
放热:414.4×4+615.3+435.3(kJ/mol)
ΔH =(414.4×6+347.4)-(414.4×4+615.3+435.3)
= +125.6 kJ/mol
热化学方程式与数学上的方程式相似,可以移项地同时改变正、负号;
各项的系数包括ΔH的数值可以同时扩大或缩小相同的倍数。
[注意事项]
(1)反应热数值与各物质的化学计量数成正比,因此热化学方程式中各
物质的化学计量数改变时,其反应热数值需同时做相同倍数的改变。
(2)热化学方程式中的反应热是指反应按所给形式完全进行时的反应热。
(3)正、逆反应的反应热数值相等,符号相反。
3.根据热化学方程式计算
[练一练]已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1;
②2H2(g)+O2(g)===2H2O(g) ΔH2;
③2H2(g)+O2(g)===2H2O(l) ΔH3。
常温下取体积比4∶1的甲烷和氢气的混合气体11.2 L(标准状况),经完全燃烧后恢复至室温,则放出的热量为?
先算出甲烷和氢气各自的物质的量,再根据热化学方程式分别求算它们各自完全燃烧放出的热量,就可求出总热量。
n(气体)=0.5 mol,n(CH4)=0.4 mol,n(H2)=0.1 mol。
燃烧后恢复至室温,H2O为液态,所以放出热量:
Q=0.4 mol×(-ΔH1)+0.1 mol×(-ΔH3) =-(0.4 mol·ΔH1+0.05 mol·ΔH3)。
4.根据燃烧热计算反应热
注意关键条件——可燃物的物质的量为1 mol、生成物为指定产物。
Q放=n(可燃物)×|ΔH|
(1)请与出FeS2燃烧的热化学方程式。
[练一练]黄铁矿(主要成分为FeS2)的燃烧是工业上制硫酸时得到SO2
的途径之一,反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
在25℃和101kPa时,1mol FeS2 (s)完全燃烧生成Fe2O3 (s)和SO2(g)时放出853kJ的热量。这些热量(工业中叫做“废热”)在生产过程中得到了充分利用,大大降低了生产成本,对于节约资源、能源循环利用具有重要意义。
[练一练]
(2)计算理论上1kg黄铁矿(FeS 的含量为90%)完全燃烧放出的热量。
FeS2+O2Fe2O3+2SO2(g) H=-853 kJ/mol
FeS2的摩尔质量为120g·mol-1
1kg黄铁矿含FeS2的质量为:1000g×90%=900g
900gFeS的物质的量为: =7.5mol
理论上1kg黄铁矿完全燃烧放出的热量为:7.5mol×853kJ/mol=6398kJ
[练一练]已知3.0 g乙烷在常温下完全燃烧放出的热量为155.98 kJ,则表示乙烷燃烧热的热化学方程式是( )
A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3 119.6 kJ·mol-1
B.C2H6(g)+O2(g)=2CO(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
C.C2H6(g)+O2(g)=2CO2(g)+3H2O(g) ΔH=-1 559.8 kJ·mol-1
D.C2H6(g)+ O2(g)=2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
D
5.根据盖斯定律计算反应热
(1)找出待求热化学方程式中反应物与生成物在已知热化学方程式中的位置。
(2)调整已知热化学方程式方向、计量数和ΔH。
(3)加和已调整的热化学方程式中的ΔH,确定待求反应的ΔH。
[注意事项]
①热化学方程式同乘以某一个数时,反应热的数值也必须乘上该数。
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
③将一个热化学方程式左右颠倒时,ΔH的“+”“-”号必须随之改变。
[练一练]已知下列反应的反应热为
①CH3COOH (l) + 2O2(g) == 2CO2(g) + 2H2O(l) H1= -870.3 kJ/mol
②C(s) + O2 (g) == CO2(g) H2= -393.5 kJ/mol
③ H2(g) + O2(g) == H2O(l) H3= -285.8 kJ/mol
试计算2C(s) + 2H2 (g) + O2 (g) == CH3COOH (l) 的反应热:
分析各方程式的关系,可知将方程式按2[② + ③] - ①组合得上述反应方程式
即:△H = 2[△H 2 + △H3] - △H1
△H =2[(-393.5kJ/mol) + (-285.8kJ/mol)]-(-870.3kJ/mol)
= - 488.3kJ/mol
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=-ckJ/mol
H=(E2-E1)kJ/mol
=(a-b) kJ/mol
=+ckJ/mol
6.根据图像计算反应热
[练一练]已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
B
A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
[练一练]化学反应H2+Cl2=2HCl的能量变化如图所示。关于该过程能量变化的叙述不正确的是( )
A.氢气与氯气反应的热化学方程式:
H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
B.该反应在光照和点燃条件下的反应热效应相同
C.2 mol HCl分子中的化学键形成时要释放862 kJ能量
D.2 mol气态氢原子的能量低于1 mol氢气的能量
D
[练一练]饮用水中的主要来自于。已知在微生物的作用下,经过两步反应被氧化成。两步反应的能量变化示意图如下:
1mol全部被氧化成的热化学方程式为?
反应热的计算
根据△H=生成物的总能量-反应物的总能量
根据键能计算
根据热化学方程式计算
根据燃烧热计算
根据盖斯定律计算
根据图像信息计算
