3.3 课时2 影响盐类水解的主要因素 课件(共25张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.3 课时2 影响盐类水解的主要因素 课件(共25张PPT) 2023-2024学年高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 131.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:37:43 | ||
图片预览








文档简介
(共25张PPT)
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解 课时2
1.会分析外界条件对盐类水解平衡的影响;
2.认识盐的水解平衡常数,并能运用盐的水解平衡常数解释盐溶液显酸碱性的原因。
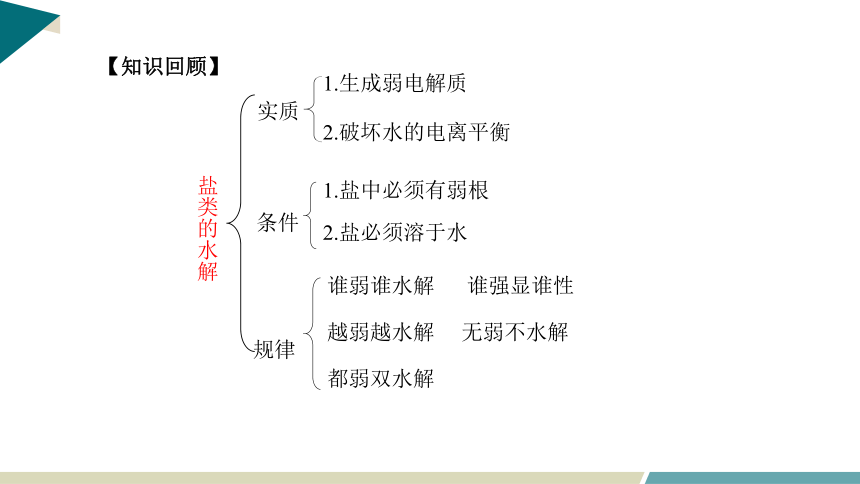
盐类的水解
实质
1.生成弱电解质
2.破坏水的电离平衡
谁弱谁水解 谁强显谁性
越弱越水解 无弱不水解
都弱双水解
条件
1.盐中必须有弱根
2.盐必须溶于水
规律
【知识回顾】
F- + H2O HF + OH-
CN- + H2O HCN +OH-
已知浓度相同的NaF和NaCN溶液, NaCN溶液的pH远大于NaF,分析其原因
酸性
HF>HCN
HCN酸性弱,
CN-水解程度大,
生成的OH- 浓度大,
【问题与思考】
越弱越水解
NaCN碱性强。
一、影响盐类水解的因素
1.内因
H2O H+ + OH-
+
MA = A- + M+
HA
对于强碱弱酸盐来说,生成盐的弱酸酸性越弱,即越 电离(电离常数越小),该盐的水解程度越 。同理,对于强酸弱碱盐来说,生成盐的弱碱碱性越弱,该盐的水解程度越 。
盐类水解程度的大小,主要是由 所决定的。例如,对于强碱弱酸盐(MA)的水解:
盐的性质
难
大
大
NH4Cl < AlCl3
2.比较等浓度 NH4Cl溶液与AlCl3溶液的酸性:
1.已知酸性:CH3COOH>H2CO3>HClO>HCO3-,
比较等浓度CH3COONa,Na2CO3,NaHCO3,NaClO碱性
Na2CO3 > NaClO > NaHCO3> CH3COONa
【练一练】
2. 外因(外界条件): 盐类的水解是可逆反应,水解平衡受到盐的浓度、温度等反应条件的影响——符合勒夏特列原理。
实验探究——反应条件对FeCl3水解平衡的影响
[提出问题]
问题一:FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
问题二:从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
[实验探究]
实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
影响因素 实验步骤 实验现象 解释
温度
反应物的浓度
生成物的浓度
(1)验证温度对水解平衡的影响
(2)验证反应物浓度对水解平衡的影响
(3)验证生成物浓度对水解平衡的影响
加氢氧化钠
加蒸馏水
加盐酸
加蒸馏水
向FeCl3溶液中加入少量浓酸或浓碱,观察溶液颜色变化。
影响因素 实验现象 解释
温度 (升温)溶液颜色 . 温度升高,平衡向 的方向移动
反应物的浓度 (增加)溶液颜色 . c(Fe3+)增大,平衡向 的方向移动
生成物的浓度 (加酸)溶液颜色 . 加入盐酸,c(H+)增大,平衡向
方向移动
(加碱)溶液颜色 . 加入NaOH溶液,c(H+)减小,平衡向
的方向移动
加深
加深
变浅
加深
FeCl3水解
FeCl3水解
FeCl3水解的逆反应
FeCl3水解
应用平衡移动原理分析CH3COONa的水解,列举可能影响水解反应程度的因素,并说明所依据的原理。
c(CH3COO-) c(CH3COOH) c(OH-) c(H+) pH 水解程度
加热
加水
加CH3COOH
加CH3COONa
加HCl
加NaOH
减小
增大
增大
减小
增大
增大
减小
减小
减小
减小
增大
增大
增大
增大
增大
减小
减小
减小
增大
增大
增大
减小
增大
减小
减小
减小
减小
增大
增大
增大
增大
增大
增大
减小
减小
减小
【思考与交流】
1.比较下列溶液的pH大小(填“>”“<”或“=”)
(1)0.2mol/LNH4Cl溶液____0.1mol/LNH4Cl溶液
(2)0.1mol/LNa2CO3溶液____0.1mol/LNaHCO3溶液
(3)25℃1mol/LFeCl3溶液___80℃1mol/LFeCl3溶液
(4)0.1mol/L(NH4)2CO3溶液___0.1mol/LNa2CO3溶液
<
>
>
<
【练一练】
2.向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
A
二、盐的水解常数Kh
在一定温度下,能水解的盐在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)的浓度之比是一个常数,该常数称为水解平衡常数。
水解平衡常数是描述能水解的盐水解平衡的主要参数。
它只受温度影响,因水解过程是吸热过程,故它随温度的升高而增大。
1.强碱弱酸盐(HA为弱酸) A-+H2O HA +OH-
Kh=
c ( HA).c( OH- )
c(A-)
=
c ( HA).c( OH- ).c(H+ )
c(A-).c(H+ )
=
Kw
Ka
Kh=
c (MOH).c(H+)
c(M+)
=
c ( MOH). c(H+) .c ( OH- )
c(M+).c(OH- )
=
Kw
Kb
2.强酸弱碱盐(MOH为弱碱) M++H2O MOH+H+
越弱越水解
试解释:1.酸式盐NaHCO3显碱性
2.酸式盐NaH2PO4溶液为酸性,Na2HPO4为碱性?
几种多元弱酸的电离常数(25℃)
弱酸 电离常数 弱酸 电离常数
H2CO3 K1=4.4×10-7 K2=4.7×10-11 H2C2O4 (草酸) K1=5.4×10-2
K2=5.4×10-5
H3PO4 K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 H3C6H5O7 (柠檬酸) K1=7.4×10-4
K2=1.73×10-5
K3=4×10-7
(1)NaHCO3
①水解
②电离
程度:
>
∴溶液呈 性
碱
①HCO3 -+H2O H2CO3+OH- Kh
②HCO3-+H2O CO32-+H3O+ Ka2=4.7×10-11
Kh=
c(H2CO3).c(OH-)
c(HCO3-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(HCO3-).c(H+)
c(H2CO3)
=
10-14
4.4×10-7
=2.3×10-8
Ka2=4.7×10-11
∴Kh>Ka2
(2)NaH2PO4
①H2PO4 -+H2O H3PO4+OH- Kh
=
10-14
7.1×10-3
=1.4×10-12
Ka2=6.3×10-8
∴Ka2>Kh
Kh=
c (H3PO4).c(OH-)
c(H2PO4-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(H2PO4-).c(H+)
c(H3PO4)
②电离
①水解
程度:
>
∴溶液呈 性
酸
③HPO42- PO43-+H+ Ka3
②H2PO4- HPO42-+H+ Ka2=6.3×10-8
(3)Na2HPO4
①HPO4 2-+H2O H2PO4-+OH- Kh
②HPO42- PO43-+H+ Ka3=4.2×10-13
=
10-14
6.3×10-8
=1.6×10-7
Ka3=4.2×10-13
Kh=
c (H2PO4-).c( OH- )
c(HPO42-)
=
Kw
Ka2
=
c( OH- ).c(H+ )
c(HPO42-).c(H+ )
c(H2PO4-)
程度:
∴Kh>Ka3
①水解
②电离
>
∴溶液呈 性
碱
2.弱酸酸式盐溶液的酸碱性取决于电离和水解程度的相对大小
显酸性(电离大于水解):NaH2PO4 NaHSO3 NaHC2O4
显碱性(水解大于电离):NaHCO3 Na2HPO4 NaHS
★酸式盐溶液酸碱性判断
1.强酸酸式盐(NaHSO4)只电离不水解,溶液呈酸性
归纳总结
【练一练】
影响盐类水解的因素
1.决定因素(内因):
2.外界条件(外因):
(1)温度
(2)反应物浓度
(3)生成物浓度
越弱越水解
3.盐的水解常数Kh
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解 课时2
1.会分析外界条件对盐类水解平衡的影响;
2.认识盐的水解平衡常数,并能运用盐的水解平衡常数解释盐溶液显酸碱性的原因。
盐类的水解
实质
1.生成弱电解质
2.破坏水的电离平衡
谁弱谁水解 谁强显谁性
越弱越水解 无弱不水解
都弱双水解
条件
1.盐中必须有弱根
2.盐必须溶于水
规律
【知识回顾】
F- + H2O HF + OH-
CN- + H2O HCN +OH-
已知浓度相同的NaF和NaCN溶液, NaCN溶液的pH远大于NaF,分析其原因
酸性
HF>HCN
HCN酸性弱,
CN-水解程度大,
生成的OH- 浓度大,
【问题与思考】
越弱越水解
NaCN碱性强。
一、影响盐类水解的因素
1.内因
H2O H+ + OH-
+
MA = A- + M+
HA
对于强碱弱酸盐来说,生成盐的弱酸酸性越弱,即越 电离(电离常数越小),该盐的水解程度越 。同理,对于强酸弱碱盐来说,生成盐的弱碱碱性越弱,该盐的水解程度越 。
盐类水解程度的大小,主要是由 所决定的。例如,对于强碱弱酸盐(MA)的水解:
盐的性质
难
大
大
NH4Cl < AlCl3
2.比较等浓度 NH4Cl溶液与AlCl3溶液的酸性:
1.已知酸性:CH3COOH>H2CO3>HClO>HCO3-,
比较等浓度CH3COONa,Na2CO3,NaHCO3,NaClO碱性
Na2CO3 > NaClO > NaHCO3> CH3COONa
【练一练】
2. 外因(外界条件): 盐类的水解是可逆反应,水解平衡受到盐的浓度、温度等反应条件的影响——符合勒夏特列原理。
实验探究——反应条件对FeCl3水解平衡的影响
[提出问题]
问题一:FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
问题二:从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
[实验探究]
实验用品:
试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 mol/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
影响因素 实验步骤 实验现象 解释
温度
反应物的浓度
生成物的浓度
(1)验证温度对水解平衡的影响
(2)验证反应物浓度对水解平衡的影响
(3)验证生成物浓度对水解平衡的影响
加氢氧化钠
加蒸馏水
加盐酸
加蒸馏水
向FeCl3溶液中加入少量浓酸或浓碱,观察溶液颜色变化。
影响因素 实验现象 解释
温度 (升温)溶液颜色 . 温度升高,平衡向 的方向移动
反应物的浓度 (增加)溶液颜色 . c(Fe3+)增大,平衡向 的方向移动
生成物的浓度 (加酸)溶液颜色 . 加入盐酸,c(H+)增大,平衡向
方向移动
(加碱)溶液颜色 . 加入NaOH溶液,c(H+)减小,平衡向
的方向移动
加深
加深
变浅
加深
FeCl3水解
FeCl3水解
FeCl3水解的逆反应
FeCl3水解
应用平衡移动原理分析CH3COONa的水解,列举可能影响水解反应程度的因素,并说明所依据的原理。
c(CH3COO-) c(CH3COOH) c(OH-) c(H+) pH 水解程度
加热
加水
加CH3COOH
加CH3COONa
加HCl
加NaOH
减小
增大
增大
减小
增大
增大
减小
减小
减小
减小
增大
增大
增大
增大
增大
减小
减小
减小
增大
增大
增大
减小
增大
减小
减小
减小
减小
增大
增大
增大
增大
增大
增大
减小
减小
减小
【思考与交流】
1.比较下列溶液的pH大小(填“>”“<”或“=”)
(1)0.2mol/LNH4Cl溶液____0.1mol/LNH4Cl溶液
(2)0.1mol/LNa2CO3溶液____0.1mol/LNaHCO3溶液
(3)25℃1mol/LFeCl3溶液___80℃1mol/LFeCl3溶液
(4)0.1mol/L(NH4)2CO3溶液___0.1mol/LNa2CO3溶液
<
>
>
<
【练一练】
2.向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大
A
二、盐的水解常数Kh
在一定温度下,能水解的盐在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)的浓度之比是一个常数,该常数称为水解平衡常数。
水解平衡常数是描述能水解的盐水解平衡的主要参数。
它只受温度影响,因水解过程是吸热过程,故它随温度的升高而增大。
1.强碱弱酸盐(HA为弱酸) A-+H2O HA +OH-
Kh=
c ( HA).c( OH- )
c(A-)
=
c ( HA).c( OH- ).c(H+ )
c(A-).c(H+ )
=
Kw
Ka
Kh=
c (MOH).c(H+)
c(M+)
=
c ( MOH). c(H+) .c ( OH- )
c(M+).c(OH- )
=
Kw
Kb
2.强酸弱碱盐(MOH为弱碱) M++H2O MOH+H+
越弱越水解
试解释:1.酸式盐NaHCO3显碱性
2.酸式盐NaH2PO4溶液为酸性,Na2HPO4为碱性?
几种多元弱酸的电离常数(25℃)
弱酸 电离常数 弱酸 电离常数
H2CO3 K1=4.4×10-7 K2=4.7×10-11 H2C2O4 (草酸) K1=5.4×10-2
K2=5.4×10-5
H3PO4 K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 H3C6H5O7 (柠檬酸) K1=7.4×10-4
K2=1.73×10-5
K3=4×10-7
(1)NaHCO3
①水解
②电离
程度:
>
∴溶液呈 性
碱
①HCO3 -+H2O H2CO3+OH- Kh
②HCO3-+H2O CO32-+H3O+ Ka2=4.7×10-11
Kh=
c(H2CO3).c(OH-)
c(HCO3-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(HCO3-).c(H+)
c(H2CO3)
=
10-14
4.4×10-7
=2.3×10-8
Ka2=4.7×10-11
∴Kh>Ka2
(2)NaH2PO4
①H2PO4 -+H2O H3PO4+OH- Kh
=
10-14
7.1×10-3
=1.4×10-12
Ka2=6.3×10-8
∴Ka2>Kh
Kh=
c (H3PO4).c(OH-)
c(H2PO4-)
=
Kw
Ka1
=
c(OH-).c(H+)
c(H2PO4-).c(H+)
c(H3PO4)
②电离
①水解
程度:
>
∴溶液呈 性
酸
③HPO42- PO43-+H+ Ka3
②H2PO4- HPO42-+H+ Ka2=6.3×10-8
(3)Na2HPO4
①HPO4 2-+H2O H2PO4-+OH- Kh
②HPO42- PO43-+H+ Ka3=4.2×10-13
=
10-14
6.3×10-8
=1.6×10-7
Ka3=4.2×10-13
Kh=
c (H2PO4-).c( OH- )
c(HPO42-)
=
Kw
Ka2
=
c( OH- ).c(H+ )
c(HPO42-).c(H+ )
c(H2PO4-)
程度:
∴Kh>Ka3
①水解
②电离
>
∴溶液呈 性
碱
2.弱酸酸式盐溶液的酸碱性取决于电离和水解程度的相对大小
显酸性(电离大于水解):NaH2PO4 NaHSO3 NaHC2O4
显碱性(水解大于电离):NaHCO3 Na2HPO4 NaHS
★酸式盐溶液酸碱性判断
1.强酸酸式盐(NaHSO4)只电离不水解,溶液呈酸性
归纳总结
【练一练】
影响盐类水解的因素
1.决定因素(内因):
2.外界条件(外因):
(1)温度
(2)反应物浓度
(3)生成物浓度
越弱越水解
3.盐的水解常数Kh
