5.3从微观结构看物质的多样性(教学课件)(共37张PPT)—高中化学苏教版(2019)必修第一册高一上学期
文档属性
| 名称 | 5.3从微观结构看物质的多样性(教学课件)(共37张PPT)—高中化学苏教版(2019)必修第一册高一上学期 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:50:52 | ||
图片预览








文档简介
(共37张PPT)
第三单元
从微观结构看
物质的多样性
CONTENTS
目录
晶体与非晶体
03
同素异形体
01
同分异构体现象
02
01
同素异形体
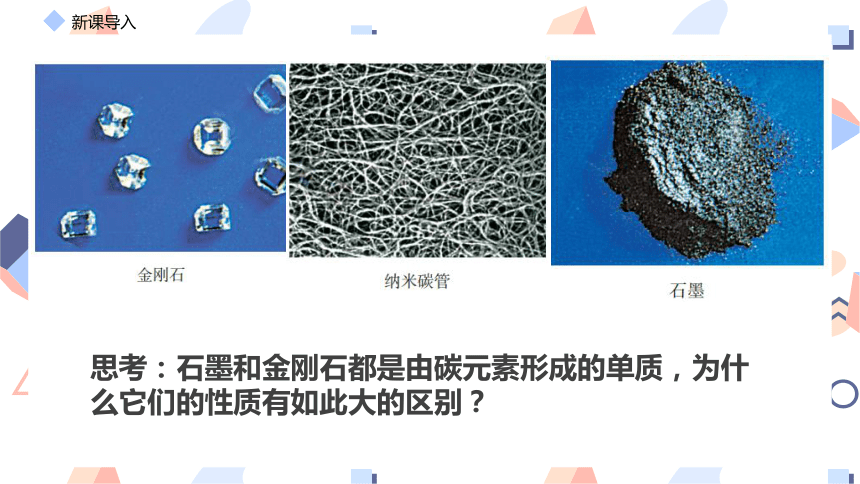
思考:石墨和金刚石都是由碳元素形成的单质,为什么它们的性质有如此大的区别?
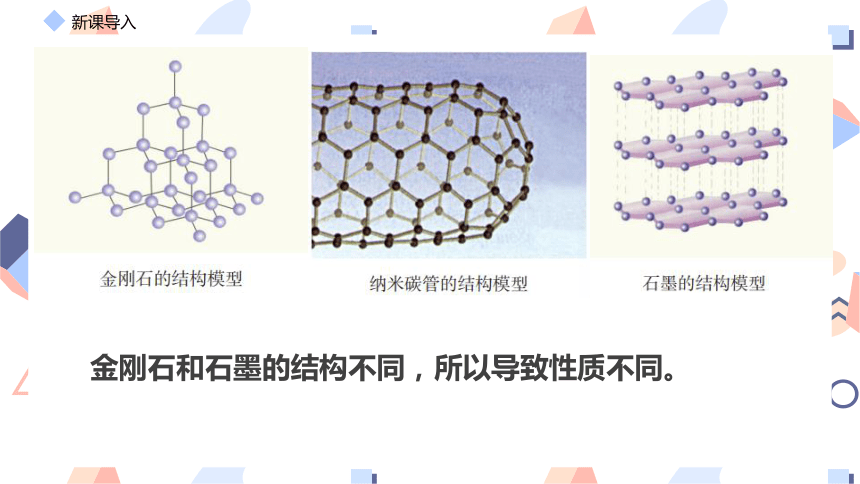
金刚石和石墨的结构不同,所以导致性质不同。
同素异形现象
概念:同一种元素能够形成几种不同的单质,这种现象称为同素异形现象
同素异形体
概念:同一种元素可形成不同单质,这些单质互称为该元素的同素异形体
同素 异形 体
指的是元素相同
指的是结构不同
指的是单质
常见的同素异形体
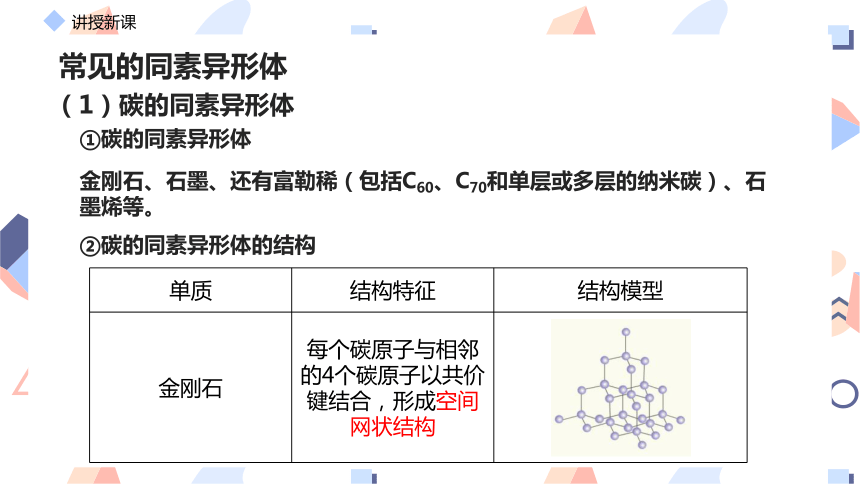
(1)碳的同素异形体
金刚石、石墨、还有富勒稀(包括C60、C70和单层或多层的纳米碳)、石墨烯等。
①碳的同素异形体
②碳的同素异形体的结构
单质 结构特征 结构模型
金刚石 每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构
单质 结构特征 结构模型
石墨 层状结构,层内碳原子间以共价键结合,每一层内碳原子排列成平面六边形,一个个六边形形排列成平面网状结构,层间碳分子间存在分子间作用力。
C60 由60个碳原子形成的封闭笼状分子,形似足球,人们又称它为“足球稀”
单质 结构特征 结构模型
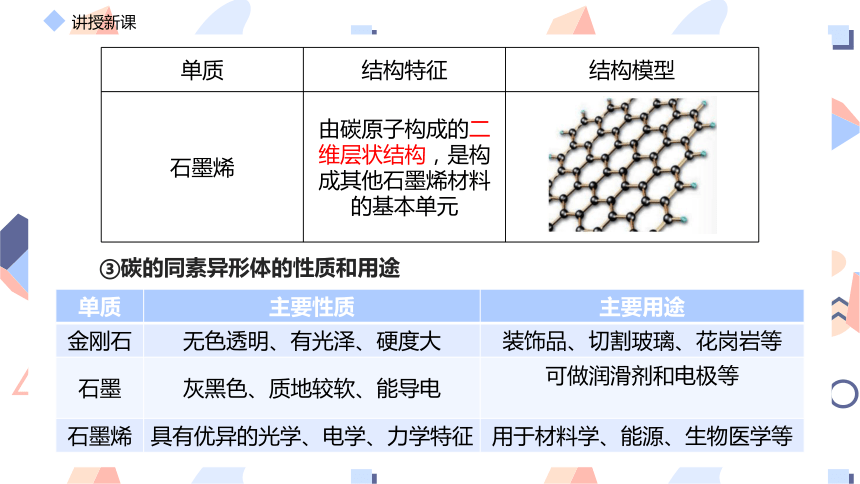
石墨烯 由碳原子构成的二维层状结构,是构成其他石墨烯材料的基本单元
③碳的同素异形体的性质和用途
单质 主要性质 主要用途
金刚石 无色透明、有光泽、硬度大 装饰品、切割玻璃、花岗岩等
石墨 灰黑色、质地较软、能导电 可做润滑剂和电极等
石墨烯 具有优异的光学、电学、力学特征 用于材料学、能源、生物医学等
(2)氧的同素异形体
氧气的常见同素异形体有氧气(O2)、臭氧(O3);两者分子中氧原子个数和氧原子的成键方式各不相同,因此性质也不完全相同。
(3)磷的同素异形体
磷的常见同素异形体有白磷和红磷;两者分子中磷原子个数和结构各不相同,因此性质也不完全相同。
总结 加深对同素异形体的理解
项目 分析
组成元素 只含有一种元素
物质类型 互为同素异形体的物质只能是单质
性质关系 同素异形体之间的物理性质有差异,但化学性质性质
相互转化 同素异形体之间的转化属于化学变化,因为转化过程中有化学键的断裂与形成
下列各组中,互称为同素异形体( )
A.12C和14C
B.水和冰
C.CO和CO2
D.斜方硫(S8,又称α-硫)和单斜硫(S8-又称β-硫)
D
解析:A项,12C、14C互为同位素;B项,水和冰是同一种物质的不同状态;C项,CO如和CO2是化合物而不是单质;D项,由题给信息知,斜方硫和单斜硫是硫元素形成的不同单质,互为同素异形体。
02
同分异构体现象
实验探究
用不同颜色的小球代表碳、氢原子,用塑料棒代表原子间形成的共价键,依据碳、氢原子形成共价键的特征,制作分子式为C4H10的有机化合物的分子结构模型。你可以制作出几种不同的分子结构模型
名称
分子式 C4H10 C4H10
沸点 -0.5℃ -11.7℃
结构式
结构简式 CH3CH2CH2CH3 CH3CH(CH3)CH3
球棍模型
正丁烷
异丁烷
同分异构现象和同分异构体
(1)同分异构现象
(2)同分异构体
化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象
分子式相同而结构不同的化合物互称为称为同分异构体
同分 异构 体
指的是分子式相同
指的是结构不同
指的是化合物
观察思考
名称 乙醇 二甲醚
分子式 C2H6O C2H6O
沸点 78℃ -23℃
结构式
球棍模型
由此可知,两者的分子结构不同,沸点不同
注意:
项目 分析
组成元素 两种或两种以上元素
物质类型 互为同分异构体的物质只能是化合物
性质关系 同分异构体之间的性质有差异,有的差异小,有的差异大
(1)判断是否属于同分异构体一定要满足三个条件:
一是分子式相同;二是结构不同;三是化合物。
总结 加深对同分异构体的理解
(2)不仅有机物中存在同分异构现象,无机物中也有,只是无机物当中同分异构体想象较少,有机物当中同分异构想象普遍存在。
下列关于同分异构体说法正确的是( )
A.分子式相同、结构不同的物质一定属于同分异构体
B.互为同分异构体的物质的相对分子质量一定相同
C.12H2O和13H2O属于同分异构体
D.NH4CNO是无机物,CO(NH2)2是有机物,两者不互为同分异构体
解析:A项,这里没有说明物质是不是化合物,如果是单质,则为同素异形体,错误;B项,同分异构体的分子式相同,因此相对分子质量一定相同,正确;C项,两者的结构相同,错误;D项,两者的分子式相同,结构不同,互为同分异构体,错误。
B
03
晶体与非晶体
晶体
概念:具有规则的几何外形和固定的熔点的固体。
晶体的结构与性质
结构
性质
①有规则的几何外形
②晶体内部,微粒在空间呈有规则的重复排列
①晶体具有固定的熔、沸点
②不同类型的晶体性质不同
非晶体
概念:不具有规则的几何外形和固定的熔点的固体。
晶体的类型
(1)离子晶体
①概念
离子化合物中的阴、阳离子按一定的方式有规则地排列形成的晶体
②实例---NaCl的晶体结构如图所示
(2)分子晶体
①概念
由分子构成的物质所形成的晶体。分子晶体是分子之间依靠分子间作用力按一定规则排列所形成的。
②实例---干冰晶体结构如图所示
(3)共价晶体
①概念
原子间以共价键结合并以一定方式有规则排列成空间网状结构的晶体。
②实例---石英晶体结构如图所示
(4)金属晶体
①概念
金属阳离子和自由电子通过强烈的作用结合形成的晶体。
②性质---有金属光泽,能导电,传热,具有延展性等。
1、科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,它们互称为( )
A.同一种物质
B.同分异构体
C.同素异形体
D.同位素
解析:C60与C50、C70、C120、 C540均是由碳元素组成的不同单质,互为同素异形体,所以C项正确。
C
2、下列各项描述的结论正确的是( )
选项 描述 结论
A 由同种元素组成的物质一定是纯净物 正确
B 科学家合成了一种新型的化合物N4 正确
C 红磷转化为白磷是物理变化 错误
D 纳米泡沫碳和金刚石是同素异形体 错误
解析:A项,氧气和臭氧都是由氧元素组成的单质,它们的混合气体属于混合物;B项,N4只含有一种元素,是一种新单质,不属于化合物;C项,红磷和白磷属于同素异形体,同素异形体之间的转化均是化学变化;D项,纳米泡沫碳和金刚石是由碳元素组成的不同种单质,互为同素异形体。
C
(1)明确同素异形体“同”“异”和“体”的含义
①“同”-----指元素相同。
②“异”----指形成 单质不同,结构不同,性质有差异。
③“体”---- 指单质。
总结提升
(2)明确产生同素异形现象的原因
①组成分子的原子个数不同,如氧气(O2)和臭氧(O3)。
②晶体中原子的成键方式和排列方式不同,如金刚石和石墨。
(3)明确同素异形体的“结构决定性质“
①同素异形体的结构不同,性质存在差异。
②物理性质不同,化学性质有的相似,有的相差较大。
3、下列关于同分异构体的描述正确的是( )
A.16O和18O互为同分异构体
B.有机物与无机物之间可以存在同分异构现象
C.同分异构体的性质相同
D.组成元素相同,相对分子质量相同的化合物一定属于同分异构体
解析:A项,16O和18O互为同位素,错误;B项,无机物和无机物、无机物和有机物、有机物和有机物之间均可能存在同分异构现象,正确;C项,结构不同,因此同分异构体的性质不同,错误;D项,C2H6O和CH2O2的组成元素相同,相对分子质量均为46,但两者分子式不同,因此不属于同分异构体,错误。
B
4、在化学中,每种物质都有自己对应的化学式,但往往同一化学式可能表示不同的物质。下列化学式中,只表示一种纯净物的是( )
A.C
B. CH4
C. C2H6O
D. C4H10
解析:A项,C可能是金刚石、石墨,错误;B项,CH4没有同分异构体,只表示一种纯净物,正确;C项,C2H6O可能是乙醇、二甲醚,错误;D项,C4H10可能是正丁烷、异丁烷,错误。
B
1.考查角度
此类题目主要有两种考查角度:一是概念的分析判断;二是围绕题给具体物质分析判断。
2.考查点
此类题目主要考查两个方面:一是同分异构体的判断;二是同分异构体结构与性质的分析。
总结提升
3.具体要求
(1)明确同分异构体“同”“异”和“体”的含义
①“同”一指分 子式相同。
②“异”一 指结构不同,性质有差异。
③“体”一指化合 物。
(2)明确产生同分异构现象的原因
各原子的连接方式不同。
(3)明确同分异构体的“结构决定性质”
①同分异构体的结构不同,性质存在差异。
②物理性质不同,化学性质有的相似,有的相差较大。
(4)明确有关同分异构体的三组“一定”和“不一定”
①分子式相同,一定有相同的相对分子质量,反之不一定成立。如C2H6O和CH2O2相对分子质量相同,但分子式不同。
②分子式相同,一定有相同的元素的质量分数,反之不一定成立。如C2H4和C3H6分子中C、H的质量分数均相同,但分子式不同。
③分子式相同,一定有相同的原子个数比,反之不一定成立。如C2H4和C3H6分子中C、H的原子个数比均为1:2,但分子式不同。
下一节课见!
THANKS
第三单元
从微观结构看
物质的多样性
CONTENTS
目录
晶体与非晶体
03
同素异形体
01
同分异构体现象
02
01
同素异形体
思考:石墨和金刚石都是由碳元素形成的单质,为什么它们的性质有如此大的区别?
金刚石和石墨的结构不同,所以导致性质不同。
同素异形现象
概念:同一种元素能够形成几种不同的单质,这种现象称为同素异形现象
同素异形体
概念:同一种元素可形成不同单质,这些单质互称为该元素的同素异形体
同素 异形 体
指的是元素相同
指的是结构不同
指的是单质
常见的同素异形体
(1)碳的同素异形体
金刚石、石墨、还有富勒稀(包括C60、C70和单层或多层的纳米碳)、石墨烯等。
①碳的同素异形体
②碳的同素异形体的结构
单质 结构特征 结构模型
金刚石 每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构
单质 结构特征 结构模型
石墨 层状结构,层内碳原子间以共价键结合,每一层内碳原子排列成平面六边形,一个个六边形形排列成平面网状结构,层间碳分子间存在分子间作用力。
C60 由60个碳原子形成的封闭笼状分子,形似足球,人们又称它为“足球稀”
单质 结构特征 结构模型
石墨烯 由碳原子构成的二维层状结构,是构成其他石墨烯材料的基本单元
③碳的同素异形体的性质和用途
单质 主要性质 主要用途
金刚石 无色透明、有光泽、硬度大 装饰品、切割玻璃、花岗岩等
石墨 灰黑色、质地较软、能导电 可做润滑剂和电极等
石墨烯 具有优异的光学、电学、力学特征 用于材料学、能源、生物医学等
(2)氧的同素异形体
氧气的常见同素异形体有氧气(O2)、臭氧(O3);两者分子中氧原子个数和氧原子的成键方式各不相同,因此性质也不完全相同。
(3)磷的同素异形体
磷的常见同素异形体有白磷和红磷;两者分子中磷原子个数和结构各不相同,因此性质也不完全相同。
总结 加深对同素异形体的理解
项目 分析
组成元素 只含有一种元素
物质类型 互为同素异形体的物质只能是单质
性质关系 同素异形体之间的物理性质有差异,但化学性质性质
相互转化 同素异形体之间的转化属于化学变化,因为转化过程中有化学键的断裂与形成
下列各组中,互称为同素异形体( )
A.12C和14C
B.水和冰
C.CO和CO2
D.斜方硫(S8,又称α-硫)和单斜硫(S8-又称β-硫)
D
解析:A项,12C、14C互为同位素;B项,水和冰是同一种物质的不同状态;C项,CO如和CO2是化合物而不是单质;D项,由题给信息知,斜方硫和单斜硫是硫元素形成的不同单质,互为同素异形体。
02
同分异构体现象
实验探究
用不同颜色的小球代表碳、氢原子,用塑料棒代表原子间形成的共价键,依据碳、氢原子形成共价键的特征,制作分子式为C4H10的有机化合物的分子结构模型。你可以制作出几种不同的分子结构模型
名称
分子式 C4H10 C4H10
沸点 -0.5℃ -11.7℃
结构式
结构简式 CH3CH2CH2CH3 CH3CH(CH3)CH3
球棍模型
正丁烷
异丁烷
同分异构现象和同分异构体
(1)同分异构现象
(2)同分异构体
化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象
分子式相同而结构不同的化合物互称为称为同分异构体
同分 异构 体
指的是分子式相同
指的是结构不同
指的是化合物
观察思考
名称 乙醇 二甲醚
分子式 C2H6O C2H6O
沸点 78℃ -23℃
结构式
球棍模型
由此可知,两者的分子结构不同,沸点不同
注意:
项目 分析
组成元素 两种或两种以上元素
物质类型 互为同分异构体的物质只能是化合物
性质关系 同分异构体之间的性质有差异,有的差异小,有的差异大
(1)判断是否属于同分异构体一定要满足三个条件:
一是分子式相同;二是结构不同;三是化合物。
总结 加深对同分异构体的理解
(2)不仅有机物中存在同分异构现象,无机物中也有,只是无机物当中同分异构体想象较少,有机物当中同分异构想象普遍存在。
下列关于同分异构体说法正确的是( )
A.分子式相同、结构不同的物质一定属于同分异构体
B.互为同分异构体的物质的相对分子质量一定相同
C.12H2O和13H2O属于同分异构体
D.NH4CNO是无机物,CO(NH2)2是有机物,两者不互为同分异构体
解析:A项,这里没有说明物质是不是化合物,如果是单质,则为同素异形体,错误;B项,同分异构体的分子式相同,因此相对分子质量一定相同,正确;C项,两者的结构相同,错误;D项,两者的分子式相同,结构不同,互为同分异构体,错误。
B
03
晶体与非晶体
晶体
概念:具有规则的几何外形和固定的熔点的固体。
晶体的结构与性质
结构
性质
①有规则的几何外形
②晶体内部,微粒在空间呈有规则的重复排列
①晶体具有固定的熔、沸点
②不同类型的晶体性质不同
非晶体
概念:不具有规则的几何外形和固定的熔点的固体。
晶体的类型
(1)离子晶体
①概念
离子化合物中的阴、阳离子按一定的方式有规则地排列形成的晶体
②实例---NaCl的晶体结构如图所示
(2)分子晶体
①概念
由分子构成的物质所形成的晶体。分子晶体是分子之间依靠分子间作用力按一定规则排列所形成的。
②实例---干冰晶体结构如图所示
(3)共价晶体
①概念
原子间以共价键结合并以一定方式有规则排列成空间网状结构的晶体。
②实例---石英晶体结构如图所示
(4)金属晶体
①概念
金属阳离子和自由电子通过强烈的作用结合形成的晶体。
②性质---有金属光泽,能导电,传热,具有延展性等。
1、科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,它们互称为( )
A.同一种物质
B.同分异构体
C.同素异形体
D.同位素
解析:C60与C50、C70、C120、 C540均是由碳元素组成的不同单质,互为同素异形体,所以C项正确。
C
2、下列各项描述的结论正确的是( )
选项 描述 结论
A 由同种元素组成的物质一定是纯净物 正确
B 科学家合成了一种新型的化合物N4 正确
C 红磷转化为白磷是物理变化 错误
D 纳米泡沫碳和金刚石是同素异形体 错误
解析:A项,氧气和臭氧都是由氧元素组成的单质,它们的混合气体属于混合物;B项,N4只含有一种元素,是一种新单质,不属于化合物;C项,红磷和白磷属于同素异形体,同素异形体之间的转化均是化学变化;D项,纳米泡沫碳和金刚石是由碳元素组成的不同种单质,互为同素异形体。
C
(1)明确同素异形体“同”“异”和“体”的含义
①“同”-----指元素相同。
②“异”----指形成 单质不同,结构不同,性质有差异。
③“体”---- 指单质。
总结提升
(2)明确产生同素异形现象的原因
①组成分子的原子个数不同,如氧气(O2)和臭氧(O3)。
②晶体中原子的成键方式和排列方式不同,如金刚石和石墨。
(3)明确同素异形体的“结构决定性质“
①同素异形体的结构不同,性质存在差异。
②物理性质不同,化学性质有的相似,有的相差较大。
3、下列关于同分异构体的描述正确的是( )
A.16O和18O互为同分异构体
B.有机物与无机物之间可以存在同分异构现象
C.同分异构体的性质相同
D.组成元素相同,相对分子质量相同的化合物一定属于同分异构体
解析:A项,16O和18O互为同位素,错误;B项,无机物和无机物、无机物和有机物、有机物和有机物之间均可能存在同分异构现象,正确;C项,结构不同,因此同分异构体的性质不同,错误;D项,C2H6O和CH2O2的组成元素相同,相对分子质量均为46,但两者分子式不同,因此不属于同分异构体,错误。
B
4、在化学中,每种物质都有自己对应的化学式,但往往同一化学式可能表示不同的物质。下列化学式中,只表示一种纯净物的是( )
A.C
B. CH4
C. C2H6O
D. C4H10
解析:A项,C可能是金刚石、石墨,错误;B项,CH4没有同分异构体,只表示一种纯净物,正确;C项,C2H6O可能是乙醇、二甲醚,错误;D项,C4H10可能是正丁烷、异丁烷,错误。
B
1.考查角度
此类题目主要有两种考查角度:一是概念的分析判断;二是围绕题给具体物质分析判断。
2.考查点
此类题目主要考查两个方面:一是同分异构体的判断;二是同分异构体结构与性质的分析。
总结提升
3.具体要求
(1)明确同分异构体“同”“异”和“体”的含义
①“同”一指分 子式相同。
②“异”一 指结构不同,性质有差异。
③“体”一指化合 物。
(2)明确产生同分异构现象的原因
各原子的连接方式不同。
(3)明确同分异构体的“结构决定性质”
①同分异构体的结构不同,性质存在差异。
②物理性质不同,化学性质有的相似,有的相差较大。
(4)明确有关同分异构体的三组“一定”和“不一定”
①分子式相同,一定有相同的相对分子质量,反之不一定成立。如C2H6O和CH2O2相对分子质量相同,但分子式不同。
②分子式相同,一定有相同的元素的质量分数,反之不一定成立。如C2H4和C3H6分子中C、H的质量分数均相同,但分子式不同。
③分子式相同,一定有相同的原子个数比,反之不一定成立。如C2H4和C3H6分子中C、H的原子个数比均为1:2,但分子式不同。
下一节课见!
THANKS
