5.3物质多样性(教案表格式)——高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 5.3物质多样性(教案表格式)——高一上学期化学苏教版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:53:49 | ||
图片预览


文档简介
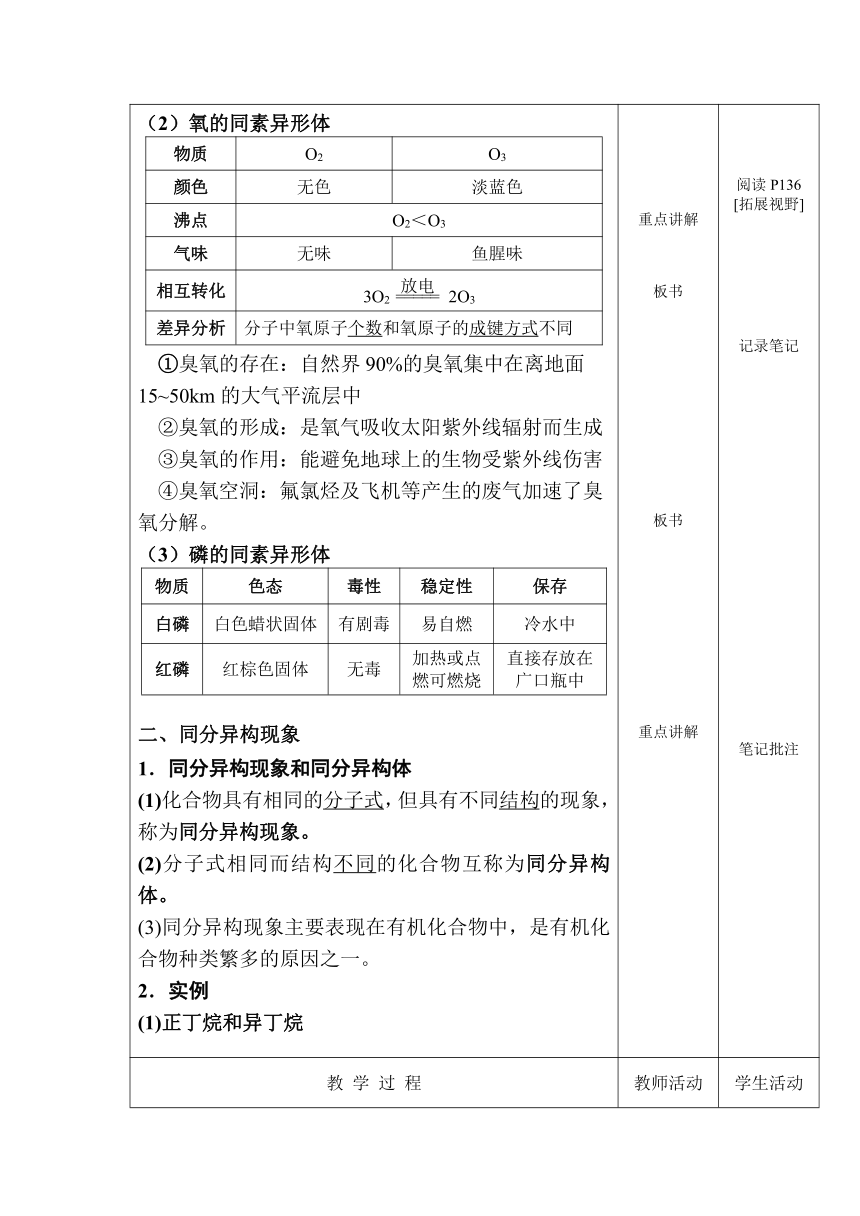
课题: 5.4 从微观结构看物质的多样性
教学目的要求: 1.能构建微观结构与物质多样性之间的联系。2.能依据物质的微观结构特征对物质进行分类。3.能解释或预测物质具有的一些性质。
教学重点: 同素异形体、同分异构体、晶体及非晶体概念
教学难点: 同素异形体、同分异构体、晶体及非晶体概念的理解
教 学 过 程 教师活动 学生活动
【课前回顾】 概念 (1)化学键 (2)离子键——离子化合物 (3)共价键——共价分子、共价化合物 (4)分子间作用力 (5)氢键 2.离子键成键三要素 3.电子式书写 4.共价分子的结构式 作业讲评 旧知巩固 提问学生 作业讲解 思考回答 记录笔记
教 学 过 程 教师活动 学生活动
【导入】 丰富多彩的物质世界,仅由人类发现的百余种元素组成,由于物质的组成及微观结构不同而产生了多样性的物质。深入研究物质的微观结构,能更好地利用已有物质去创造出更多优异性能的新物质,以满足现代文明的各种需要,不断提高人类的生活质量。 【新授】 一、同素异形现象 物质的结构决定物质的存在形态和性质。 1.同素异形现象和同素异形体 (1)同素异形现象:同一种元素能够形成几种不同的单质,这种现象称为同素异形现象。 (2)同素异形体:同一种元素可形成不同单质,这些单质之间互称为这种元素的同素异形体。 它们的物理性质不相同,化学性质相似。同素异形体之间的转化属于化学变化。 2.常见的同素异形体 物质金刚石石墨足球烯(C60)石墨烯物理性质颜色状态无色透明固体灰黑色固体灰黑色 固体灰黑色固体硬度熔点坚硬、熔点很高质软 熔点高硬度小 熔点低优异的光学、力学特征导电性不导电导电不导电导电微观 结构空间网状结构平面网状结构封闭笼状 结构二维层状 结构差异 分析碳原子的成键方式和排列方式不同
(1)碳的同素异形体 导入新课 概念讲解 提问 对比区别 板书 听讲 思考 讨论回答 完成P134 [交流讨论] 记录笔记
教 学 过 程 教师活动 学生活动
(2)氧的同素异形体 物质O2O3颜色无色淡蓝色沸点O2<O3气味无味鱼腥味相互转化3O2 2O3差异分析分子中氧原子个数和氧原子的成键方式不同
①臭氧的存在:自然界90%的臭氧集中在离地面15~50km的大气平流层中 ②臭氧的形成:是氧气吸收太阳紫外线辐射而生成 ③臭氧的作用:能避免地球上的生物受紫外线伤害 ④臭氧空洞:氟氯烃及飞机等产生的废气加速了臭氧分解。 (3)磷的同素异形体 物质色态毒性稳定性保存白磷白色蜡状固体有剧毒易自燃冷水中红磷红棕色固体无毒加热或点燃可燃烧直接存放在广口瓶中
二、同分异构现象 1.同分异构现象和同分异构体 (1)化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。 (2)分子式相同而结构不同的化合物互称为同分异构体。 (3)同分异构现象主要表现在有机化合物中,是有机化合物种类繁多的原因之一。 2.实例 (1)正丁烷和异丁烷 重点讲解 板书 板书 重点讲解 阅读P136 [拓展视野] 记录笔记 笔记批注
教 学 过 程 教师活动 学生活动
名称正丁烷异丁烷分子式C4H10分子 结构结构式结构简式CH3CH2CH2CH3球棍模型结论分子结构不同沸点-0.5 ℃-11.7 ℃差异分析原子的连接方法不同,化学键的类型相同,物质类别相同
(2)乙醇和二甲醚 名称乙醇二甲醚分子式C2H6O分子结构结构式结论分子结构不同性质沸点78 ℃-23 ℃物理性质不同,化学性质不同
晶体与非晶体 常见固体物质一般可分为晶体和非晶体。 (1)晶体有规则的几何外形,如氯化钠、金刚石、干冰等。 (2)非晶体没有固定的熔点,一般也不具备规则的几何外形。 重点讲解 板书 板书 重点讲解 阅读P137 表5-10 讨论回答 完成P137 [观察思考] 讨论P138 [交流讨论]
教 学 过 程 教师活动 学生活动
微点拨:晶体规则的几何外形是其内部构成微粒有规则排列的结果。 2.常见的几类晶体 晶体类型离子晶体原子晶体分子晶体金属晶体晶体微粒阴、阳离子原子分子金属阳离子、自由电子形成晶体 的作用力离子键共价键分子间作用力(或氢键)金属键实例氯化钠、氢氧化钾金刚石、二氧化硅冰、干冰Na、Zn
【思考】二氧化碳、二氧化硅都是ⅣA族元素的氧化物,但二者的物理性质相差较大,你知道是什么原因吗?试比较二者熔点的高低。 [提示] CO2属于分子晶体而SiO2属于原子晶体,故二者物理性质差别较大。SiO2的熔点高于CO2。 晶体类型离子晶体分子晶体共价 晶体金属 晶体结 构构成晶体的粒子阴、阳离子分子原子……微粒间的相互作用离子键分子间作用力共价键……性 质硬度较大小大差距大熔点较高低高差距大导电性熔融或在水溶液中导电本身不导电,溶于水时发生电离后可导电不导电(或半导体)导电物质类别强碱,部分金属氧化物,大部分盐类,如NaClCl2、O2等多数非金属单质,稀有气体,多数非金属氧化物等共价分子,如:干冰SO2、 SiC、 金刚石、 晶体硅等钠、钾、铜等
重点讲解 提问 知识小结 阅读P138-139 [交流讨论] 记录笔记 思考回答 记录笔记
教 学 过 程 教师活动 学生活动
【总结】 同素异形体同分异构体同位素相同点同一种元素分子式(Mr)相同质子数相同不同点结构不同空间结构不同中子数不同研究对象单质化合物原子性质物理性质不同,化学性质相似物理性质不同,化学性质可能相似——转化化学变化;非氧化还原反应化学变化——共存混合物混合物——
常 见 固 态 物 质 【作业】 对比区别 课堂总结 作业布置 记录笔记 记录作业
板书设计
教学课后小结
教学目的要求: 1.能构建微观结构与物质多样性之间的联系。2.能依据物质的微观结构特征对物质进行分类。3.能解释或预测物质具有的一些性质。
教学重点: 同素异形体、同分异构体、晶体及非晶体概念
教学难点: 同素异形体、同分异构体、晶体及非晶体概念的理解
教 学 过 程 教师活动 学生活动
【课前回顾】 概念 (1)化学键 (2)离子键——离子化合物 (3)共价键——共价分子、共价化合物 (4)分子间作用力 (5)氢键 2.离子键成键三要素 3.电子式书写 4.共价分子的结构式 作业讲评 旧知巩固 提问学生 作业讲解 思考回答 记录笔记
教 学 过 程 教师活动 学生活动
【导入】 丰富多彩的物质世界,仅由人类发现的百余种元素组成,由于物质的组成及微观结构不同而产生了多样性的物质。深入研究物质的微观结构,能更好地利用已有物质去创造出更多优异性能的新物质,以满足现代文明的各种需要,不断提高人类的生活质量。 【新授】 一、同素异形现象 物质的结构决定物质的存在形态和性质。 1.同素异形现象和同素异形体 (1)同素异形现象:同一种元素能够形成几种不同的单质,这种现象称为同素异形现象。 (2)同素异形体:同一种元素可形成不同单质,这些单质之间互称为这种元素的同素异形体。 它们的物理性质不相同,化学性质相似。同素异形体之间的转化属于化学变化。 2.常见的同素异形体 物质金刚石石墨足球烯(C60)石墨烯物理性质颜色状态无色透明固体灰黑色固体灰黑色 固体灰黑色固体硬度熔点坚硬、熔点很高质软 熔点高硬度小 熔点低优异的光学、力学特征导电性不导电导电不导电导电微观 结构空间网状结构平面网状结构封闭笼状 结构二维层状 结构差异 分析碳原子的成键方式和排列方式不同
(1)碳的同素异形体 导入新课 概念讲解 提问 对比区别 板书 听讲 思考 讨论回答 完成P134 [交流讨论] 记录笔记
教 学 过 程 教师活动 学生活动
(2)氧的同素异形体 物质O2O3颜色无色淡蓝色沸点O2<O3气味无味鱼腥味相互转化3O2 2O3差异分析分子中氧原子个数和氧原子的成键方式不同
①臭氧的存在:自然界90%的臭氧集中在离地面15~50km的大气平流层中 ②臭氧的形成:是氧气吸收太阳紫外线辐射而生成 ③臭氧的作用:能避免地球上的生物受紫外线伤害 ④臭氧空洞:氟氯烃及飞机等产生的废气加速了臭氧分解。 (3)磷的同素异形体 物质色态毒性稳定性保存白磷白色蜡状固体有剧毒易自燃冷水中红磷红棕色固体无毒加热或点燃可燃烧直接存放在广口瓶中
二、同分异构现象 1.同分异构现象和同分异构体 (1)化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。 (2)分子式相同而结构不同的化合物互称为同分异构体。 (3)同分异构现象主要表现在有机化合物中,是有机化合物种类繁多的原因之一。 2.实例 (1)正丁烷和异丁烷 重点讲解 板书 板书 重点讲解 阅读P136 [拓展视野] 记录笔记 笔记批注
教 学 过 程 教师活动 学生活动
名称正丁烷异丁烷分子式C4H10分子 结构结构式结构简式CH3CH2CH2CH3球棍模型结论分子结构不同沸点-0.5 ℃-11.7 ℃差异分析原子的连接方法不同,化学键的类型相同,物质类别相同
(2)乙醇和二甲醚 名称乙醇二甲醚分子式C2H6O分子结构结构式结论分子结构不同性质沸点78 ℃-23 ℃物理性质不同,化学性质不同
晶体与非晶体 常见固体物质一般可分为晶体和非晶体。 (1)晶体有规则的几何外形,如氯化钠、金刚石、干冰等。 (2)非晶体没有固定的熔点,一般也不具备规则的几何外形。 重点讲解 板书 板书 重点讲解 阅读P137 表5-10 讨论回答 完成P137 [观察思考] 讨论P138 [交流讨论]
教 学 过 程 教师活动 学生活动
微点拨:晶体规则的几何外形是其内部构成微粒有规则排列的结果。 2.常见的几类晶体 晶体类型离子晶体原子晶体分子晶体金属晶体晶体微粒阴、阳离子原子分子金属阳离子、自由电子形成晶体 的作用力离子键共价键分子间作用力(或氢键)金属键实例氯化钠、氢氧化钾金刚石、二氧化硅冰、干冰Na、Zn
【思考】二氧化碳、二氧化硅都是ⅣA族元素的氧化物,但二者的物理性质相差较大,你知道是什么原因吗?试比较二者熔点的高低。 [提示] CO2属于分子晶体而SiO2属于原子晶体,故二者物理性质差别较大。SiO2的熔点高于CO2。 晶体类型离子晶体分子晶体共价 晶体金属 晶体结 构构成晶体的粒子阴、阳离子分子原子……微粒间的相互作用离子键分子间作用力共价键……性 质硬度较大小大差距大熔点较高低高差距大导电性熔融或在水溶液中导电本身不导电,溶于水时发生电离后可导电不导电(或半导体)导电物质类别强碱,部分金属氧化物,大部分盐类,如NaClCl2、O2等多数非金属单质,稀有气体,多数非金属氧化物等共价分子,如:干冰SO2、 SiC、 金刚石、 晶体硅等钠、钾、铜等
重点讲解 提问 知识小结 阅读P138-139 [交流讨论] 记录笔记 思考回答 记录笔记
教 学 过 程 教师活动 学生活动
【总结】 同素异形体同分异构体同位素相同点同一种元素分子式(Mr)相同质子数相同不同点结构不同空间结构不同中子数不同研究对象单质化合物原子性质物理性质不同,化学性质相似物理性质不同,化学性质可能相似——转化化学变化;非氧化还原反应化学变化——共存混合物混合物——
常 见 固 态 物 质 【作业】 对比区别 课堂总结 作业布置 记录笔记 记录作业
板书设计
教学课后小结
