专题5微观结构与物质的多样性复习(教案表格式)——高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题5微观结构与物质的多样性复习(教案表格式)——高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 408.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 14:54:26 | ||
图片预览


文档简介
课题: 5 微观结构及物质多样性 复习
教学目的要求: 1.了解元素性质周期性变化规律。2.掌握元素周期表的编排原则及结构。3.掌握微粒之间的作用力。4.会区分同素异形体、同分异构体及晶体。
教学重点: 掌握同周期元素性质的递变规律、微粒之间的作用力、概念区分
教学难点: 掌握同周期元素性质的递变规律、微粒之间的作用力
教 学 过 程 教师活动 学生活动
【课前回顾】 同素异形现象 同素异形体 同分异构现象 同分异构体 3.晶体和非晶体的特点 4.作业讲评 旧知巩固 提问学生 作业讲解 思考回答 记录笔记
教 学 过 程 教师活动 学生活动
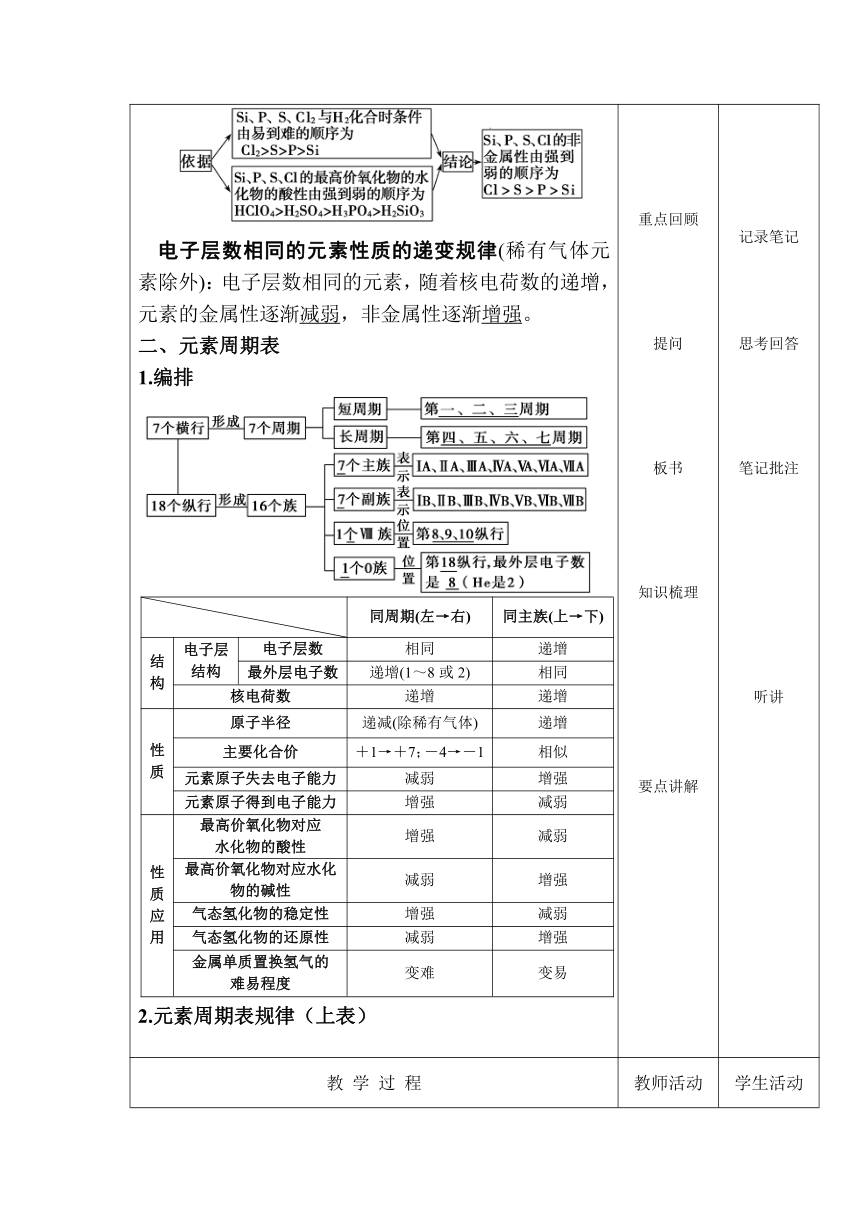
【导入】 丰富多彩的物质世界,由微观粒子通过相互作用力以不同的方式结合组成,元素周期表和周期律为探究和制备更多的新物质提供了思路和线索。让我们一起回顾下本章的重点内容。 【巩固】 一、元素周期律 1.原子序数:按照核电荷数由小到大的顺序给元素依次编号 原子序数 = 原子的核电荷数 2.元素周期律 (1)内容:元素的性质随着元素核电荷数的递增而呈周期性变化的规律。 (2)实质:元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果。 3.原子结构、性质的周期性变化 (1)除H、He 外,随着核电荷数(原子序数)的递增,元素原子的最外层电子排布呈现1~8周期性变化 (2)电子层数相同的元素随着核电荷数的递增,元素的原子半径呈现由大到小的周期性变化(稀有气体元素除外)。 (3)随着核电荷数的递增,元素的主要化合价呈现周期性变化(F无正化合价,O无+6价,稀有气体元素除外)最高正价:+1→+7(第2周期为+5), 负价:-4→-1→0。 |最低化合价|+最高化合价=8(氢、氧、氟例外);最高化合价=最外层电子数(氧、氟例外)。 (4)第三周期元素性质的递变规律 导入课程 基础回顾 提问 知识讲解 板书 提问 听讲 思考回答 思考回答
教 学 过 程 教师活动 学生活动
电子层数相同的元素性质的递变规律(稀有气体元素除外):电子层数相同的元素,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。 二、元素周期表 1.编排 2.元素周期表规律(上表) 同周期(左→右)同主族(上→下)结构电子层结构电子层数相同递增最外层电子数递增(1~8或2)相同核电荷数递增递增性质原子半径递减(除稀有气体)递增主要化合价+1→+7;-4→-1相似元素原子失去电子能力减弱增强元素原子得到电子能力增强减弱性质应用最高价氧化物对应 水化物的酸性增强减弱最高价氧化物对应水化物的碱性减弱增强气态氢化物的稳定性增强减弱气态氢化物的还原性减弱增强金属单质置换氢气的 难易程度变难变易
重点回顾 提问 板书 知识梳理 要点讲解 记录笔记 思考回答 笔记批注 听讲
教 学 过 程 教师活动 学生活动
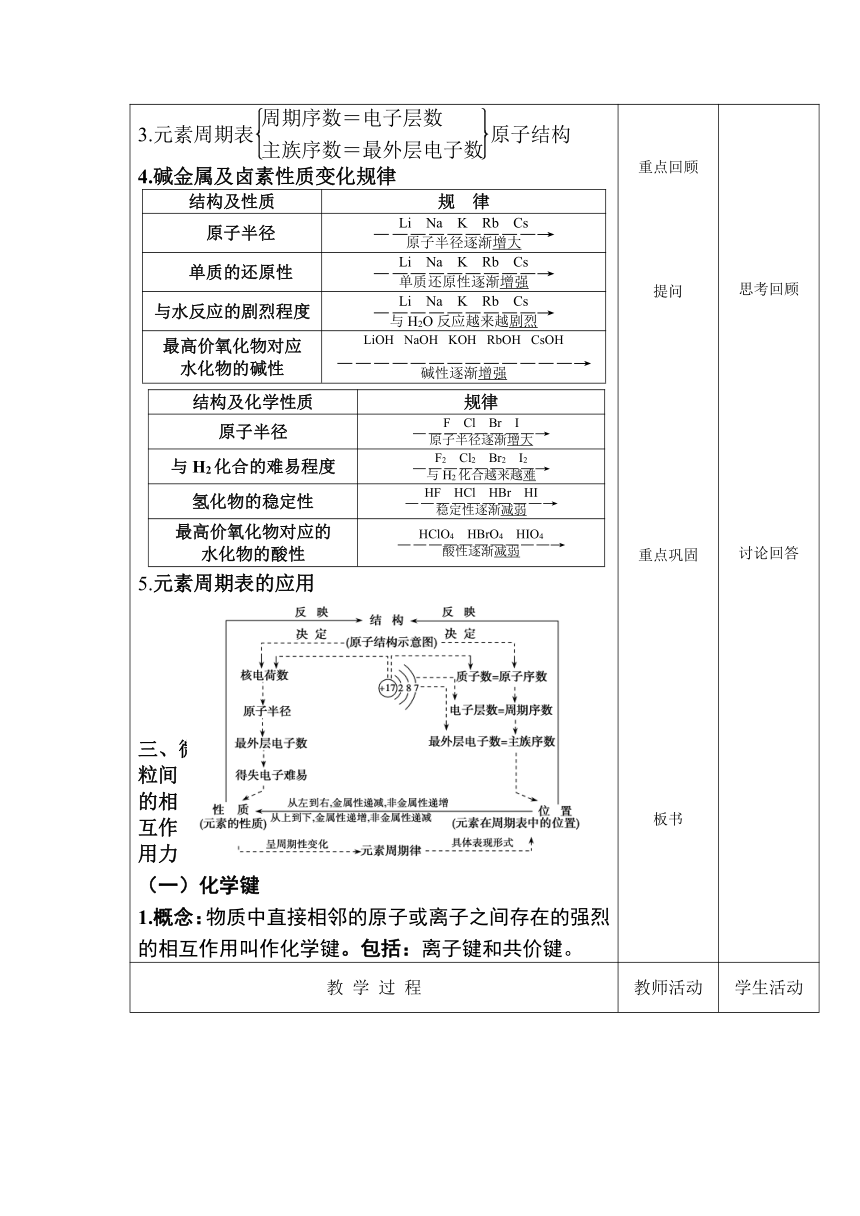
3.元素周期表原子结构 4.碱金属及卤素性质变化规律 结构及性质规 律 原子半径 单质的还原性与水反应的剧烈程度最高价氧化物对应 水化物的碱性
结构及化学性质 规律原子半径与H2化合的难易程度氢化物的稳定性最高价氧化物对应的 水化物的酸性
5.元素周期表的应用 微粒间的相互作用力 (一)化学键 1.概念:物质中直接相邻的原子或离子之间存在的强烈的相互作用叫作化学键。包括:离子键和共价键。 重点回顾 提问 重点巩固 板书 思考回顾 讨论回答
教 学 过 程 教师活动 学生活动
2.离子键与共价键 离子键共价键概念使带相反电荷的阴、阳离子结合的相互作用原子间通过共用电子对所形成的强烈相互作用成键微粒阴、阳离子原子成键元素活泼金属元素和活泼非金属元素(铵盐除外)大多数为非金属元素成键实质阴、阳离子之间的电性作用共用电子对对两原子核产生的电性作用形成过程NaCl的形成过程HCl的形成过程如下: 存在范围活泼金属氧化物、强碱、大多数盐多数非金属单质、共价化合物及部分离子化合物实例CaCl2、Na2O2、NaOHCl2、CCl4、NaHCO3
3.电子式的书写及注意事项 原子在元素符号周围用“·”或“×”来表示原子最外层电子的式子。例如,简单 阳离子简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示。例如,Na+、Li+、Ca2+、Al3+等。简单 阴离子不但要画出最外层电子,而且还应用方括号“[ ]”括起来,并在右上角用“n ”标明电荷。例如,氧离子、氟离子。复杂离子不仅要画出各原子最外层电子,而且还应用方括号“[]”括起来,并在右上角用“n ”或“n+”标明电荷。例如,铵根离子、氢氧根离子:。离子 化合物每个离子都要单独写,而且要符合其实际相邻关系。例如,CaCl2要写成,不能写成,也不能写成
4.共价键与共价化合物 (1)共价键 ①概念:原子间通过共用电子对形成的强烈的相互作 要点回顾 提问 知识讲解 拓展讲解 记录笔记 思考回答 记录笔记 记录笔记
教 学 过 程 教师活动 学生活动
用。 ②形成过程:两种元素相互化合时,原子间共用最外层上的电子,形成共用电子对,以达到稳定的电子层结构,共用电子对同时受到两个原子核的吸引。 (2)共价分子与共价化合物 ①原子之间全部以共价键结合的分子叫作共价分子。 ②分子中直接相邻的原子之间均以共价键相结合所形成的化合物属于共价化合物 (3)结构式:用原子间的一条短线表示一对共用电子对 (4) (5)分子间作用力 ①概念:分子间存在着将分子聚集在一起的作用力 ②分子间作用力比化学键弱得多。 ③分子间作用力是影响物质熔、沸点和溶解性的重要因素之一。 (6)氢键 (1)像H2O、NH3、HF这样的分子之间存在着一种比分子间作用力稍强的相互作用,这种相互作用叫氢键。 (2)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱,比分子间作用力强。 (3)分子间形成的氢键会使物质的熔点和沸点升高,对物质的溶解度有影响 四、微观结构与物质多样性 (一)同素异形现象 知识梳理 板书 知识梳理 思考巩固 记录笔记
教 学 过 程 教师活动 学生活动
1.同素异形现象:同一种元素能形成几种不同的单质。 2.同素异形体:同一种元素可形成不同单质,这些单质之间互称为这种元素的同素异形体。 它们的物理性质不相同,化学性质相似。同素异形体之间的转化属于化学变化。 3.常见的同素异形体 (1)碳的同素异形体 石墨、金刚石、足球烯、石墨烯 物理性质(颜色、硬度、熔点、导电性)及微观结构的差异性原因分析:碳原子的成键方式和排列方式不同。 (2)氧的同素异形体:氧气、臭氧 颜色、沸点、气味、相互转化的差异性原因:分子中氧原子个数和氧原子的成键方式不同 磷的同素异形体:白磷、红磷 色态、毒性、稳定性、保存的差异性 (二)同分异构现象 1.同分异构现象和同分异构体 (1)化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。 (2)分子式相同而结构不同的化合物互称同分异构体。 (3)同分异构现象主要表现在有机化合物中,是有机化合物种类繁多的原因之一。 2.实例 (1)正丁烷和异丁烷 分子式、结构式、结构简式、沸点差异性分析:原子的连接方式不同,化学键类型相同,物质类别相同、 乙醇和二甲醚 (三)晶体与非晶体 常见固体物质一般可分为晶体和非晶体。 知识梳理 提问 提问 思考巩固 思考回答 思考回答
教 学 过 程 教师活动 学生活动
(1)晶体有规则的几何外形,如氯化钠、金刚石、干冰等。 (2)非晶体没有固定的熔点,一般也不具备规则的几何外形。 2.常见的几类晶体 晶体类型离子晶体原子晶体分子晶体金属晶体晶体微粒阴、阳离子原子分子金属阳离子、自由电子形成晶体 的作用力离子键共价键分子间作用力(或氢键)金属键实例氯化钠、氢氧化钾金刚石、二氧化硅冰、干冰Na、Zn
【总结】 【作业】 知识梳理 课堂总结 作业布置 记录笔记 记录作业
板书设计 微观结构与物质的多样性 一、元素周期表 二、微观结构与物质多样性 1.元素周期表的结构 1.微粒间的作用力 2.元素位置与原子结构的关系 2.微观结构与物质的多样性 3.原子结构和性质的递变规律 (1)同素异形现象 (1)原子结构递变规律 (2)同分异构现象 (2)性质的递变规律 (3)晶体与非晶体
教学课后小结
教学目的要求: 1.了解元素性质周期性变化规律。2.掌握元素周期表的编排原则及结构。3.掌握微粒之间的作用力。4.会区分同素异形体、同分异构体及晶体。
教学重点: 掌握同周期元素性质的递变规律、微粒之间的作用力、概念区分
教学难点: 掌握同周期元素性质的递变规律、微粒之间的作用力
教 学 过 程 教师活动 学生活动
【课前回顾】 同素异形现象 同素异形体 同分异构现象 同分异构体 3.晶体和非晶体的特点 4.作业讲评 旧知巩固 提问学生 作业讲解 思考回答 记录笔记
教 学 过 程 教师活动 学生活动
【导入】 丰富多彩的物质世界,由微观粒子通过相互作用力以不同的方式结合组成,元素周期表和周期律为探究和制备更多的新物质提供了思路和线索。让我们一起回顾下本章的重点内容。 【巩固】 一、元素周期律 1.原子序数:按照核电荷数由小到大的顺序给元素依次编号 原子序数 = 原子的核电荷数 2.元素周期律 (1)内容:元素的性质随着元素核电荷数的递增而呈周期性变化的规律。 (2)实质:元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果。 3.原子结构、性质的周期性变化 (1)除H、He 外,随着核电荷数(原子序数)的递增,元素原子的最外层电子排布呈现1~8周期性变化 (2)电子层数相同的元素随着核电荷数的递增,元素的原子半径呈现由大到小的周期性变化(稀有气体元素除外)。 (3)随着核电荷数的递增,元素的主要化合价呈现周期性变化(F无正化合价,O无+6价,稀有气体元素除外)最高正价:+1→+7(第2周期为+5), 负价:-4→-1→0。 |最低化合价|+最高化合价=8(氢、氧、氟例外);最高化合价=最外层电子数(氧、氟例外)。 (4)第三周期元素性质的递变规律 导入课程 基础回顾 提问 知识讲解 板书 提问 听讲 思考回答 思考回答
教 学 过 程 教师活动 学生活动
电子层数相同的元素性质的递变规律(稀有气体元素除外):电子层数相同的元素,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。 二、元素周期表 1.编排 2.元素周期表规律(上表) 同周期(左→右)同主族(上→下)结构电子层结构电子层数相同递增最外层电子数递增(1~8或2)相同核电荷数递增递增性质原子半径递减(除稀有气体)递增主要化合价+1→+7;-4→-1相似元素原子失去电子能力减弱增强元素原子得到电子能力增强减弱性质应用最高价氧化物对应 水化物的酸性增强减弱最高价氧化物对应水化物的碱性减弱增强气态氢化物的稳定性增强减弱气态氢化物的还原性减弱增强金属单质置换氢气的 难易程度变难变易
重点回顾 提问 板书 知识梳理 要点讲解 记录笔记 思考回答 笔记批注 听讲
教 学 过 程 教师活动 学生活动
3.元素周期表原子结构 4.碱金属及卤素性质变化规律 结构及性质规 律 原子半径 单质的还原性与水反应的剧烈程度最高价氧化物对应 水化物的碱性
结构及化学性质 规律原子半径与H2化合的难易程度氢化物的稳定性最高价氧化物对应的 水化物的酸性
5.元素周期表的应用 微粒间的相互作用力 (一)化学键 1.概念:物质中直接相邻的原子或离子之间存在的强烈的相互作用叫作化学键。包括:离子键和共价键。 重点回顾 提问 重点巩固 板书 思考回顾 讨论回答
教 学 过 程 教师活动 学生活动
2.离子键与共价键 离子键共价键概念使带相反电荷的阴、阳离子结合的相互作用原子间通过共用电子对所形成的强烈相互作用成键微粒阴、阳离子原子成键元素活泼金属元素和活泼非金属元素(铵盐除外)大多数为非金属元素成键实质阴、阳离子之间的电性作用共用电子对对两原子核产生的电性作用形成过程NaCl的形成过程HCl的形成过程如下: 存在范围活泼金属氧化物、强碱、大多数盐多数非金属单质、共价化合物及部分离子化合物实例CaCl2、Na2O2、NaOHCl2、CCl4、NaHCO3
3.电子式的书写及注意事项 原子在元素符号周围用“·”或“×”来表示原子最外层电子的式子。例如,简单 阳离子简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示。例如,Na+、Li+、Ca2+、Al3+等。简单 阴离子不但要画出最外层电子,而且还应用方括号“[ ]”括起来,并在右上角用“n ”标明电荷。例如,氧离子、氟离子。复杂离子不仅要画出各原子最外层电子,而且还应用方括号“[]”括起来,并在右上角用“n ”或“n+”标明电荷。例如,铵根离子、氢氧根离子:。离子 化合物每个离子都要单独写,而且要符合其实际相邻关系。例如,CaCl2要写成,不能写成,也不能写成
4.共价键与共价化合物 (1)共价键 ①概念:原子间通过共用电子对形成的强烈的相互作 要点回顾 提问 知识讲解 拓展讲解 记录笔记 思考回答 记录笔记 记录笔记
教 学 过 程 教师活动 学生活动
用。 ②形成过程:两种元素相互化合时,原子间共用最外层上的电子,形成共用电子对,以达到稳定的电子层结构,共用电子对同时受到两个原子核的吸引。 (2)共价分子与共价化合物 ①原子之间全部以共价键结合的分子叫作共价分子。 ②分子中直接相邻的原子之间均以共价键相结合所形成的化合物属于共价化合物 (3)结构式:用原子间的一条短线表示一对共用电子对 (4) (5)分子间作用力 ①概念:分子间存在着将分子聚集在一起的作用力 ②分子间作用力比化学键弱得多。 ③分子间作用力是影响物质熔、沸点和溶解性的重要因素之一。 (6)氢键 (1)像H2O、NH3、HF这样的分子之间存在着一种比分子间作用力稍强的相互作用,这种相互作用叫氢键。 (2)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱,比分子间作用力强。 (3)分子间形成的氢键会使物质的熔点和沸点升高,对物质的溶解度有影响 四、微观结构与物质多样性 (一)同素异形现象 知识梳理 板书 知识梳理 思考巩固 记录笔记
教 学 过 程 教师活动 学生活动
1.同素异形现象:同一种元素能形成几种不同的单质。 2.同素异形体:同一种元素可形成不同单质,这些单质之间互称为这种元素的同素异形体。 它们的物理性质不相同,化学性质相似。同素异形体之间的转化属于化学变化。 3.常见的同素异形体 (1)碳的同素异形体 石墨、金刚石、足球烯、石墨烯 物理性质(颜色、硬度、熔点、导电性)及微观结构的差异性原因分析:碳原子的成键方式和排列方式不同。 (2)氧的同素异形体:氧气、臭氧 颜色、沸点、气味、相互转化的差异性原因:分子中氧原子个数和氧原子的成键方式不同 磷的同素异形体:白磷、红磷 色态、毒性、稳定性、保存的差异性 (二)同分异构现象 1.同分异构现象和同分异构体 (1)化合物具有相同的分子式,但具有不同结构的现象,称为同分异构现象。 (2)分子式相同而结构不同的化合物互称同分异构体。 (3)同分异构现象主要表现在有机化合物中,是有机化合物种类繁多的原因之一。 2.实例 (1)正丁烷和异丁烷 分子式、结构式、结构简式、沸点差异性分析:原子的连接方式不同,化学键类型相同,物质类别相同、 乙醇和二甲醚 (三)晶体与非晶体 常见固体物质一般可分为晶体和非晶体。 知识梳理 提问 提问 思考巩固 思考回答 思考回答
教 学 过 程 教师活动 学生活动
(1)晶体有规则的几何外形,如氯化钠、金刚石、干冰等。 (2)非晶体没有固定的熔点,一般也不具备规则的几何外形。 2.常见的几类晶体 晶体类型离子晶体原子晶体分子晶体金属晶体晶体微粒阴、阳离子原子分子金属阳离子、自由电子形成晶体 的作用力离子键共价键分子间作用力(或氢键)金属键实例氯化钠、氢氧化钾金刚石、二氧化硅冰、干冰Na、Zn
【总结】 【作业】 知识梳理 课堂总结 作业布置 记录笔记 记录作业
板书设计 微观结构与物质的多样性 一、元素周期表 二、微观结构与物质多样性 1.元素周期表的结构 1.微粒间的作用力 2.元素位置与原子结构的关系 2.微观结构与物质的多样性 3.原子结构和性质的递变规律 (1)同素异形现象 (1)原子结构递变规律 (2)同分异构现象 (2)性质的递变规律 (3)晶体与非晶体
教学课后小结
