2023-2024学年高中化学人教版2019选择性必修1课后习题 第二章第一节 第2课时 影响化学反应速率的因素 活化能(含解析)
文档属性
| 名称 | 2023-2024学年高中化学人教版2019选择性必修1课后习题 第二章第一节 第2课时 影响化学反应速率的因素 活化能(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 336.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 15:27:38 | ||
图片预览



文档简介
第2课时 影响化学反应速率的因素 活化能
A级 必备知识基础练
1.(2022山东滨州高三期末)甲醇在钯基催化剂表面制氢的反应历程如图所示,其中吸附在钯基催化剂表面上的物种用*标注。下列说法正确的是( )
A.参与反应的反应物总键能小于生成物总键能
B.该历程中最大能垒(活化能)E正=179.6 kJ·mol-1
C.CH3OH(g)CO(g)+2H2(g)的ΔH=+157.2 kJ·mol-1
D.甲醇在不同催化剂表面上制氢的反应历程相同
2.某反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
3.(2022辽宁大东高三开学考试)热催化合成氨面临的两难问题:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti—H—Fe 双温区催化剂(Ti—H区域和Fe区域的温度差可超过100 ℃)。
Ti—H—Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
A.整个反应的总反应速率由②决定
B.①为氮氮三键的断裂过程
C.④为N原子由Ti—H区域向Fe区域的传递过程
D.使用Ti—H—Fe双温区催化剂使合成氨反应转变为吸热反应
4.下列有关化学反应速率的说法正确的是( )
A.C与CO2反应生成CO时,增加C的量能使反应速率增大
B.等质量的锌粉和锌片与相同体积、相同物质的量浓度的盐酸反应,反应速率相等
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减小
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以增大该化学反应速率
5.A、B在溶液中发生反应:A+BC。现将A、B两种反应物进行以下五个实验,其中①~④在20 ℃时进行,⑤在40 ℃时进行,实验刚开始时,反应速率由大到小的顺序正确的是 ( )
①20 mL 0.2 mol·L-1 A+20 mL 0.2 mol·L-1 B
②50 mL 0.5 mol·L-1 A+50 mL 0.5 mol·L-1 B
③10 mL 1 mol·L-1 A+10 mL 1 mol·L-1 B+30 mL H2O
④20 mL 1 mol·L-1 A+60 mL 0.4 mol·L-1 B
⑤30 mL 0.6 mol·L-1 A+30 mL 0.6 mol·L-1 B
A.②④⑤①③ B.⑤④②③①
C.④②⑤①③ D.③⑤④②①
6.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
A.5 mL 2% H2O2溶液
B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液
D.5 mL 10% H2O2溶液
7.(2021山东师大附中月考)在含Fe3+的S2和I-的混合溶液中,反应S2(aq)+2I-(aq)2S(aq)+I2(aq)的分解机理及反应过程中的能量变化如图:
步骤①:2Fe3+(aq)+2I-(aq)I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2(aq)2Fe3+(aq)+2S(aq)
下列有关该反应的说法正确的是( )
A.反应速率与Fe3+的浓度有关
B.Fe2+是该反应的催化剂
C.v(S2)=v(I-)=v(I2)
D.若不加Fe3+,则正反应的活化能比逆反应的大
8.硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
t/s 0 120 180 240 330
α/% 0 33.0 41.8 48.8 58.0
t/s 530 600 700 800
α/% 69.0 70.4 71.0 71.0
(1)列式计算该反应在120~180 s与180~240 s区间的平均反应速率: 、 。
(2)比较两者大小可得出的结论是 。
B级 关键能力提升练
以下选择题中有一个或两个选项符合题目要求
9.100 mL 6 mol·L-1的硫酸溶液与过量锌粉反应,在一定温度下,为了减小反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.硫酸钠固体 B.碳酸钠固体
C.水 D.氯化钾溶液
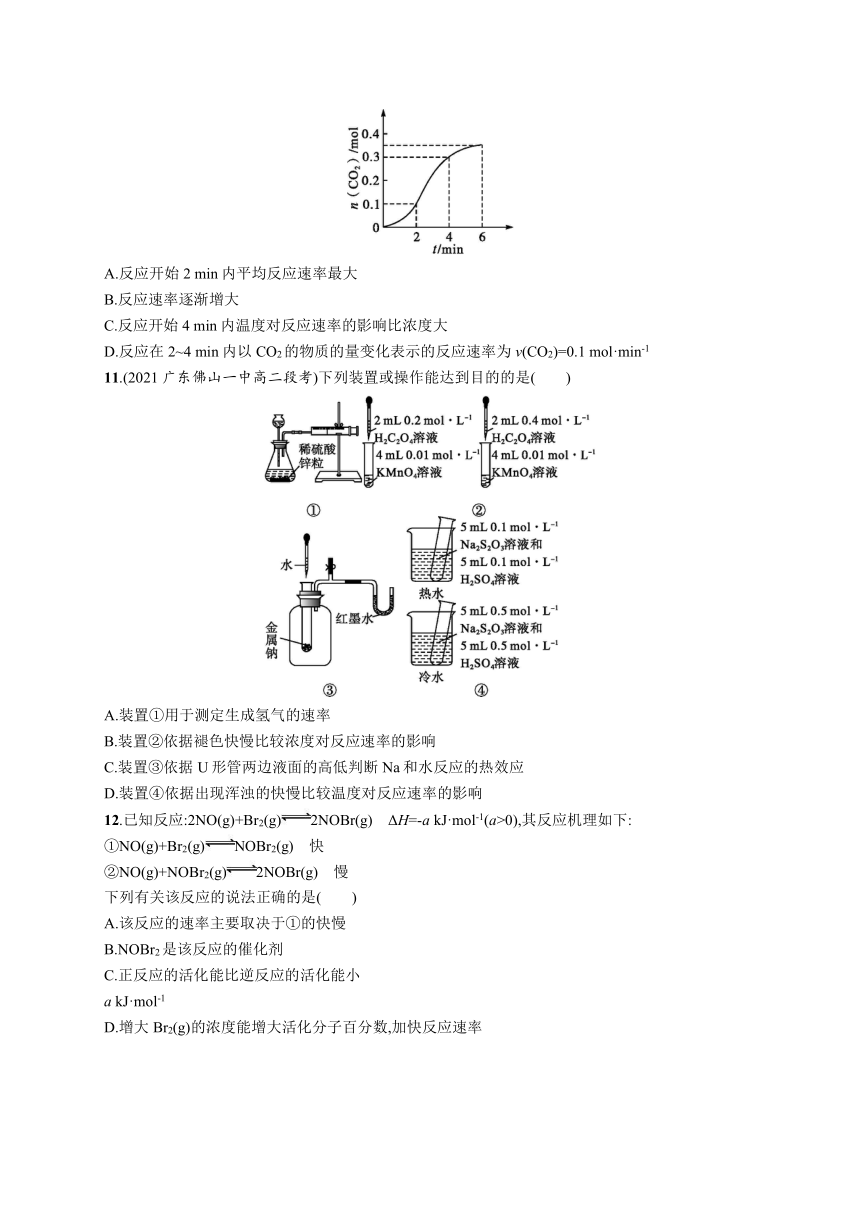
10.碳酸钙与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论错误的是( )
A.反应开始2 min内平均反应速率最大
B.反应速率逐渐增大
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)=0.1 mol·min-1
11.(2021广东佛山一中高二段考)下列装置或操作能达到目的的是( )
A.装置①用于测定生成氢气的速率
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.装置③依据U形管两边液面的高低判断Na和水反应的热效应
D.装置④依据出现浑浊的快慢比较温度对反应速率的影响
12.已知反应:2NO(g)+Br2(g)2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下:
①NO(g)+Br2(g)NOBr2(g) 快
②NO(g)+NOBr2(g)2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小
a kJ·mol-1
D.增大Br2(g)的浓度能增大活化分子百分数,加快反应速率
13.某探究小组利用反应CH3COCH3+Br2CH3COCH2Br+HBr来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验 序号 初始浓度c/( mol·L-1) 溴颜色消失 所需时间 t/s
CH3COCH3 HCl Br2
① 0.80 0.20 0.001 0 290
② 1.60 0.20 0.001 0 145
③ 0.80 0.40 0.001 0 145
④ 0.80 0.20 0.002 0 580
分析实验数据所得出的结论不正确的是 ( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
14.(2021广州高二调研)KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
实验编号 ① ② ③ ④ ⑤
温度/ ℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该反应的离子方程式为 。
(2)该实验的目的是 。
(3)实验试剂除了1 mol·L-1 KI溶液、0.1 mol·L-1 H2SO4溶液外,还需要的试剂是 ,实验现象为 。
(4)实验操作中除了需要上述条件外,还必须控制 (填字母)不变。
A.温度
B.试剂的用量(体积)
C.试剂添加的顺序
(5)由上述实验记录可得出的结论是 。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的措施是 。
C级 学科素养拔高练
15.“碘钟”实验中,3I-+S2+2S的反应速率可以用与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃时进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
0.040 0.080 0.080 0.160 0.120
0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是 。
(2)表中t1= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22.0 s
B.22.0~44.0 s
C.>44.0 s
D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
第2课时 影响化学反应速率的因素 活化能
1.B 由题图可以看出该反应是吸热反应,参与反应的反应物总键能大于生成物总键能,故A错误;由题图可以看出该历程中最大能垒(活化能)E正=113.9 kJ·mol-1-(-65.7) kJ·mol-1=179.6 kJ·mol-1,故B正确;CH3OH(g)CO(g)+2H2(g)的ΔH=+97.9 kJ·mol-1,故C错误;甲醇在不同催化剂表面上制氢的反应历程不相同,故D错误。
2.C 使用催化剂可降低反应的活化能,增加活化分子百分数,使化学反应速率增大,但不会改变反应的焓变。
3.A 热区主要是为活化能高的反应提供能量,反应②为吸热反应,活化能最大。对于多步反应,整个化学反应的速率由慢反应决定,故整个反应的总反应速率由②决定,A正确;经历①过程之后氮气分子被催化剂吸附,并没有变成氮原子,则N≡N没有断裂,B错误;由题中图示可知,过程④完成了Ti—H—Fe—*N到Ti—H—*N—Fe两种过渡态的转化,N原子由Fe区域向Ti—H区域传递,C错误;催化剂只能改变反应途径,降低反应的活化能,而不能改变反应物、生成物的能量,因此化学反应不会因加入催化剂而改变反应的吸、放热情况,D错误。
4.D C是固体,增加C的量不影响化学反应速率,A不正确;锌粉的表面积大,反应速率快,B不正确;升高温度,吸热反应、放热反应速率均增大,C不正确;催化剂可以增大化学反应速率,D正确。
5.B 由提供数据可算出第①组A、B物质的量浓度均为0.1 mol·L-1;第②组A、B物质的量浓度均为
0.25 mol·L-1;第③组A、B物质的量浓度均为0.2 mol·L-1;第④组A物质的量浓度为0.25 mol·L-1,B物质的量浓度为0.3 mol·L-1;第⑤组A、B物质的量浓度均为0.3 mol·L-1且温度最高,因此其反应速率由大到小的顺序为⑤④②③①。
6.C 本实验的目的是运用控制变量法,探究浓度、催化剂对反应速率的影响,表中已有数据中,①和③两组实验有两个反应条件不同,二者无法达到实验目的;实验②和③中,应是探究催化剂对反应速率的影响,所以实验②中双氧水浓度和体积必须与③相同,即反应物为10 mL 5% H2O2溶液;实验①和②中都没有使用催化剂,可以探究双氧水浓度对反应速率的影响,实验②的反应物为10 mL 5% H2O2溶液时符合条件,C正确。
7.A 由题中信息知,Fe3+浓度增大,可加快步骤①的反应速率,在整个反应过程中Fe3+为催化剂,所以反应速率与Fe3+的浓度有关,A正确、B错误;由反应S2(aq)+2I-(aq)2S(aq)+I2(aq)可知,S2~2I-~I2,则2v(S2)=v(I-)=2v(I2),C错误;由图像可知该反应是放热反应,则正反应的活化能比逆反应的小,D错误。
8.答案 (1)v=≈7.3×10-5 mol·L-1·s-1
v=≈5.8×10-5 mol·L-1·s-1
(2)随反应的进行,反应物浓度降低,反应速率减小
9.CD 硫酸钠不与硫酸或锌反应,不改变溶液的体积,对反应速率无影响,A错误;碳酸钠能与硫酸反应,使生成氢气的量减小,B错误;加入水使硫酸的浓度变小,可以减小化学反应速率,但不影响生成H2的总量,C正确;加入氯化钾溶液,KCl不参与反应,相当于加入水使硫酸的浓度变小,可以减小化学反应速率,但不影响生成H2的总量,D正确。
10.AB 题图中的曲线表明,在0~2 min内产生了0.1 mol CO2,以CO2的物质的量变化表示的反应速率v1=0.05 mol·min-1;2~4 min内产生了0.2 mol CO2,v2=0.1 mol·min-1;4~6 min内产生了0.05 mol CO2,v3=0.025 mol·min-1,产生CO2的速率先快后慢,故2~4 min的平均反应速率最大,4~6 min的平均反应速率最小,A项错误、D项正确;反应速率先增大后减小,B项错误;反应速率先增大是由于反应放热,使溶液温度升高,导致反应速率增大,4 min后反应速率减小则是由浓度减小引起的,C项正确。
11.BC 装置①生成的氢气会从长颈漏斗口逸出,不能根据生成氢气的体积测定生成氢气的速率,A错误;装置②用不同浓度的草酸(乙二酸)溶液与浓度相同的高锰酸钾溶液反应,实验过程中所用草酸过量,依据褪色快慢比较浓度对反应速率的影响,B正确;Na和水反应放热,广口瓶内气体受热膨胀,U形管左侧液面下降,右侧液面上升,所以装置③能达到目的,C正确;装置④中物质的浓度、温度都不同,无法判断温度对反应速率的影响,D错误。
12.C 反应速率主要取决于慢反应,所以该反应的速率主要取决于②的快慢,故A错误;NOBr2是反应过程中的中间产物,不是该反应的催化剂,故B错误;由于该反应为放热反应,说明反应物的总能量高于生成物的总能量,所以正反应的活化能比逆反应的活化能小a kJ· mol-1,故C正确;增大Br2(g)的浓度,活化分子百分数不变,但单位体积内的活化分子数目增多了,所以能加快反应速率,故D错误。
13.D 从表中数据看,①④中CH3COCH3、HCl的初始浓度是相同的,而④中Br2的初始浓度是①中的2倍,但④中溴颜色消失所需时间是①的2倍,D项错误。
14.答案 (1)4H++4I-+O22I2+2H2O
(2)探究温度对反应速率的影响
(3)淀粉溶液 无色溶液变蓝
(4)BC
(5)温度每升高10 ℃,反应速率约增大2倍
(6)保证其他实验条件不变,采用不同浓度的H2SO4溶液进行对比实验
解析 (1)根据得失电子数目相等、电荷守恒和原子守恒,可得该反应的离子方程式为4H++4I-+O22I2+2H2O。
(2)表中数据只有温度和显色时间,故该实验的目的是探究温度对反应速率的影响。
(3)为测定显色时间,产物中有碘单质生成,还需要的试剂是淀粉溶液,实验现象为无色溶液变为蓝色。
(4)设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论,故还必须控制试剂的用量(体积)和试剂添加的顺序不变。
(5)分析实验数据,温度每升高10 ℃,显色时间缩短到原来的一半,故可得出结论:温度每升高10 ℃,反应速率约增大2倍。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,需保证其他实验条件不变,采用不同浓度的H2SO4溶液进行对比实验。
15.答案 (1)研究反应物I-与S2的浓度对反应速率的影响
(2)29.3
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
解析 (2)分析所给数据,可以得出显色时间与c(I-)、c(S2)数值成反比,利用①⑤两组数据,可知两组实验中c(S2)相同,而⑤中c(I-)是①的3倍,因此⑤所用显色时间是①的,即≈29.3 s。
A级 必备知识基础练
1.(2022山东滨州高三期末)甲醇在钯基催化剂表面制氢的反应历程如图所示,其中吸附在钯基催化剂表面上的物种用*标注。下列说法正确的是( )
A.参与反应的反应物总键能小于生成物总键能
B.该历程中最大能垒(活化能)E正=179.6 kJ·mol-1
C.CH3OH(g)CO(g)+2H2(g)的ΔH=+157.2 kJ·mol-1
D.甲醇在不同催化剂表面上制氢的反应历程相同
2.某反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
3.(2022辽宁大东高三开学考试)热催化合成氨面临的两难问题:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti—H—Fe 双温区催化剂(Ti—H区域和Fe区域的温度差可超过100 ℃)。
Ti—H—Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
A.整个反应的总反应速率由②决定
B.①为氮氮三键的断裂过程
C.④为N原子由Ti—H区域向Fe区域的传递过程
D.使用Ti—H—Fe双温区催化剂使合成氨反应转变为吸热反应
4.下列有关化学反应速率的说法正确的是( )
A.C与CO2反应生成CO时,增加C的量能使反应速率增大
B.等质量的锌粉和锌片与相同体积、相同物质的量浓度的盐酸反应,反应速率相等
C.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减小
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以增大该化学反应速率
5.A、B在溶液中发生反应:A+BC。现将A、B两种反应物进行以下五个实验,其中①~④在20 ℃时进行,⑤在40 ℃时进行,实验刚开始时,反应速率由大到小的顺序正确的是 ( )
①20 mL 0.2 mol·L-1 A+20 mL 0.2 mol·L-1 B
②50 mL 0.5 mol·L-1 A+50 mL 0.5 mol·L-1 B
③10 mL 1 mol·L-1 A+10 mL 1 mol·L-1 B+30 mL H2O
④20 mL 1 mol·L-1 A+60 mL 0.4 mol·L-1 B
⑤30 mL 0.6 mol·L-1 A+30 mL 0.6 mol·L-1 B
A.②④⑤①③ B.⑤④②③①
C.④②⑤①③ D.③⑤④②①
6.某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为( )
实验编号 反应物 催化剂
① 10 mL 2% H2O2溶液 无
② 无
③ 10 mL 5% H2O2溶液 MnO2固体
A.5 mL 2% H2O2溶液
B.10 mL 2% H2O2溶液
C.10 mL 5% H2O2溶液
D.5 mL 10% H2O2溶液
7.(2021山东师大附中月考)在含Fe3+的S2和I-的混合溶液中,反应S2(aq)+2I-(aq)2S(aq)+I2(aq)的分解机理及反应过程中的能量变化如图:
步骤①:2Fe3+(aq)+2I-(aq)I2(aq)+2Fe2+(aq)
步骤②:2Fe2+(aq)+S2(aq)2Fe3+(aq)+2S(aq)
下列有关该反应的说法正确的是( )
A.反应速率与Fe3+的浓度有关
B.Fe2+是该反应的催化剂
C.v(S2)=v(I-)=v(I2)
D.若不加Fe3+,则正反应的活化能比逆反应的大
8.硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH,两种反应物的初始浓度均为0.050 mol·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
t/s 0 120 180 240 330
α/% 0 33.0 41.8 48.8 58.0
t/s 530 600 700 800
α/% 69.0 70.4 71.0 71.0
(1)列式计算该反应在120~180 s与180~240 s区间的平均反应速率: 、 。
(2)比较两者大小可得出的结论是 。
B级 关键能力提升练
以下选择题中有一个或两个选项符合题目要求
9.100 mL 6 mol·L-1的硫酸溶液与过量锌粉反应,在一定温度下,为了减小反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.硫酸钠固体 B.碳酸钠固体
C.水 D.氯化钾溶液
10.碳酸钙与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论错误的是( )
A.反应开始2 min内平均反应速率最大
B.反应速率逐渐增大
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)=0.1 mol·min-1
11.(2021广东佛山一中高二段考)下列装置或操作能达到目的的是( )
A.装置①用于测定生成氢气的速率
B.装置②依据褪色快慢比较浓度对反应速率的影响
C.装置③依据U形管两边液面的高低判断Na和水反应的热效应
D.装置④依据出现浑浊的快慢比较温度对反应速率的影响
12.已知反应:2NO(g)+Br2(g)2NOBr(g) ΔH=-a kJ·mol-1(a>0),其反应机理如下:
①NO(g)+Br2(g)NOBr2(g) 快
②NO(g)+NOBr2(g)2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2是该反应的催化剂
C.正反应的活化能比逆反应的活化能小
a kJ·mol-1
D.增大Br2(g)的浓度能增大活化分子百分数,加快反应速率
13.某探究小组利用反应CH3COCH3+Br2CH3COCH2Br+HBr来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验 序号 初始浓度c/( mol·L-1) 溴颜色消失 所需时间 t/s
CH3COCH3 HCl Br2
① 0.80 0.20 0.001 0 290
② 1.60 0.20 0.001 0 145
③ 0.80 0.40 0.001 0 145
④ 0.80 0.20 0.002 0 580
分析实验数据所得出的结论不正确的是 ( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
14.(2021广州高二调研)KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
实验编号 ① ② ③ ④ ⑤
温度/ ℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该反应的离子方程式为 。
(2)该实验的目的是 。
(3)实验试剂除了1 mol·L-1 KI溶液、0.1 mol·L-1 H2SO4溶液外,还需要的试剂是 ,实验现象为 。
(4)实验操作中除了需要上述条件外,还必须控制 (填字母)不变。
A.温度
B.试剂的用量(体积)
C.试剂添加的顺序
(5)由上述实验记录可得出的结论是 。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的措施是 。
C级 学科素养拔高练
15.“碘钟”实验中,3I-+S2+2S的反应速率可以用与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃时进行实验,得到的数据如下表:
实验编号 ① ② ③ ④ ⑤
0.040 0.080 0.080 0.160 0.120
0.040 0.040 0.080 0.020 0.040
t/s 88.0 44.0 22.0 44.0 t1
回答下列问题:
(1)该实验的目的是 。
(2)表中t1= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)。
A.<22.0 s
B.22.0~44.0 s
C.>44.0 s
D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
第2课时 影响化学反应速率的因素 活化能
1.B 由题图可以看出该反应是吸热反应,参与反应的反应物总键能大于生成物总键能,故A错误;由题图可以看出该历程中最大能垒(活化能)E正=113.9 kJ·mol-1-(-65.7) kJ·mol-1=179.6 kJ·mol-1,故B正确;CH3OH(g)CO(g)+2H2(g)的ΔH=+97.9 kJ·mol-1,故C错误;甲醇在不同催化剂表面上制氢的反应历程不相同,故D错误。
2.C 使用催化剂可降低反应的活化能,增加活化分子百分数,使化学反应速率增大,但不会改变反应的焓变。
3.A 热区主要是为活化能高的反应提供能量,反应②为吸热反应,活化能最大。对于多步反应,整个化学反应的速率由慢反应决定,故整个反应的总反应速率由②决定,A正确;经历①过程之后氮气分子被催化剂吸附,并没有变成氮原子,则N≡N没有断裂,B错误;由题中图示可知,过程④完成了Ti—H—Fe—*N到Ti—H—*N—Fe两种过渡态的转化,N原子由Fe区域向Ti—H区域传递,C错误;催化剂只能改变反应途径,降低反应的活化能,而不能改变反应物、生成物的能量,因此化学反应不会因加入催化剂而改变反应的吸、放热情况,D错误。
4.D C是固体,增加C的量不影响化学反应速率,A不正确;锌粉的表面积大,反应速率快,B不正确;升高温度,吸热反应、放热反应速率均增大,C不正确;催化剂可以增大化学反应速率,D正确。
5.B 由提供数据可算出第①组A、B物质的量浓度均为0.1 mol·L-1;第②组A、B物质的量浓度均为
0.25 mol·L-1;第③组A、B物质的量浓度均为0.2 mol·L-1;第④组A物质的量浓度为0.25 mol·L-1,B物质的量浓度为0.3 mol·L-1;第⑤组A、B物质的量浓度均为0.3 mol·L-1且温度最高,因此其反应速率由大到小的顺序为⑤④②③①。
6.C 本实验的目的是运用控制变量法,探究浓度、催化剂对反应速率的影响,表中已有数据中,①和③两组实验有两个反应条件不同,二者无法达到实验目的;实验②和③中,应是探究催化剂对反应速率的影响,所以实验②中双氧水浓度和体积必须与③相同,即反应物为10 mL 5% H2O2溶液;实验①和②中都没有使用催化剂,可以探究双氧水浓度对反应速率的影响,实验②的反应物为10 mL 5% H2O2溶液时符合条件,C正确。
7.A 由题中信息知,Fe3+浓度增大,可加快步骤①的反应速率,在整个反应过程中Fe3+为催化剂,所以反应速率与Fe3+的浓度有关,A正确、B错误;由反应S2(aq)+2I-(aq)2S(aq)+I2(aq)可知,S2~2I-~I2,则2v(S2)=v(I-)=2v(I2),C错误;由图像可知该反应是放热反应,则正反应的活化能比逆反应的小,D错误。
8.答案 (1)v=≈7.3×10-5 mol·L-1·s-1
v=≈5.8×10-5 mol·L-1·s-1
(2)随反应的进行,反应物浓度降低,反应速率减小
9.CD 硫酸钠不与硫酸或锌反应,不改变溶液的体积,对反应速率无影响,A错误;碳酸钠能与硫酸反应,使生成氢气的量减小,B错误;加入水使硫酸的浓度变小,可以减小化学反应速率,但不影响生成H2的总量,C正确;加入氯化钾溶液,KCl不参与反应,相当于加入水使硫酸的浓度变小,可以减小化学反应速率,但不影响生成H2的总量,D正确。
10.AB 题图中的曲线表明,在0~2 min内产生了0.1 mol CO2,以CO2的物质的量变化表示的反应速率v1=0.05 mol·min-1;2~4 min内产生了0.2 mol CO2,v2=0.1 mol·min-1;4~6 min内产生了0.05 mol CO2,v3=0.025 mol·min-1,产生CO2的速率先快后慢,故2~4 min的平均反应速率最大,4~6 min的平均反应速率最小,A项错误、D项正确;反应速率先增大后减小,B项错误;反应速率先增大是由于反应放热,使溶液温度升高,导致反应速率增大,4 min后反应速率减小则是由浓度减小引起的,C项正确。
11.BC 装置①生成的氢气会从长颈漏斗口逸出,不能根据生成氢气的体积测定生成氢气的速率,A错误;装置②用不同浓度的草酸(乙二酸)溶液与浓度相同的高锰酸钾溶液反应,实验过程中所用草酸过量,依据褪色快慢比较浓度对反应速率的影响,B正确;Na和水反应放热,广口瓶内气体受热膨胀,U形管左侧液面下降,右侧液面上升,所以装置③能达到目的,C正确;装置④中物质的浓度、温度都不同,无法判断温度对反应速率的影响,D错误。
12.C 反应速率主要取决于慢反应,所以该反应的速率主要取决于②的快慢,故A错误;NOBr2是反应过程中的中间产物,不是该反应的催化剂,故B错误;由于该反应为放热反应,说明反应物的总能量高于生成物的总能量,所以正反应的活化能比逆反应的活化能小a kJ· mol-1,故C正确;增大Br2(g)的浓度,活化分子百分数不变,但单位体积内的活化分子数目增多了,所以能加快反应速率,故D错误。
13.D 从表中数据看,①④中CH3COCH3、HCl的初始浓度是相同的,而④中Br2的初始浓度是①中的2倍,但④中溴颜色消失所需时间是①的2倍,D项错误。
14.答案 (1)4H++4I-+O22I2+2H2O
(2)探究温度对反应速率的影响
(3)淀粉溶液 无色溶液变蓝
(4)BC
(5)温度每升高10 ℃,反应速率约增大2倍
(6)保证其他实验条件不变,采用不同浓度的H2SO4溶液进行对比实验
解析 (1)根据得失电子数目相等、电荷守恒和原子守恒,可得该反应的离子方程式为4H++4I-+O22I2+2H2O。
(2)表中数据只有温度和显色时间,故该实验的目的是探究温度对反应速率的影响。
(3)为测定显色时间,产物中有碘单质生成,还需要的试剂是淀粉溶液,实验现象为无色溶液变为蓝色。
(4)设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论,故还必须控制试剂的用量(体积)和试剂添加的顺序不变。
(5)分析实验数据,温度每升高10 ℃,显色时间缩短到原来的一半,故可得出结论:温度每升高10 ℃,反应速率约增大2倍。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,需保证其他实验条件不变,采用不同浓度的H2SO4溶液进行对比实验。
15.答案 (1)研究反应物I-与S2的浓度对反应速率的影响
(2)29.3
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
解析 (2)分析所给数据,可以得出显色时间与c(I-)、c(S2)数值成反比,利用①⑤两组数据,可知两组实验中c(S2)相同,而⑤中c(I-)是①的3倍,因此⑤所用显色时间是①的,即≈29.3 s。
