2023-2024学年高中化学人教版2019选择性必修1课后习题 第三章第二节 第3课时 酸碱中和滴定(含解析)
文档属性
| 名称 | 2023-2024学年高中化学人教版2019选择性必修1课后习题 第三章第二节 第3课时 酸碱中和滴定(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 63.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-11 15:28:42 | ||
图片预览


文档简介
第2课时 酸碱中和滴定
A级 必备知识基础练
1.如图表示50 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积( )
A.等于a mL
B.等于(50-a) mL
C.一定大于a mL
D.一定大于(50-a) mL
2.下列有关叙述正确的是( )
A.下端连有橡胶管的滴定管为酸式滴定管
B.在进行滴定时,左手操作锥形瓶,右手操作滴定管
C.滴定前应排除滴定管尖嘴部分的气泡
D.滴定过程中两眼应注意滴定管内液面的变化
3.(1)取一锥形瓶,用NaOH待测溶液润洗两次;(2)在锥形瓶中放入25.00 mL NaOH待测溶液;(3)加入几滴石蕊溶液作指示剂;(4)取一支酸式滴定管,洗涤干净;(5)直接往酸式滴定管中注入标准酸溶液,进行滴定;(6)左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶;(7)两眼注视着滴定管内标准酸溶液液面的变化,直至滴定终点。
以上关于酸碱中和滴定实验的叙述错误的是 ( )
A.(4)(6)(7) B.(1)(5)(6)(7)
C.(3)(5)(7) D.(1)(3)(5)(7)
4.已知NaHCO3溶液呈碱性,常温、常压下饱和CO2的水溶液的pH=3.9,则可推断用标准的盐酸滴定NaHCO3水溶液时,适宜选用的指示剂及滴定终点时颜色变化是( )
A.石蕊,由蓝变红
B.甲基橙,由橙变黄
C.酚酞,红色褪去
D.甲基橙,由黄变橙
5.用NaOH标准溶液测定未知浓度的盐酸,下列实验操作不会引起误差的是( )
A.用待测液润洗锥形瓶
B.用蒸馏水洗净后的酸式滴定管直接量取待测液
C.选用酚酞作指示剂,实验时不小心多加了两滴指示剂
D.实验开始时碱式滴定管尖嘴部分无气泡,结束实验时有气泡
6.下列有关滴定操作的说法正确的是( )
A.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mL
B.用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低
C.用标准KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高
D.用未知浓度的盐酸滴定标准KOH溶液时,若读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
7.用已知浓度的盐酸滴定未知浓度的NaOH溶液,待测液放在锥形瓶中。中和滴定时下列操作会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)( )
A.碱式滴定管未用待测碱液润洗
B.酸式滴定管未用标准盐酸润洗
C.滴定过程中滴定管内不慎有标准溶液溅出
D.滴定前俯视读数,滴定后读数正确
8.用酸碱中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在 (填字母)称量。
A.小烧杯中 B.洁净纸片上
C.托盘上
(2)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,不可选用 (填字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞
(3)滴定过程中,眼睛应注视 ;在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。
滴定 次数 待测溶液 体积/mL 标准酸溶液体积
滴定前的 刻度/mL 滴定后的 刻度/mL
第一次 10.00 0.40 20.50
第二次 10.00 4.10 24.00
B级 关键能力提升练
以下选择题中有一个或两个选项符合题目要求
9.用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用酚酞作指示剂滴至溶液由红色刚变无色时立即停止滴定
C.用蒸馏水洗净锥形瓶后,立即装入NaOH溶液进行滴定
D.将NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入少量蒸馏水后进行滴定
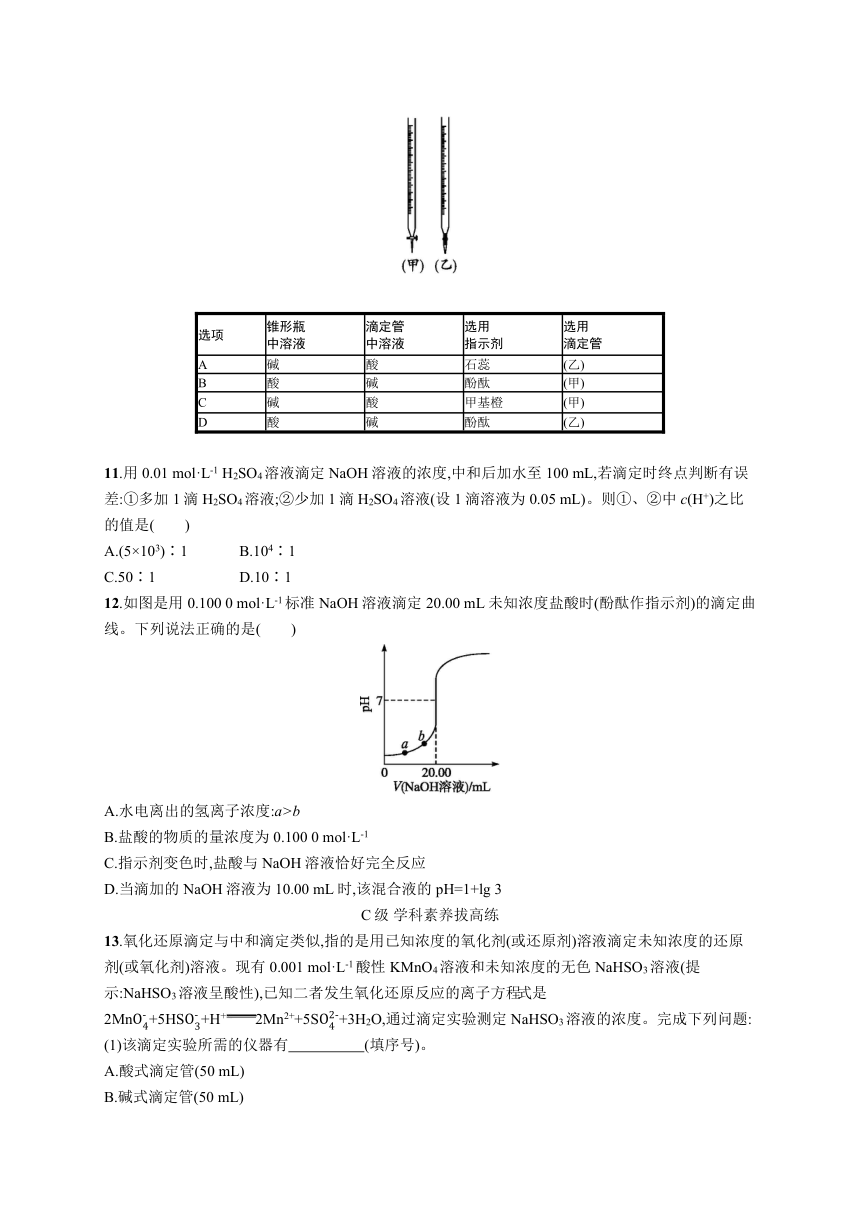
10.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,如下图所示,从下表中选出正确选项( )
选项 锥形瓶 中溶液 滴定管 中溶液 选用 指示剂 选用 滴定管
A 碱 酸 石蕊 (乙)
B 酸 碱 酚酞 (甲)
C 碱 酸 甲基橙 (甲)
D 酸 碱 酚酞 (乙)
11.用0.01 mol·L-1 H2SO4溶液滴定NaOH溶液的浓度,中和后加水至100 mL,若滴定时终点判断有误差:①多加1滴H2SO4溶液;②少加1滴H2SO4溶液(设1滴溶液为0.05 mL)。则①、②中c(H+)之比的值是( )
A.(5×103)∶1 B.104∶1
C.50∶1 D.10∶1
12.如图是用0.100 0 mol·L-1标准NaOH溶液滴定20.00 mL未知浓度盐酸时(酚酞作指示剂)的滴定曲线。下列说法正确的是( )
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.100 0 mol·L-1
C.指示剂变色时,盐酸与NaOH溶液恰好完全反应
D.当滴加的NaOH溶液为10.00 mL时,该混合液的pH=1+lg 3
C级 学科素养拔高练
13.氧化还原滴定与中和滴定类似,指的是用已知浓度的氧化剂(或还原剂)溶液滴定未知浓度的还原剂(或氧化剂)溶液。现有0.001 mol·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液(提示:NaHSO3溶液呈酸性),已知二者发生氧化还原反应的离子方程式是2Mn+5HS+H+2Mn2++5S+3H2O,通过滴定实验测定NaHSO3溶液的浓度。完成下列问题:
(1)该滴定实验所需的仪器有 (填序号)。
A.酸式滴定管(50 mL)
B.碱式滴定管(50 mL)
C.量筒(10 mL) D.锥形瓶
E.铁架台 F.滴定管夹
G.烧杯 H.白纸
I.胶头滴管 J.漏斗
(2)不能用 (填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是 。
(3)该滴定实验 (填“需要”或“不需要”)另加入指示剂,说明理由: 。
(4)滴定前平视酸性KMnO4溶液的液面,读数为a mL,滴定后俯视液面,读数为b mL,则(b-a) mL比实际消耗的KMnO4溶液的体积 (填“多”或“少”)。则根据(b-a) mL计算得到的待测溶液的浓度比实际浓度 (填“大”或“小”)。
第2课时 酸碱中和滴定
1.D 滴定管的零刻度在上面,滴定管刻度线以下还有一小段没有刻度,因此滴定管能量取的液体体积大于其量程,故题给滴定管中液体的体积一定大于(50-a) mL。
2.C A项中所指滴定管是碱式滴定管;B项中应右手操作锥形瓶,左手操作滴定管;D项,滴定过程中两眼应观察锥形瓶内溶液颜色的变化。
3.D 锥形瓶不用润洗,操作(1)错误;一般不用石蕊作酸碱中和滴定的指示剂,操作(3)错误;滴定管必须用待装液润洗后才能注入待装液,操作(5)错误;滴定时两眼应注视锥形瓶中溶液颜色的变化,操作(7)错误。
4.D 甲基橙的变色范围在pH=3.1~4.4,与该滴定后溶液的pH=3.9接近,应选择甲基橙作指示剂,因滴定时溶液pH由大到小,故溶液颜色变化是由黄变橙。
5.C A项,用待测液润洗锥形瓶,滴定时消耗标准溶液体积增大,测定结果偏大;B项,酸式滴定管用蒸馏水洗净后,要先用待测液润洗,否则会使测定结果不准确;C项,用NaOH溶液滴定未知浓度盐酸时选用酚酞作指示剂,多加两滴对实验结果无影响;D项,开始实验时碱式滴定管尖嘴部分无气泡,滴定终点时碱式滴定管尖嘴部分有气泡,读数时标准溶液的体积偏小,导致测定的待测液浓度偏低;故选C项。
6.D 滴定管读数时应保留小数点后2位,A项错误;用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,由于没有润洗,标准溶液浓度减小,消耗标准溶液体积增加,则测定结果偏高,B项错误;所用的固体KOH中混有NaOH,相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配的溶液中OH-浓度偏大,导致消耗标准溶液的体积V碱偏小,根据c酸=可知测定结果偏小,C项错误;用未知浓度的盐酸滴定标准KOH溶液时,若滴定前仰视读数,滴定至终点后俯视读数,导致读取的盐酸体积偏小,根据c酸=可知测定结果偏高,D项正确。
7.A A项,碱式滴定管未用待测碱液润洗,导致消耗的酸少,结果偏低;B项,酸式滴定管未用标准盐酸润洗,会造成消耗的酸的体积偏大,结果偏高;C项,消耗的酸的体积将会偏大,结果偏高;D项,计算出消耗的酸的体积将会偏大,结果偏高。
8.答案 (1)A (2)B
(3)锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差
(4)0.400 0 97.56%
解析 (1)称量氢氧化钠等易潮解、腐蚀性强的试剂时,样品应放在小烧杯中。
(2)酸碱中和滴定时,一般选甲基橙、酚酞等颜色变化较明显的指示剂,石蕊在酸碱中和滴定终点时颜色变化不明显,易造成误差。
(4)第一次实验,V(盐酸)=20.50 mL-0.40 mL=20.10 mL;第二次实验,V(盐酸)=24.00 mL-4.10 mL=19.90 mL,则两次实验平均消耗V(盐酸)=20.00 mL。则c(NaOH)===0.400 0 mol·L-1,则w(NaOH)=×100%≈97.56%。
9.CD 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定,标准盐酸被稀释,浓度偏小,造成消耗的V酸偏大,测得c碱偏大,A项不符合题意;用酚酞作为指示剂,应滴至溶液由红色变为无色且半分钟内颜色不再变化时停止加盐酸,B项不符合题意;蒸馏水洗净锥形瓶后,即装入NaOH溶液进行滴定,操作正确,C项符合题意;将NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水后进行滴定,待测液的物质的量不变,对V酸无影响,可知c碱不变,D项符合题意。
10.CD 甲为酸式滴定管,用来盛酸溶液,不能用来盛碱溶液,据此可排除B项;乙为碱式滴定管,用来盛碱溶液,不能用来盛酸溶液,据此可排除A项;而且强酸强碱进行中和滴定时,一般不选石蕊作指示剂,因为其颜色变化不明显,难以准确判断滴定终点。C、D两项均正确。
11.B 若多加1滴H2SO4溶液,则c(H+)==1.0×10-5 mol·L-1;若少加1滴H2SO4溶液,则c(OH-)==1.0×10-5 mol·L-1,c(H+)=1.0×10-9 mol·L-1。则①、②中c(H+)之比为,故B项正确。
12.BD A项,b点时溶液中H+浓度小,对水电离的抑制程度小,因此水电离出的氢离子浓度:b>a,错误;B项,观察滴定曲线可知,盐酸和氢氧化钠溶液完全反应时消耗NaOH溶液20.00 mL,则盐酸和氢氧化钠溶液的物质的量浓度相等,c(HCl)=0.100 0 mol·L-1,正确;C项,指示剂变色时,盐酸与NaOH溶液并不是恰好完全反应,因为酚酞的变色范围(pH)为8.2~10.0,错误;D项,当滴加的NaOH溶液为10.00 mL时,混合溶液的总体积为30.00 mL,混合溶液中c(H+)== mol·L-1,所以该混合溶液的pH=1+lg 3,正确。
13.答案 (1)ADEFGH
(2)碱 酸性KMnO4溶液有强氧化性,能腐蚀碱式滴定管上的橡胶管
(3)不需要 KMnO4溶液为紫红色,滴定至终点时,混合溶液由无色变为浅红色,且半分钟内不褪色
(4)少 小
解析 (1)取用酸性KMnO4溶液和NaHSO3溶液均应使用酸式滴定管。
(3)用酸性KMnO4溶液进行氧化还原反应滴定时,一般不需要另加指示剂,因为KMnO4溶液为紫红色,本身就可起到指示剂的作用。
(4)根据离子反应2Mn+5HS+H+2Mn2++5S+3H2O可得,5c(KMnO4)·V(KMnO4溶液)=2c(NaHSO3)·V(NaHSO3溶液),则c(NaHSO3)=。
A级 必备知识基础练
1.如图表示50 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积( )
A.等于a mL
B.等于(50-a) mL
C.一定大于a mL
D.一定大于(50-a) mL
2.下列有关叙述正确的是( )
A.下端连有橡胶管的滴定管为酸式滴定管
B.在进行滴定时,左手操作锥形瓶,右手操作滴定管
C.滴定前应排除滴定管尖嘴部分的气泡
D.滴定过程中两眼应注意滴定管内液面的变化
3.(1)取一锥形瓶,用NaOH待测溶液润洗两次;(2)在锥形瓶中放入25.00 mL NaOH待测溶液;(3)加入几滴石蕊溶液作指示剂;(4)取一支酸式滴定管,洗涤干净;(5)直接往酸式滴定管中注入标准酸溶液,进行滴定;(6)左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶;(7)两眼注视着滴定管内标准酸溶液液面的变化,直至滴定终点。
以上关于酸碱中和滴定实验的叙述错误的是 ( )
A.(4)(6)(7) B.(1)(5)(6)(7)
C.(3)(5)(7) D.(1)(3)(5)(7)
4.已知NaHCO3溶液呈碱性,常温、常压下饱和CO2的水溶液的pH=3.9,则可推断用标准的盐酸滴定NaHCO3水溶液时,适宜选用的指示剂及滴定终点时颜色变化是( )
A.石蕊,由蓝变红
B.甲基橙,由橙变黄
C.酚酞,红色褪去
D.甲基橙,由黄变橙
5.用NaOH标准溶液测定未知浓度的盐酸,下列实验操作不会引起误差的是( )
A.用待测液润洗锥形瓶
B.用蒸馏水洗净后的酸式滴定管直接量取待测液
C.选用酚酞作指示剂,实验时不小心多加了两滴指示剂
D.实验开始时碱式滴定管尖嘴部分无气泡,结束实验时有气泡
6.下列有关滴定操作的说法正确的是( )
A.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mL
B.用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低
C.用标准KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高
D.用未知浓度的盐酸滴定标准KOH溶液时,若读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
7.用已知浓度的盐酸滴定未知浓度的NaOH溶液,待测液放在锥形瓶中。中和滴定时下列操作会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)( )
A.碱式滴定管未用待测碱液润洗
B.酸式滴定管未用标准盐酸润洗
C.滴定过程中滴定管内不慎有标准溶液溅出
D.滴定前俯视读数,滴定后读数正确
8.用酸碱中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在 (填字母)称量。
A.小烧杯中 B.洁净纸片上
C.托盘上
(2)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,不可选用 (填字母)作指示剂。
A.甲基橙 B.石蕊
C.酚酞
(3)滴定过程中,眼睛应注视 ;在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。
滴定 次数 待测溶液 体积/mL 标准酸溶液体积
滴定前的 刻度/mL 滴定后的 刻度/mL
第一次 10.00 0.40 20.50
第二次 10.00 4.10 24.00
B级 关键能力提升练
以下选择题中有一个或两个选项符合题目要求
9.用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用酚酞作指示剂滴至溶液由红色刚变无色时立即停止滴定
C.用蒸馏水洗净锥形瓶后,立即装入NaOH溶液进行滴定
D.将NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入少量蒸馏水后进行滴定
10.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,如下图所示,从下表中选出正确选项( )
选项 锥形瓶 中溶液 滴定管 中溶液 选用 指示剂 选用 滴定管
A 碱 酸 石蕊 (乙)
B 酸 碱 酚酞 (甲)
C 碱 酸 甲基橙 (甲)
D 酸 碱 酚酞 (乙)
11.用0.01 mol·L-1 H2SO4溶液滴定NaOH溶液的浓度,中和后加水至100 mL,若滴定时终点判断有误差:①多加1滴H2SO4溶液;②少加1滴H2SO4溶液(设1滴溶液为0.05 mL)。则①、②中c(H+)之比的值是( )
A.(5×103)∶1 B.104∶1
C.50∶1 D.10∶1
12.如图是用0.100 0 mol·L-1标准NaOH溶液滴定20.00 mL未知浓度盐酸时(酚酞作指示剂)的滴定曲线。下列说法正确的是( )
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.100 0 mol·L-1
C.指示剂变色时,盐酸与NaOH溶液恰好完全反应
D.当滴加的NaOH溶液为10.00 mL时,该混合液的pH=1+lg 3
C级 学科素养拔高练
13.氧化还原滴定与中和滴定类似,指的是用已知浓度的氧化剂(或还原剂)溶液滴定未知浓度的还原剂(或氧化剂)溶液。现有0.001 mol·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液(提示:NaHSO3溶液呈酸性),已知二者发生氧化还原反应的离子方程式是2Mn+5HS+H+2Mn2++5S+3H2O,通过滴定实验测定NaHSO3溶液的浓度。完成下列问题:
(1)该滴定实验所需的仪器有 (填序号)。
A.酸式滴定管(50 mL)
B.碱式滴定管(50 mL)
C.量筒(10 mL) D.锥形瓶
E.铁架台 F.滴定管夹
G.烧杯 H.白纸
I.胶头滴管 J.漏斗
(2)不能用 (填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因是 。
(3)该滴定实验 (填“需要”或“不需要”)另加入指示剂,说明理由: 。
(4)滴定前平视酸性KMnO4溶液的液面,读数为a mL,滴定后俯视液面,读数为b mL,则(b-a) mL比实际消耗的KMnO4溶液的体积 (填“多”或“少”)。则根据(b-a) mL计算得到的待测溶液的浓度比实际浓度 (填“大”或“小”)。
第2课时 酸碱中和滴定
1.D 滴定管的零刻度在上面,滴定管刻度线以下还有一小段没有刻度,因此滴定管能量取的液体体积大于其量程,故题给滴定管中液体的体积一定大于(50-a) mL。
2.C A项中所指滴定管是碱式滴定管;B项中应右手操作锥形瓶,左手操作滴定管;D项,滴定过程中两眼应观察锥形瓶内溶液颜色的变化。
3.D 锥形瓶不用润洗,操作(1)错误;一般不用石蕊作酸碱中和滴定的指示剂,操作(3)错误;滴定管必须用待装液润洗后才能注入待装液,操作(5)错误;滴定时两眼应注视锥形瓶中溶液颜色的变化,操作(7)错误。
4.D 甲基橙的变色范围在pH=3.1~4.4,与该滴定后溶液的pH=3.9接近,应选择甲基橙作指示剂,因滴定时溶液pH由大到小,故溶液颜色变化是由黄变橙。
5.C A项,用待测液润洗锥形瓶,滴定时消耗标准溶液体积增大,测定结果偏大;B项,酸式滴定管用蒸馏水洗净后,要先用待测液润洗,否则会使测定结果不准确;C项,用NaOH溶液滴定未知浓度盐酸时选用酚酞作指示剂,多加两滴对实验结果无影响;D项,开始实验时碱式滴定管尖嘴部分无气泡,滴定终点时碱式滴定管尖嘴部分有气泡,读数时标准溶液的体积偏小,导致测定的待测液浓度偏低;故选C项。
6.D 滴定管读数时应保留小数点后2位,A项错误;用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,由于没有润洗,标准溶液浓度减小,消耗标准溶液体积增加,则测定结果偏高,B项错误;所用的固体KOH中混有NaOH,相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配的溶液中OH-浓度偏大,导致消耗标准溶液的体积V碱偏小,根据c酸=可知测定结果偏小,C项错误;用未知浓度的盐酸滴定标准KOH溶液时,若滴定前仰视读数,滴定至终点后俯视读数,导致读取的盐酸体积偏小,根据c酸=可知测定结果偏高,D项正确。
7.A A项,碱式滴定管未用待测碱液润洗,导致消耗的酸少,结果偏低;B项,酸式滴定管未用标准盐酸润洗,会造成消耗的酸的体积偏大,结果偏高;C项,消耗的酸的体积将会偏大,结果偏高;D项,计算出消耗的酸的体积将会偏大,结果偏高。
8.答案 (1)A (2)B
(3)锥形瓶内溶液颜色的变化 便于观察锥形瓶内液体颜色的变化,减小滴定误差
(4)0.400 0 97.56%
解析 (1)称量氢氧化钠等易潮解、腐蚀性强的试剂时,样品应放在小烧杯中。
(2)酸碱中和滴定时,一般选甲基橙、酚酞等颜色变化较明显的指示剂,石蕊在酸碱中和滴定终点时颜色变化不明显,易造成误差。
(4)第一次实验,V(盐酸)=20.50 mL-0.40 mL=20.10 mL;第二次实验,V(盐酸)=24.00 mL-4.10 mL=19.90 mL,则两次实验平均消耗V(盐酸)=20.00 mL。则c(NaOH)===0.400 0 mol·L-1,则w(NaOH)=×100%≈97.56%。
9.CD 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定,标准盐酸被稀释,浓度偏小,造成消耗的V酸偏大,测得c碱偏大,A项不符合题意;用酚酞作为指示剂,应滴至溶液由红色变为无色且半分钟内颜色不再变化时停止加盐酸,B项不符合题意;蒸馏水洗净锥形瓶后,即装入NaOH溶液进行滴定,操作正确,C项符合题意;将NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水后进行滴定,待测液的物质的量不变,对V酸无影响,可知c碱不变,D项符合题意。
10.CD 甲为酸式滴定管,用来盛酸溶液,不能用来盛碱溶液,据此可排除B项;乙为碱式滴定管,用来盛碱溶液,不能用来盛酸溶液,据此可排除A项;而且强酸强碱进行中和滴定时,一般不选石蕊作指示剂,因为其颜色变化不明显,难以准确判断滴定终点。C、D两项均正确。
11.B 若多加1滴H2SO4溶液,则c(H+)==1.0×10-5 mol·L-1;若少加1滴H2SO4溶液,则c(OH-)==1.0×10-5 mol·L-1,c(H+)=1.0×10-9 mol·L-1。则①、②中c(H+)之比为,故B项正确。
12.BD A项,b点时溶液中H+浓度小,对水电离的抑制程度小,因此水电离出的氢离子浓度:b>a,错误;B项,观察滴定曲线可知,盐酸和氢氧化钠溶液完全反应时消耗NaOH溶液20.00 mL,则盐酸和氢氧化钠溶液的物质的量浓度相等,c(HCl)=0.100 0 mol·L-1,正确;C项,指示剂变色时,盐酸与NaOH溶液并不是恰好完全反应,因为酚酞的变色范围(pH)为8.2~10.0,错误;D项,当滴加的NaOH溶液为10.00 mL时,混合溶液的总体积为30.00 mL,混合溶液中c(H+)== mol·L-1,所以该混合溶液的pH=1+lg 3,正确。
13.答案 (1)ADEFGH
(2)碱 酸性KMnO4溶液有强氧化性,能腐蚀碱式滴定管上的橡胶管
(3)不需要 KMnO4溶液为紫红色,滴定至终点时,混合溶液由无色变为浅红色,且半分钟内不褪色
(4)少 小
解析 (1)取用酸性KMnO4溶液和NaHSO3溶液均应使用酸式滴定管。
(3)用酸性KMnO4溶液进行氧化还原反应滴定时,一般不需要另加指示剂,因为KMnO4溶液为紫红色,本身就可起到指示剂的作用。
(4)根据离子反应2Mn+5HS+H+2Mn2++5S+3H2O可得,5c(KMnO4)·V(KMnO4溶液)=2c(NaHSO3)·V(NaHSO3溶液),则c(NaHSO3)=。
